复方D-核糖对小鼠抗疲劳作用的研究
2017-01-13袁保辉刘桂芹李大成王正平
袁保辉,刘桂芹,刘 敏,李大成,韩 军,王正平
(聊城大学临床营养研究中心,山东聊城 252000)
复方D-核糖对小鼠抗疲劳作用的研究
袁保辉,刘桂芹,刘 敏,李大成,韩 军,王正平
(聊城大学临床营养研究中心,山东聊城 252000)
本实验以80只雄性小鼠为实验动物,通过连续四周的灌胃实验研究了核糖复方对疲劳小鼠生理功能的影响。实验小鼠被随机分为生理盐水组、核糖组、人参玛咖组以及核糖复方组。在各组给予相应的干预措施下,测定了小鼠末次运动0 h和24 h后的血清乳酸含量、尿素氮含量及肝糖原含量的变化。结果表明,与对照组比较,D-核糖及核糖复方在急性疲劳期间可以显著延长小鼠的游泳时间(p<0.05);长期疲劳中,核糖复方组可以增加小鼠的肝糖原(p<0.01),降低血清乳酸(p<0.01)及尿素氮(p<0.05)含量。实验结果证实核糖复方总体效果优于人参玛咖及核糖单方的抗疲劳功效;对急性疲劳中的小鼠,D-核糖及其核糖复方均具有明显的抗疲劳作用;对长期疲劳的小鼠,D-核糖没有表现出明显的抗疲劳作用。
小鼠,抗疲劳,D-核糖,人参,玛咖,D-核糖复方
D-核糖天然存在于所有生命细胞中,是生物体内遗传物质核酸的重要组成成份,与腺苷酸的形成和ATP的再生有关[1]。D-核糖除了在核苷类物质、蛋白质及脂肪代谢中处于枢纽位置[2],具有重要的生物功能外,更在心脏和骨骼肌代谢中起关键作用。D-核糖的生理作用已成为近年来营养保健领域的研究热点,其临床应用也逐渐增多[3]。欧美市场上有关D-核糖的食品及保健食品比较丰富[4],国内以D-核糖作为功效因子添加的保健食品较少。研究表明,D-核糖能够促进局部缺血组织、局部缺氧组织的功能恢复[5]、还有助于由心肌缺血缺氧引起的心脏功能下降的恢复[6]。还有数据表明,D-核糖能有效解除机体疲劳、消除肌肉酸痛强直[7]及痉挛[8],外源D-核糖通过直接进入ATP的重新合成过程[1]显现出明显的抗疲劳功能。但前期的动物实验数据却反映出D-核糖在提高动物的耐力上具有一定的局限性。国内外诸多文献表明,人参[9]、玛咖[10]具有良好的抗疲劳功效,其作用原理有别于D-核糖的机制。为此,本课题拟以核糖、人参和玛咖组成复合配方,探究复方D-核糖对小鼠游泳能力及长期疲劳后生理功能的影响。
1 材料与方法
1.1 材料与仪器
SPF级昆明种小鼠 100只,动物批号:N0.37009200000724,济南朋悦实验动物繁育有限公司,4周龄,体质量(19±1) g,单一雄性;标准鼠颗粒饲料 济南朋悦实验动物繁育有限公司;D-核糖 纯度99.2%,由江西诚志生物工程有限公司提供;人参提取物(UV含量10%)、玛咖提取物 由浙江天草生物制品有限公司提供;其它试剂 均为国产分析纯。
塑料游泳箱(80 cm×50 cm×50 cm);S-3100紫外分光光度计 Scinco;5804R台式冷冻离心机 Eppendorf;BIO-MEDICAL超低温保存冰箱 Haier;双列大孔仪表恒温水浴锅 上海树立仪器仪表有限公司;FB224电子分析天平 上海舜宇恒平科学仪器有限公司;乳酸测定试剂盒、肝糖原试剂盒、血清尿素氮试剂盒 南京建成生物工程研究所。
1.2 实验方法
1.2.1 样品制备 各组灌胃液均以高温灭菌的双蒸水为溶剂,4 ℃储存。100 mL核糖复方中含有10 g D-核糖、1 g人参提取物、1 g玛咖提取物;100 mL人参玛咖溶液含有1 g人参提取物、1 g玛咖提取物;100 mL核糖溶液含有10 g D-核糖。D-核糖的剂量选择参考Hellsten[11]的报道,核糖复方剂量的选择参考预实验优选结果。
1.2.2 动物分组与模型 100只小鼠购进后,实验室适应性饲养7 d,进行连续3 d的适应性游泳训练,每天游泳20 min。随后进行游泳能力筛选实验,淘汰体重及游泳能力与平均水平有显著性差异的小鼠,淘汰后剩余80只。按体重随机分为4组,每组20只,分别为生理盐水组(NC组)、D-核糖组(DH组)、人参玛咖组(RM组)、核糖复方组(HF组)。每日灌胃1次,连续28 d,每两天称体重1次,根据小鼠的体重按0.10 mL/10 g剂量经口灌胃,每天给药30 min后进行负重游泳实验。每天负重游泳实验的水箱温度为25 ℃,铅皮绑定在小鼠尾根部。
急性疲劳模型:第1周绑定小鼠体质量3.5%的铅皮游泳,每天游泳至力竭,记录力竭时间,通过比较同一组小鼠每天的游泳能力是否呈现稳定的显著性差异,来决定小鼠的急性疲劳模型是否成功。长期疲劳模型:第2周负重增加为体质量的4%,每天游泳至力竭,捞出并记录时间;第3周负重增加为体质量的4.5%,每天游泳至力竭;第4周的每天上午增加不负重游泳10 min(水温20 ℃),间隔6 h后再进行负重体质量5%的游泳,共4周。
1.2.3 样品处理以及指标测定 末次给药30 min后,进行负重游泳实验,待小鼠力竭后捞出,各组一半小鼠立即取血,剩余一半小鼠在运动24 h后取血。取血方式是用毛细管从眼眶内眦采血0.7 mL(不加抗凝剂),然后将血液置4 ℃冰箱约2 h,3700 r/min离心10 min后取血清,血清分装两管,置于-20 ℃冰箱冻存。前面一半小鼠取血后立即颈椎脱臼处死,剩余的小鼠运动结束72 h后以同样方法处死,取出肝脏、心脏、腓肠肌,将样品迅速投到液氮中速冻,然后转移至-80 ℃冰箱保存。取肝脏约0.1 g在冰冷的生理盐水中漂洗,除去血液,滤纸拭干,称重,根据试剂盒说明书要求测定肝糖原含量(蒽酮法)。血清解冻后,根据试剂盒说明书要求测定血清的尿素氮含量(二乙酰肟比色法)和血清乳酸含量(比色法)。
1.3 数据处理
本实验数据使用SPSS 19统计软件进行分析,各组的结果分别以平均数±标准差表示,组间的数据差异比较用单因素方差分析法,当数据的差异有统计学意义时再用最小显著差值法(LSD)进行两两比较。
2 结果与讨论
2.1 小鼠第1周的游泳时间比较
由图1~图4可知,各组小鼠在前期先进入游泳适应期,游泳能力达到顶峰后逐渐下降或趋于平稳。生理盐水组第4 d游泳能力最强,平均游泳时间由415 s提高到536 s;D-核糖组第3 d游泳能力最强,平均游泳时间由416 s提高到712 s;人参玛咖组第2 d游泳能力最强,平均游泳时间由426 s提高到556 s;核糖复方组第2 d游泳能力最强,平均游泳时间由452 s提高到664 s。各组出现最强游泳能力后,随后几天与这一天比较出现不同程度的显著性差异,说明各组均进入不同程度的运动性疲劳期,表明急性疲劳模型构建成功。
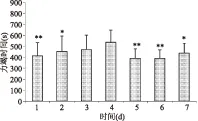
图1 NC组小鼠第1周力竭时间Fig.1 Swimming time of the NC group of first week注:各实验组每天的力竭时间与该组力竭时间最高值比较,*表示有显著性差异(p<0.05),**表示有极显著性差异(p<0.01);图2~图4同。
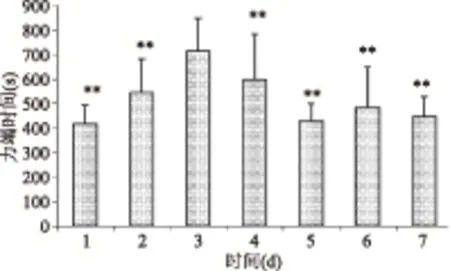
图2 DH组小鼠第1周力竭时间Fig.2 Swimming time of the DH group of first week
表1 各组小鼠负重游泳力竭时间比较±s,n=20)
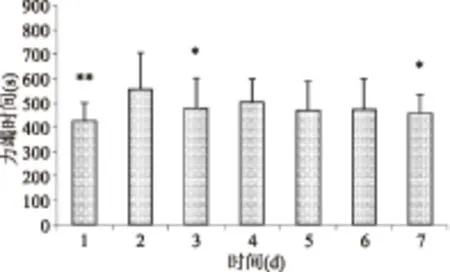
图3 RM组小鼠第1周力竭时间Fig.3 Swimming time of the RM group of first week
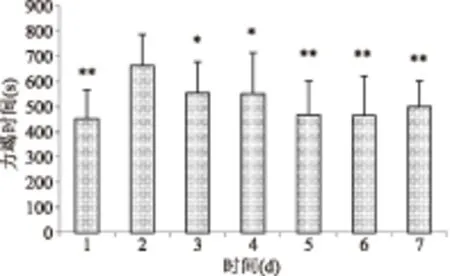
图4 HF组小鼠第1周力竭时间Fig.4 Swimming time of the HF group of first week
注:*表示与生理盐水组组比较差异显著,p<0.05;**表示与生理盐水组组比较差异极显著,p<0.01。2.2 各处理组小鼠负重游泳力竭时间
由表1数据可知,与生理盐水组比较,核糖组在第3 d呈极显著性差异,人参玛咖组在第9、11、23、27 d呈显著性差异,核糖复方组在第2、5、8、9、11、27 d呈显著性差异。数据表明,D-核糖在运动前期具有一定抗疲劳功效,但在后期功效不显著;人参玛咖组合物的抗疲劳功效主要体现在疲劳模型后期;核糖复方组合物在全程均具有一定的抗疲劳功效。人参玛咖复方的抗疲劳功效比较慢速,所以在前期的作用不明显,在后期逐渐呈现出一定的抗疲劳功效。
外源供给的D-核糖在机体内代谢迅速[12],可以绕过磷酸戊糖途径中的限速步骤,使心肌和骨骼肌细胞通过重新合成过程快速合成5-磷酸核糖-1-焦磷[13](PRPP)。随着PRPP含量增加,肌肉组织的腺苷酸合成速度加快,从而使组织中的ATP含量得以快速恢复[14]。这样,组织中增加的ATP将支持肌肉组织进行更长时间的收缩,小鼠的游泳能力也会相应延长,这一作用使D-核糖在疲劳模型前期具有一定功效。随着疲劳程度的增加,核糖组的优势逐渐不明显,可能是由于D-核糖对机体ATP的补充作用弥补不了它的流失,说明核糖在长期疲劳中的作用不显著,实验结果与Hellsten[11]等的研究结果相符。
2.3 对小鼠肝糖元的影响
由表2数据可知,运动后即刻,与生理盐水对照组比较,D-核糖组无明显变化;人参玛咖组有显著性提高(p<0.05);核糖复方组有极显著提高(p<0.01)。D-核糖组的肝糖原含量极显著低于核糖复方组(p<0.01),人参玛咖组低于核糖复方组但无统计学意义。
机体处于疲劳状态时,糖分解代谢占优势,为了维持稳定的血糖浓度,机体的糖异生作用将加强[15],同时机体会促进糖原降解,抑制肝糖原合成[16],所以肝糖原的含量是机体抗疲劳的指标之一。本实验中核糖复方及人参玛咖组可以明显的提高运动中小鼠的肝糖原含量,D-核糖组并未出现显著性增加,说明核糖复方中人参玛咖组合物可以增加肝糖原的储备。在长期运动疲劳中,人参玛咖与核糖复方可以具有良好的作用,可能是核糖复方中的人参玛咖通过提高小鼠的肝糖原储备,来提高小鼠的抗疲劳作用。
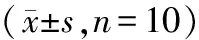
表2 各组小鼠肝糖原的比较
注:*表示与NC组比较差异显著,p<0.05;**表示与NC组比较差异极显著,p<0.01;#表示与核糖复方组比较差异显著,p<0.05;##表示与核糖复方组比较差异极显著,p<0.01;表3、表4同。
2.4 对小鼠血乳酸的影响
由表3数据可知,运动后即刻,与生理盐水对照组比较,核糖复方组乳酸含量极显著降低(p<0.01);核糖组与人参玛咖组降低不显著。与核糖复方组比较,人参玛咖组显著高于核糖复方组;核糖组无显著性差异。运动后24 h,与生理盐水对照组比较,D-核糖组与核糖复方组均有显著降低(p<0.05)。与核糖复方组比较,核糖组与人参玛咖组没有显著性差异。数据表明,核糖可以加速乳酸循环及乳酸的清除速度,可能是由于核糖可以加速乳酸循环速度,人参玛咖在清除乳酸的作用上不明显。
机体经历血供不足、高强度运动或重体力劳动时,心肌和骨骼肌处于相对缺氧状态,细胞的有氧氧化过程受到严重抑制,转而以糖酵解过程为主要供能来源[17],导致肌肉组织中丙酮酸、乳酸的大量累积,血浆乳酸水平上升,加重机体疲劳感,所以乳素的含量可以表明机体的疲劳程度。运动后即刻,核糖复方的乳酸含量显著低于生理盐水组,说明核糖复方抗疲劳的作用最明显。小鼠恢复24 h后,核糖及其核糖复方组的乳酸显著低于生理盐水组,说明疲劳后恢复期,D-核糖及其复方可以加快机体的乳酸清除速度,提高乳酸的清除能力,防止乳酸堆积,从而有利于运动后机体的体力恢复。
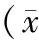
表3 各组小鼠乳酸含量的比较±s,n=10)
2.5 对小鼠尿素氮的影响
由表4可知,运动后即刻,与生理盐水组比较,D-核糖组出现极显著降低(p<0.01);核糖复方组出现显著下降;人参玛咖组没有显著性变化。与核糖复方组比较,人参玛咖组与核糖组无显著性差异。运动后24 h,D-核糖组的血清尿素氮含量出现极显著降低(p<0.01);核糖复方组出现显著下降(p<0.05);人参玛咖组没有显著性变化。与核糖复方组比较,人参玛咖组极显著(p<0.01)高于核糖复方组;核糖组显著性(p<0.05)低于核糖复方组。
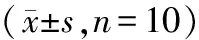
表4 各组小鼠尿素氮的比较
机体疲劳时,机体不能通过糖代谢和脂肪代谢产生足够能量,会引起蛋白质代谢增加[18],蛋白质降解、脱氨基作用加强,使进入肝脏鸟氨酸循环的氨增多[19],从而导致血浆尿素氮水平上升,所以尿素氮的含量是机体疲劳状态的指标之一。本实验中,运动后即刻核糖及其核糖复方组尿素氮含量显著降低,说明在运动期间核糖可以降低机体蛋白质的分解速度的作用,降低疲劳对机体的不利影响;人参玛咖复方在降低尿素氮含量的作用上不明显。运动后24 h,核糖组的尿素氮平均含量由3.39 mmol/L下降到2.85 mmol/L,说明核糖还具有一定清除血清尿素氮的作用,核糖复方组的清除速度显著低于核糖组的清除速度,但依然与生理盐水组有显著性差异,可能是由于测量误差引起。
3 结论
本实验成功的建立了一个小鼠运动疲劳模型,各组小鼠均出现了运动性疲劳。在第一周负重游泳实验中,核糖复方组与核糖组小鼠游泳力竭时间显著高于人参玛咖组及生理盐水组。随着小鼠机体的进一步疲劳,D-核糖的作用不在显著,人参玛咖复方的抗疲劳功效逐渐体现。实验结果证实对急性疲劳中的小鼠,D-核糖具有明显的抗疲劳作用;对长期疲劳的小鼠,D-核糖没有表现出明显的抗疲劳作用。核糖复方在两种疲劳状态下均具有良好的功效,其总体效果优于人参玛咖复方及核糖单方的抗疲劳功效,其可能通过提高机体内的肝糖原储备,降低血清尿素氮含量及减少乳酸堆积来作用于机体,产生一定的抗疲劳效果,有关其抗疲劳机理还需要进一步探讨。本实验结果为更有效的利用D-核糖,以及开发核糖相关的抗疲劳功能产品提供了一定的实验基础和理论根据。
[1]Stephen T.Sinatra. The Sinatra Solution[M]. USA:2005,Basic Health Publications:128-136.
[2]Melike Bayram. D-ribose aids heart failure patients with preserved ejection fraction and diastolic dysfunction:a pilot study[J]. Ther Adv Cardiovasc Dis,2015,9(3):56-65.
[3]周珏,魏转,孙文敬.D-核糖的生产及应用[J].食品科技,2014,39(10):273-278.
[4]王正平. 一种新型能量饮料添加剂—D-核糖支持骨骼肌的健康和功能之机理浅(之一)[J]. 食品工业科技,2008(4):26.
[5]Mac Carter D,Vijay N,Washam M,et al. D-ribose aids advanced ischemic heart failure patients[J]. International Journal of Cardiology,2008,137(1):79-80.
[6]王亚坤,孙文敬,秦丽.D-核糖功能与应用研究进展[J].食品科学,2005,26(8):486-489.
[7]Kiterie M E Faller,Debra J Medway,Dunja Aksentijevic,et al. Ribose supplementation alone or with elevated creatine does not preserve high energy nucleotides or cardiacfunction in the failing mouse heart[J]. PLo S ONE,2013,8(6):661-664.
[8]Jeff Thompson,Joel Neutel,Ken Homer,et al. Evaluation of D-Ribose Pharmacokinetics,Dose Proportionality,Food Effect,and Pharmacodynamics after Oral Solution Administration in Healthy Male and Female Subjects[J]. The Journal of Clinical Pharmacology,2013,54(5):546-554.
[9]龚梦鹃,谢媛媛,邹忠杰.基于小鼠游泳计算机自动控制系统的人参抗疲劳作用研究[J].中国实验方剂学杂志,2014,20(3):140-143.
[10]胡远,李兴平,周毅,等. 引种玛咖的抗疲劳实验研究[J]. 华西药学杂志,2015,30(4):440-441.
[11]Hellsten Y,Skadhauge L,Bangsbo J. Effect of ribose supplementation on resynthesis of adenine nucleotides after intense intermittent training in humans[J]. Am J Physiol Regul Integr Comp Physiol,2004,286:182-188.
[12]阿丽玛,田明杰,韩涛,等.D-核糖对高脂喂饲小鼠胰岛素抵抗的影响[J]. 营养学报,2013,35(2):142-145.
[13]Wei Yan,Han Chan Shuai,Zhou Jun,et al.D-ribose in glycation and protein aggregation[J]. Biochimica et Biophysica Acta,2012:488-494.
[14]王亚坤,李梦,魏转,等.补充D-核糖对大鼠游泳及恢复期心肌、骨骼肌高能磷酸物质的影响[J].食品科学,2015,36(11):202-207.
[15]Paul Addis,Linda M. Shecterle.Cellular Protection During Oxidative Stress:A Potential Role for D-ribose and Antioxidants[J]. Journal of Dietary Supplements,2012,9(3):178-182.
[16]Chi Aiping,Li Hong,Kang Chenzhe,et al. Anti-fatigue activity of a novel polysaccharide conjugates from Ziyang green tea[J].International Journal of Biological Macromolecules,2015,80:566-572.
[17]Melike Bayram,JA St Cyr,William T. Abraham.D-Ribose aids heart failure patients with preserved ejection fraction and diastolic dysfunction:a pilot study[J]. Ther Adv Cardiovasc Dis,2015,9(3):56-65.
[18]田颖刚,牛俊卿,谢明勇,等. 芦笋提取物抗疲劳及耐缺氧活性研究[J].食品工业科技,2013,34(13):325-329.
[19]G Phani Kumar,T Anand,Dongzagin Singsit,et al. Evaluation of antioxidant and anti-fatigue properties of Trigonella foenum-graecum L. in rats subjected to weight loaded forced swim test[J]. Pharmacognosy Journal,2013,5:66-71.
Study on anti-fatigue effect of compound D-ribose on mice
YUAN Bao-hui,LIU Gui-qin,LIU Min,LI Da-cheng,HAN Jun,WANG Zheng-ping
(Laboratory of Clinical Nutrition,Liaocheng University,Liaocheng 252000,China)
In this study,80 male mice were examined over a 4-week period of daily gavage feeding to study the effects of D-ribose compounds on the ability of mice to withstand fatigue. The mice were randomly divided into the saline control group,the ribose group,the ginseng and maca group,and the ribose compounds group. Each group was given the appropriate intervening measures,and the mice were evaluated at 0 hours and 24 hours after their movements to measure changes in lactic acid,urea nitrogen,and liver glycogen. The results showed that D-ribose and ribose compounds,during periods of extreme fatigue,could significantly extend the swimming time of mice(p<0.05),and that ribose compounds could increase liver glycogen(p<0.01)and decrease lactic acid(p<0.01)and urea nitrogen concentration(p<0.05). The results also confirmed that the compound d-ribose was better than the D-ribose or the ginseng and maca group in general terms and during period of extreme fatigue in mice,D-ribose and ribose compounded clearly possess anti-fatigue properties. With regards to long-term fatigue,D-ribose did not show clear anti-fatigue uses.
mice;anti-fatigue;D-ribose;ginseng;maca;D-ribose compounds
2016-06-13
袁保辉(1990-),男,硕士研究生,研究方向:营养学,E-mail:lcuyuanbaohui@163.com。
*通讯作者:王正平(1961-),女,教授,研究方向:临床营养,E-mail:bioactiveschina@163.com。
聊城市科技计划项目(2013 GJH15);聊城大学科技项目(318011405);聊城大学大学生科技文化创新基金项目(26312158809)。
TS201.4
A
1002-0306(2016)22-0349-05
10.13386/j.issn1002-0306.2016.22.060
