响应面法优化板栗多肽制备及其清除DPPH·能力的研究
2017-01-13冯艳霞贾一凡顾海华王丰俊
冯艳霞,贾一凡,顾海华,王丰俊
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
响应面法优化板栗多肽制备及其清除DPPH·能力的研究
冯艳霞,贾一凡,顾海华,王丰俊*
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
采用碱性蛋白酶酶解板栗蛋白制备抗氧化肽并测定其清除DPPH·能力。以水解度及DPPH·清除率为指标通过单因素实验初步得到板栗多肽提取工艺,再根据Box-Behnken中心组合实验设计原理,采用四因素三水平响应面分析法,建立了以加酶量、酶解温度、酶解pH、酶解时间与响应值DPPH·清除能力间的回归方程预测模型,确定了板栗抗氧化肽的最佳制备工艺条件:加酶量2.5%,酶解温度50 ℃,酶解pH9.5,酶解时间3.7 h。在此条件下DPPH·清除率为92.86%,与理论值基本相符。
板栗多肽,酶解,响应面,DPPH·
板栗(Castaneamollissima)属壳斗科、栗属、坚果类植物[1]。板栗仁含有丰富的淀粉、蛋白质、脂肪、钙、磷、铁以及多种维生素,具有养胃健脾、补肾强筋、活血止血之功效[2]。板栗中蛋白质含量约为5%~11%,高于稻米,其中赖氨酸、苏氨酸、色氨酸、蛋氨酸等含量超过FAO/WHO的标准[3]。但目前对板栗的研究多集中在板栗淀粉上,对其蛋白的研究很少,蛋白质酶解后可以得到具有抗氧化、降血压、抗菌等活性的多肽类物质[4],为了更加合理有效地利用板栗蛋白资源,对多肽的研究是十分必要的。
目前食品工业中使用的抗氧化剂多数为人工合成,毒副作用大[5],而一些天然抗氧化剂因原料、价格、颜色以及其他一些因素使其应用受到限制,各种原料生产的抗氧化肽以其分子量小、易吸收、活性强等特点受到重视,并能有效地清除体内过剩的活性氧自由基,保护细胞和线粒体的正常结构和功能,防止脂质过氧化的发生,因而筛选具有强抗氧化活性的天然资源已成为生物学、医学和食品科学研究的新趋势[6]。酶解法制多肽因其反应条件温和、反应时间短、效率高,在一定条件下可以定位水解,且反应过程易控制,产品纯度高,成本低廉,可较好地满足肽的生产需要,是获得食品级生物活性肽的常用方法[7]。吕佼等研究了板栗蛋白的提取工艺[8-9],李艳等从板栗中分离鉴定出了欧栗球蛋白并研究了其活性[10],张帅等研究了板栗蛋白的水解工艺[11-12],但目前对板栗多肽抗氧化活性的研究报道很少。本研究以DPPH·清除能力为指标,通过响应面法优化了板栗抗氧化多肽的制备条件。
1 材料与方法
1.1 材料与仪器
新鲜板栗 河北迁西板栗研发工程中心提供;碱性蛋白酶(2000 U/g) 丹麦诺维信公司;DPPH Sigma公司;其它试剂 国产分析纯。
JAV-Ⅳ型超声波细胞粉碎仪 济宁市奥波超声波电器有限公司;Thermo Fisher LL1500冻干机 美国赛默飞世尔科技有限公司;H/T16MM型高速离心机 湖南赫西仪器装备有限公司;DHG-903385-Ⅲ型电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;DK-98-Ⅱ型电热恒温水浴锅 天津市泰斯特仪器有限公司;实验室pH计 梅特勒-托利多仪器有限公司;SHA-BA水浴恒温振荡器 金坛市荣华仪器制造有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 板栗蛋白的制备 采用超声波辅助碱溶酸沉法[8],准确称取板栗粉,按1∶10料液比加入蒸馏水,用1 mol/L NaOH调节pH到10,超声波破碎14 min后,在40 ℃水浴温度下提取83 min。浸提液4000 r/min离心15 min,取上清液,考马斯亮兰法测上清液中板栗蛋白含量[13]。
1.2.2 板栗多肽的制备 参照许慧娇等人的方法并作适当的修改[14]。
板栗蛋白溶液→水浴(90 ℃,10 min)→调pH至酶解条件→加酶→恒温水浴酶解→100 ℃,10 min灭酶→调pH至4.2→离心(4000 r/min,5 min)→上清液调pH至7.0→冷冻干燥→板栗多肽。
1.2.3 板栗蛋白水解度的测定 水解度的测定采用TCA法[15]。
1.2.4 板栗多肽DPPH·清除能力的测定 将冷冻干燥后的蛋白酶解产物用超纯水配制成质量浓度为2.0 mg/mL的溶液,取2.0 mL于10 mL试管中,然后加入浓度为0.2 mol/L的磷酸缓冲溶液(pH为7.0)1.0 mL和浓度为0.2 mmol/L的DPPH·乙醇溶液2.0 mL,混合均匀,于室温下暗处静置30 min,然后在波长为517 nm处测定其吸光度[16-17]。清除率计算公式如下:
清除率(%)=[1-(A1-A2)/A0]×100
式中:A1-DPPH·溶液+样品溶液的吸光度;A2-体积分数95%的乙醇溶液+样品溶液的吸光度;A0-DPPH·溶液+超纯水的吸光度。
1.2.5 单因素实验 酶解步骤如1.2.2,在以下条件进行实验:固定pH9.5、温度50 ℃、水解时间4 h,研究加酶量(0.5%、2%、4%、6%、8%)对板栗蛋白水解度及多肽DPPH·清除率的影响;固定加酶量2%、pH9.5、水解时间4 h,研究酶解温度(40、45、50、55、60 ℃)对板栗蛋白水解度及多肽DPPH·清除率的影响;固定加酶量2%、温度50 ℃、水解时间4 h,研究酶解pH(8.5、9.0、9.5、10.0、10.5)对板栗蛋白水解度及多肽DPPH·清除率的影响;固定加酶量2%、pH9.5、温度50 ℃,研究酶解时间(2、4、6、8、10 h)对板栗蛋白水解度及多肽DPPH·清除率的影响。
1.2.6 响应面实验 根据Box-Behnken的中心组合实验设计原理和单因素实验的结果,选取加酶量、酶解温度、酶解pH、酶解时间四个因素为自变量,以DPPH·清除率为响应值,采用四因素三水平的响应面分析方法进行实验设计,其因素水平编码表见表1。
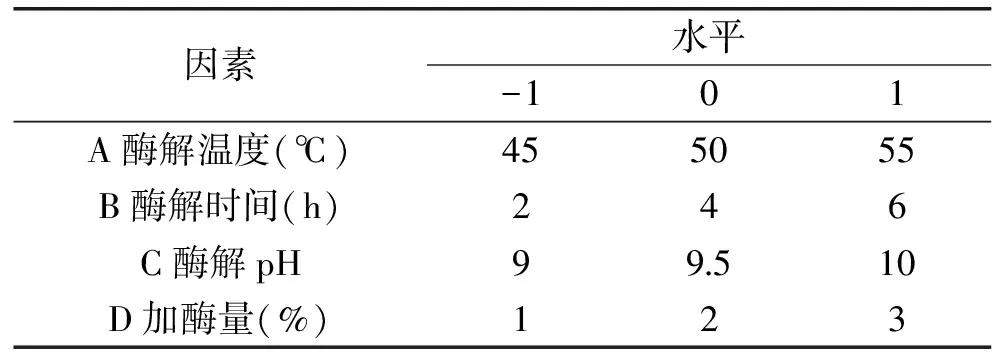
表1 实验因素和水平
1.3 数据处理
响应面实验结果利用Design-Expert 8.0软件进行分析,建立回归方程并作等高线和三维曲面图,对任意两种因素的交互效应进行分析和评价,得到最优加工工艺组合。其他实验结果均用Excel软件进行处理。
2 结果与分析
2.1 单因素实验
2.1.1 加酶量对板栗多肽水解度及DPPH·清除能力的影响 由图1可以看出,板栗多肽水解度随加酶量增加先升高,到达最高点后呈现缓慢下降趋势,在加酶量为2%时水解度达到最大。其DPPH·清除率随加酶量的增大先升高后降低,同样在加酶量为2%时达到最大值。加酶量小于4%时,可以看出随加酶量的增加,板栗多肽水解度及DPPH·清除率变化基本一致,因此用水解度代替DPPH·清除率为衡量指标研究其抗氧化活性。但当加酶量大于4%时,DPPH·清除率的下降速率要比水解度的大,原因可能是过多的加酶量会使蛋白过度水解从而使小分子量的活性多肽分解氨基酸,从而活性降低。因此,此条件下选择加酶量1%、2%、3%为响应面优化条件。
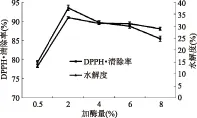
图1 加酶量对水解度及DPPH·清除率的影响Fig.1 Effect of enzyme concentration on degree of hydrolysis and DPPH· scavenging ability
2.1.2 温度对板栗多肽水解度及DPPH·清除能力的影响 由图2可以看出,当酶解温度低于50 ℃时,板栗蛋白水解度及多肽清除DPPH·的能力均随加酶量的增加逐渐增加,在酶解温度为50 ℃时,达到最大值,酶解温度高于50 ℃时,随着酶解温度的升高,清除率及水解度均下降,原因可能是较高的温度会降低酶的活力,从而使水解度及DPPH·清除率也下降。从图2中可以看出,随着温度的增加,水解度及DPPH·清除率的变化趋势基本相同,因此该条件下可以用水解度代替DPPH·清除率为指标评价抗氧化活性。碱性蛋白酶的酶解温度选择50 ℃ 较合适,因此选择45、50、55 ℃为响应面优化条件。
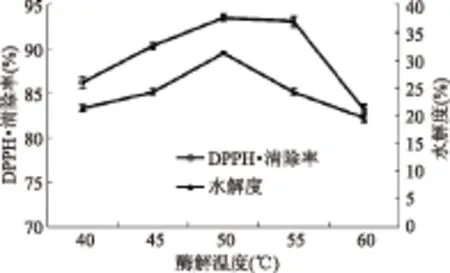
图2 酶解温度对水解度及DPPH·清除率的影响Fig.2 Effect of temperature on degree of hydrolysis and DPPH· scavenging ability
2.1.3 pH对板栗多肽水解度及DPPH·清除能力的影响 由图3可以看出,随pH的增加,水解度及DPPH·清除率均呈现先升高后降低的趋势,当pH为9.5时,DPPH·清除率达到最大值,随着pH的继续增大,DPPH·清除率迅速下降,原因可能是较大的pH破坏了活性多肽的结构,从而使其活性降低。而水解度在pH为10时达到最大,随后稍有下降,可以看出碱性蛋白酶的最适pH为10。考虑到实验的研究重点,因此选择pH9.0、9.5、10为响应面优化条件。
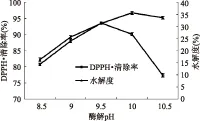
图3 酶解pH对水解度及DPPH·清除率的影响Fig.3 Effect of pH on degree of hydrolysis and DPPH· scavenging ability
2.1.4 酶解时间对板栗多肽水解度及DPPH·清除能力的影响 由图4可以看出,随着酶解时间的增加,水解度不断增大,在酶解时间为8 h时趋于稳定,而DPPH·清除率却先升高后降低,在酶解时间为4 h时达到最大值。两者变化趋势不一样的可能原因是随着酶解时间的增加,一些小分子的多肽水解为氨基酸,从而丧失了抗氧化活性。因此在此酶解条件下,选择2、4、6 h为响应面优化条件。
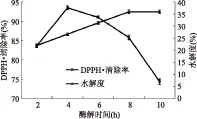
图4 酶解时间对水解度及DPPH·清除率的影响Fig.4 Effect of hydrolysis time on degree of hydrolysis and DPPH· scavenging ability
2.2 响应面优化实验
2.2.1 响应面模型的建立及结果 实验设计及结果如表2所示。采用Design Expert 8.0统计软件对实验结果进行响应面回归分析,回归方程的方差显著性检验分析结果如表3所示。
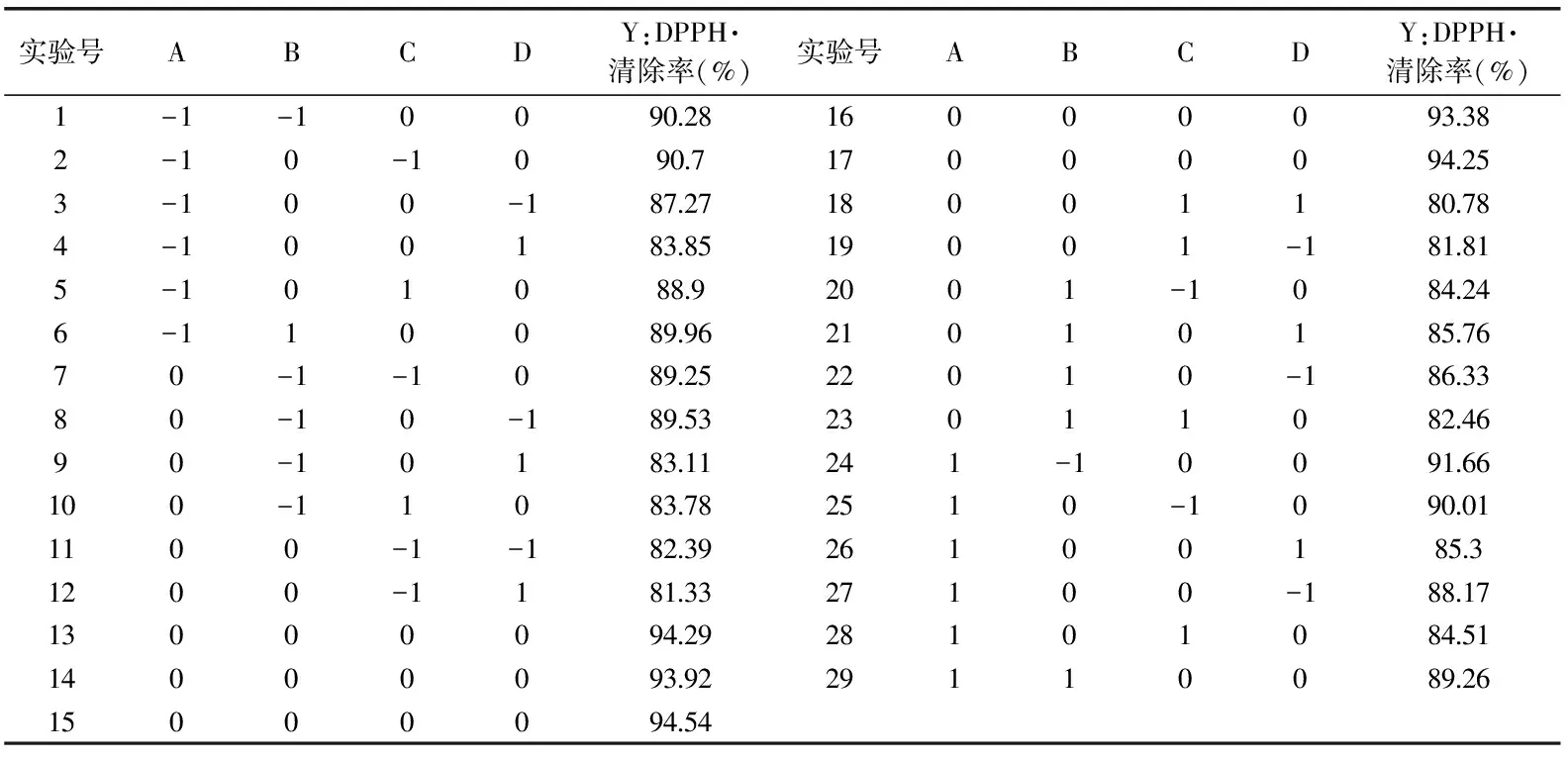
表2 响应面实验设计及结果
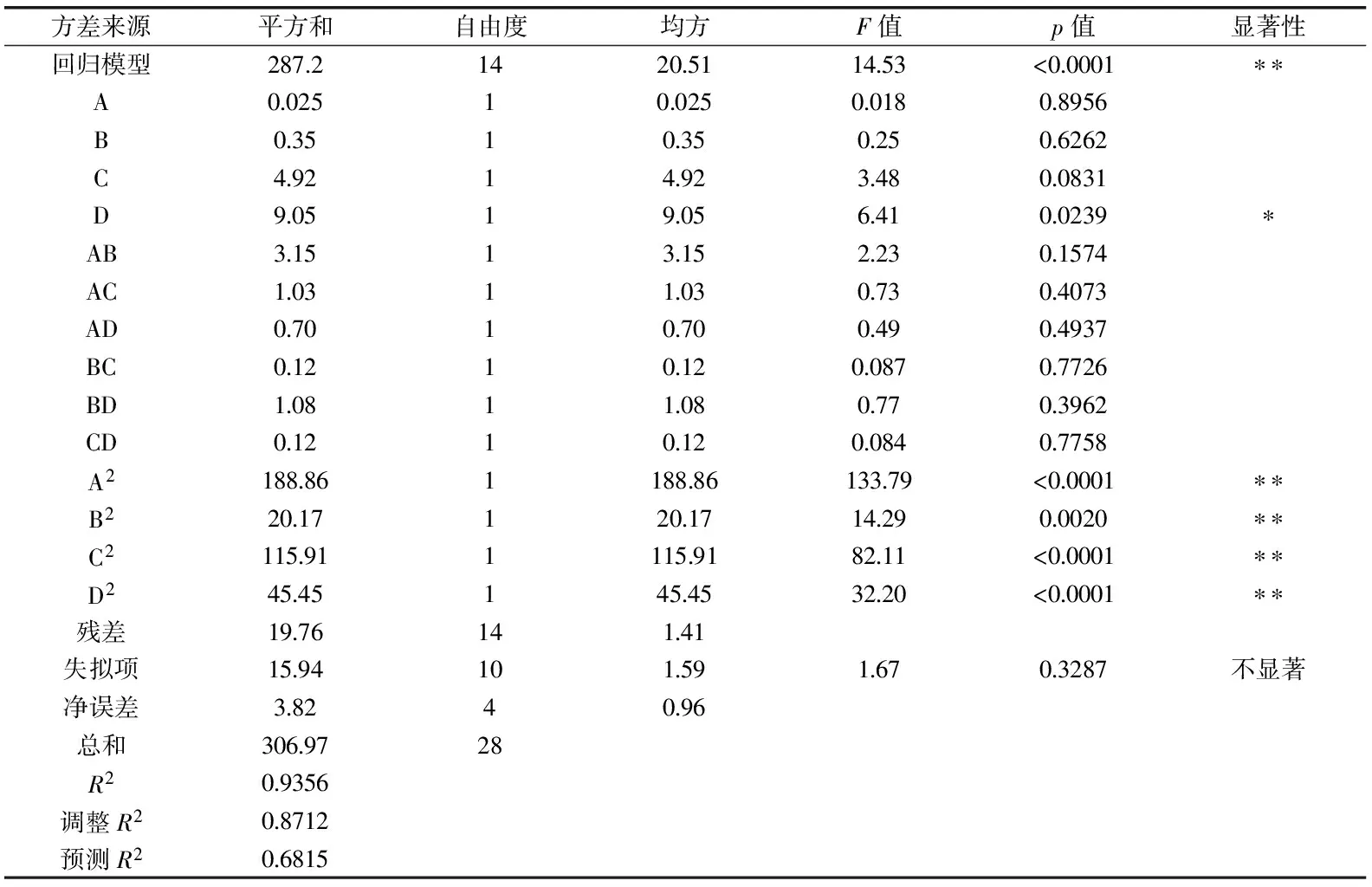
表3 回归分析结果
注:* 差异显著p<0.05,** 差异极显著,p<0.01。 实验数据进行二次回归分析,得到回归方程:Y(%)=2.19A+7.54B+320.76C+5.4D+0.18AB+1.02AC+0.21AD-0.07BC-0.05BD+0.17CD-5.4A2-0.07B2-16.91C2-0.66D2-1622.54。回归方程中二次项A2、B2、C2、D2的系数均为负数,说明回归方程存在稳定点,即极大值点。
图5~图10直观地反映了各因素对响应值的影响,随着各个因素增加,对响应值的影响都呈现先升高再降低的趋势。由以上分析可知,在各因素中心点附近,多肽有最大的DPPH·清除率,回归方程具有最优水平。
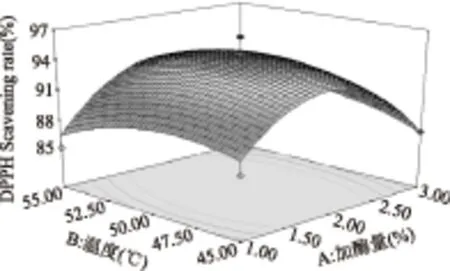
图5 温度与加酶量对DPPH·清除率影响的响应面图Fig.5 Responsive surfaces of effect of temperature and enzyme concentration on DPPH· scavenging ability
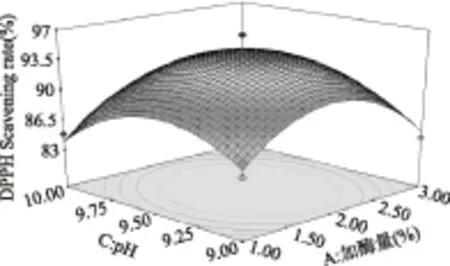
图6 pH与加酶量对DPPH·清除率影响的响应面图Fig.6 Responsive surfaces of effect of pH and enzyme concentration on DPPH· scavenging ability
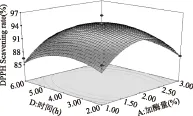
图7 时间与加酶量对DPPH·清除率影响的响应面图Fig.7 Responsive surfaces of effect of time and enzyme concentration on DPPH· scavenging ability
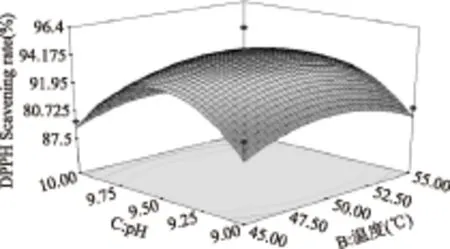
图8 pH与温度对DPPH·清除率影响的响应面图Fig.8 Responsive surfaces of effect of pH and temperature on DPPH· scavenging ability
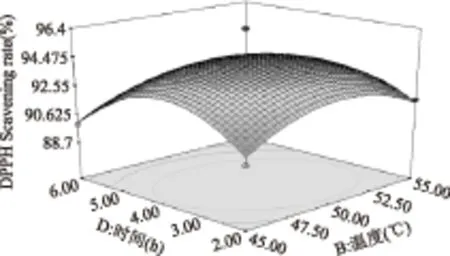
图9 时间与温度对DPPH·清除率影响的响应面图Fig.9 Responsive surfaces of effect of time and temperature on DPPH· scavenging ability
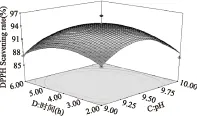
图10 时间与pH对DPPH·清除率影响的响应面图Fig.10 Responsive surfaces of effect of time and pH on DPPH· scavenging ability
2.2.2 酶解工艺条件的确定 为进一步确定最佳点,利用Design Expert 8.0软件程序对工艺条件进行优化,可得板栗蛋白酶解的最优水平为:加酶量2.53%,酶解温度50.54 ℃,酶解pH9.48,酶解时间3.73 h,在此工艺条件下,软件程序对板栗蛋白酶解物DPPH·清除率的预测值为93.19%。为了实际的操作方便,将板栗蛋白酶解的工艺参数修正为:加酶量2.5%,酶解温度50 ℃,酶解pH9.5,酶解时间3.7 h。在此条件下实际测得的DPPH·清除率为92.86%,与理论预测值相比相对误差在0.35%左右,其IC50值为3.336 mg/mL。采用修正后的提取工艺参数准确可靠,具有实用价值。
3 结论
采用碱溶酸沉法提取板栗蛋白,经碱性蛋白酶酶解制备板栗多肽,并测定板栗多肽的水解度及DPPH·清除能力。通过单因素实验和Box-Behnken实验设计以及响应面分析,建立响应值与各因素之间的数学模型,用响应面分析法对工艺参数进行优化,得到制备板栗多肽的最佳工艺参数:加酶量2.5%,酶解温度50 ℃,酶解pH9.5,酶解时间3.7 h。在此条件下实际测得的DPPH·清除率为92.86%,IC50值为3.336 mg/mL。
[1]张乐,王赵改,杨慧,等.不同板栗品种营养成分及风味物质分析[J]. 食品科学,2016,37(10):164-169.
[2]龙志敏,吴立军,孙博航,等. 板栗种仁的化学成分(Ⅳ)[J]. 沈阳药科大学学报,2009,26(8):614-616.
[3]张袖丽,胡颖蕙,檀华榕. 板栗品质的化学成分分析和评价[J]. 安徽农业科学,1996,24(4):330-331,334.
[4]R E Cian,O M Augustin,S R Drago. Bioactive properties of peptides obtained by enzymatic hydrolysis from protein byproducts of Porphyra columbina[J]. Food Research International,2012(49):364-372.
[5]宋晓燕,高彦祥,袁芳. 响应面法优化羊胎粉中抗氧化多肽制备工艺的研究[J]. 食品科技,2008,33(11):237-241.
[6]裴小平,唐道邦,肖更生,等. 抗氧化肽制备的应用现状及趋势[J]. 食品工业科技,2009,30(2):319-322.
[7]李高扬. 蚕蛹抗氧化多肽的制备及分离纯化研究[D]. 广州:华南理工大学,2011.
[8]吕佼,赵媛,金世超,等. 响应面法优化超声波辅助提取板栗蛋白的工艺研究[J]. 中国粮油学报,2015(3):41-45.
[9]常学东,朱京涛,舒媛,等. 板栗水溶性蛋白质提取工艺的优化[J]. 食品科学,2004,25(11):141-143.
[10]李艳,张太平,张鹤云. 板栗中蛋白质的分离鉴定及活性研究[J]. 中国生化药物杂志,2012,33(4):365-368.
[11]张帅,张培宜,冯翠萍. 板栗蛋白质的提取及多肽的制备[J]. 山西农业大学学报:自然科学版,2011,31(1):73-76.
[12]郑瑞婷,刘长海,沈湘. 风味蛋白酶水解板栗蛋白工艺研究[J]. 广东农业科学,2010(4):146-148.
[13]P A Harnedy,M B Keeffe,R J FitzGerald. Purification and identification of dipeptidyl peptidase(DPP)IV inhibitory peptides from the macroalga Palmaria palmate[J]. Food Chemistry,2015(172):400-406.
[14]许慧娇,郝艳宾,齐建勋,等. 核桃蛋白酶解物体外抗氧化及降血压活性研究[J]. 农产品加工·创新版,2009(10):38-42.
[15]M R Marques,R A M S Freitas,A C C Carlos,et al. Peptides from cowpea present antioxidant activity,inhibit cholesterol synthesis and its solubilisation into micelles[J]. Food Chemistry,2015(168):288-293.
[16]Q J Yan,L H Huang,Q Sun,et al. Isolation,identification and synthesis of four novel antioxidant peptides from rice residue protein hydrolyzed by multiple proteases[J]. Food Chemistry,2015(179):290-295.
[17]李学鹏,王祺,励建荣,等.海参酶解液的体外抗氧化活性研究[J]. 食品工业科技,2014,35(24):100-103.
Optimization of extraction conditions of Chinese chestnut peptides by response surface methodology and its DPPH· scavenging abilities
FENG Yan-xia,JIA Yi-fan,GU Hai-hua,WANG Feng-jun*
(Key Laboratory of Forestry Food Processing and Security in Beijing,College of Biological Science and Technology of Beijing Forestry University,Beijing 100083,China)
Antioxidant peptide was prepared by alkaline protease enzymolysising Chinese chestnut protein and its antioxidant activity determined. The craft was obtained with the degree of hydrolysis and the DPPH· scavenging ratio as indicators by single factor tests primarily,then according to Box-Behnken central composition design principle,the method of response surface analysis with 4 factors and 3 levels combined with Design Expert 8.0-statistical data analysis software was adopted to establish the regression equation prediction model of enzyme dose,enzymolysis temperature,enzymolysis pH and enzymolysis time and the DPPH· scavenging ratio as the response value. The optimum preparation conditions were established as follows:enzymedose 2.5%,enzymolysis temperature 50 ℃,enzymolysis pH9.5 and enzymolysis time 3.7 h. Under these conditions,the DPPH· scavenging ratio reached 92.86%,consistent with the theoretical value.
Chinese chestnut peptides;enzymatic hydrolysis;response surface methodology;DPPH·
2016-06-15
冯艳霞(1990-),女,硕士研究生,研究方向:功能性蛋白研究,E-mail:13141234578@163.com。
*通讯作者:王丰俊(1975-),男,副教授,研究方向:油脂与植物蛋白研究,E-mail:wangfengjun@bjfu.edu.cn。
林业公益性行业科研专项重大项目(201204401)。
TS255.1
B
1002-0306(2016)22-0315-06
10.13386/j.issn1002-0306.2016.22.053
