基于响应面法优化Flavobacteriaceae sp.CZ1127中岩藻糖苷酶提取参数的研究
2017-01-13申晶晶董书君常耀光
陈 丰,王 俊,申晶晶,董书君,常耀光
(中国海洋大学食品科学与工程学院,山东青岛 266003)
基于响应面法优化Flavobacteriaceaesp.CZ1127中岩藻糖苷酶提取参数的研究
陈 丰,王 俊,申晶晶,董书君,常耀光*
(中国海洋大学食品科学与工程学院,山东青岛 266003)
海洋细菌Flavobacteriaceaesp.CZ1127胞内含有大量岩藻糖苷酶,为高效获取该胞内酶,本文比较了超声破碎法、化学试剂法、反复冻融法、溶菌酶法及渗透压冲击法等多种细胞破碎方法,确定了超声破碎法为较优的提取方式。在此基础上,利用响应面实验设计研究超声破碎各因素对提取效果的影响。最终建立了基于超声破碎法提取岩藻糖苷酶实验数据的数学模型,优化后的工艺条件参数为:破碎功率300 W,菌悬液浓度20 mg/mL,破碎总时长10.2 min,单次破碎时长2 s,间歇时长2 s。在优化条件下,Flavobacteriaceaesp.CZ1127菌体中获得岩藻糖苷酶酶活为(13285.6±274.3) mU/g。本文针对岩藻糖苷酶的提取建立了一种高效简便的方法,对该酶的进一步开发利用具有积极意义。
岩藻糖苷酶,提取,优化,响应面,Flavobacteriaceaesp.
L-岩藻糖是常出现于糖基片段末端的单糖之一,研究认为岩藻糖基化能够赋予被修饰的寡糖、多糖及复合物众多独特的功能特性,例如:以L-岩藻糖为主要组分的多糖类化合物-岩藻聚糖硫酸酯被证实具有抗肿瘤[1]、抗凝血[2]、调节免疫[3]以及预防乙醇型胃溃疡[4]等多种生理调节功能;对一种海参来源类硫酸软骨素的研究表明,去掉其岩藻糖支链将显著降低其抗凝血活性[5];岩藻糖基化乳糖作为人乳寡糖的重要成分,是婴儿发育早期重要的益生元[6-7]。岩藻糖基化化合物在功能食品开发方面展现出巨大潜力,如日本的“海の雫”冲剂和韩国“FUCOIDAN”口服液等基于岩藻聚糖硫酸酯开发的功能食品已实现商业化,但国内仍缺乏相关产品。岩藻糖苷酶是研究及改造岩藻糖基化化合物不可缺少的工具酶[8],因此,岩藻糖苷酶的获取及进一步应用可能将有利于岩藻糖基化化合物的研究与产品开发。
岩藻糖苷酶广泛存在于动物、植物与微生物中,相较动物与植物产生的岩藻糖苷酶,微生物所产生的酶产量更大,更适于大规模发酵生产以及满足应用所需[8-9]。本课题组前期从近海海水中筛选得到一株海洋细菌Flavobacteriaceaesp.CZ1127,可大量产生岩藻糖苷酶,但其主要产酶位置为胞内。基于此背景,本研究拟针对Flavobacteriaceaesp.CZ1127胞内岩藻糖苷酶的提取方式及条件展开系统探索,从而为该酶制备与应用奠定基础。
1 材料与方法
1.1 材料与仪器
Flavobacteriaceaesp.CZ1127 本实验室分离于近海海水[10],保藏于中国典型微生物保藏中心(保藏号:CCTCC AB 2015089T);海地瓜参(Acaudinamolpadioides) 购自青岛南山水产品市场;TritonX-100 AMRESCO公司;对硝基苯酚岩藻糖苷、十二烷基硫酸钠(SDS) Sigma公司;吐温20、吐温40、吐温60、吐温80 天津博迪化工股份有限公司;溶菌酶 北京Solarbio科技有限公司;其他试剂 购于国药集团化学试剂有限公司。
高速冷冻离心机 上海安亭科学仪器厂;HZQ-F160振荡培养箱 哈尔滨市东联生化仪器;UV-2550紫外可见分光光度计 SHIMADZU公司;Scientz-650E超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 岩藻聚糖硫酸酯的制备 以海地瓜参体壁为原料,按参考文献方法提取其中的岩藻聚糖硫酸酯[10],关键步骤如下:干海参粉碎,丙酮浸泡脱脂,木瓜蛋白酶酶解,氯化十六烷基吡啶沉淀得到粗多糖,Sepharose Q Fast Flow离子交换树脂纯化,透析脱盐,冻干后得到岩藻聚糖硫酸酯。
1.2.2 菌体制备 接种Flavobacteriaceaesp.CZ1127至液体发酵培养基(岩藻聚糖硫酸酯 0.2%,NaNO30.2%,MgSO40.5%,CaCl20.01%,Fe2(SO4)30.001%,溶于过滤膜海水,pH7.0),接种量5%,25 ℃恒温培养箱培养48 h[10]。培养结束后4 ℃离心(10000 r/min,10 min),以20 mmol/L pH7.2 Tris-HCl缓冲液(含5 mmol/L MgCl2)重悬沉淀并再次离心(10000 r/min,10 min),收集沉淀得到湿菌体并称重。
1.2.3 提取方法的筛选 分别采用化学试剂法[11]、反复冻融法[12]、溶菌酶法[12]、渗透压冲击法[12]及超声破碎法[12-13]提取Flavobacteriaceaesp.CZ1127菌体胞内的岩藻糖苷酶,测定提取酶液中岩藻糖苷酶的酶活(方法见1.2.6),依据公式(1)计算提取率。

式(1)
1.2.3.1 化学试剂法 选择吐温20、吐温40、吐温60、吐温80、TritonX-100及SDS作为提取试剂,分散或溶解于20 mmol/L pH7.2 Tris-HCl缓冲液中,浓度分别为0.2%(v/v)、0.2%(v/v)、0.2%(v/v)、0.2%(v/v)、0.75%(v/v)及0.03 mg/mL。将菌体按20 mg/mL的浓度重悬于各提取液,25 ℃振摇1 h后4 ℃离心(10000 r/min,10 min),取上清即得酶液。
1.2.3.2 反复冻融法 将菌体按20 mg/mL的浓度重悬于20 mmol/L pH7.2 Tris-HCl缓冲液,-40 ℃冷冻2 h后于25 ℃融化,反复冻融5次,4 ℃离心(10000 r/min,10 min)收集上清即得酶液。
1.2.3.3 溶菌酶法 将菌体以20 mg/mL的浓度重悬于溶菌酶溶液(10 mg/mL,20 mmol/L Tris-HCl,pH8.0)中,37 ℃孵育1 h,4 ℃离心(10000 r/min,10 min)取上清即得酶液。
1.2.3.4 渗透压冲击法 将菌体以20 mg/mL的浓度重悬于高渗透压溶液(20 mmol/L pH7.2 Tris-HCl缓冲液含0.5 mg/mL EDTA及0.15 g/mL蔗糖),冰水浴0.5 h,4 ℃离心(12000 r/min,10 min),收集菌体沉淀并加入与高渗透压溶液等体积的20 mmol/L pH7.2 Tris-HCl缓冲液,冰水浴0.5 h,4 ℃离心(10000 r/min,10 min)收集菌体,再次重复上述操作,取上清即得酶液。
1.2.3.5 超声破碎法 将菌体按20 mg/mL的浓度重悬于20 mmol/L pH7.2 Tris-HCl缓冲液。菌悬液置于冰水浴中超声破碎,超声功率500 W,单次破碎时长2 s,间歇时长2 s,工作总时长12 min。完毕后4 ℃离心(10000 r/min,10 min),取上清即得酶液。
1.2.4 超声破碎法单因素实验 选择超声功率、超声总时长、菌悬液浓度、单次超声时长、间歇时长等5个因素进行单因素实验,考察这5个因素对岩藻糖苷酶提取率的影响。
1.2.4.1 破碎功率的影响 破碎总时长固定为12 min,菌悬液浓度为20 mg/mL,单次破碎时长为2 s,间歇时长为2 s,破碎功率分别为100、200、300、400、500 W。
1.2.4.2 破碎总时长的影响 破碎功率固定为300 W,菌悬液浓度为20 mg/mL,单次破碎时长为2 s,间歇时长为2 s,破碎总时长分别为3、6、9、12、15 min。
1.2.4.3 菌悬液浓度的影响 破碎功率固定为300 W,破碎总时长为6 min,单次破碎时长为2 s,间歇时长为2 s,菌悬液浓度分别为5、10、20、30、40 mg/mL。
1.2.4.4 单次破碎时长的影响 破碎功率固定为300 W,破碎总时长为6 min,菌悬液浓度为20 mg/mL,间歇时长为2 s,单次破碎时长分别为1、2、4、6、8 s。
1.2.4.5 间歇时长的影响 破碎功率固定为300 W,破碎总时长为6 min,菌悬液浓度为20 mg/mL,单次破碎时长为2 s,间歇时长分别为1、2、4、6、8 s。
1.2.5 超声破碎法响应面优化 利用Design Expert软件(v 8.0.6),根据中心组合实验设计原理,以破碎总时长(X1)、单次破碎时长(X2)及菌悬液浓度(X3)等三个变量为自变量,以提取率(Y)为响应值,设计三因素五水平响应面优化实验。实验因素及其水平的取值见表1。
1.2.6 酶活测定方法 以岩藻糖苷酶降解对硝基苯酚岩藻糖苷的能力定量其酶活[14]:将150 μL底物溶液(对硝基苯酚岩藻糖苷溶于20 mmol/L pH7.2 Tris-HCl,浓度为3.0 mmol/L)与150 μL适当稀释的酶液混合,28 ℃下反应30 min后立即加入2.7 mL 0.55 mol/L Na2CO3溶液终止反应,利用分光光度计测定400 nm 波长下吸光值,根据OD400 nm与对硝基苯酚浓度的关系,计算对硝基苯酚生成量,
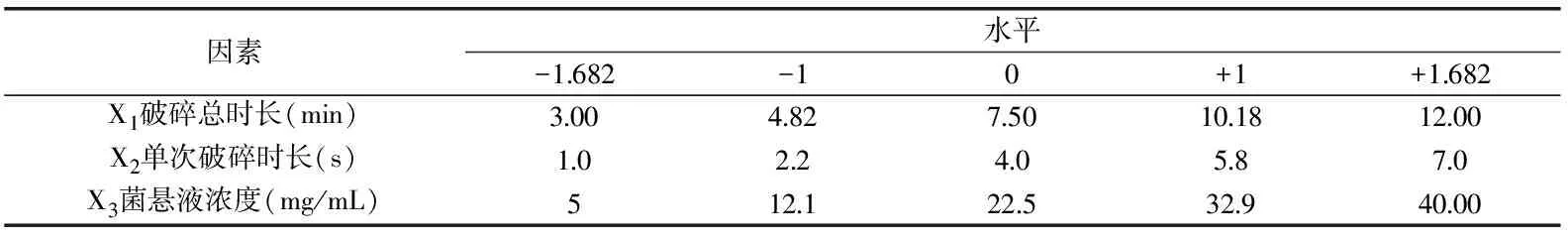
表1 中心组合实验设计因素与水平表

表2 不同提取方法对岩藻糖苷酶的提取效果
从而计算出岩藻糖苷酶酶活。酶活单位定义1 mL酶液于1 min内水解底物产生1 μmol对硝基苯酚的活力为1 U;以单位质量(g)菌体获得岩藻糖苷酶酶活的量(10-3U,mU)表示提取率,其单位以mU/g表示。
1.2.7 数据处理 各实验重复3次,结果以平均值±标准偏差表示。利用Design Expert软件进行响应面实验数据分析,建立数学模型。
2 结果与讨论
2.1 不同提取方法的比较研究
利用化学试剂法(Triton、SDS及吐温)、反复冻融法、溶菌酶法、渗透压冲击法以及超声破碎法对Flavobacteriaceaesp.CZ1127进行处理,各方法提取率,见表2。
Trition及SDS处理对Flavobacteriaceaesp.CZ1127胞内岩藻糖苷酶具有一定的提取效果,吐温20、40、60以及80的提取效果较差。TritonX-100、SDS、吐温20、吐温40、吐温60及吐温80属于表面活性剂,具有双亲性,可通过扰乱细胞壁及细胞膜中脂质分子的致密性、增加膜结构的通透程度,实现胞内酶释放。吐温20、40、60以及80的表面活性比Triton X-100和SDS弱,这可能导致它们的提取效果不如后两者理想。
反复冻融法和渗透压冲击法的提取率并不显著。反复冻融法是利用冻结-解冻过程中冰晶对细胞产生机械性损伤从而使细胞破碎的物理方法[16]。渗透压冲击法利用高渗透压及低渗透压的转换使细胞发生溶胀,释放胞内物质。
溶菌酶可水解细菌细胞壁中的肽聚糖,从而破坏细胞壁结构、实现胞内物质的获取。溶菌酶常用于革兰氏阳性菌胞内物质的提取。Flavobacteriaceaesp.CZ1127属于革兰氏阴性菌[11],细胞壁中肽聚糖含量较少,这使得溶菌酶处理的提取率有限。
超声波作为一种弹性机械振动波,可以产生空化效应和强烈的振动作用,从而破坏细胞的完整结构、释放胞内成分[15]。结果显示,超声破碎法的提取率最高,为12450.26 mU/g。基于此,选择超声破碎法进行下一步的条件优化。
2.2 超声破碎法条件的单因素实验
2.2.1 超声破碎功率对提取效果的影响 在本实验选取的条件范围内,各破碎功率对应的提取率之间无显著性差异(p>0.05)(图1)。其中破碎功率为300 W时提取率在数值上最高,因此将破碎功率固定为300 W进行后续优化实验。
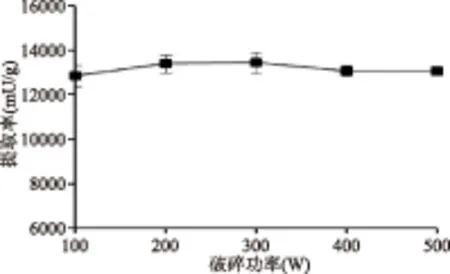
图1 功率对超声破碎法提酶效果的影响Fig.1 Influence of power on the performance of ultrasonication
2.2.2 超声破碎总时长对提取效果的影响 随着破碎总时长增加,超声破碎法的提取率呈现先明显增加(3~6 min)后保持相对稳定(6~15 min)的趋势(图2)。这提示破碎总时长达到6 min时细胞的破碎效果已较为完全,继续延长可能将增强超声破碎的热效应从而使酶活受到损失。因此选择破碎时间为6 min进行后续优化实验。
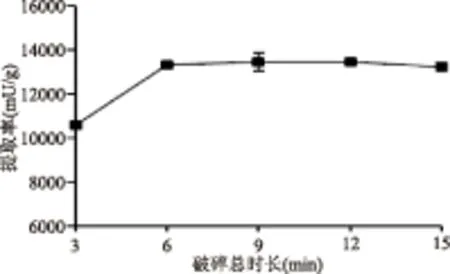
图2 破碎总时长对超声破碎法提酶效果的影响Fig.2 Influence of total ultrasonic time on the performance of ultrasonication
2.2.3 超声破碎菌悬液浓度对提取效果的影响 超声破碎法的提取率随着菌悬液浓度的增加呈现先增加后下降的趋势,当菌悬液浓度为20 mg/mL时,提取率最高(图3)。当菌液浓度较低的时候,超声波在传递中会损失较多的能量,不利于细胞的破碎;随着菌液浓度的增加,超声波的能量损失减少,表现为破碎效果的提高;但随着菌液浓度的增加液体的粘稠度会相应增加,从而使超声波的空化效应减弱,导致破碎效果降低[17]。
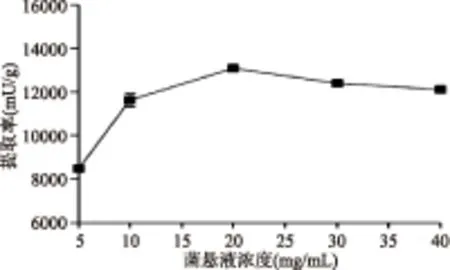
图3 菌悬液浓度对超声破碎法提酶效果的影响Fig.3 Influence of bacterial concentration on the performance of ultrasonication
2.2.4 超声破碎单次破碎时长对提取效果的影响 随着单次破碎时长的增长,超声破碎法的提取率呈现先增加后下降的趋势,当单次破碎时长为2 s时呈现出最高值(图4)。超声波的空化效应是空气泡形成、振动、膨胀、压缩和崩溃闭合的过程,这种效应的形成需要一定的时间,时间过短不足以完成空化,适时的工作方式使超声波产生的空气泡有更多时间和机会完成膨胀与爆炸,从而增加破碎效果[18],但是时间过长会产生过多热量导致酶活损失。
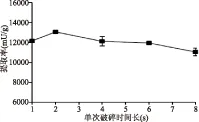
图4 单次破碎时长对超声破碎法提酶效果的影响Fig.4 Influence of single ultrasonic time on the performance of ultrasonication
2.2.5 超声破碎间歇时长对提取效果的影响 超声破碎法的提取率随间歇时长增加整体呈现先增长而后轻微降低的趋势,间歇时长为2 s时提取效果最佳(图5)。超声破碎中设定间歇时长的目的是为了促进处理液与冰水浴环境之间的热交换,从而降低超声产热导致的酶活损失。上述结果提示,间歇时长设置为2 s时热交换的效果已较为充分,同时,从节约时间成本的角度考虑,选择2s为适宜的间歇时长条件。
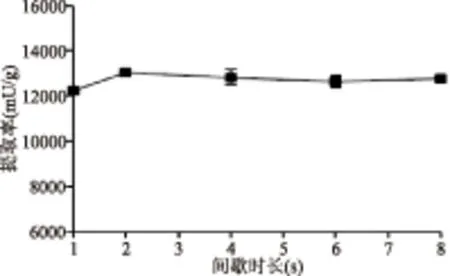
图5 间歇时长对超声破碎法提酶效果的影响Fig.5 Influence of interval time on the performance of ultrasonication
2.3 超声破碎条件的响应面优化
单因素实验的结果表明,破碎总时长(X1)、单次破碎时长(X2)以及菌悬液浓度(X3)可能对岩藻糖苷酶的提取率具有显著影响。为进一步优化提取条件,选取上述三个因素进行响应面实验。
根据中心组合实验设计,共设置20个实验点,实验结果如表3所示。利用Design Expert软件对表3进行多元线性回归和二项式拟合,建立的模型为:
Y=13027.7+191.46X1- 510.62X2- 524.31X3-232.94X1X2+35.23X1X3+56.79X2X3- 122.08X12-241.93X22- 1134.19X32
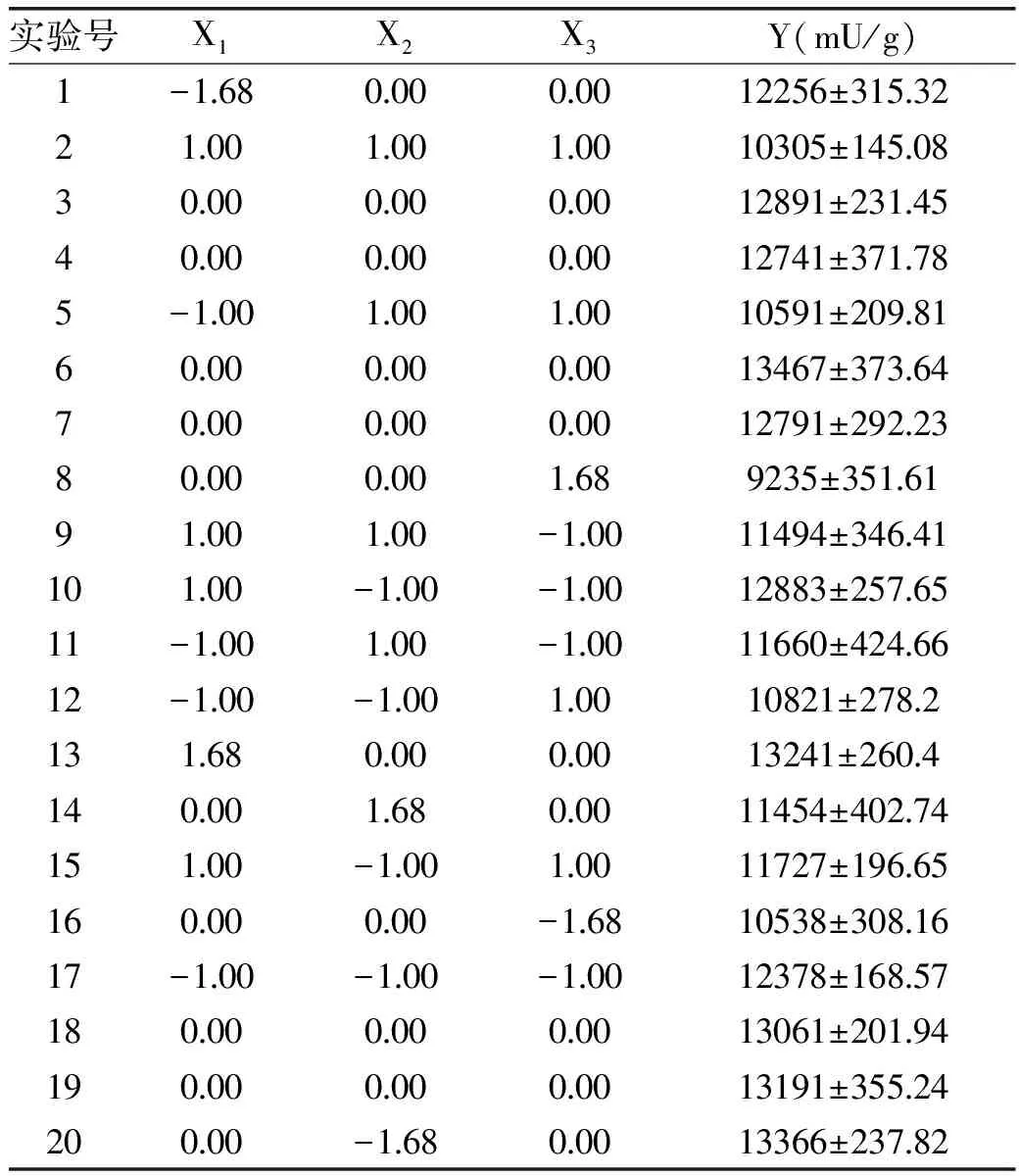
表3 响应面实验设计及结果
模型方差分析如表4所示,模型整体达极显著水平(p<0.01),失拟项不显著(p>0.05),说明其他因素对实验结果的干扰小。模型相关系数R2(0.9723)较高,表明该模型和实际情况拟合较好。同时,该模型的变异系数较低,为2.31%,变异系数是衡量每个平均值偏离情况的参数,其值越小,重复性越好。综上分析,该模型可以较好的描述各因素和响应值之间关系,能够用于预测超声破碎法对Flavobacteriaceaesp.CZ1127胞内岩藻糖苷酶的提取率。同时,对于回归方程系数的显著性检验结果表明,单次破碎时长(X2)、菌悬液浓度(X3)对提酶率影响极显著,破碎总时长(X1)对提酶率影响显著;同时,交互项X1X2也具有显著性影响,表明破碎总时长和单次破碎时长之间存在显著交互作用。
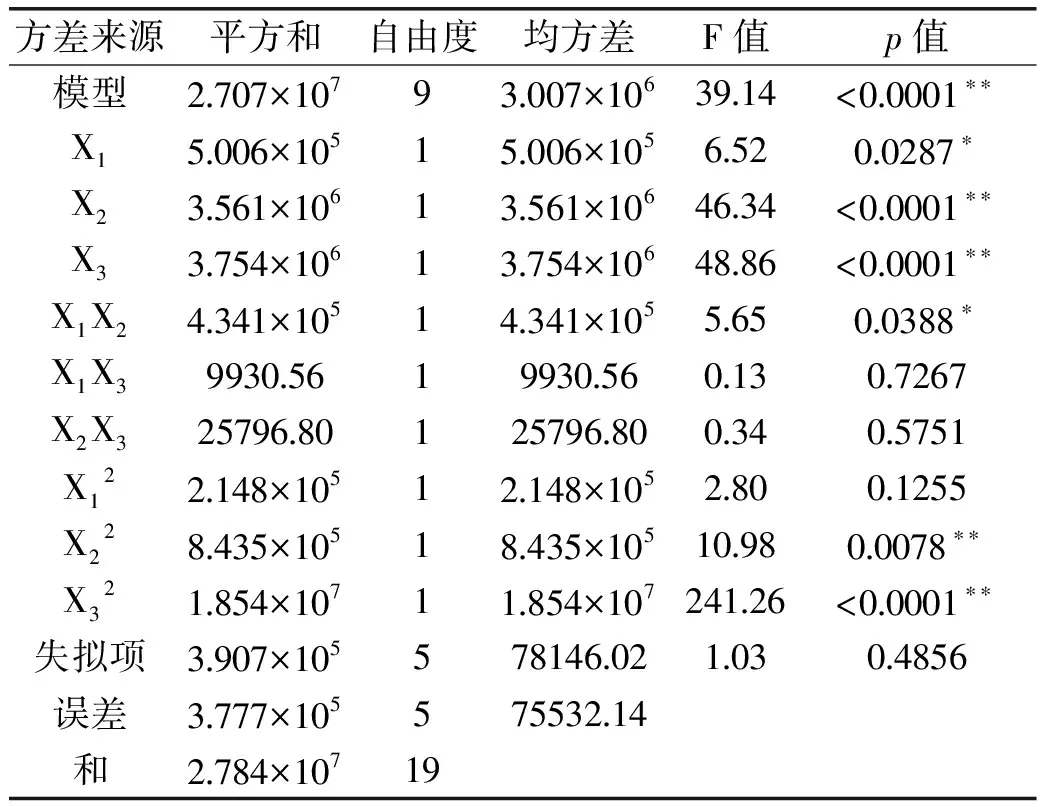
表4 回归模型方差分析
注:*:差异显著,p<0.05;**:差异极显著,p<0.01。
各因素之间的交互影响如图6所示。当单次破碎时长较短时,增大破碎总时长利于细胞破碎,提取率呈增长趋势;当单次破碎时长较大时,增大破碎总时长会加剧超声波的热效应使酶失活,提取率则呈减小趋势(图6a),这说明破碎总时长和单次破碎时长交互效应显著,与方差分析结果相一致。
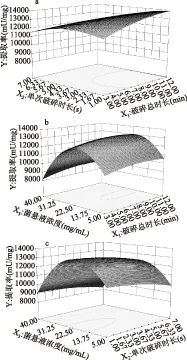
图6 各显著因素对破碎效果的交互影响Fig.6 The interaction effect of significant factors on ultrasonic results
根据拟合的数学模型,预测提取率最高时的超声条件为:破碎总时长10.2 min,单次破碎时长2 s,菌悬液浓度20 mg/mL。预测得出最优的提取率为13664.4 mU/g。为验证模型预测的准确性,按照预测的提取条件进行岩藻糖苷酶的提取,提取率为(13285.6±274.3) mU/g,结果与预测值相近,说明模型的预测效果较为理想。
3 结论
考察了多种细胞破碎方法对Flavobacteriaceaesp.CZ1127胞内岩藻糖苷酶的提取效果,确定了超声破碎法是较优的提取方式。通过单因素及响应面优化实验,成功建立了超声破碎提取效果与破碎总时长、单次破碎时长以及菌悬液浓度等显著影响因素之间的数学模型,得出最优工艺条件为:破碎功率300 W,菌悬液浓度20 mg/mL,破碎总时长10.2 min,单次破碎时长2 s,间歇时长2 s。在最优条件下,可从单位质量(g)菌体中获得岩藻糖苷酶酶活(13285.6±274.3) mU。本研究建立了一种提取制备岩藻糖苷酶的良好方法,为该酶的进一步开发利用提供了有益的技术支撑。
[1]张珣,王静凤,徐雷,等. 海地瓜和冰岛刺参海参岩藻聚糖硫酸酯抗肿瘤作用的比较研究[J]. 食品科学,2012,33(7):251-255.
[2]Pereira M S,Mulloy B,Mourao P. Structure and anticoagulant activity of sulfated fucans-Comparison between the regular,repetitive,and linear fucans from echinoderms with the more heterogeneous and branched polymers from brown algae[J]. Journal of Biological Chemistry,1999,274(12):7656-7667.
[3]Raghavendran H,Srinivasan P,Rekha S. Immunomodulatory activity of fucoidan against aspirin-induced gastric mucosal damage in rats[J]. International Immunopharmacology,2011,11(2):157-163.
[4]Wang Y C,Su W,Zhang C Y,et al. Protective effect of sea cucumber(Acaudinamolpadioides)fucoidan against ethanol-induced gastric damage[J]. Food Chemistry,2012,133(4):1414-1419.
[5]Mourao P,Pereira M S,Pavao M,et al. Structure and anticoagulant activity of a fucosylated chondroitin sulfate from echinoderm-Sulfated fucose branches on the polysaccharide account for its high anticoagulant action[J]. Journal of Biological Chemistry,1996,271(39):23973-23984.
[6]Sela D A,Mills D A. Nursing our microbiota:molecular linkages between bifidobacteria and milk oligosaccharides[J]. Trends in Microbiology,2010,18(7):298-307.
[7]Ashida H,Miyake A,Kiyohara M,et al. Two distinct alpha-l-fucosidases from Bifidobacterium bifidum are essential for the utilization of fucosylated milk oligosaccharides and glycoconjugates[J]. Glycobiology,2009,19(9):1010-1017.
[8]Berteau O,Mccort I,Goasdoue N,et al. Characterization of a new alpha-L-fucosidase isolated from the marine mollusk Pecten maximus that catalyzes the hydrolysis of alpha-L-fucose form algal fucoidan(Ascophyllumnodosum)[J]. Glycobiology,2002,12(4):273-282.
[9]Eneyskaya E V,Kulminskaya A A,Kalkkinen N,et al. An alpha-L-fucosidase from Thermus sp with unusually broad specificity[J].Glycoconjugate Journal,2001,18(10):827-834.
[10]Chang Y,Xue C,Tang Q,et al. Isolation and characterization of a sea cucumber fucoidan-utilizing marine bacterium[J]. Letters in Applied in Applied Microbiology,2010,50(3):301-307.
[11]杨翠竹,李艳,阮南,等. 酵母细胞破壁技术研究与应用进展[J]. 食品科技,2006,49(7):138-142.
[12]李琦,张兰威,韩雪,等. 破壁方法对嗜热链球菌SP1.1胞内乳糖代谢关键酶活性的影响及其条件优化[J]. 食品科学,2011,32(9):183-187.
[13]王辉龙,孙永峰,陈淑玲,等. 番茄果实中脂肪氧化酶的分离纯化及9-过氧化物亚油酸的制备[J]. 食品科学,2004,25(12):97-100.
[14]Angel Reglero,José A Cabezas. Purification and Properties of a-L-Fucosidase fromChawleleagallinaL.[J]. The FEBS Journal,1976,66(2):379-387.
[15]邓洁,程龙,刘谊,等. 根肿(Plasmodiophorabrassicae)休眠孢子的纯化和超声波破碎方法研究[J]. 应用与环境生物学报,2006,12(2):269-272.
[16]郭卫芸,杜冰,袁根良,等. 反复冻融法破壁啤酒废酵母的研究[J]. 酿酒科技,2009(3):103-105.
[17]傅绍军,李微,朱利民. 瑞士乳酸杆菌摇瓶发酵条件及产酶条件优化[J]. 药物生物技术,2005,12(6):361-365.
[18]吴克刚,杨连生,黄通旺. 超声波破碎Thraustochytrium提取脂质的研究[J]. 郑州工程学院学报,2001,12(4):31-34.
Optimization of the parameters for fucosidase extraction fromFlavobacteriaceaesp.CZ1127 based on response surface methodology
CHEN Feng,WANG Jun,SHEN Jing-jing,DONG Shu-jun,CHANG Yao-guang*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
The marine bacteriaFlavobacteriaceaesp.CZ1127 is abundant in intracellular fucosidase activity. This paper compared various methods for extracting fucosidase,including ultrasonication,chemical reagents,repeated freeze-thawing technique,lysozyme method and osmotic shock,and found that ultrasonication was an favorable one. In order to optimize parameters,the factors of ultrasonication for extracting fucosidase were investigated by response surface methodology,and a second order quadratic equation was finally established. The optimal operating parameters were determined as follows:total ultrasonic time 10.2 min,single ultrasonic time 2 s,intermittent 2 s,and bacterial concentration 20 mg/mL. Under those condition,the yield of fucosidase activity from the bacteria cells was high to(13285.6±274.3)mU/g. This study established an optimal method for extracting and preparing fucosidase,which would facilitate the further utilization of the enzyme.
fucosidase;extraction;optimization;response methodology;Flavobacteriaceaesp.
2016-03-24
陈丰(1992-),男,硕士研究生,研究方向:食品酶学,E-mail:cfeng719@163.com。
*通讯作者:常耀光(1985-),男,副教授,研究方向:海洋食品碳水化合物,E-mail:changyg@ouc.edu.cn。
国家自然科学基金(31471684)。
TS201.1
A
1002-0306(2016)22-0248-06
10.13386/j.issn1002-0306.2016.22.040
