激光捕获显微切割结合低体积扩增技术研究*
2017-01-13曾宪海戈文东
李 斌 吕 政 曾宪海 戈文东
激光捕获显微切割结合低体积扩增技术研究*
李 斌1吕 政2曾宪海1戈文东1
1. 福建省公安厅刑事技术总队,福建省刑事科学技术重点实验室 2. 福州市鼓楼区公安分局刑事技术大队
目的:研究激光捕获显微切割技术联合应用低体积扩增技术,建立一套微量混合样本DNA的检验方法。方法:使用PALM系统切割捕获目标细胞,弹射到低体积扩增玻片的反应位点上,消化细胞,提取DNA,使用Identifiler®试剂盒在1.5μL体系中进行PCR扩增。结果:分别捕获10个口腔上皮细胞、20个精子细胞,成功获得16个完整的STR 基因座分型谱带。结论:激光捕获显微切割技术联合应用低体积扩增技术适用于法医学中微量混合样本DNA检验。
法医物证学 激光捕获显微切割 低体积扩增 STR分型
激光捕获显微切割(Laser capture microdissection, LCM)技术主要应用于病理学、肿瘤学、发育生物学、神经生物学中,可以从复杂组织中快速准确地分离均一性样品组分[1,3]。因其可在显微镜直视下捕获目标细胞,以排除异质性细胞的影响,为解决困扰法医物证检验的难题——混合样品DNA的检验分析提供新的解决方案,受到了法医科学工作者的重视与应用。而低体积扩增技术(如安利快得系统)采用显微镜玻片平面印刷技术,整个PCR反应体系为1μL,半球状的空间构象为微量反应提供了最佳的环境,使灵敏度大大提高[4]。本实验将激光捕获显微切割和低体积扩增技术相结合,建立微量混合样本DNA的检验方法,探讨其在法医DNA检验中应用的可行性。
1 材料与方法
1.1 实验样本
样本一:志愿者口腔拭子。
样本二:实际强奸案件中的卫生纸。
1.2 主要仪器和试剂
PALM激光显微切割捕获系统(Carl Zeiss公司,德国),PEN1.0玻片,AG480F AmpliGrid微量反应玻片与密封油,0.04mol/L PK溶液,0.05g/ml龙胆紫染液(国药集团化学试剂有限公司,中国),Identifiler®试剂盒(Life Technologies公司,美国),AmpliSpeed ASN400 PCR扩增仪(Olympus欧洲生命科学公司,德国),离心机,ABI 3130XL型遗传分析仪(Life Technologies公司,美国)。
1.3 实验方法
1.3.1制备细胞悬液
在样本一放入加有700μL去离子水的EP管内,震荡洗脱5min,使拭子上的细胞充分脱落,弃去拭子。
用剪刀剪取1cm×1cm大小样本二置于EP管内,剪碎,加1mLTNE室温浸泡30min,期间不断震荡,套管离心去除载体。
1.3.2涂片
细胞悬液13000r/min离心3min,吸取上清液,保留约30μL,加入适量的龙胆紫染液,混匀染色5min。吸取5μL,轻轻涂铺在PEN1.0玻片上,用热快37℃烘干10~15min。
1.3.3切割
将玻片放置在PALM激光显微切割捕获系统的载物台上,显微镜下查找选择结构清晰、完整的单个细胞(样本一为口腔上皮细胞,样本二为精子细胞),用绘制工具,通过软件依次选定标记需要分离的目标细胞,切割细胞。切割的激光束能量要适中,以切割后膜面在视野中稍变模糊为宜。
1.3.4收集
切割下的口腔上皮细胞弹射到加0.75μL PK溶液的AG480F AmpliGrid微量反应玻片位点上。切割下的精子细胞弹射到加0.75μL含有PK和DTT的裂解液(0.1mg/mL PK,5mmol/L DTT)的AG480F AmpliGrid微量反应玻片位点上。分别捕获5、10、15、20、30个细胞,每个细胞数重复3次。
1.3.5 DNA提取
5 μL密封油密封玻片位点,静置5min,待反应液沉到玻片上后,口腔上皮细胞56℃消化1h,95℃变性15min;精子细胞56℃消化2h,99℃变性10min。
1.3.6扩增
加入0.75μL PCR反应液(Identifiler®试剂盒,配比为:Mix 4μL;Primer 2μL;Golden酶1μL),置于AmpliSpeed ASN400 PCR扩增仪上扩增。扩增体系为1.5μL,扩增程序为95℃ 11min、94℃ 1min、59℃ 1min、72℃ 1min、30个循环[5];60℃延伸1h;4℃保存。
扩增产物全部上样,经ABI 3130XL型遗传分析仪检测,GeneMapper ID v3.2分析检测结果。
2 结果
捕获5、10、15、20、30个细胞,重复实验3次,所获图谱峰高高于100RFU为标准,DNA检测结果见表1。其中等位基因丢失率=等位基因丢失条带总数/预计等位基因总条带×3次实验;位点丢失率=出现等位基因丢失的位点数/16个位点×3次实验;完整检出率=有效分型次数/3次实验。经χ2检验,P<0.05,不同细胞数量实验组检出率的差别有统计学意义。
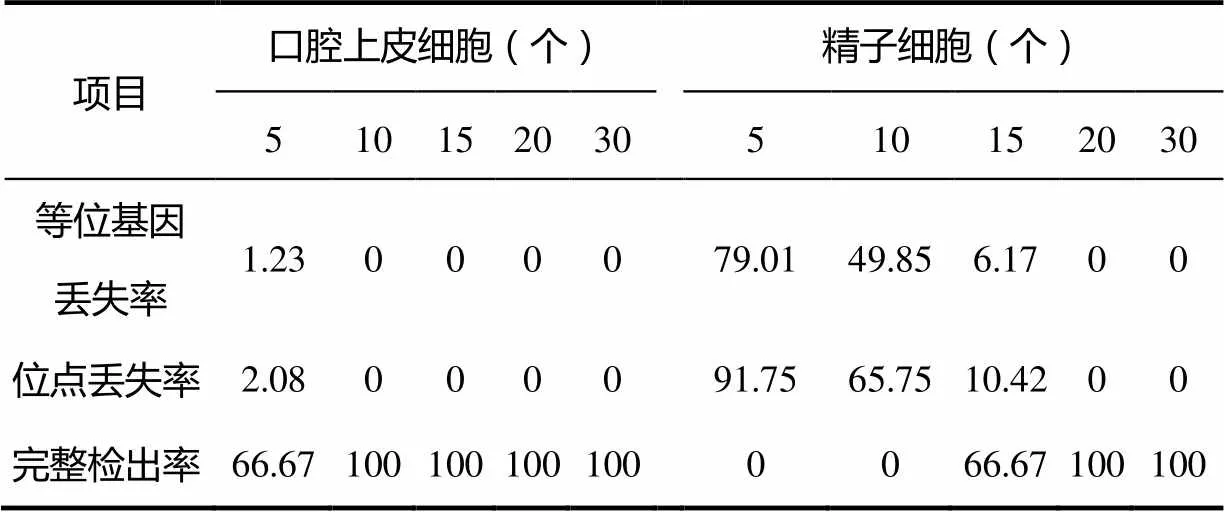
表1 捕获不同数量细胞的实验结果(n=3)
结果显示,对志愿者口腔上皮细胞,采用PALM激光显微切割捕获系统捕获目标细胞,结合低体积扩增技术,捕获5个口腔上皮细胞,有1次扩增在D18S51基因座上杂合子13/17变成纯合子13,等位基因丢失率为1.23%。捕获10个以上的口腔上皮细胞,3次平行扩增,均稳定获得Identifiler®试剂盒所包含的15个STR与Amelogenin基因座的基因分型,完整检出率为100%(见图1、图2)。随着细胞数目的增多,扩增产物的检验峰值提高。
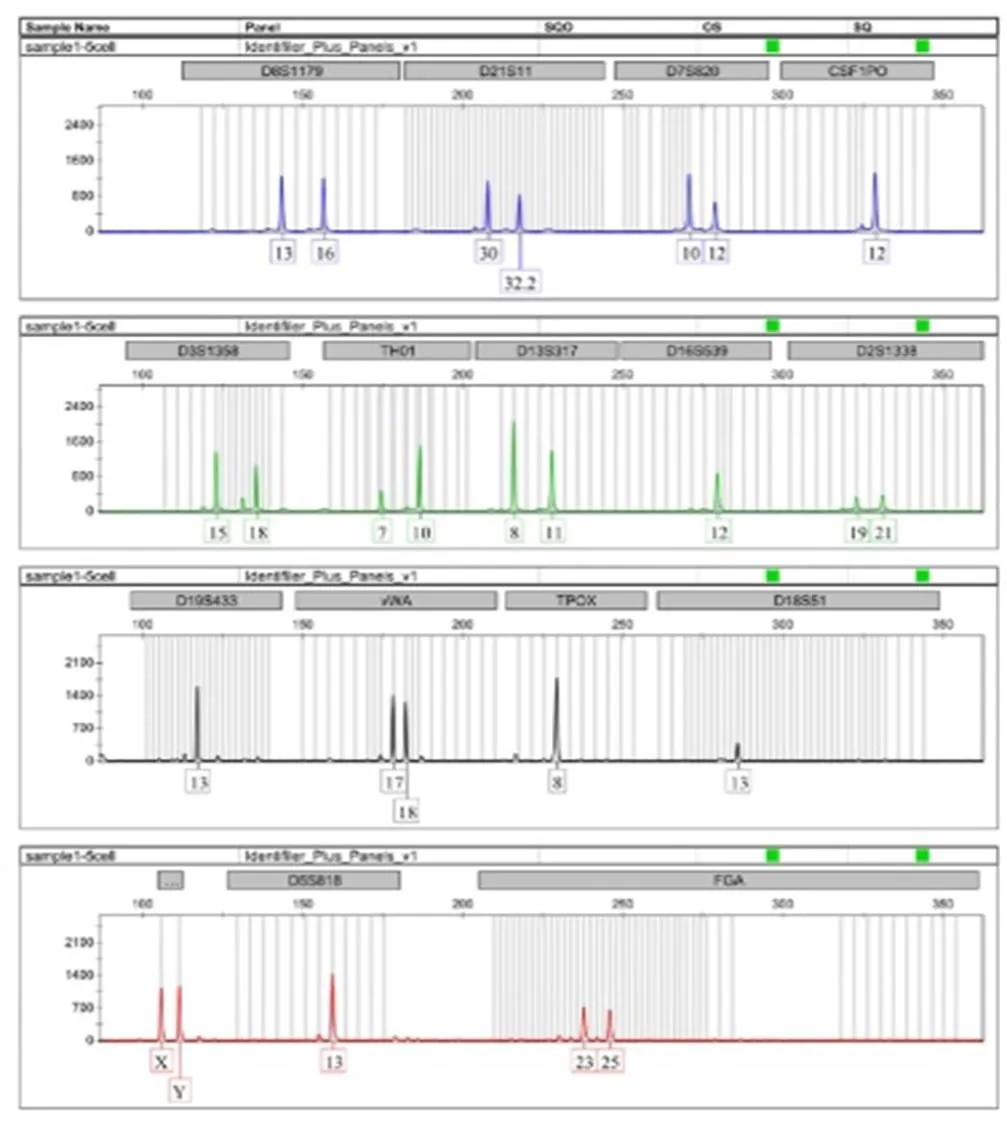
图1 5个口腔上皮细胞的STR分型结果
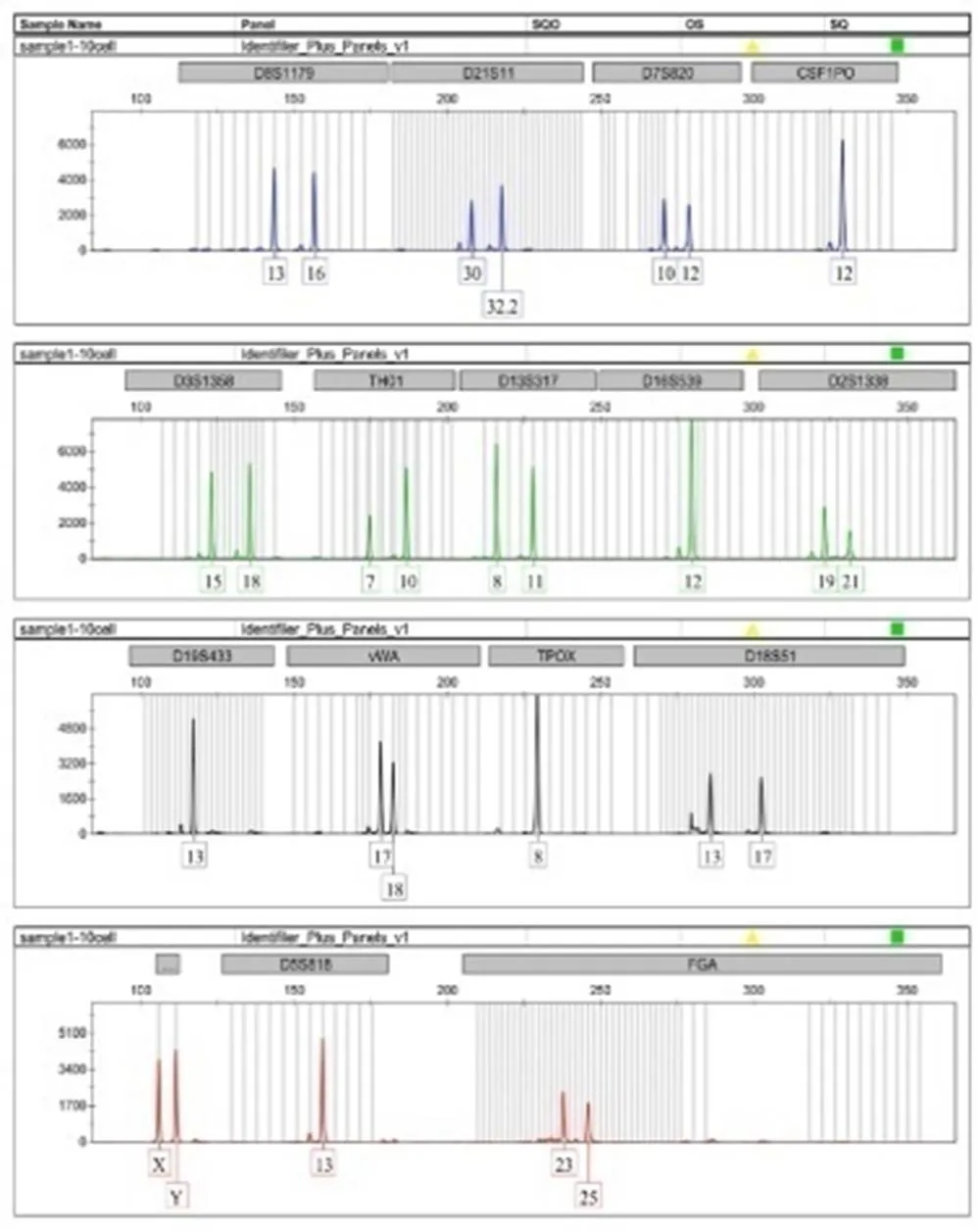
图2 10个口腔上皮细胞的STR分型结果
对于强奸案件中的卫生纸,采用PALM激光显微切割捕获系统捕获目标细胞,结合低体积扩增技术,捕获5个精子细胞,仅5~6个基因座检测出条带,等位基因丢失严重,达79.01%。捕获10个细胞,大部分基因座出现等位基因丢失,且每次都在不同的基因座上出现等位基因丢失,无法获得完整的STR分型图谱,等位基因丢失率为49.85%。随着捕获细胞数目的增多,完整检出率逐渐提高,而等位基因丢失率逐渐降低。捕获15个精子细胞,2次扩增出现2~3个基因座等位基因丢失现象,杂合子变成纯合子,等位基因丢失率为6.17%。捕获20个以上的精子细胞3次平行扩增,才可获得完整的STR分型结果图,如图3~图6所示。
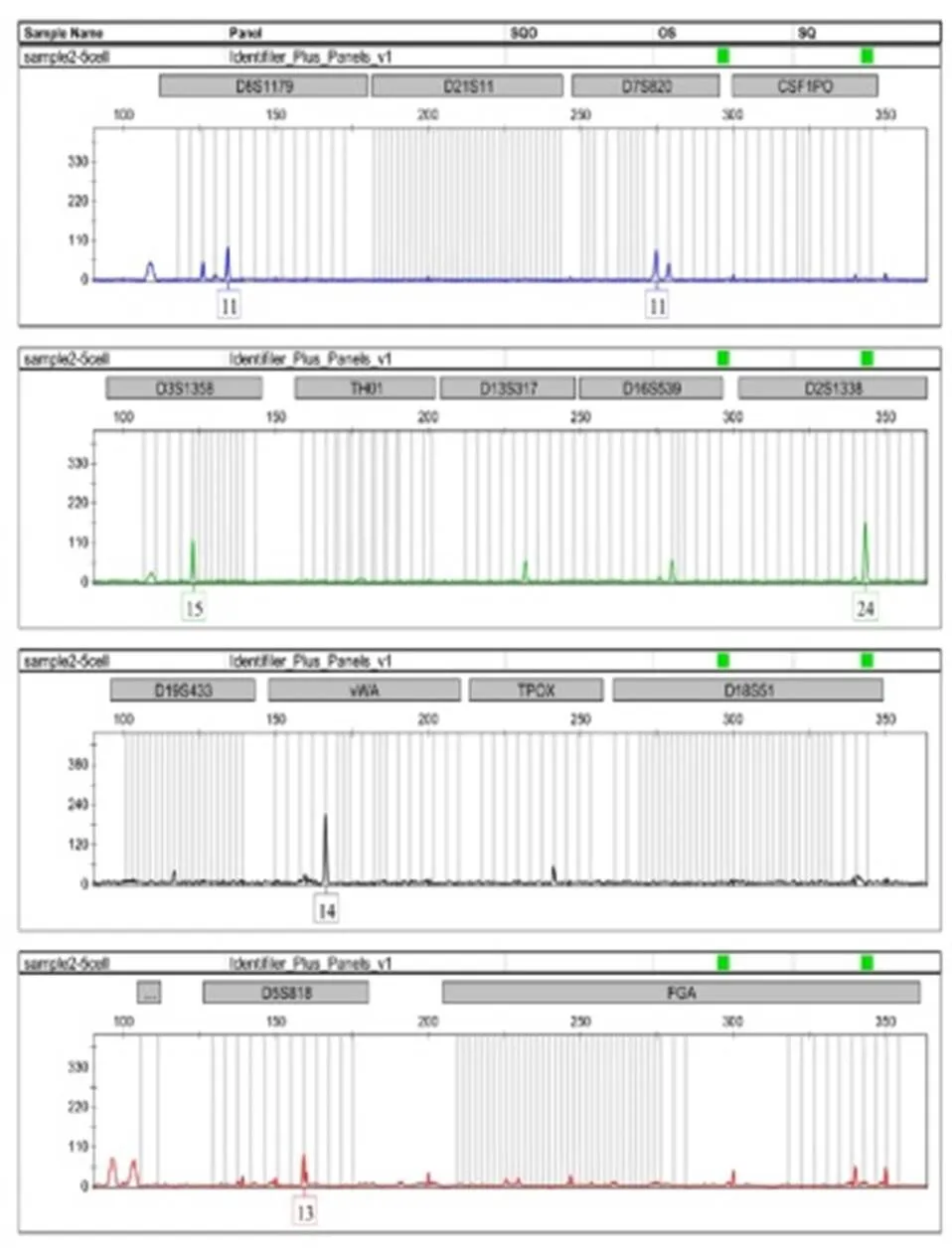
图3 5个精子细胞的STR分型结果
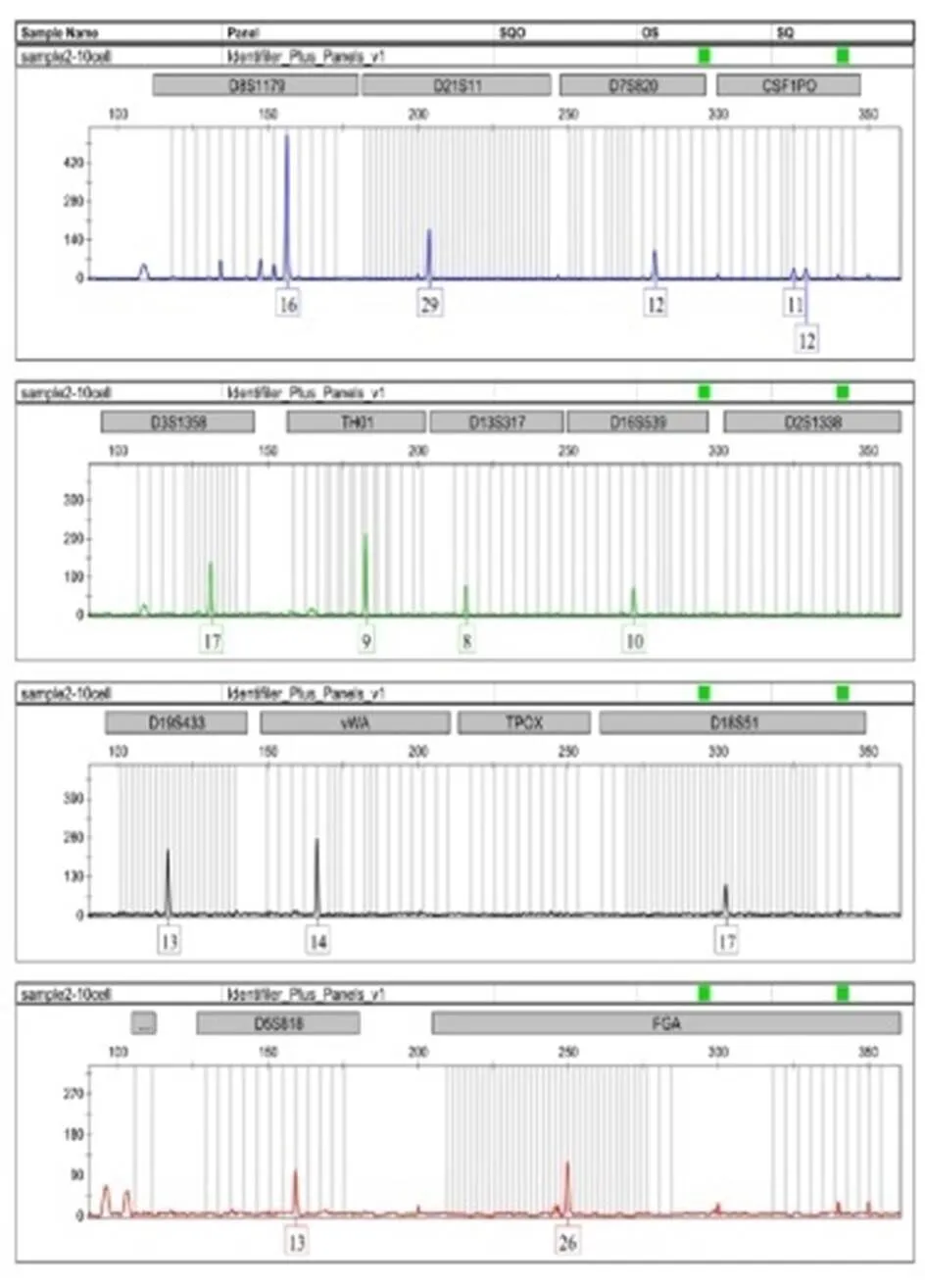
图4 10个精子细胞的STR分型结果

图5 15个精子细胞的STR分型结果

图6 20个精子细胞的STR分型结果
3 讨论
微量混合样品DNA的检验和分析一直是法医物证检验的难题。在微量混合样品中,有时犯罪嫌疑人的信息为被 害人的信息所掩盖,无法获得犯罪嫌疑人的基因型,有时得到的DNA分型结果为混合基因型,不能达到认定水平。而PALM激光显微切割捕获系统与低体积扩增技术联合,能从微量混合样品中收集单一种类细胞,使常规方法难以成功分型的样本也能获得单一样本的STR分型结果,对案件的认定意义重大[6]。
本实验使用的PALM激光显微切割捕获系统,其核心功能是激光弹射,激光通过高数值孔径的物镜集中在1μm大小的点上,在1ns内激光脉冲释放出的能量,将细胞切割下来。切割好的细胞弹射收集到AmpliGrid玻片,整个过程由激光完成,无接触、无污染。AmpliGrid玻片采用平面印刷技术,表面构建48个1μL亲水性基因座,使DNA模板、反应物锚定在特定位置上,覆盖4~5μL封闭液体避免液体蒸发,构成最佳的半球状反应空间。同时疏水性基因座使覆盖在反应试剂上的封闭液互相隔离,亦保证无气溶胶、无交叉污染。再配合专门为AmpliGrid玻片设计的AmpliSpeed ASN400 PCR扩增仪进行低体积扩增,相较于常规扩增,节省了试剂,提高了样本在扩增体系中的浓度,使得实验的灵敏度和成功率得到提升。在本实验中,我们仅需捕获10个口腔上皮细胞、20个精子细胞数,就能获得完整的STR分型图谱,这是常规PCR扩增难以实现的。
特别是利用PALM激光显微切割捕获系统将精子细胞捕获到反应位点上,直接进行裂解扩增,省去了传统差异裂解消化女性物质的步骤,大大缩短检验时间,简化了操作步骤,避免了污染和精子细胞的损失。同时,该系统准确捕获精子细胞,排除了女性物质的干扰,使分型结果由混合型变成单一型,极大提高了现场物证的证据价值,为强奸案件中女性成分去除不干净的混合斑提供了一个有效的解决方案。
本文实验结果显示,捕获精子细胞数为20个时,才能获得完整的STR分型图谱,而口腔上皮细胞仅需10个就可以。亓冰通过显微操作法,联合安利快得系统,使用Identifiler®试剂盒在3个口腔上皮细胞就能获得完整的STR分型[7]。我们认为,检材的新鲜程度对结果有很大的影响。本实验中,口腔上皮细胞采用的是志愿者口腔拭子,细胞新鲜,是理想状态下的细胞。而精子细胞使用的是实际案件中的检材,由于保存条件、保存时间、载体类型和杂质等干扰因素的存在,在显微镜下看到部分细胞核破损,不完整,甚至是无细胞核的细胞,这说明样本不新鲜,细胞已开始部分降解。其次,精子细胞是单倍体,仅含有一半的基因组信息,当细胞数目少时,很难均衡提取到两种单倍体的细胞,细胞数目多时,完整分型的可能性就增加[8]。
本实验室使用的PALM激光显微切割捕获系统相较于其它需借助针尖或微细管来分离细胞的显微分离技术相比,具有分离细胞速度快、无需精巧的操作技能的优点[8]。但笔者在实际操作PALM激光显微切割捕获系统时,通过反复试验,亦总结了一些小技巧,如:制备细胞悬液后加龙胆紫染色剂时,染色剂要离心,避免带入染色剂颗粒,影响制片。制片后宜立即进行激光切割捕获细胞,否则容易影响细胞捕获效果。添加扩增液时使用小枪头,扩增液在枪头形成小液滴,然后轻触密封油顶端,使其自行融入样本溶液中。静置检查每个扩增点顶端是否被油膜重新封住,如果没有封住,则需加少量密封油,可避免扩增过程中出现吹气泡现象,导致扩增失败。
通过以上实验结果看出,本文构建的激光显微切割捕获系统联合低体积扩增的方法,将前者的精确捕获细胞功能和后者的高灵敏度扩增特点有机结合,可解决微量混合检材DNA检验问题。但在实际案件中,由于检材载体的复杂性、保存条件的差异性,方法还需进一步摸索和完善。
[1] Jae K, Dorethee H, Kwong K. Identification of epithelial cell adhesion molecule autoantibody inpatients with ovarian cancer [J]. Clinical Cancer Research, 2003(9): 4782-4791.
[2] S Ali S, Grace B, Joseph A, et al. Patterna of CDKN2A gene loss in sequential oral epithelial dysplasias and carinomas [J]. Cancer Research, 2003(61): 2371-2375.
[3] Lee J Y, Dong S M, Kim S Y, et al. A simple, precise and economical microdissection technique for analysis of genomic DNA from archival tissue sections [J]. Virchows Arch, 1998,433(4): 305-309.
[4] 黄江平,李彩霞,亓冰, 等.显微捕获技术结合低体积扩增技术在混合唾液斑检验中的应用 [J]. 吉林公安高等专科学校学报,2010(1):49-54.
[5] 吴微微,郝宏蕾,金胄, 等. PCR扩增3因素对低拷贝模板STR分型的影响研究 [J]. 中国法医学杂志,2006(21):4-6.
[6]曾宪海,李斌. 激光显微切割技术与低体积扩增方法的法医学应用探索[J]. 刑事技术,2012(5):3-5.
[7] 亓冰. 单细胞的分离与检验[D].北京: 中国人民公安大学, 2009.
[8] 任文彦,李彩霞,黄江平, 等. PALM结合低体积扩增技术在混合斑检验中的应用[J]. 证据科学,2010, 18(1):102-109.
[9] 任峰,李宗芳. 激光捕获显微切割技术应用研究新进展[J]. 癌症,2004, 23(7):860-864.
福建省自然科学基金资助项目(2014J01273);公安部技术研究计划项目(2015JSYJB12)。
