人工分子伴侣介导液相体系中肌球蛋白热稳定性的研究
2017-01-13付苇娅钟婉玲胡亚丽周春霞洪鹏志
付苇娅,钟婉玲,胡亚丽,周春霞,洪鹏志
(1.广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室, 广东普通高等学校水产品深加工重点实验室,广东 湛江,524088)
人工分子伴侣介导液相体系中肌球蛋白热稳定性的研究
付苇娅,钟婉玲,胡亚丽,周春霞,洪鹏志
(1.广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室, 广东普通高等学校水产品深加工重点实验室,广东 湛江,524088)
为了进一步提高鱼蛋白的热稳定性,扩大水产蛋白的应用范围,本研究以罗非鱼鱼肉为原料来提取肌球蛋白,并对其进行了热处理,同时以浊度、溶解度、总巯基含量和表面疏水性为指标,试验了十二烷基硫酸钠(SDS)和β-环糊精(β-CD)的添加对肌球蛋白热变性聚集的抑制效果,探讨人工分子伴侣(SDS-β-CD)介导液相体系中肌球蛋白热稳定性的改善.单因素影响的分析表明,在试验范围内,在pH 6.0,SDS添加量为5 mmol·L-1和蛋白质量浓度2 g·L-1的条件下,于50 ℃热处理30 min后添加β-CD(SDS与β-CD的比例为1 ∶2),可以有效抑制肌球蛋白的热变性聚集;热变性抑制机理的分析显示,添加SDS和SDS-β-CD均能有效地抑制热升温处理(升温速率1 ℃·min-1,30~80 ℃)对肌球蛋白溶解度和浊度的影响(p≥0.05),抑制热处理对蛋白分子巯基的破坏作用,降低蛋白质分子间的相互作用,由此抑制肌球蛋白热处理过程中的变性聚集,从而改善体系的热稳定性.
肌球蛋白; SDS; β-环糊精; 人工分子伴侣; 热稳定性
中国是世界上最大的罗非鱼养殖生产国家,产量约占全球罗非鱼产量的50%[1].罗非鱼鱼肉的蛋白含量较高,但其蛋白的稳定性差,在加工贮藏过程中极易变性.热处理是食品加工中最重要的工艺之一,也是常见的蛋白质变性方法,在热处理过程中蛋白质分子会产生变性,其分子结构展开,分子间的相互作用可导致分子的聚集和沉淀[2-3].为了减少蛋白质热处理过程中分子间的相互作用和聚集,常尝试添加蛋白质保护剂[4].SDS是具有双亲性结构的小分子表面活性剂,它可与蛋白质分子通过彼此疏水的相互作用而形成复合物,掩盖蛋白质分子所暴露的疏水位点,从而在蛋白质重折叠和恢复天然结构前起到抑制蛋白质聚集的作用[5].相关的研究显示,SDS可有效提高多种食物蛋白质的溶解性,尽管如此,但仍缺乏对其相关机理的解释[6].β-环糊精(β-CD)是一种环状低聚糖,由脱水葡萄糖单位以α-1,4-糖苷键首尾相连而成,在空间呈螺旋状结构,“内疏水,外亲水”的特殊分子结构使其容易包结不同的客体化合物而形成特殊结构的包结物[7],当向表面活性剂-蛋白质混合体系中加入β-CD时,环糊精会通过强烈的竞争性结合作用将表面活性剂从蛋白质分子的表面剥离,使分子恢复到天然构象.小分子表面活性剂和环糊精这种作用体系通常被称为人工分子伴侣(Artificial molecular chaperone),目前它已被用于改善大豆蛋白[5]、牛血清蛋白[8]、溶菌酶[4, 9]等的稳定性.由于肌球蛋白是构成鱼类肌肉蛋白的主要成分之一,因此,本研究从提高鱼蛋白热稳定性的角度出发,研究了单因素的影响和热聚集变性抑制机理,以期为今后罗非鱼蛋白的加工提供理论依据.
1 材料与方法
1.1 实验材料鲜活的罗非鱼:购于湛江市麻章区湖光岩市场,在迅速带回实验室后,去内脏、去骨刺、去红肉,再取其背部白肉,清洗,绞碎.
氯化钾、六水合氯化镁、硫酸铵、十二水合磷酸氢二钠、磷酸二氢钠、氢氧化钠等均为分析纯.
1.2 实验仪器TJ12-A绞肉机,广东番禺恒联食品机械厂;Avanti J-26sxp高效离心机,美国Beckman公司;UV-2550型紫外分光光度计,RF-5301P荧光分光光度计,日本岛津公司;
1.3 实验方法
1.3.1 罗非鱼肌球蛋白的制备 参照课题组洪伟[10]的硫酸铵沉淀法提取肌球蛋白.经硫酸铵沉淀后,取沉淀于Tris-HCl缓冲液(20 mmol·L-1,0.6 mol·L-1KCl,pH 7.0)中透析,然后离心(50 000 g,60 min),所得上清液即为肌球蛋白溶液.接着,采用Lowry法检测上清液的蛋白含量,以牛血清白蛋白(BSA)为标准物,在测量波长为750 nm下,进行SDS-PAGE电泳(5%分离胶,12%浓缩胶),经凝胶成像系统计算,蛋白质的纯度超过93%.
1.3.2 肌球蛋白热变性聚集的抑制实验 用上述Tris-HCl缓冲液稀释肌球蛋白原液到一定浓度,调节pH值,于50 ℃热处理30 min,分别考察SDS添加量(0~50 mmol·L-1)、蛋白质量浓度(0.5~10 g·L-1)、β-CD的添加顺序(热处理前、热处理后)、SDS与β-CD添加的比例(1 ∶1~1 ∶5)对肌球蛋白体系浊度和溶解度的影响;在确定的实验条件下对肌球蛋白溶液进行热处理(升温速率为1 ℃·min-1,30~80 ℃).所有经热处理后的样品立即冷却至室温,检测其浊度的变化,经离心(10 000 g,10 min)后,检测上清液中的可溶性蛋白含量、总巯基含量和表面疏水性.
1.3.3 肌球蛋白浊度的测定 将未加热和热处理后的肌球蛋白样品冷却至室温后,以上述Tris-HCl缓冲液做空白,使用紫外分光光度计在350 nm下测量吸光度A350[11],记为浊度,实验重复3次,取平均值.
1.3.4 总巯基含量的测定 采用DTNB[12]测量可溶性肌球蛋白的总巯基含量.
1.3.5 表面疏水性的测定 采用ANS荧光探针法[13]检测可溶性肌球蛋白的表面疏水性.
1.3.6 统计分析 试验所得的数据结果表示为:平均值±标准差Mean values±SD(Standard Deviation),数据统计分析采用JMP程序进行方差分析,差异显著性(p<0.05)分析采用t统计程序,作图采用origin 7.5软件作图.
2 结果与分析

2.1 人工分子伴侣抑制肌球蛋白热变性聚集的影响因素
2.1.1 SDS添加量对热处理肌球蛋白体系浊度和溶解性的影响
固定肌球蛋白质量浓度为2 g·L-1,调节pH至6.0,于50 ℃热处理30 min,试验SDS添加量对肌球蛋白体系浊度和溶解性的影响,结果如图1.由图1可知,在实验范围内,当SDS浓度高于1 mmol·L-1时,随着SDS浓度的增加,热处理后肌球蛋白体系的浊度下降,而可溶性蛋白质含量增加(p<0.05),且当SDS浓度达到3 mmol·L-1时,热处理后肌球蛋白体系的浊度变化极小,其可溶性蛋白含量基本保持在2 g·L-1(p>0.05).溶解度反映了加热后肌球蛋白的变性程度以及其在溶液中的状态,溶解度越大,则蛋白的变性程度越小;浊度可粗略地估计已溶解的肌球蛋白的热聚集情况,浊度越大,则蛋白的变性程度越大.因此,SDS浓度高于3 mmol·L-1时可以有效地抑制肌球蛋白的热变性和聚集,相关的研究结果在王君[4]的报道中也有体现,适宜浓度的表面活性剂的单独作用即可以抑制聚集并促进复性,且表面活性剂的作用主要在于抑制聚集体的生成[14].综合分析,确定SDS溶液浓度为5 mmol·L-1时进行下一步的实验.

2.1.2 不同蛋白质量浓度条件下SDS对肌球蛋白热变性聚集的影响 固定SDS浓度为5 mmol·L-1,调节pH 6.0,试验不同蛋白质量浓度条件下SDS对肌球蛋白体系浊度和溶解度的影响,结果如图2.由图2可知,没有加SDS的蛋白样品经50 ℃热处理30 min后,体系浊度和可溶性蛋白含量均随初始蛋白质量浓度的增大而增大(p<0.05);添加了SDS的体系在相同条件下热处理后,其浊度变化不明显(p>0.05),且浊度均低于未添加SDS的体系;当蛋白质量浓度为2.0 g·L-1和4.0g·L-1时,添加SDS的蛋白样品在热处理后的溶解度大于没有加SDS的蛋白样品在热处理后的溶解度,但当蛋白质量浓度高于4.0 g·L-1时,添加SDS后体系的可溶性蛋白含量下降(p<0.05),此时,SDS的存在可能促进了分子的聚集,而体系的浊度仍然较低,这表明可能形成了可溶性的大分子聚集体,经离心后即产生沉淀.随着体系蛋白质量浓度的增加,肌球蛋白分子之间的距离减小,这时各种化学键很容易通过相互作用而产生凝集,所以,肌球蛋白的浊度随蛋白质浓度变化明显[15].综合分析,确定蛋白质量浓度为2.0 g·L-1时进行下一步实验.
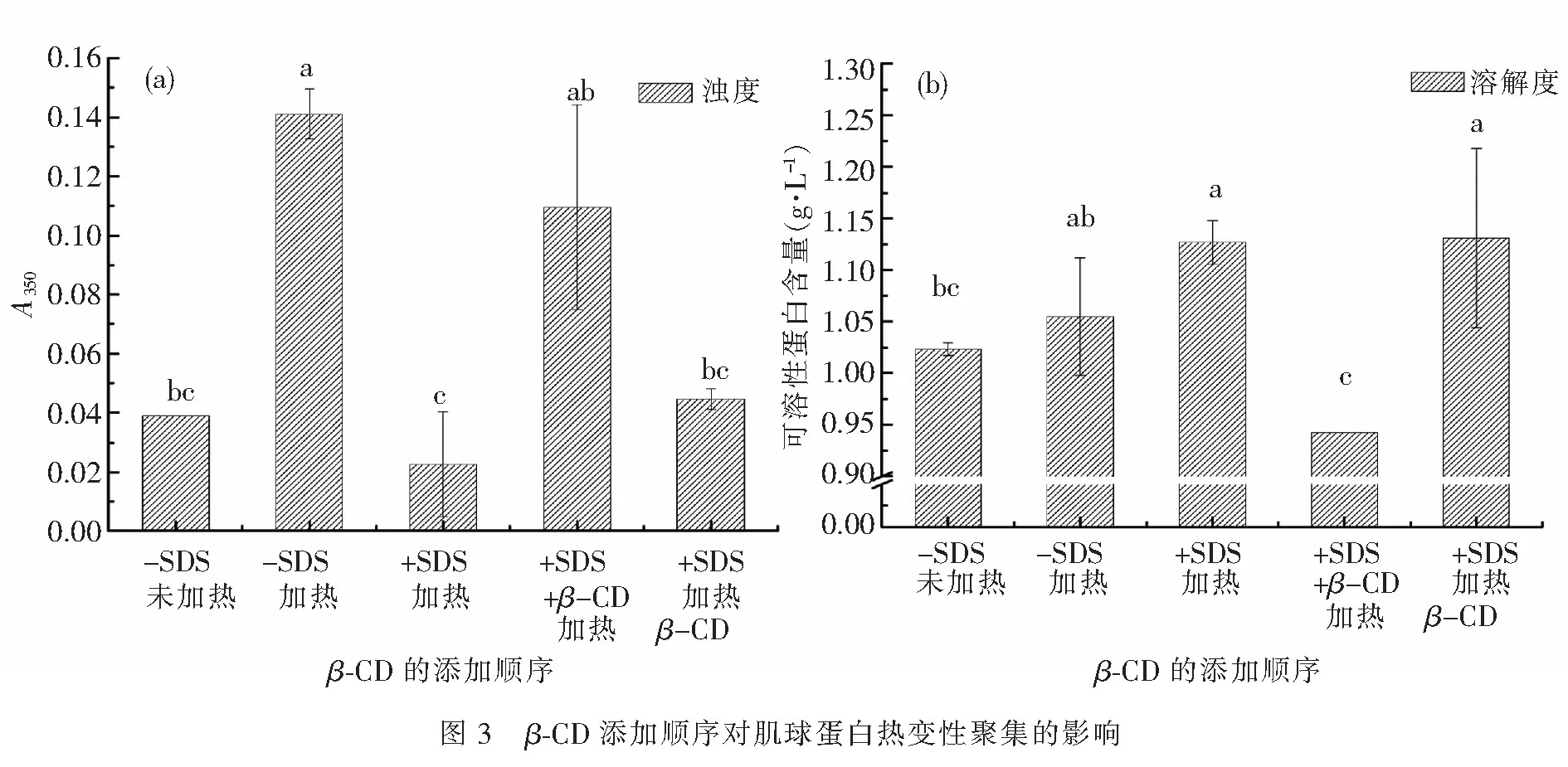
2.1.3β-CD添加顺序对肌球蛋白热变性聚集的影响 固定肌球蛋白质量浓度为2 g·L-1,SDS溶液浓度为5 mmol·L-1,调节pH为6.0,试验β-C添加顺序对肌球蛋白体系浊度和溶解度的影响,结果如图3.由图3可知,添加SDS的肌球蛋白体系经热处理后再添加β-CD,其体系肌球蛋白的溶解度最大,浊度也相对较小;在表面活性剂抑制蛋白质聚集后,添加β-CD,利用β-CD与蛋白质的竞争来吸附表面活性剂,可使蛋白质与表面活性剂分离,从而恢复单体状态.郭建[6]的研究表明,若在热处理前添加β-CD至大豆11S蛋白-SDS分散液,加热后其浊度轻微下降,表明此时SDS起不到抑制蛋白质聚集的作用.若在热处理后添加β-CD至大豆11S蛋白-SDS分散液,加热后其浊度大幅下降,说明SDS能有效抑制蛋白质聚集,但该体系的浊度仍比没有添加β-CD的体系的浊度高,这是由于SDS在加热过程中与大豆11S蛋白形成了复合物;热处理后,β-CD的加入可使SDS与大豆11S蛋白分离.综合分析,确定添加SDS并进行热处理后再添加β-CD来进行下一步实验.
2.1.4 SDS与β-CD添加比例对肌球蛋白热变性聚集的影响 固定肌球蛋白质量浓度为2 g·L-1,调节pH至6.0,添加5 mmol·L-1的SDS,加热后再加β-CD,以此试验SDS与β-CD的添加比例对肌球蛋白体系浊度和溶解度的影响,结果如图4.由图4可知,SDS与β-CD的比例为1∶2时,热处理后肌球蛋白体系的浊度最小,其可溶性蛋白的含量最高(p<0.05),这表明适宜比例的人工分子伴侣组合可以有效抑制肌球蛋白的热变性聚集.人工分子伴侣由SDS和β-CD组成,SDS可以与蛋白质结合而形成复合体,从而抑制蛋白质的聚集,然后,β-CD从复合体中剥离掉SDS,蛋白质再进行折叠[5].Dong等[9]在人工分子伴侣辅助溶菌酶复性的实验中发现,蛋白质折叠率随人工分子伴侣浓度的上升而增大.王君[4]的研究表明,在同样的CTAB用量下,β-CD浓度越高,则复性率越高,当β-CD与CTAB的比为2时,可以实现CTAB的剥离而辅助复性,而当β-CD/CTAB≥4时,复性率达到最高并保持不变;但若β-CD/CTAB<2,那么仅在CTAB用量较低时才能实现复性,当CTAB用量较高时则不足以脱除CTAB而实现溶菌酶的复性.因此,确定SDS与β-CD添加的比例为1 ∶2时进行下一步实验.

综合分析,确定人工分子伴侣抑制肌球蛋白热变性的条件为:pH 6.0,SDS添加浓度为5 mmol·L-1,在蛋白质量浓度为2 g·L-1的条件下,于50 ℃热处理30 min后再添加β-CD(SDS与β-CD的比例为1∶2).
2.2 人工分子伴侣抑制肌球蛋白热变性聚集的机理研究
2.2.1 人工分子伴侣对热处理肌球蛋白体系溶解度的影响 在上述确定的人工分子伴侣抑制肌球蛋白热变性条件下,对肌球蛋白体系进行升温处理(升温速率1 ℃·min-1,30~80 ℃),试验人工分子伴侣体系对热处理肌球蛋白体系溶解度的影响,结果如图5所示.由图5可知,在升温处理过程中,未添加SDS的样品在体系温度上升到40 ℃之后开始急速下降(p<0.05),到50 ℃之后下降速度趋于平缓,且其值较小;对于添加SDS的蛋白样品和添加SDS-β-CD的样品其溶解度随温度升高的变化不明显(p>0.05),由此表明,SDS可以抑制肌球蛋白的热变性,并可增加肌球蛋白的溶解度;比较而言,热处理后加入的β-CD与SDS结合所形成的包结物则进一步增加了肌球蛋白体系在高温时的溶解度.因此,添加SDS关于加热后加β-CD,在高温时其抑制效果更好.


2.2.2 人工分子伴侣对热处理肌球蛋白体系浊度的影响 在上述确定的人工分子伴侣抑制肌球蛋白热变性条件下,进一步试验人工分子伴侣对热处理肌球蛋白浊度的影响,结果如图6所示.由图6可知,在实验温度范围内,未添加SDS的蛋白体系在热处理过程中,其浊度从40 ℃开始显著上升(p<0.05),到60 ℃之后,上升速度趋于平缓,80℃时其浊度最大.很明显,热处理导致了蛋白质分子的变性和聚集,从而引起蛋白溶液浊度的上升[2, 16];添加SDS和添加SDS-β-CD的蛋白样品的浊度随温度升高的变化不明显(p>0.05),表明在热处理过程中,蛋白质分子所暴露的疏水基团与SDS疏水基相互作用而形成可溶性复合体,从而抑制了肌球蛋白分子间的聚集.结合人工分子伴侣对肌球蛋白溶解度的影响的分析可知,加入SDS可以抑制分子的热变性聚集,而添加SDS并于加热后加β-CD,在高温时其抑制效果更好.
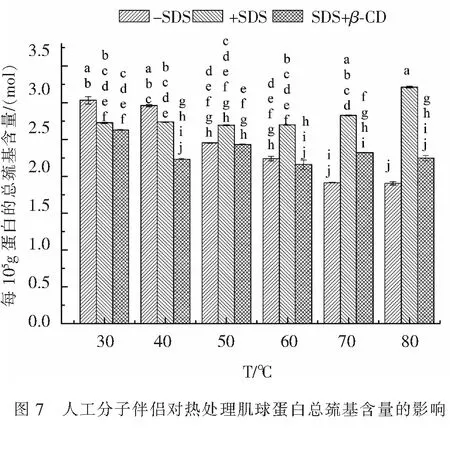
2.2.3 人工分子伴侣对热处理肌球蛋白总巯基含量的影响 进一步分析人工分子伴侣对热处理肌球蛋白总巯基含量的影响,结果如图7.由图7可知,在实验范围内,未添加SDS的肌球蛋白总巯基含量随着热处理温度的升高而下降,且温度高于40 ℃时变化明显(p<0.05),这与Ko等[16]对罗非鱼肌球蛋白热变性的实验结果类似,即总巯基含量随热处理温度的升高而下降;对于热处理前添加了5 mmo·L-1SDS的样品,其总巯基含量在温度上升到70 ℃之前没有明显变化(p>0.05),而当温度升到80 ℃时,其总巯基的含量上升(p<0.05),且在温度上升到50 ℃时,共总巯基的含量开始高于未添加SDS的样品的总巯基含量,这表明SDS的添加对肌球蛋白的分子结构产生了影响;添加SDS并于加热后加β-CD,温度为40 ℃时其总巯基含量下降(p<0.05),温度大于40 ℃时,随着温度的升高其变化不明显(p>0.05).相比较而言,对于添加SDS并于加热后加β-CD的蛋白样品,其总巯基的含量在高温时更趋于稳定.蛋白的热变性和聚集是由于在热处理过程中蛋白分子间的相互作用受到破坏,使其巯基暴露出来,同时被氧化成二硫键,而破坏少量的巯基就会对蛋白性质产生很大的影响[3].综合分析,SDS能有效抑制热处理对肌球蛋白巯基的破坏作用,而在添加SDS并于加热后加β-CD,其在高温时的作用效果更稳定.
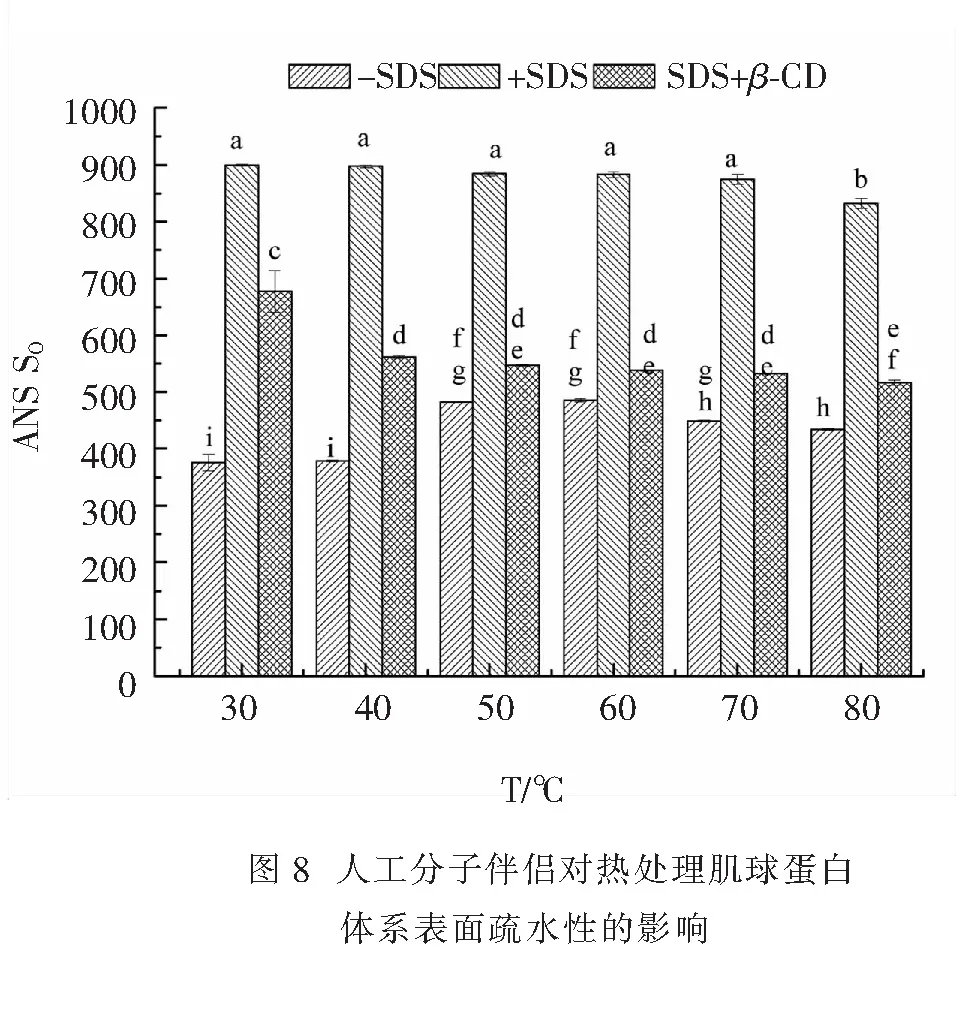
2.2.4 人工分子伴侣对热处理肌球蛋白体系表面疏水性的影响 人工分子伴侣对热处理肌球蛋白表面疏水性的影响结果如图8.由图8可知,在实验范围内,当热处理温度上升到50 ℃时,未添加SDS的肌球蛋白样品的表面疏水性上升,这表明其分子内部的疏水基团暴露了;添加了SDS的蛋白样品都具有较强的表面疏水性,且随热处理温度的升高其变化不明显,可能是因为SDS与蛋白分子之间通过疏水基形成了复合体,避免了蛋白分子的聚集,结合人工分子伴侣对热处理体系浊度和溶解度影响的分析,其进一步表明,SDS的作用主要是抑制蛋白质分子间的疏水聚集[14];对于添加SDS并于加热后加β-CD的蛋白样品,其表面疏水性低于添加SDS的样品的表面疏水性,但仍高于未加SDS的蛋白溶液,表明β-CD未完全剥除复合体中的SDS,溶液中仍存在部分SDS-蛋白复合体,因而使得溶液表面疏水性高于对照组.由此表明,添加SDS可以明显增加热处理后肌球蛋白的表面疏水性,维持其原有的功能特性.也有研究表明,SDS可以与溶菌酶形成一种特殊的复合结构而不会导致分子构象的改变;但产生这种作用需要疏水基团和溶菌酶所带的正电荷来共同参与[9].
3 结 论
单因素影响的分析表明,在试验范围内,于pH为6.0,SDS添加浓度为5 mmol·L-1,蛋白质量浓度为2 g·L-1的条件下,于50 ℃热处理30 min后添加β-CD(SDS与β-CD的添加比例为1∶2),可以有效抑制肌球蛋白热变性聚集.热聚集变性抑制机理的分析显示,添加SDS和SDS-β-CD均能有效抑制热处理(1 ℃·min-1,30~80 ℃)对肌球蛋白溶解度和浊度的影响,并能抑制热处理对蛋白分子巯基的破坏作用,降低蛋白质分子间的疏水相互作用,由此抑制肌球蛋白热处理过程中的变性聚集,从而改善体系的热稳定性.
[1] 郝向举,Helga J.全球罗非鱼的生产与消费[J].中国水产,2012(3):43-44.
[2] Ding Y Q, Liu R, Rong J H, et al. Heat-induced denaturation and aggregation of actomyosin and myosin from yellowcheek carp during setting [J]. Food Chemistry,2014,149:237-243.
[3] Wei W, Sandeep N, Dirk T. Protein aggregation-pathways and influencing factors [J]. International Journal of Pharmaceutics, 2010, 390(2): 89-99.
[4] 王君.表面活性剂辅助蛋白质复性过程机理研究[D].北京:清华大学,2004.
[5] Shlomo M, Yelena V, Perla R. Formation and structural heat stability of β-lactoglobulin surfactant complexes [J]. Colloids and Surfaces B: Biointerfaces, 1996, 6: 353-362.
[6] 郭建.大豆蛋白热聚集行为控制及其结构表征的研究[D].广州:华南理工大学,2012.
[7] 李伟刚,陈超球,廖森.环糊精及其应用[J].广西师范学报:自然科学版,1994(2):58-608.
[8] 刘洋.环糊精对离子型表面活性剂与牛血清白蛋白相互作用的影响[D].扬州:扬州大学,2008.
[9] Dong X Y, Shi J H, Sun Y. Cooperative effect of artificial chaperones and guanidinium chloride on lysozyme renaturation at high concentrations [J]. Biotechnology Progress, 2002, 18(3): 663-665.
[10] 洪伟.pH值调节诱导鳄蛇鲻肌球蛋白分子展开/折叠行为的研究[D].湛江:广东海洋大学,2014.
[11] 陈铮,朱蓓薇,李冬梅,等.热处理过程中牡蛎闭壳肌肌原纤维蛋白部分理化特性的变化[J].食品与发酵工业,2012,38(7):53-57.
[12] Yasir A A, Soottawat B.Impact of zinc salts on heat-induced aggregation of natural actomyosin from yellow stripe trevally[J]. Food Chemistry, 2012(135):2 721-2 727.
[13] Yongsawatdigul J, Park J W.Thermal denaturation and aggregation of threadfin bream actomyosin [J]. Food Chemistry,2003(83):409-416.
[14] Rozema D, Gellman S H. Artificial chaperone-assisted refolding of denatured-reduced lysozyme: modulation of the competition between renaturation and aggregation [J]. Biochemistry,1996,35(49):15 760-15 771.
[15] Akutagawa T. Molecular mechanism of myosin assembly [R]. ICR Annual Report,1997,4:48-49.
[16] Ko W C, Yu C C, Hsu K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment [J]. LWT-Food Science & Technology,2007,40(8):1 316-1 320.
Artificial Molecular Chaperone-Mediated Thermal Stability of Myosin in the Liquid System
Fu Weiya, Zhong Wanling, Hu Yali, Zhou Chunxia, Hong Pengzhi
(College of Food Science and Technology, Guangdong Ocean University, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, Zhanjiang 524088, China)
In order to further enhance the thermal stability of fish protein, and expand the application range of aquatic protein, in the study, myosin was extracted from tilapia meat, and heat treatment was performed. The turbidity, solubility, total sulphur content, surface hydrophobicity and fluorescence emission spectra of myosin were used as index, and the inhibition effects of the addition of SDS and β-CD on the thermal denaturation and aggregation of myosin were studied, and the improvement of thermal stability of myosin in the liquid system was discussed by artificial molecular chaperone (SDS-β-CD). Single factor analysis results showed that at pH 6.0, when the concentration of SDS was 5mmol·L-1, the concentration of myosin was 2mg·mL-1, and when the sample was heated at 50℃ for 30min and β-CD (SDS and β-CD ratio of 1:2) was added, the thermal denaturation and aggregation of myosin were could effectively inhibited. The inhibition mechanism analysis of thermal denaturation and aggregation showed that effects of addition of SDS and SDS-β-CD on the solubility and turbidity (p>0.05) was effectively inhibited during the process of heating treatment (1℃·min-1, 30~80℃). The destructive effects of heat-treatment on sulfydryl of protein molecules were inhibited, and the interactions between protein molecules were decreased, which resulted in the inhibition of thermal denaturation and aggregation of myosin, and the thermal stability of the system was improved.
Myosin; SDS; β-CD; artificial molecular chaperone; thermal stability
2016-03-16
广东省教育厅科技创新项目(2013KJCX0098);广东省高等学校学科与专业建设专项科技创新项目(2013KJCX0098)
付苇娅(1990-),女,河南周口人,广东海洋大学食品科技学院2014级在读硕士生,E-mail:happydall@126.com
周春霞(1979-),女,博士,副教授,研究方向:水产品高值化加工与利用研究,E-mail:chunxia.zhou@163.com
1004-1729(2016)04-0356-07
Q2
A DOl:10.15886/j.cnki.hdxbzkb.2016.0054
