鰤鱼诺卡氏菌与黄粉色诺卡氏菌原生质体融合的研究
2017-01-13王英华陈建林张红莲夏立群
王英华,陈建林,徐 亮,张红莲,夏立群,2,3
(1. 广东海洋大学 水产学院,广东 湛江 524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088;3. 广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524088)
鰤鱼诺卡氏菌与黄粉色诺卡氏菌原生质体融合的研究
王英华1,陈建林1,徐 亮1,张红莲1,夏立群1,2,3
(1. 广东海洋大学 水产学院,广东 湛江 524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088;3. 广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524088)
鰤鱼诺卡氏菌是鱼类诺卡氏菌病的主要病原,黄粉色诺卡氏菌为一种近缘无毒环境诺卡氏菌.本实验研究主要以鰤鱼诺卡氏菌和黄粉色诺卡氏菌为两亲本,开展了原生质体融合研究.针对诺卡氏菌细胞壁厚的特性,本实验对原生质体制备时的溶菌酶脱壁时间进行了筛选,确定鰤鱼诺卡氏菌和黄粉色诺卡氏菌的最佳脱壁时间分别是65 min和100 min.用聚乙二醇促使两亲本菌的原生质体融合后,通过选择性培养基培养、菌落形态筛选、革兰氏染色观察、16S rRNA测序等方法,对融合菌株进行了初步鉴定.鉴定结果表明:融合菌株的菌落形态较两亲本发生了改变,为革兰氏阳性菌,通过16S rRNA基因序列比对,其与鰤鱼诺卡氏菌的同源性为99%.融合菌株的毒力较鰤鱼诺卡氏菌野生株有所降低.本研究为鰤鱼诺卡氏菌活疫苗的研制提供了新思路,对鱼类诺卡氏菌病的防治具有一定的潜在价值.
原生质体融合; 鰤鱼诺卡氏菌; 黄粉色诺卡氏菌
诺卡氏菌为革兰氏阳性菌,是一种放线菌,菌体呈线状、短杆状或细长分枝状,细胞壁厚.由诺卡氏菌引起的淡水养殖鱼类诺卡氏菌病,最早报道是发生于南美阿根廷,后来在北美和欧洲发病,近年来也见于东南亚和大洋洲.诺卡氏菌感染海水养殖鱼类的病例最初确认于日本,近来频发于东南亚、地中海等地区[1-4].
鰤鱼诺卡氏菌(Nocardia seriolae)是鱼类诺卡氏菌病的主要病原,它可引起系统性肉芽肿疾病,在鱼体内及体表形成大量结节、引起其体表出血及溃疡[3-6].鰤鱼诺卡氏菌的疫苗研制进展缓慢,其灭活疫苗无法提供有效保护.Itano等人[7]以土壤诺卡氏菌(N. soli)和河流诺卡氏菌(N. fluminea)作为活疫苗,免疫五条鰤(Seriola quinqueradiata),然后用鰤鱼诺卡氏菌攻毒,结果表明能产生一定的免疫保护,相对保护率最高达65. 4%,但可能由于所用环境的诺卡氏菌的免疫原性与鰤鱼诺卡氏菌差异较大,其免疫效果离商品化尚有一段差距.
鰤鱼诺卡氏菌NS株(N. seriolae NS)是通过强毒株鰤鱼诺卡氏菌ZJ0503进行多重诱变后经筛选所获得的减毒株,将鰤鱼诺卡氏菌NS与无毒环境诺卡氏菌——黄粉色诺卡氏菌(N. flavorosea)进行原生质体融合研究,旨在获得高免疫原性、低毒性的融合菌株,进而研制疫苗.
1 材料与方法
1.1 实验材料
1.1.1 菌株和培养基 鰤鱼诺卡氏菌减毒株N. seriolae NS由本实验室筛选保藏,黄粉色诺卡氏菌(N. flavorosea)购自中国普通微生物保藏管理中心,编号4.1175,是从中国云南省的土壤中分离而得到.改良液体培养基:葡萄糖20 g·L-1, 酵母粉15 g·L-1,K2HPO40.75 g·L-1, NaCl 5 g·L-1, CaCl20.2 g·L-1, pH(6.5±0.2)(固体培养基添加琼脂20 g·L-1).再生补充基本培养基(SMR):葡萄糖5 g·L-1,(NH4)2SO42 g·L-1,柠檬酸钠 1 g·L-1,K2HPO4·3H2O 14 g·L-1,KH2PO46 g·L-1,MgSO4·7H2O 0.2 g·L-1,腺嘌呤 20 mg·L-1,蔗糖 0.5 mol·L-1,pH 7.0,100 Pa灭菌20 min.
1.1.2 试剂和引物 细菌基因组DNA提取试剂盒、溶菌酶(50 g·L-1)购自Tiangen公司;Premix TaqTMPCR预混液购自TaKaRa公司;聚乙二醇(PEG-4000)等其他试剂均为国产分析纯.16S rRNA通用引物为27F:5′ AGAGTTTGATCCTGGCTCAG 3′和1492R:5′ GGTTACCTTGTTACGACTT 3′.
1.2 实验方法
1.2.1 细菌悬液的制备 将-80 ℃保存的鰤鱼诺卡氏菌NS和黄粉色诺卡菌划线,接种于改良固体培养基,于28 ℃恒温倒置培养.待长出菌落后,挑取单菌落接种于100 mL改良液体培养基培养48~72 h.各取10 mL菌液,4 000 r·min-1离心10 min,弃上清液,将菌体沉淀用PBS重悬后,4 000 r·min-1离心弃上清,重复两次.最后将菌体重悬于原生质体稳定液(SMM:蔗糖0.5 mol·L-1,MgCl220 mol·L-1,顺丁烯二酸 0.02 mol·L-1,pH 6.5)中,调整菌密度至108~109cfu·mL-1.
1.2.2 脱壁处理 分别取鰤鱼诺卡氏菌NS、黄粉色诺卡菌的细菌悬液各5 mL,加入溶菌酶(终质量浓度1 g·L-1)混匀后,于30 ℃水浴(进行脱壁处理),于处理后的30~105 min内每隔5 min取样一次,染色后在显微镜下观察原生质体形成的情况,当95%以上的细胞成球形原生质体时,即为最佳脱壁时间.将原生质体悬液以4 000 r·min-1离心10 min,弃去酶液,加入5 mL高渗缓冲液(Na2HPO40.07 mol·L-1,甘露醇0.8 mol·L-1,pH8.6)重悬.
1.2.3 原生质体的融合 各取1 mL鰤鱼诺卡氏菌NS、黄粉色诺卡菌的原生质体悬液于4 mL的离心管中混合,静置5~10 min,然后以2 500 r·min-1离心10 min,弃上清,往沉淀中加入200 μL的原生质体稳定液(SMM),混匀,再加入1.8 mL促融合剂溶液(含φ=40%的聚乙二醇PEG-4000的SMM溶液),微微摇晃混匀后,放入30 ℃的水浴锅中水浴40~90 min,其间每隔5 min取样,染色镜检融合情况,确定最佳的融合时间.融合完成后,以2 500 r·min-1离心10 min,弃上清,加入2 mL的原生质体稳定液(SMM),制成融合悬液.
1.2.4 融合子检出 往培养皿中倒入含2.0%琼脂的再生补充基本培养基(SMR),并以其作为基层培养基.然后取500 μL融合悬液,用原生质体稳定液(SMM)作适度稀释(100、10-1、10-2),取1 mL稀释液,将其与新鲜灭菌并冷却到50 ℃左右的再生补充基本培养基(含1.0%琼脂)混匀,并迅速倒在基层培养基上,28 ℃培养3~4 d.初步认为所长出的菌落是融合子,继续转接传代培养.
1.2.5 融合子的筛选 通过菌落形态特征来进行融合子的初步筛选.即依据存活菌落的形态、颜色等特征,选择与两亲本菌株菌落特征都不相同的融合子菌落,并进行革兰氏染色.
1.2.6 序列分析 将步骤1.2.5中筛选出的融合子,提取DNA.利用细菌的16S rRNA通用引物F27和R1492,使用Premix TaqTMPCR预混液进行16S rRNA扩增,产物送生工生物工程(上海)股份有限公司进行测序.将测序结果在NCBI上通过Blast N进行同源性比对,并用DNAMAN进行多重序列比对.
1.2.7 融合菌株毒力测试 挑取融合菌株和野生株鰤鱼诺卡氏菌ZJ0503单菌落,经PBS重悬清洗,以4 000 r·min-1离心10 min,收集菌体后,加入适量的PBS以制成菌悬液,调整细菌密度为108cfu·mL-1.用PBS对菌悬液进行10倍稀释,以用于平板菌落计数法中测cfu.实验组(30尾斑马鱼):用微量注射器将融合菌悬液于腹腔注入斑马鱼(10 μL·尾-1);阳性对照组(30尾):接种同剂量的鰤鱼诺卡氏菌ZJ0503;阴性对照组(30尾):接种PBS.将斑马鱼分组饲养于不同的水族箱,水温保持在28 ℃左右,连续观察5 d,在此期间观察斑马鱼的死亡情况.
2 结 果
2.1 细菌脱壁处理的结果在未脱壁前,鰤鱼诺卡氏菌NS在显微镜下所观察到的形态大致为长杆状,具隔横,容易断裂为杆状,有分枝(图1A);以1 g·L-1溶菌酶对菌体进行脱壁处理后,每隔5 min取样,染色镜检,观察细菌的脱壁情况,确定鰤鱼诺卡氏菌NS在脱壁处理65 min后其脱壁率达95%(图1B),此后原生质体的形成不再增加,故确立鰤鱼诺卡氏菌NS的脱壁时间为65 min.
进行脱壁处理前,通过革兰氏染色在显微镜下可看到黄粉色诺卡氏菌呈长杆状,菌丝有横隔和分枝(图1C);对黄粉色诺卡氏菌脱壁处理后,在100 min时原生质体形成较明显,脱壁率达到95%左右(图1D),故确立鰤鱼诺卡氏菌NS的脱壁时间为100 min.

图1 鰤鱼诺卡氏菌NS和黄粉色诺卡氏菌脱壁前后的变化(1 000×)
2.2 原生质体的融合结果细菌脱壁后形成的球状原生质体在PEG-4000的作用下,原生质体发生融合.在此过程中,需要控制好融合的时间及温度,每隔一段时间取样观察,能够看到原生质体小球互相靠近并融合,在融合原生质体的周围会呈现椭圆状光圈.图2为鰤鱼诺卡氏菌NS与黄粉色诺卡氏菌原生质体融合时不同时间的融合情况,从图2可知,原生质体的融合时间在50 min时达到理想效果,50 min以上的融合效果基本不变,因此确定两种原生质体融合的最佳时间为50 min.

A:融合45 min; B:融合50 min; C:融合55 min
融合后在再生补充基本培养基平板上长出的菌落,在经多次传代后,选性状稳定的菌落,观察各菌落的形态和颜色,将其与亲本菌落的特征进行比较,筛选菌落形态和颜色明显不同的菌落,初步认为其是成功的融合子(图3).鰤鱼诺卡氏菌NS的菌落呈淡黄色、半干燥、沙粒状(图3A);而黄粉色诺卡氏菌的菌落大、边缘不整齐、呈黄粉色(图3B);融合子菌落为白色、偏湿润(图3C).融合子菌落在显微镜下的形态为短杆状,经革兰氏染色呈紫色,为革兰氏阳性菌(图3D).
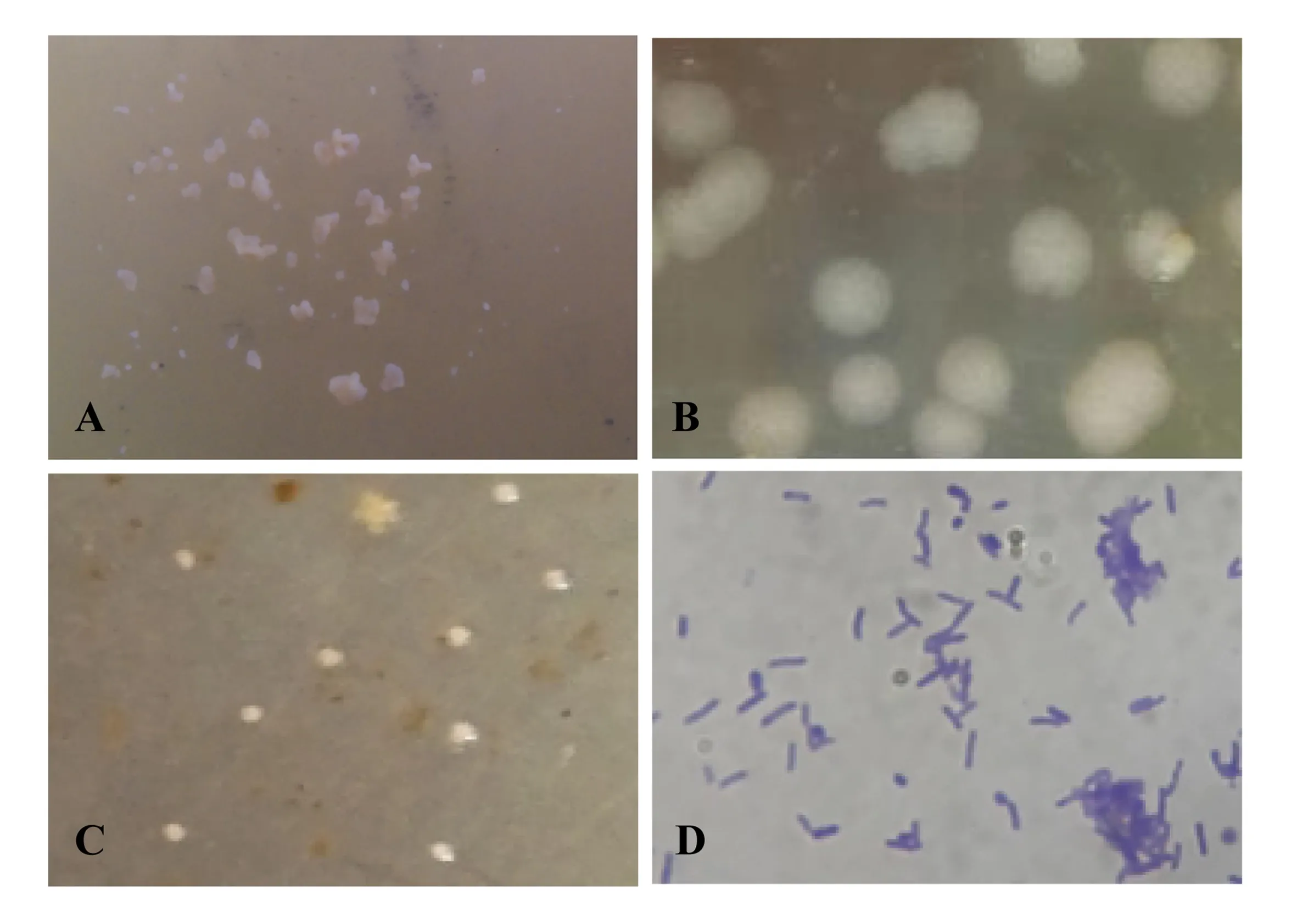
A:鰤鱼诺卡氏菌NS; B:黄粉色诺卡氏菌; C:融合子; D:融合子革兰氏染色(1 000×)
2.3 16S rRNA序列的分析结果将融合子16S rRNA PCR扩增产物送到生工生物工程(上海)股份有限公司测序,将测序结果在NCBI上通过Blast N进行同源性比对,其结果与鰤鱼诺卡氏菌ZJ0503的16S rRNA基因序列的同源性最高,达99%(图4).故确定该菌株为诺卡氏菌属的细菌,它与鰤鱼诺卡氏菌的遗传关系较近.
2.4 融合菌株毒力测试结果毒力实验表明,对于腹腔注射融合菌株的斑马鱼,在攻毒5天后其存活率为88%,而野生株鰤鱼诺卡氏菌ZJ0503的存活率为60%,融合菌攻毒后的斑马鱼存活率明显高于鰤鱼诺卡氏菌ZJ0503(图5),结果表明,筛选到的融合菌毒力较野生株鰤鱼诺卡氏菌ZJ0503有所降低.
3 讨 论
研究表明,传统的鰤鱼诺卡氏菌灭活疫苗,如甲醛灭活疫苗、热灭活疫苗、添加弗氏佐剂的灭活疫苗等,虽然可以提高血清凝集抗体的效价,但攻毒后并不能提供有效的免疫保护作用[8-9],这可能是由于灭活过程损失了重要抗原物质的缘故.根据近缘菌具有交叉保护性抗原的原理,Itano[7]等人以近缘环境诺卡氏菌作为活疫苗,免疫保护率较鰤鱼诺卡氏菌灭活疫苗有大幅提高,但仍然不够理想.目前看来,在进行鰤鱼诺卡氏菌疫苗研制时,活疫苗较灭活疫苗更为可行[10].


本实验室前期通过多重诱变后筛选获得了减毒株鰤鱼诺卡氏菌NS,作为活疫苗它能提供85%的免疫保护率.为了进一步降低活疫苗在使用过程中毒力回复的风险,我们将该减毒株与筛选到的无毒近缘种黄粉色诺卡氏菌进行了原生质体的融合,构建融合菌,以期获得高免疫原性、低毒性的融合菌株,并以其作为更为安全有效的鰤鱼诺卡氏菌活疫苗.结果表明,初步筛选到一株菌落形态和颜色与亲本菌落有差异的融合子,其16S rRNA基因序列与鰤鱼诺卡氏菌的同源性最高,且毒力较野生株有所下降,初步证明鰤鱼诺卡氏菌与黄粉色诺卡氏菌的原生质体融合成功.
在进一步的研究中,可对所得的融合菌进行免疫保护率评估.本研究为鰤鱼诺卡氏菌活疫苗的研制提供了新思路,这对鱼类诺卡氏菌病的防治具有一定的潜在价值.
[1] Xia L Q,Zhang H L,Lu Y S,et al.Development of a loop-mediated isothermal amplification assay for rapid detection of Nocardia salmonicida, the causative agent of nocardiosis in Fish[J].Journal of Microbiology and Biotechnology,2015,25(3):321-327.
[2] 夏洪丽,鲁义善,汤菊芬,等.鱼类致病杀鲑诺卡氏菌(Nocardia salmonicida)特异性PCR检测方法的建立[J].广东海洋大学学报,2014,34(4):56-61.
[3] Elkesh A,Kantham K P,Shinn A P,et al.Systemic nocardiosis in a Mediterranean population of cultured meagre,Argyrosomus regius Asso (Perciformes:Sciaenidae) [J].Journal of Fish Diseases,2013,36(2):141-149.
[4] Wang G L,Yuan S P,Jin S.Nocardiosis in large yellow croaker,Larimichthys crocea (Richardson) [J].Journal of Fish Diseases,2005,28(6):339-345.
[5] 满其蒙.鰤鱼诺卡氏菌致病机制的研究[D].上海:上海海洋大学,2013.
[6] Labrie L,Ng J,Tan Z,et al.Nocardial infections in fish:an emerging problem in both freshwater and marine aquaculture systems in Asia[C].Diseases in Asian aquaculture VI.Fish health section.Manila:Asian Fisheries Society,2008:297-312.
[7] Itano T, Kawakami H, Kono T,et a1.Live vaccine trials against nocardiosis in yellowtail,Seriola quinqueradiata [J].Aquaculture,2006,261(4):1 175-1 180.
[8] Shimahara Y,Yasuda H,Nakamura,et al.A Detection of antibody responses against Nocardia seriolae by enzyme-linked immunosorbent assay (ELISA) and a preliminary vaccine trial in yellowtail Seriola quinqueradiata[J]. Bulletin of the European Association of Fish Pathologists,2005,25(6):270-275.
[9] Kato G, Kato K,Jirapongpairo J W,et al.Development of DNA vaccines against Nocardia seriolae infection in fish[J].Fish Pathology,2014,49(4):165-172.
[10] Shoemaker C A, Klesius P H, Evans J J,et al.Use of Modified live vaccines in aquaculture[J].Journal of the World Aquaculture Society,2009,40(5):573-585.
Protoplast Fusion ofNocardiaseriolaeandNocardiaflavorosea
Wang Yinghua1, Chen Jianlin1, Xu Liang1, Zhang Honglian1, Xia Liqun1,2,3
(1. Fisheries College of Guangdong Ocean University, Zhanjiang 524088, China; 2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, China; 3. Key Laboratory of Diseases Controlling for Aquatic Economic Animals of Guangdong Higher Education Institutions, Zhanjiang 524088, China)
Nocardia seriolae is the main pathogen of fish nocardiosis, while N. flavorosea is an avirulent related environmental Nocardia spp. In the study, N. seriolae and N. flavorosea were selected as parent strains and protoplast fusion was carried out. According to the cell wall characteristics of the two Nocardia spp, which were thick, the cell wall treating time by lysozyme during protoplast preparation were optimized, and the optimal treating time for N. seriolae and N. flavorosea was 65min and 100min, respectively. After the two kinds of protoplast were fused by using polyethylene glycol (PEG) as fusogen under high concentration of Ca2+, the fusion strains were identified by selective medium culture, colony morphology filtering, Gram staining, and 16s rRNA sequencing. The results indicated that the fusant was Gram-positive bacteria, and whose colony morphology was different with that of the parent strains, the 16S rRNA sequence of fusant was 99% identical to that of N. seriolae. Compared with wild strains N. seriolae ZJ0503, the virulence of fusant was decreased. Our study provides a new idea for N. seriolae live vaccine development, and is valuable for the prevention and treatment of fish nocardiosis.
protoplast fusion; Nocardia seriolae; Nocardia flavorosea
2016-07-12
广东省国际科技合作项目(2016A050502061);广东省教育厅特色创新项目(2014KTSCX075);深圳大鹏新区产业发展专项资金(KY20160207);广东省攀登计划项目(pdjh2016b0234);“海之帆—起航计划”大学生科技创新培育专项(hzfqhjhzrkx2015b03)
王英华(1991-),女,广东信宜人,广东海洋大学水产学院2012级本科生,E-mail:1024765309@qq.com
夏立群(1976-),女,安徽太和人,博士,副教授,硕士生导师,研究方向:水生动物病原生物学,Email:xialq@gdou.edu.cn
1004-1729(2016)04-0350-06
S 943. 2
A DOl:10.15886/j.cnki.hdxbzkb.2016.0053
