右美托咪定与氯胺酮联用对神经病理性痛大鼠脊髓小胶质细胞活化的影响*
2017-01-12于明良彭晓红杨文超
于明良, 彭晓红, 杨文超
华中科技大学同济医学院附属武汉普爱医院麻醉科,武汉 430022
右美托咪定与氯胺酮联用对神经病理性痛大鼠脊髓小胶质细胞活化的影响*
于明良, 彭晓红△, 杨文超
华中科技大学同济医学院附属武汉普爱医院麻醉科,武汉 430022
目的 观察联合使用右美托咪定和氯胺酮对神经病理性痛大鼠脊髓小胶质细胞活化及细胞因子释放的影响。方法 雄性SD大鼠50只,分为假手术组(S组)、坐骨神经结扎模型组(C组)、氯胺酮组(K组)、右美托咪定组(CL组)、氯胺酮+右美托咪定(KC组)组。C组、K组、CL组、KC组采用坐骨神经慢性压迫法(CCI)制备大鼠神经病理性痛模型,S组仅暴露坐骨神经,不结扎。手术当天至术后第6天,每天给予K组氯胺酮(10 mg/kg)、CL组右美托咪定(50 μg/kg)、KC组氯胺酮(10 mg/kg)+右美托咪定(50 μg/kg)腹腔注射,S组和C组腹腔注射等容量生理盐水。各组分别于术前1 d、术后3、7、11 d测定机械痛阈和热痛阈,术后第11天用免疫组化法测大鼠脊髓小胶质细胞标志物Iba-1的表达,ELISA试剂盒测肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)的表达。结果 与S组比较,C组、K组、CL组、KC组术后机械痛阈和热痛阈均降低(均P<0.05),小胶质细胞Iba-1表达增多(P<0.05),TNF-α、IL-1β表达升高(均P<0.05);与C组比较,K组、CL组、KC组术后机械痛阈和热痛阈升高(均P<0.05),小胶质细胞Iba-1、TNF-α和IL-1β表达降低(均P<0.05);与K组、CL组比较,KC组术后机械痛阈和热痛阈升高(均P<0.05),小胶质细胞Iba-1、TNF-α和IL-1β表达降低(均P<0.05)。结论 右美托咪定联合氯胺酮使用能抑制小胶质细胞的活化,并减少TNF-α、IL-1β的表达,具有显著的协同镇痛作用。
神经病理性疼痛; 小胶质细胞; 右美托咪定; 氯胺酮
神经病理性疼痛(neuropathic pain)是因为神经系统功能紊乱或者是最初的损伤而造成的疼痛[1]。近年关于神经病理性痛的研究重点转移到小胶质细胞,发现活化的小胶质细胞通过产生和释放细胞因子,在神经病理性疼痛的发生、维持中发挥着重要的作用[2]。研究发现氯胺酮(ketamine,KET)作为非竞争性N-甲基-D-天冬氨酸(NMDA)受体拮抗剂,可抑制伤害性信息的传递[3],在神经病理性疼痛的治疗中发挥作用。右美托咪定是α2肾上腺素能受体激动剂,具有镇静、镇痛的作用,因具有高度的选择性而被临床广泛使用[4]。其镇痛机制可能与抑制小胶质细胞激活有关。因此,推测二者联合用药可能通过作用于小胶质细胞而发挥协同镇痛作用。本研究拟通过观察右美托咪定与氯胺酮联合使用对神经病理性痛大鼠脊髓小胶质细胞活化及细胞因子表达的影响,对其可能的镇痛机制进行初步探究。
1 材料与方法
1.1 实验动物的选择及实验分组
实验共选取了50只SD大鼠,均为健康雄性大鼠,体重170~210 g,由华中科技大学同济医学院实验动物学部提供,SPF级,实验动物分别单独饲养。按照随机原则将实验大鼠分为5组,每组10只,分别为假手术组(S组)、坐骨神经结扎组(C组)、氯胺酮组(K组)、右美托咪定组(CL组)及氯胺酮+右美托咪定组(KC组)。
1.2 实验所用药品、试剂和仪器
兔抗大鼠Iba-1多克隆抗体(武汉博士德生物有限公司,货号:PB0517,稀释度1∶200);即用型SABC-POD(兔IgG)试剂盒(武汉博士德生物有限公司,货号:SA1022);盐酸氯胺酮注射液(福建古田药业有限公司,批号:KH140309);右美托咪定注射液(江苏恒瑞医药股份有限公司,批号:15020632);PL-200热辐射仪(成都泰盟科技有限公司)。
1.3 模型制备
参照文献[5]所介绍的坐骨神经慢性压迫法(CCI)进行神经病理性痛大鼠模型的制备。实验大鼠腹腔注射10%水合氯醛,剂量为300 mg/kg,游离坐骨神经,用4-0羊肠线在坐骨神经干位置扎4道,每道间隔1 mm左右,结扎的松紧程度以不对血运造成影响为宜,大鼠肢体在结扎时会出现轻微抽动。S组不结扎,仅将坐骨神经暴露,其余各组均制作坐骨神经结扎模型。术后当天至第6天,每天给予K组氯胺酮(10 mg/kg)、CL组右美托咪定(50 μg/kg)、KC组氯胺酮(10 mg/kg)+右美托咪定(50 μg/kg)腹腔注射,S组和C组腹腔注射等容量生理盐水。然后观察大鼠术后1~11 d自发性痛行为。
1.4 行为学测定
各组大鼠分别在术前1 d、术后3、7、11 d时对机械痛阈(MWT)和热痛阈(TWL)进行测定。①机械痛阈(MWT)的测定:采用up-down法对大鼠的机械痛阈进行测定[6]。把大鼠放置在实验箱中适应30 min以上,使之安静并适应,实验箱为30 cm×40 cm×60 cm的有机玻璃箱,底部为1 cm×1 cm的铁丝网,采用von Frey纤维丝测定机械缩足反射阈值(paw withdrawl thershold,PWT)。②热痛阈(TWL)的测定:参照Hargreaves等[7]的方法测定热痛阈。热辐光源通过3 mm厚的玻璃板对大鼠右后肢足底的中部进行照射,并对其缩足反应出现的时间予以记录,且每隔5 min测定1次,连测3次,取其平均值作为热痛阈。
1.5 免疫组化法检测小胶质细胞活化
每组大鼠于术后第11天用10%水合氯醛麻醉,生理盐水快速行主动脉灌注,取脊髓腰膨大段,4%多聚甲醛固定3 h后,蔗糖梯度脱水,石蜡包埋,4 μm石蜡切片,二甲苯脱蜡,组织抗原修复,双氧水封闭内源性过氧化物酶;滴加5%的BSA常温封闭1 h,滴加一抗(Iba-1,浓度1∶200)4℃过夜。次日PBS冲洗,加二抗,DAB显色,苏木精复染,阴性对照用PBS代替,树胶封片后显微镜下拍片观察实验结果。随机在每张切片的脊髓背角部位选取5个视野,采用Image-Pro Plus 6.0软件测定阳性反应细胞的吸光度(A)值,取平均吸光度值作为测量值。
1.6 酶联免疫吸附法检测脊髓TNF-α、IL-1β含量
取清洗后的大鼠脊髓腰膨大,加入5 mL预冷PBS研磨,离心5 min后取上清液,采用相应的试剂盒检测脊髓提取液中的TNF-α、IL-1β含量,严格按照试剂盒说明书进行操作。
1.7 统计学分析
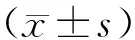
2 结果
2.1 大鼠机械痛阈与热痛阈改变
各组大鼠在术前1 d的机械痛阈和热痛阈比较差异无统计学意义(均P>0.05)。较之术前1 d及S组,C组、K组、CL组和KC组大鼠出现了机械痛阈和热痛阈的明显降低,差异均有统计学意义(均P<0.05);较之C组,K组、CL组和KC组大鼠在术后的3、7、11 d都出现了机械痛阈值和热痛阈值的明显升高,差异均有统计学意义(均P<0.05);较之K组、CL组,KC组术后机械痛阈和热痛阈升高,差异均有统计学意义(均P<0.05),见表1、表2。


组别术前术后不同时间3d7d11dS22.8±2.622.5±3.321.8±3.523.1±2.6C23.3±3.510.9±2.9#△7.2±1.9#△8.9±1.7#△K22.5±2.314.1±2.1#△▲14.3±2.1#△▲15.7±2.2#△▲CL23.2±2.713.7±2.9#△▲13.9±1.8#△▲15.1±2.9#△▲KC23.9±2.814.9±2.4#△▲17.1±3.2#△▲★☆18.1±2.3#△▲★☆
与术前比较,#P<0.05;与S组比较,△P<0.05;与C组比较,▲P<0.05;与K组比较,★P<0.05;与CL组比较,☆P<0.05


组别术前术后不同时间3d7d11dS11.5±0.711.4±0.511.3±0.711.2±0.6C11.3±0.56.9±0.6#△7.2±0.6#△7.9±0.7#△K11.2±0.37.7±0.3#△▲8.1±0.3#△▲9.1±0.6#△▲CL11.5±0.37.6±0.4#△▲8.3±0.3#△▲8.7±0.9#△▲KC11.3±0.49.5±1.1#△▲10.1±1.4#△▲★☆10.3±1.2#△▲★☆
与术前比较,#P<0.05;与S组比较,△P<0.05;与C组比较,▲P<0.05;与K组比较,★P<0.05;与CL组比较,☆P<0.05
2.2 大鼠脊髓背角小胶质细胞的活化
由图1可见,术后第11天S组小胶质细胞处于静止状态,表现为细胞数量少、突起少、染色浅。其余各组小胶质细胞呈现不同程度的激活状态,表现为细胞数目增多、体积增大、细胞突起伸长和染色变深等。术后第11天C组小胶质细胞特异表达产物Iba-1的平均吸光度值为(255.2±14.1),高于S组的(61.2±6.8),差异有统计学意义(P<0.05);KC组小胶质细胞Iba-1的平均吸光度值为(106.6±11.6),低于K组的(175.3±11.4)和CL组的(166.2±9.9),差异均有统计学意义(均P<0.05)。

图1 各组大鼠脊髓小胶质细胞Iba-1的表达(免疫组化染色,×200)Fig.1 Expression of Iba-1 in spinal microglia of different groups(immunohistochemical staining,× 200)
2.3 大鼠脊髓细胞因子TNF-α、IL-1β的表达
由表3可见,术后第11天K组、CL组和KC组的TNF-α、IL-1β表达较S组有明显的升高,差异均有统计学意义(均P<0.05);较之C组,K组、CL组和KC组的TNF-α、IL-1β的表达降低明显,差异均有统计学意义(均P<0.05);较之K组、CL组,KC组的TNF-α、IL-1β的表达降低,差异均有统计学意义(均P<0.05)。


组别TNF-αIL-1βS13.31±2.3415.24±3.15C62.66±10.44△75.05±11.34△K46.63±7.71△▲53.73±8.26△▲CL38.35±6.57△▲★42.41±6.89△▲★KC28.59±5.28△▲★☆33.31±5.34△▲★☆
与S组比较,△P<0.05;与C组比较,▲P<0.05;与K组比较,★P<0.05;与CL组比较,☆P<0.05
3 讨论
目前临床上神经病理性疼痛的患者数量呈现快速增长,疼痛不适给患者的身心造成了严重的损害。神经病理性疼痛的发病机制复杂,目前尚无有效的治疗方案,本实验采用了大鼠CCI模型来研究神经病理性痛,该模型具有制作简单,疼痛行为学变化稳定、明显,成功率高等特点,结扎能够同时引起神经纤维的直接和间接损伤,与人类的外周神经损伤很类似。实验中模型鼠在术后3 d出现了明显的痛行为学改变,表现为热痛阈与机械痛阈的下降,提示模型制备成功,整个实验过程中大鼠未发生患肢自噬及死亡等。
小胶质细胞在正常状态下呈分枝状,被伤害性刺激激活后形态发生明显变化,可出现阿米巴样形态,细胞突起变短,同时小胶质细胞标记物(如Iba-1等)表达增强及数量增多,激活的小胶质细胞能产生和释放细胞因子(如IL-1、IL-6、TNF-α等)和脑源性神经营养因子,这些促炎因子能活化痛觉传导神经元,诱发和加剧神经病理性疼痛[8]。相关研究[9]发现在多种神经损伤引起的病理性疼痛大鼠模型中,TNF-α的合成或表达被阻断,大鼠机械痛阈和热痛阈等行为学表现较对照组升高,并且脊髓背角小胶质细胞活性被抑制,提示TNF-α可能作用于小胶质细胞,抑制其激活,减轻神经病理性疼痛。而应用米诺环素特异性抑制小胶质细胞激活也能明显减轻触诱发痛、痛觉超敏及中枢敏化的形成[10],提示小胶质细胞在神经病理性疼痛中的作用越来越重要,临床上有望通过调控脊髓小胶质细胞活性及其活性物质的释放来治疗神经病理性痛。
氯胺酮作为临床曾经广泛使用的一种静脉麻醉药,具有明确的镇痛作用。体外研究表明[11],脂多糖诱导的小胶质细胞激活可以被其所抑制。也有研究表明作为NMDA受体的非特异性拮抗剂的氯胺酮,可以通过阻断脊髓背角小胶质细胞的NMDA受体,抑制Ca2+内流,阻断MAPK通路,从而抑制ATP-P2X4R对伤害性信息的传递,有效缓解疼痛[12]。提示在神经病理性痛中,氯胺酮可能作用于小胶质细胞而发挥镇痛作用。
右美托咪定目前作为一种镇静镇痛药在临床上广泛应用,作为α2肾上腺素能受体的激动剂,其能通过结合脊髓背角突触前膜的α2AR,产生突触前抑制作用[13],通过减少Ca2+的内流,进一步减少ATP的释放,下调P2X4R的转录和翻译,抑制谷氨酸等相关神经递质的释放,使伤害性信息传递减少,增强抗伤害性效应,缓解神经病理性痛。新的研究表明,右美托咪定可降低TNF-α等炎性细胞因子水平而发挥抗炎作用[14]。推测其可能的作用靶点就是脊髓背角的小胶质细胞。
本实验利用坐骨结扎的方法制作大鼠神经病理性疼痛模型,在神经病理性痛的发生早期,观察了腹腔注射右美托咪定和氯胺酮对大鼠机械性痛觉和热痛觉以及对脊髓背角小胶质细胞的活化和相关细胞因子表达的影响。研究发现:未受到疼痛刺激的假手术组大鼠机械痛阈和热痛阈未发生明显变化,脊髓小胶质细胞也未发生活化,而建立坐骨神经结扎模型后的各组大鼠可观察到机械性痛阈与热痛阈明显降低,炎症因子表达增多,脊髓小胶质细胞被激活,与坐骨神经结扎引起的神经病理性痛有关。与单独应用右美托咪定或氯胺酮组比较,联合用药组术后3、7、11 d的机械性痛阈与热痛阈明显升高,术后11 d炎症因子TNF-α和IL-1β表达减少,小胶质细胞活化被抑制,提示二者联合使用较单独使用效果更好,且实验中未出现单独使用氯胺酮所出现的易激惹、烦躁等不良反应。提示右美托咪定联合氯胺酮腹腔给药的镇痛效果优于单独使用,且二者具有协同镇痛作用。关于二者的协同镇痛机制可能为:①右美托咪定和氯胺酮可能共同作用于NMDA受体。氯胺酮既可以阻滞神经元上的NMDA受体,亦可以作用于脊髓背角的小胶质细胞上的NMDA受体,减少Ca2+内流,抑制胶质细胞激活而发挥作用[15]。而右美托咪定亦能通过突触前抑制,抑制胶质细胞活化,阻断炎症因子的释放,并能通过作用于NR2B亚基,抑制NMDA受体的磷酸化来影响NMDA受体功能,阻止中枢敏化的形成[16]。②氯胺酮可以通过激活表达于星形胶质细胞表面的阿片类受体而与阿片类受体激动剂发挥协同镇痛作用[17]。有研究表明氯胺酮镇痛作用的发挥需要有中枢性α2受体的参与,右美托咪定可以通过增强阿片类受体的功能,与氯胺酮共同作用于阿片受体而发挥协同镇痛作用[18]。
综上所述,右美托咪定联合氯胺酮使用可能通过抑制小胶质细胞的激活,减少炎症因子的释放,使得不同的作用机制经共同的通路发挥协同镇痛的作用,不仅可以减少各自的副作用,还具有更理想的镇痛效果,对于神经病理性疼痛的治疗提供了新的理论依据。
[1] Jamison R N,Edwards R R,Liu X ,et al.Relationship of negative affect and outcome of an opioid therapy trial among low back pain patients[J].Pain Pract,2013,13(3):173-181.
[2] Tsuda M,Inoue K,Salter M W.Neuropathic pain and spinal microglia: a big problem from molecules in small glia[J].Trends Neurosci,2005,28(2):101-107.
[3] Poyhia R,Vainio A.Topically administered ketamine reduces caps-aicin-evoked mechanical hyperalgesia[J].Clin J Pain,2006,22(1):32-36.
[4] Li S S,Zhang W S,Ji D.Involvement of spinal microglia and interleukin-18 in the anti-nociceptive effect of dexmedetomidine in rats subjected to CCI[J].Neurosci Lett,2014,560:21-25.
[5] Bennett G J,Xie Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[6] Chaplan S R,Bach F W,Pogrel J W,et a1.Quantitative assessment of tactile allodynia in the rat paw[J].Neurosci Methods,1994,53(1):55-63.
[7] Hargreaves K,Dubner R,Brown F,et a1.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-81.
[8] Clark A K,Malcangio M.Microglial signalling mechanisms: Cathepsin S and fractalkine[J].Exp Neurol,2012,234(2): 283-392.
[9] Wang R K,Zhang Q Q,Pan Y D,et al.Etanercept decreases HMGB1 expression in dorsal root ganglion neuron cells in a rat chronic constriction injury model[J].Exp Ther Med,2013,5(2):581-585.
[10] Deumens R,Steyaert A,Forget P,et al.Prevention of chronic postoperative pain: cellular,molecular,and clinical insights for mechanism-based treatment approaches[J].Prog Neurobiol,2013,104:1-37.
[11] Shibakawa Y S,Sasaki Y,Goshima Y,et al.Effects of ketamine and propofol on inflammatory responses of primary glial cell cultures stimulated with Lipopolysaccharide [J].Br J Anaesth,2005,95(6):803-810.
[12] Tsuda M,Lnoue K.Neuropathic pain and ATP receptors in spinal microglia[J].Brain Nerve,2007,59(9):953-959.
[13] Guo T Z,Jiang J Y,Buttermann A E,et a1.Dexmedetomidine injection into the locus ceruleus produces antinociception[J].Anesthesiology,1996,84(4):873-881.
[14] Ishikawa T,Miyagi M,Kamoda H,et al.Differences between tumor necrosis factor-α receptors types 1 and 2 in the modulation of spinal glial cell activation and mechanical allodynia in a rat sciatic nerve injury model[J].Spine,2013,38(10):11-16.
[15] Wu G J,Chen T L,Ueng Y F,et a1.Ketamine inhibits tumor necrosis factor-alpha and interleukin-6 gene expressions in lipopolysaccha-ridestimulated macrophages through suppression of toll-like receptor 4-mediated c-Jun N-terminal kinase phosphorylation and activator protein-I activation[J].Toxicol Appl Pharmacol,2008,228(1):105-113.
[16] Zheng Y,Cui S,Liu Y,et a1.Dexmedetomidine prevents remifen-tanil-induced postoperative hyperalgesia and decreases spinal tyrosine phosphorylation of N-methyl-d-aspartate receptor 2B subunit[J].Brain Res Bull,2012,87(4/5):427-431.
[17] Kosson D,K1inowiecka A,Kosson P,et al.Intrathecal antinocicep-tive interaction between the NMDA antagonist ketamine and the opioids,morphine and biphalin[J].Eur Pain,2008,12(5):611-616.
[18] Lin T F,Yeh Y C,Lin F S,et a1.Effect of combining dexmedetomidine and morphine for intravenous patient-controlled analgesia[J].Br J Anaesthesia,2009,102(1):117-122.
(2016-06-20 收稿)
Effects of Dexmedetomidine Combined with Ketamine on Spinal Cord Microglia Activation in Sciatic Nerve Chronic Constriction Injury Rats
Yu Mingliang,Peng Xiaohong△,Yang Wenchao
DepartmentofAnesthesiology,PuaiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
Objective To observe the effects of dexmedetomidine combined with ketamine on spinal cord microglia activation and cytokine expression in sciatic nerve chronic constriction injury rats.Methods Fifty male SD rats were randomly divided into 5 groups:sham group(Group S),chronic constriction injury group(Group C),ketamine group(Group K),dexmedetomidine group(Group CL),ketamine with dexmedetomidine group(Group KC).In the group S,the right sciatic nerve was exposed but not ligated.In group C,K,CL and KC,according to the methods of Bennett,four ligatures were placed around the right sciatic nerve to establish sciatic nerve chronic constriction injury model.The rats in group K received ketamine(10 mg/kg),group CL received dexmedetomidine(50 μg/kg),group KC received ketamine(10 mg/kg)and dexmedetomidine(50 μg/kg)intrathecal injection 1 to 6 day(s)after operation,The group S and C were injected with equal volume of saline.Thermal and mechanical thresholds were measured before operation and 3,7,11 days after operation.The expression of Iba-1 in spinal microglia was detected by immunohistochemistry.TNF-α and IL-1β expression was detected by ELISA 11 days after surgery.Results Compared with group S,mechanical and thermal thresholds decreased in group C,K,CL and KC after operation(P<0.05),the expression of Iba-1,TNF-α and IL-1β increased in microglia(P<0.05);compared with group C,mechanical and thermal thresholds increased in group K,CL and KC after operation(P<0.05),the expression of Iba-1,TNF-α and IL-1β decreased in microglia(P<0.05).Compard with group K and CL.mechanical and thermal thresholds increased in group KC (P<0.05),and the expression of Iba-1,TNF-α and IL-1β decreased in microglia(P<0.05).Conclusion Dexmedetomidine combined with ketamine can inhibit activation of microglia,reduce expression of TNF-α and IL-1β,and has a significant synergistic analgesic effect.
neuropathic pain; microglia; dexmedetomidine; ketamine
*湖北省卫生计生委科研基金资助项目(No.WJ2015MB154),武汉市卫生计生委科研基金资助项目(No.WX14C63)
R741.02
10.3870/j.issn.1672-0741.2016.06.010
于明良,男,1984年生,医学硕士,E-mail:yu329110186@126.com
△通讯作者,Corresponding author,E-mail:Pxhong01@163.com
