三维共培养模型下人脐静脉内皮细胞对鼻咽癌CNE2细胞侵袭、迁移及增殖能力的影响
2017-01-12霞高超唐刘翰楠吴健勇李宇虹庞波陈
梁 霞高 超唐 勇▲刘翰楠吴健勇李宇虹庞 波陈 玉
1.广西医科大学附属肿瘤医院放疗科,广西南宁 530021;2.广西医科大学附属肿瘤医院泌尿外科,广西南宁 530021
三维共培养模型下人脐静脉内皮细胞对鼻咽癌CNE2细胞侵袭、迁移及增殖能力的影响
梁 霞1高 超2唐 勇2▲刘翰楠2吴健勇2李宇虹2庞 波2陈 玉2
1.广西医科大学附属肿瘤医院放疗科,广西南宁 530021;2.广西医科大学附属肿瘤医院泌尿外科,广西南宁 530021
目的探讨三维共培养下人脐静脉内皮细胞(HUVEC)对CNE2细胞侵袭、迁移及增殖能力的影响。方法采用Transwell小室对HUVEC细胞和CNE2细胞进行共培养,CCK-8法比较两组实验中CNE2细胞增殖能力,细胞计数法比较细胞迁移能力,以及Matrigel胶法比较侵袭能力。结果HUVEC与CNE2共培养条件下,共培养组迁移能力显著高于非共培养组(P<0.01)。共培养组侵袭能力显著高于非共培养组(P<0.01)。在增殖实验中,共培养组和非共培养组的OD值第3天,第4天及第5天,共培养组的细胞增殖率显著高于非共培养组(P<0.05)。结论在三维共培养条件下,HUVEC对CNE2鼻咽癌细胞的侵袭、迁移及增殖能力有促进作用。
三维共培养模型;CNE2鼻咽癌细胞;人脐静脉内皮细胞;增殖;迁移;侵袭
鼻咽癌是我国南方地区常见的恶性肿瘤之一,其中广东、广西、湖南等地发病率最高,具有显著的地域和种族聚集特点[1-2]。手术根治难度较大,放疗是其主要治疗手段[3],但放疗后复发率仍然较高,中晚期患者的五年生存率仅为50%[4]。影响鼻咽癌预后的主要因素是肿瘤细胞侵袭和转移程度,但其具体机制仍然不是十分清楚。而肿瘤的侵袭、转移与细胞的异常运动有关[5],是癌细胞粘附、降解、运动及新生血管形成等多种生物学行为相互作用的结果,因此研究鼻咽癌细胞微环境对其复发及转移的分子机制研究显得十分重要。
血管内皮细胞已被证实是肿瘤微环境的重要组成部分[6],本实验主要利用三维共培养模型,模拟体内鼻咽癌微环境,将人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)和人鼻咽癌细胞(human nasopharyngeal carcinoma cell,CNE2)共培养,探索HUVEC对CNE2的侵袭、转移及增殖能力的影响。
1 材料与方法
1.1 主要试剂和材料
人鼻咽癌CNE2细胞系为低分化鳞状细胞癌细胞系,以及人脐静脉内皮细胞均购自中科院上海细胞库;Matrigel基质胶、RPMI-1640、胎牛血清(FBS)、胰酶EDTA、Transwell小室(3μm和8μm)、24孔培养培养板、96孔板(美国corning公司);PBS缓冲液(北京索莱宝公司);CCK-8试剂(日本同仁公司);吉姆萨染剂、4%多聚甲醛(北京碧云天公司);细胞培养箱、酶标仪(美国THERMO公司)。
1.2 细胞培养及传代
CNE2和HUVEC常规培养于含10%FBS的RPMI-1640中,于5% CO2、37.5℃饱和湿度的孵箱中培养,每2天换1次液(PBS冲洗后放入新培养液),2d后在倒置显微镜下观察,当细胞铺满整个瓶壁底部约75%时用0.25%胰蛋白酶(EDTA)消化,待细胞变圆吹打混匀并传代。
1.3 细胞侵袭实验
配胶:Matrigel:1640培养液按1:6的比例配置,每个小室内每孔铺体积为60μL的基质胶,37℃过夜成胶备用。共培养组在24孔板的下室放入含HUVEC细胞(2×104个)的完全培养液500μL,设置3个复孔。非共培养组放入等体积的不含HUVEC的完全培养液作为对照组处理。将此24孔板放在37.5℃、5% CO2的细胞温箱中过夜。24h后,在两组Transwell小室内分别加入10×104个CNE2鼻咽癌细胞(体积200μL),然后放入37.5℃、5% CO2的细胞温箱中培养48h。最后,小室背面的细胞用4%的多聚甲醛固定,然后用吉姆萨染色剂染色,用光学显微镜计算细胞数量。本实验重复3次,每次设置3个复孔。
1.4 细胞迁移实验
共培养组在24孔板的下室放入含HUVEC细胞(2×104个)的完全培养液500μL。设置3个复孔。非共培养组放入等体积的不含人脐静脉内皮细胞的完全培养液作为对照组处理。将这24孔板放在37.5℃、5% CO2的细胞温箱中过夜。24h后,在两组Transwell小室内分别加入1×104个的CNE2细胞(体积200μL),然后放入37.5℃、5% CO2的细胞温箱中培养48h。最后,小室背面的细胞用4%的多聚甲醛固定,吉姆萨染色剂染色,放在光学显微镜下计算细胞数目。本实验重复3次,每次设置3个复孔。
1.5 细胞增殖实验
采用CCK-8法检测CNE2增殖能力,共培养组下室内每孔放入含有0.5×104个HUVEC的培养液(体积900μL)。非共培养组下室放入900μL的10% FBS的培养液作为对照组。培养24h后,分别在两组小室内(孔径为3μm)每孔放入0.2×104个的CNE2细胞(体积为200μL)。将这两组放入37.5℃、5% CO2细胞温箱中过夜。分别检测培养第1~5天的OD值,测量两个组别OD值计数,并绘制生长曲线(图3)。本实验重复3次,每次设置3个复孔。
1.6 统计学方法
运用SPSS16.0软件进行数据分析,数据以(表示,两组独立样本比较用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 细胞侵袭能力比较
HUVEC与CNE2共培养48h后固定染色并计数侵袭细胞数,共培养组CNE2侵袭数为(37.3±22.0),显著高于非共与培养组(5.98±5.76),差异有统计学意义(P<0.01),见图1。
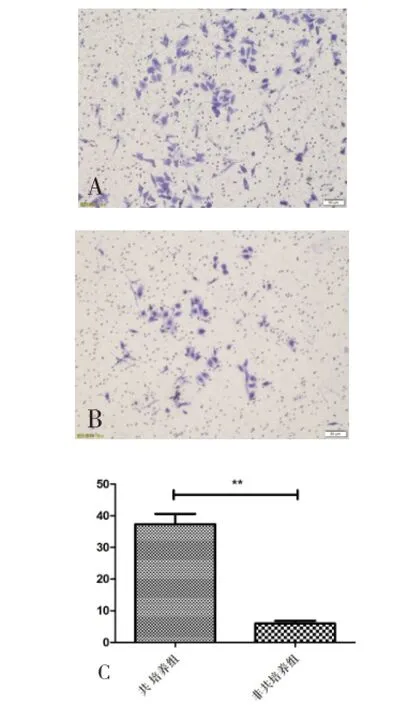
图1 共培养组和非共培养组CNE2侵袭能力比较
2.2 细胞迁移能力比较
HUVEC与CNE2培 养48h后,共 培 养 组CNE2细胞迁移数(74.00±29.40),非共培养组为(20.38±17.41),差异有统计学意义(P<0.01),见图2。

图2 共培养组和非共培养组CNE2迁移数目比较
2.3 增殖能力实验
采用CCK-8法检测CNE2细胞增殖能力,结果显示共培养组和非共培养组的OD值第3天、第4天及第5天分别为(1.321±0.036 & 1.174±0.015,P< 0.05)、(1.924±0.033 & 1.666±0.088,P<0.05)、(2.111±0.117 & 2.003±0.081,P<0.05),提示共培养组CNE2细胞增殖率高于非共培养组(见图3、表1)。
3 讨论
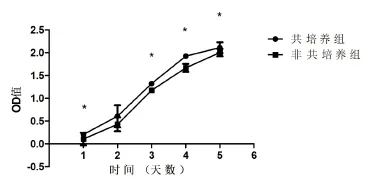
图3 共培养组和非共培养组CNE2生长曲线的比较,*P<0.05
表1 共培养组与非共培养组CNE2细胞OD值比较(
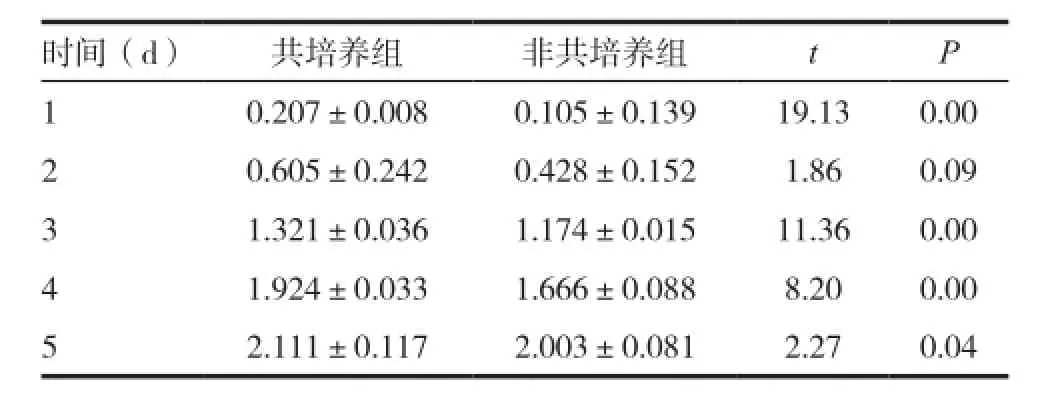
表1 共培养组与非共培养组CNE2细胞OD值比较(
时间(d) 共培养组 非共培养组 t P1 0.207±0.008 0.105±0.139 19.13 0.00 2 0.605±0.242 0.428±0.152 1.86 0.09 3 1.321±0.036 1.174±0.015 11.36 0.00 4 1.924±0.033 1.666±0.088 8.20 0.00 5 2.111±0.117 2.003±0.081 2.27 0.04
鼻咽癌是一种源自鼻黏膜上皮细胞的恶性肿瘤,其解剖位置隐匿,病理类型又多为低分化级别,且具有较高的侵袭转移能力,是治疗失败和致患者死亡的主要原因,严重困扰着临床医生和科研工作者。肿瘤细胞的恶性能力是由相邻内皮细胞和细胞外基质中的信号进行调节的,统称为肿瘤细胞微环境[7]。研究表明肿瘤微环境中的细胞,尤其是周围的内皮细胞、巨噬细胞及炎症相关细胞等分泌因子,通过系列的化学信号通路作用于癌细胞,促进或抑制肿瘤细胞增殖和转移[8]。Battiston等[9]研究表明肿瘤细胞与内皮细胞之间可通过细胞外基质的自分泌、旁分泌、双向分泌可溶性生物因子介导复杂生物信号通路,以及通过细胞与细胞间直接接触作用,互相影响彼此的发生发展。亦有文献报道,肿瘤细胞可通过与相邻的血管内皮细胞相接触,可引发新血管生成[10]。越来越多的研究证实肿瘤细胞与内皮细胞之间存在密不可分的关系,彼此之间有促进和依赖作用[11]。
二维细胞培养体系改变了细胞原有生长形态,引起细胞丧失一些原本特性,使体外实验研究受到了一定限制,而三维共培养模型能模拟体内肿瘤微环境,较好地模仿人体的细胞外基质,进而更好的研究细胞间的相互作用[12]。Wang等[13]研究亦指出三维共培养在探讨静脉内皮细胞和另一种细胞间相互作用的研究中具有重要价值,目前三维共培养倍受关注。
Transwell小室共培养是以聚碳酸酯膜分隔上、下室,因聚碳酸酯膜具有通透性,从而可以研究下层细胞或其分泌的特定因子对上室细胞的影响,进而构建一种不直接接触法研究一种细胞对另一种细胞影响的共培养模型。众所周知肿瘤的侵袭和转移是恶性肿瘤中危害最大生物学特性之一,可直接导致肿瘤患者的死亡。而肿瘤细胞发生转移,首要步骤是先穿过组织基膜,Transwell小室则可以较好地模拟体内环境,观察细胞侵袭、转移能力的改变[14]。
本研究利用Transwell小室构建HUVEC和CNE2的三维共培养模型,结果显示HUVEC对CNE2的侵袭和迁移活动有明显促进作用。研究表明内皮细胞可通过直接作用于癌细胞及其产生的细胞因子等影响肿瘤干细胞的生物学行为[15]。Cheng等[16]研究发现内皮细胞与胶质瘤干细胞共培养情况下,增强了胶质瘤干细胞的侵袭迁移能力。另有研究表明,肿瘤细胞增长到一定体积后,会分泌血管相关因子,而血管内皮细胞主动摄取由肿瘤细胞分泌的含有表皮生长因子受体的微泡,从而激活内皮细胞,启动VEGF/VEGFR2信号通路,促进肿瘤新生血管生成[17]。Nikolia等[18]在HUVEC和人神经胶质瘤U87MG细胞共培养实验中,检测到HUVEC的基因表达发生了改变,出现了Tie-2受体、VEGF-1受体、FGF-2受体等肿瘤血管内皮细胞特有基因。而肿瘤血管生成能力是恶性肿瘤侵袭周围组织,发生肿瘤远处转移的重要条件之一。进一步研究发现内皮细胞分泌的VEGF和bFGF通过刺激MMP-2和MMP9的分泌,可促进细胞外基质降解,加速肿瘤细胞的侵袭转移[19-20]。
在本研究中我们亦发现在三维共培养模型下,HUVEC促进了CNE2细胞的增殖,提示肿瘤微环境中HUVEC有利于维持CNE2细胞的活力。Bidarra等[21]研究显示共培养中骨髓间充质干细胞的细胞数量增长一直延续到第21天,且在后两周共培养者的增殖率明显高于单独培养组,提示HUVE具有刺激骨髓间充质干细胞增殖的潜力。
越来越多的研究证明,内皮细胞是癌症进展的推进器,可以增强癌细胞自发的侵入周围组织[22-23],而肿瘤微环境是一个复杂多变的体系,HUVEC细胞是CNE2细胞外重要的组成成分,HUVEC与CNE2共培养体系中是通过何种方式诱导了鼻咽癌细胞的侵袭、迁移和增殖,仍有待进一步深入研究。
[1] Wei WI,Sham JS.Nasopharyngeal carcinoma[J].Lancet,2005,365(9476):2041-2054.
[2] Feng BJ,Huang W,Shugart YY,et al.Genome-wide scan for familial nasopharyngeal carcinoma reveals evidence of linkage to chromosome 4[J].Nat Genet,2002,31(4):395-399.
[3] Razak AR,Siu LL,Liu FF,et al.Nasopharyngeal carcinoma:the next challenges[J].Eur J Cancer,2010,46(11):1967-1978.
[4] Zhou J,Xiao X,Yi H,et al.Upregulation of Gp96 correlates with the radiosensitivity and five-year survival rate of nasopharyngeal carcinoma[J].ORL J Otorhinolaryngol Relat Spec,2012,74(3):164-171.
[5] Friedl P,Gilmour D.Collective cell migration in morphogenesis,regeneration and cancer[J].Nat Rev Mol Cell Biol,2009,10(7):445-457.
[6] Shen Q,Goderie SK,Jin L,et al.Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells[J].Science,2004,304(5675):1338-1340.
[7] Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-674.
[8] Leonardi GC,Candido S,Cervello M,et al.The tumor microenvironment in hepatocellular carcinoma(review)[J]. Int J Oncol,2012,40(6):1733-1747.
[9] Battiston KG,Cheung JW,Jain D,et al.Biomaterials in co-culture systems:towards optimizing tissue integration and cell signaling within scaffolds[J].Biomaterials,2014,35(15):4465-4476.
[10] Feliz LR,Tsimberidou AM.Anti-vascular endothelial growth factor therapy in the era of personalized medicine[J].Cancer Chemother Pharmacol,2013,72(1):1-12.
[11] Franses JW,Baker AB,Chitalia VC,et al.Stromal endothelial cells directly influence cancer progression[J]. Sci Transl Med,2011,3(66):66ra65.
[12] Yamamoto S,Hotta MM,Okochi M,et al.Effect of vascular formed endothelial cell network on the invasive capacity of melanoma using the in vitro 3D co-culture patterning model[J].PLoS One,2014,9(7):e103502.
[13] Wang J,Ye Y,Tian H,et al.In vitro osteogenesis of human adipose-derived stem cells by coculture with human umbilical vein endothelial cells[J].Biochem Biophys Res Commun,2011,412(1):143-149.
[14] Oh J,Kwak JH,Kwon DY,et al.Transformation of Mouse Liver Cells by Methylcholanthrene Leads to Phenotypic Changes Associated with Epithelial-mesenchymal Transition[J].Toxicol Res,2014,30(4):261-266.
[15] Jinushi M,Baghdadi M,Chiba S,et al.Regulation of cancer stem cell activities by tumor-associated macrophages[J].Am J Cancer Res,2012,2(5):529-539.
[16] Cheng L,Huang Z,Zhou W,et al.Glioblastoma stem cells generate vascular pericytes to support vessel function and tumor growth[J].Cell,2013,153(1):139-152.
[17] Al-Nedawi K,Meehan B,Kerbel RS,et al.Endothelial expression of autocrine VEGF upon the uptake of tumorderived microvesicles containing oncogenic EGFR[J].Proc Natl Acad Sci USA,2009,106(10):3794-3799.
[18] Khodarev NN,Yu J,Labay E,et al.Tumour-endothelium interactions in co-culture:coordinated changes of gene expression profiles and phenotypic properties of endothelial cells[J].J Cell Sci,2003,116(Pt6):1013-1022.
[19] Velasco P,Lange-Asschenfeldt B.Dermatological aspects of angiogenesis[J].Br J Dermatol,2002,147(5):841-852.
[20] Slaton JW,Karashima T,Perrotte P,et al.Treatment with low-dose interferon-alpha restores the balance between matrix metalloproteinase-9 and E-cadherin expression in human transitional cell carcinoma of the bladder[J].Clin Cancer Res,2001,7(9):2840-2853.
[21] Bidarra SJ,Barrias CC,Barbosa MA,et al.Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells[J].Stem Cell Res,2011,7(3):186-197.
[22] Klausner RD.The fabric of cancer cell biology-Weaving together the strands[J].Cancer Cell,2002,1(1):3-10.
[23] Bai J,Tu TY,Kim C,et al.Identification of drugs as single agents or in combination to prevent carcinoma dissemination in a microfluidic 3D environment[J]. Oncotarget,2015,6(34):36603-36614.
Influence of human umbilical vein endothelial cells under the three-dimensional co culture model to invasion, migration and proliferation of nasopharyngeal carcinoma cell line CNE2
LIANG Xia1GAO Chao2TANG Yong2LIU Hannan2WU Jianyong2LI Yuhong2PANG Bo2CHEN Yu2
1.Department of Radiotherapy,Affiliated Tumor Hospital of Guangxi Medical University, Nanning 530021,China;
2.Department of Urology Surgery, Affiliated Tumor Hospital of Guangxi Medical University, Nanning 530021,China
ObjectiveTo explore the influence of human umbilical vein endothelial cells(HUVEC) under the three-dimensional co culture model to invasion, migration and proliferation of nasopharyngeal carcinoma cell line CNE2.MethodsTranswell was used to give co culture of HUVEC cells and CNE2 cells.CCK-8 was used to compare the CNE2 cell proliferation.Cell counting method was used to compare the cell migration ability.Matrigel method was used to compare the invasive ability.ResultsUnder the co culture condition of CNE2 and HUVEC,the migration ability of co culture group was significantly higher than that of non co culture group(P< 0.01).The invasive ability of the co culture group was significantly higher than that in the non co culture group(P< 0.01).In the proliferation experiment,On the third day,fourth day and fifth day,the cell proliferation rate was significantly higher than that of non co culture co culture group(P<0.05).ConclusionUnder three dimensional co culture conditions,HUVEC can promote the invasion,migration and proliferation of CNE2 nasopharyngeal carcinoma cells.
Three-dimensional co culture model;CNE2 nasopharyngeal carcinoma cell;Human umbilical vein endothelial cells;Proliferation; Migration;Invasion
R737.31
A
2095-0616(2016)19-36-05
2016-07-27)
国家自然科学基金资助项目(81560428);广西自然科学基金资助项目(2011GXNSFC018020,2012GXNSFAA053163);广西科学研究与技术开发计划项目(桂科攻1355005-3-11);广西医疗卫生适宜技术研究与开发课题(S201301-06);广西壮族自治区卫生厅科研课题(Z2011226)。
▲通讯作者
