苗期抗旱花生品种的筛选
2017-01-11屈春媛金毅金喜军张玉先任春元张明聪王彦宏
屈春媛,金毅,金喜军,张玉先,任春元,张明聪,王彦宏
(黑龙江八一农垦大学农学院,大庆 163319)
苗期抗旱花生品种的筛选
屈春媛,金毅,金喜军,张玉先,任春元,张明聪,王彦宏
(黑龙江八一农垦大学农学院,大庆 163319)
为了研究干旱胁迫对不同花生品种保护酶活性的影响,以10个不同花生品种为供试材料,采用沙培培养的方法,以正常供水材料为对照,设置聚乙二醇模拟干旱胁迫处理,对供试品种抗旱性进行鉴定。结果表明,随着干旱胁迫的时间延长,叶片及根部SOD、POD和CAT活性因品种不同而表现出不同程度差异。利用隶属函数分析得出10个品种抗旱性强弱,奇山208和四粒红为抗旱性强品种;花育36号和丰花5号中度抗旱品种;海花1号、白沙1 016和荣丰8号对干旱性弱;丰花3号、鲁花11和山花10号对干旱敏感。
花生;苗期干旱;保护酶活性
我国花生主产区主要分布在干旱和半干旱丘陵地区[1],季节性干旱是限制花生产量和品质最主要的非生物胁迫之一[2-3]。在我国约70%的花生种植面积受到干旱胁迫的危害,年平均减产达30%以上[4-5],同时花生品质下降[6]。实际生产中,花生苗期发生干旱的频率最高、发生面积最大,筛选苗期抗旱花生品种是花生抗旱栽培和育种首要前提,对于提升干旱和半干旱地区花生生产潜力具有十分重要的战略意义[7-8]。花生的抗旱、避旱及耐旱3种机制主要通过植株形态、气孔开闭、酶保护系统的合理调控等方式调控干旱胁迫[9],而对干旱胁迫的反应重点在于不同胁迫程度、实验室模拟干旱条件下幼苗期花生保护酶活性的研究。随着干旱胁迫的加深,花生叶片中抗氧化酶(POD、SOD、CAT)活性降低,而一定程度干旱胁迫总体上均使这3种抗氧化酶活性提高[10]。叶片及根部的超氧化物歧化酶(SOD)与品种抗旱系数达到显著水平,可以鉴定花生品种的抗旱能力[11]。强抗旱性花生品种保护酶活性显著高于弱抗旱性品种[12]。关于花生抗旱生理方面的研究已经明确了干旱对花生叶绿素合成、光合作用、保护酶活性(SOD、POD、CAT)及细胞膜脂过氧化产物代谢的影响及调节效应[13-14],其中保护酶活性可作为花生抗旱筛选指标,但缺乏统一的量化标准。研究以10个品种为供试材料,对不同花生品种保护酶活性干旱胁迫的响应,并利用隶属函数综合评价法判断品种的抗旱性,筛选出苗期抗旱花生品种,为花生抗旱栽培和育种提供种质资源。
1 材料与方法
1.1 试验材料
10个供试花生品种见表1。

表1 供试花生材料Table 1 The tested peanut materials
1.2 试验设计
试验于2014年在黑龙江八一农垦大学农学院实验基地进行,采用沙培培养方式,塑料桶直径30 cm,高20 cm,桶底钻3个1 cm直径小孔,并铺设一层纱网防止根系长出桶底。每个品种选取饱满一致的花生10粒,间苗后每盆保苗5株,自出苗开始每日淋浇1次营养液。出苗后第10天开始进行干旱处理即为干旱胁迫第0天,处理期间浇300 mL内含10%PEG的Hoagland营养液,以淋浇300 mL不含PEG-6000的Hoagland营养液培养为对照(CK),每个处理重复4次。分别在干旱胁迫后第3天、第6天、第9天、第12天、第15天取样,选择晴天上午9:00进行,共取五次。叶片用锡箔纸包好马上放入液氮中冷冻,再转入-80℃冰箱中保存待用。
1.3 测定项目与方法
1.3.1 保护酶活性测定
超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性参照李忠光[15]方法。1.3.2计算公式:
(1)测定指标的抗旱系数=处理值/对照值× 100%[16]。
(2)隶属函数值u(Xj)=(Xj-Xmin)/(Xmax-Xmin),j=1,2,…,n,Xj表示第j个综合指标;Xmin表示第j个综合指标中的最小值;Xmax表示第j个综合指标中的最大值。
1.4 数据处理
采用Excel 2010制作图表,SPSS 19.0进行数据处理。
2 结果与分析
2.1 干旱胁迫对不同花生品种超氧化物歧化酶(SOD)活性的影响
从表2和3可看出,随着干旱胁迫时间延长,花生叶片及根部的SOD活性升降幅度因品种而异,并且品种间SOD活性表现出很大差异。在干旱第3~6天,不同品种间叶片SOD活性存在显著差异(P<0.05),奇山208、四粒红、白沙1016及荣丰8号的SOD活性表现较高,最高值为432.54 μ·g-1·FW(第3天的四粒红),品种间相差158.73 μ·g-1·FW;其中干旱第6天,每个品种的SOD活性均高于对照。在干旱第9天,丰花3号和荣丰8号的SOD活性较高,分别为265.87 μ·g-1·FW和261.90 μ·g-1·FW,均高于对照。不同花生品种受到严重干旱胁迫时,SOD活性与对照(正常浇水条件下的相应品种)相比均有所下降,但不同品种的下降程度不同。在干旱第12~15天,鲁花11、奇山208、四粒红及海花1号的SOD活性较高,最高值为309.52 μ·g-1·FW,鲁花11和奇山208 的SOD活性高于对照,四粒红和海花1号则低于对照。根部对整个干旱胁迫时期的响应差异均不显著。
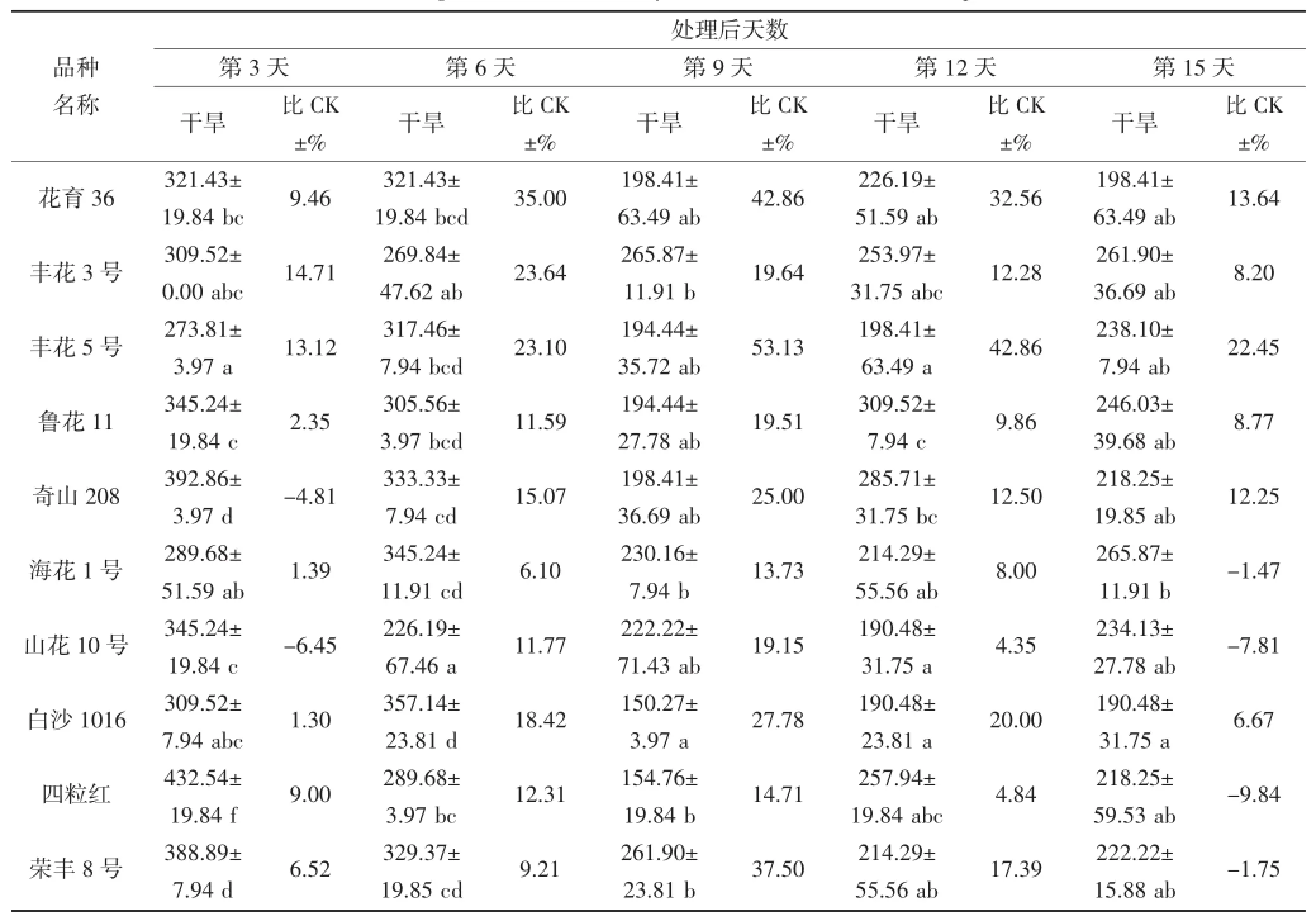
表2 干旱胁迫对不同花生品种叶片SOD酶活性的影响(单位:μ·g-1·FW)Table 2 The effect of drought stress on the activity of SOD in the leaf of different peanut cultivars
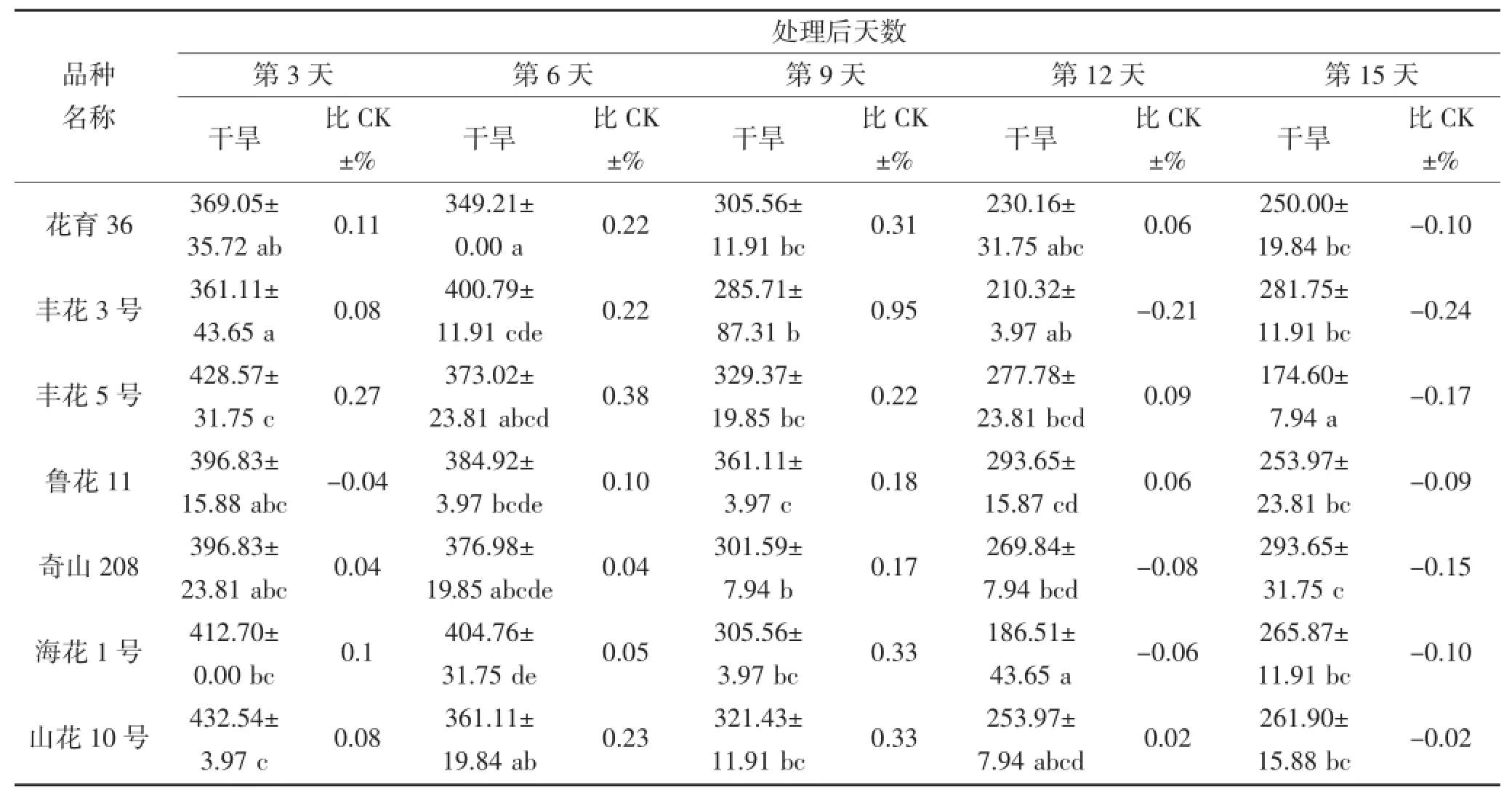
表3 干旱胁迫对不同花生品种根部SOD酶活性的影响(单位:μ·g-1·FW)Table 3 The effect of drought stress on the activity of SOD in the root of different peanut cultivars
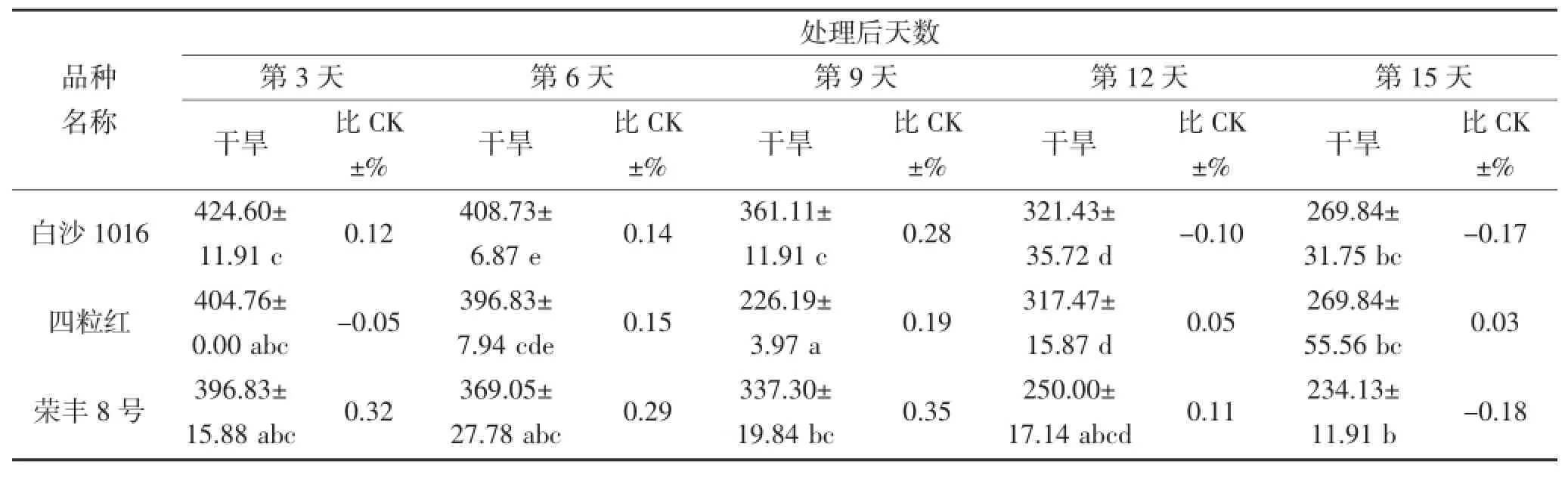
续表3 干旱胁迫对不同花生品种根部SOD酶活性的影响(单位:μ·g-1·FW)Continued table 3 The effect of drought stress on the activity of SOD in the root of different peanut cultivars
2.2 干旱胁迫对不同花生品种过氧化物酶(POD)活性的影响
由表4和表5可知,随干旱胁迫时间的延长,叶片及根部POD活性产生不同规律变化,且品种间POD活性表现出很大差异。在干旱第3~6天,丰花3号、白沙1016、海花1号及荣丰8号叶片POD活性表现较高,最高值为2 293.75△470 g·FW·min-1(第6天的白沙1016);其中干旱第6天,荣丰8号的POD活性低于对照,其他品种则高于对照;根部POD活性表现较高的品种为丰花3号和四粒红,均高于对照,其中四粒红根部POD活性最高。在干旱第9天,花育36号的叶片及根部POD活性最高,分别为2 265.63△470 g·FW·min-1和2 134.38△470 g· FW·min-1,而根部的POD活性高于对照,叶片则低于对照。不同花生品种受到严重干旱胁迫时,其POD活性与对照(正常浇水条件下的相应品种)相比均有所下降,但不同品种的下降程度不同。在干旱第15天,叶片和根部POD活性下降较多的品种分别为四粒红和奇山208,其活性均低于对照。
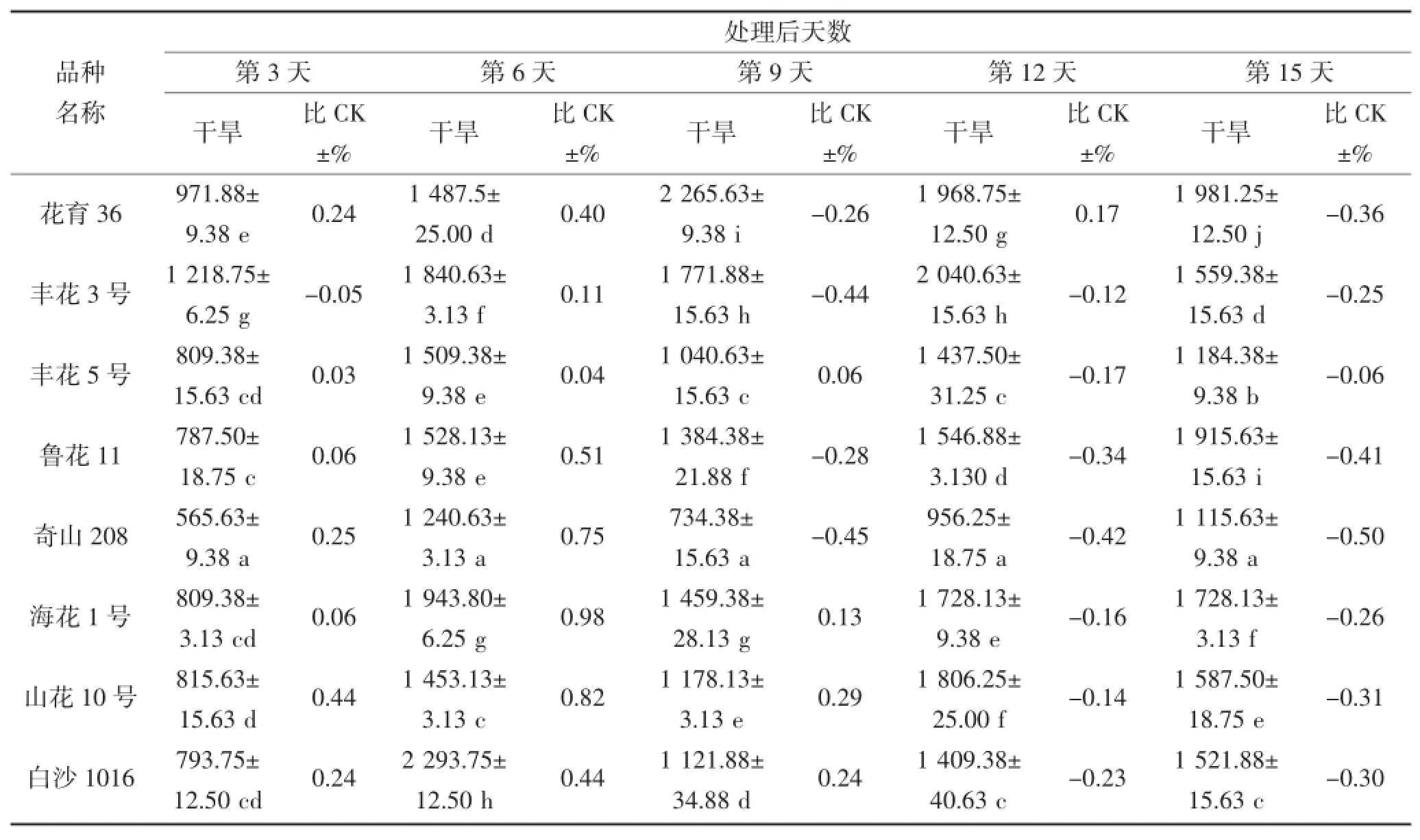
表4 干旱胁迫对不同花生品种叶片POD酶活性的影响(单位:△470 g·FW·min-1)Table 4 The effect of drought stress on the activity of POD in the leaf of different peanut cultivars
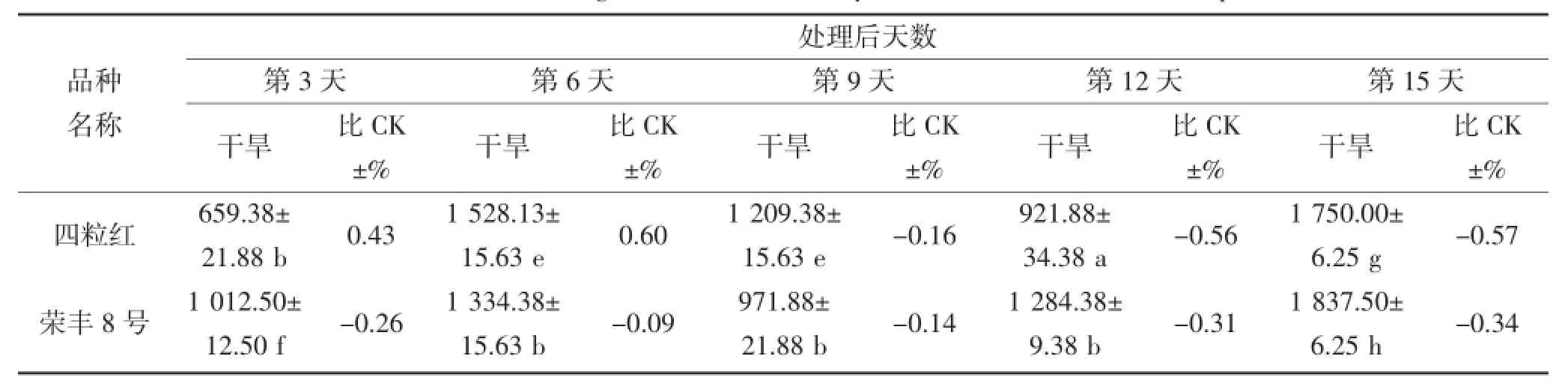
续表4 干旱胁迫对不同花生品种叶片POD酶活性的影响(单位:△470 g·FW·min-1)Continued table 4 The effect of drought stress on the activity of POD in the leaf of different peanut cultivars
2.3 干旱胁迫对不同花生品种过氧化氢酶(CAT)活性的影响
从表6和7中可以看出,在干旱胁迫期间,不同花生品种叶片和根部CAT活性相差较大。在干旱第3天,叶片CAT活性较高的品种为丰花5号和奇山208,分别为355.00 μ·g-1·FW和301.25 μ·g-1·FW,而丰花5号的CAT活性高于对照,奇山208则低于对照;根部CAT活性较高品种则为丰花3号和四粒红,分别为118.75 μ·g-1·FW和120.00 μ·g-1·FW,且均高于对照。在干旱第9天,不同品种的叶片CAT活性具有显著差异,奇山208叶片CAT活性最高为318.75 μ·g-1·FW,高于对照;根部CAT活性没有显著差异,丰花3号根部活性则为112.50 μ·g-1·FW,高于对照。不同花生品种受到严重干旱胁迫时,CAT活性与对照(正常浇水条件下的相应品种)相比均有所下降,但不同品种的下降程度不同。在干旱第15天,叶片和根部POD活性下降较多的品种分别为四粒红和奇山208,其活性均低于对照。
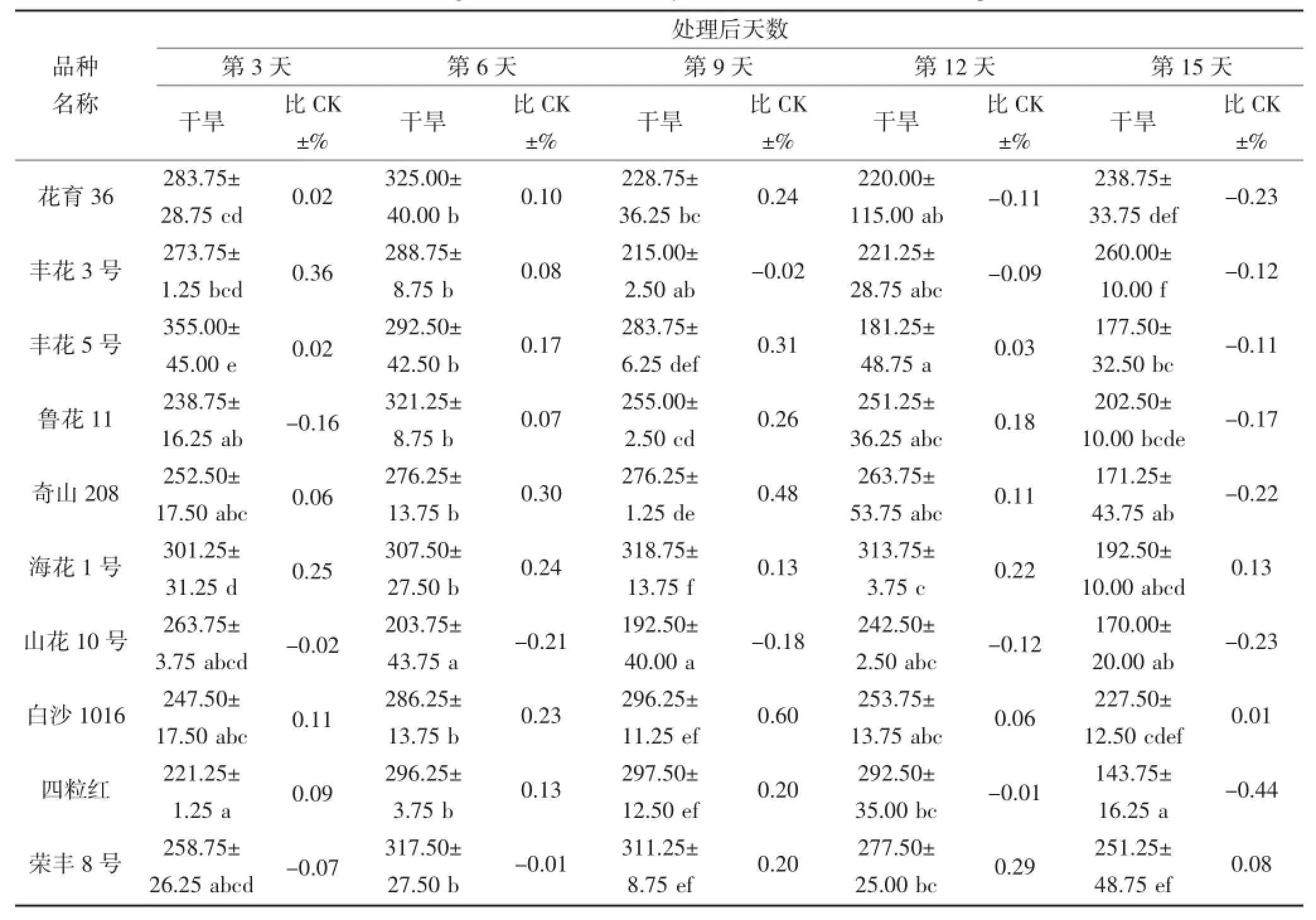
表6 干旱胁迫对不同花生品种叶片CAT酶活性的影响(单位:μ·g-1·FW)Table 6 The effect of drought stress on the activity of CAT in the leaf of different peanut cultivars
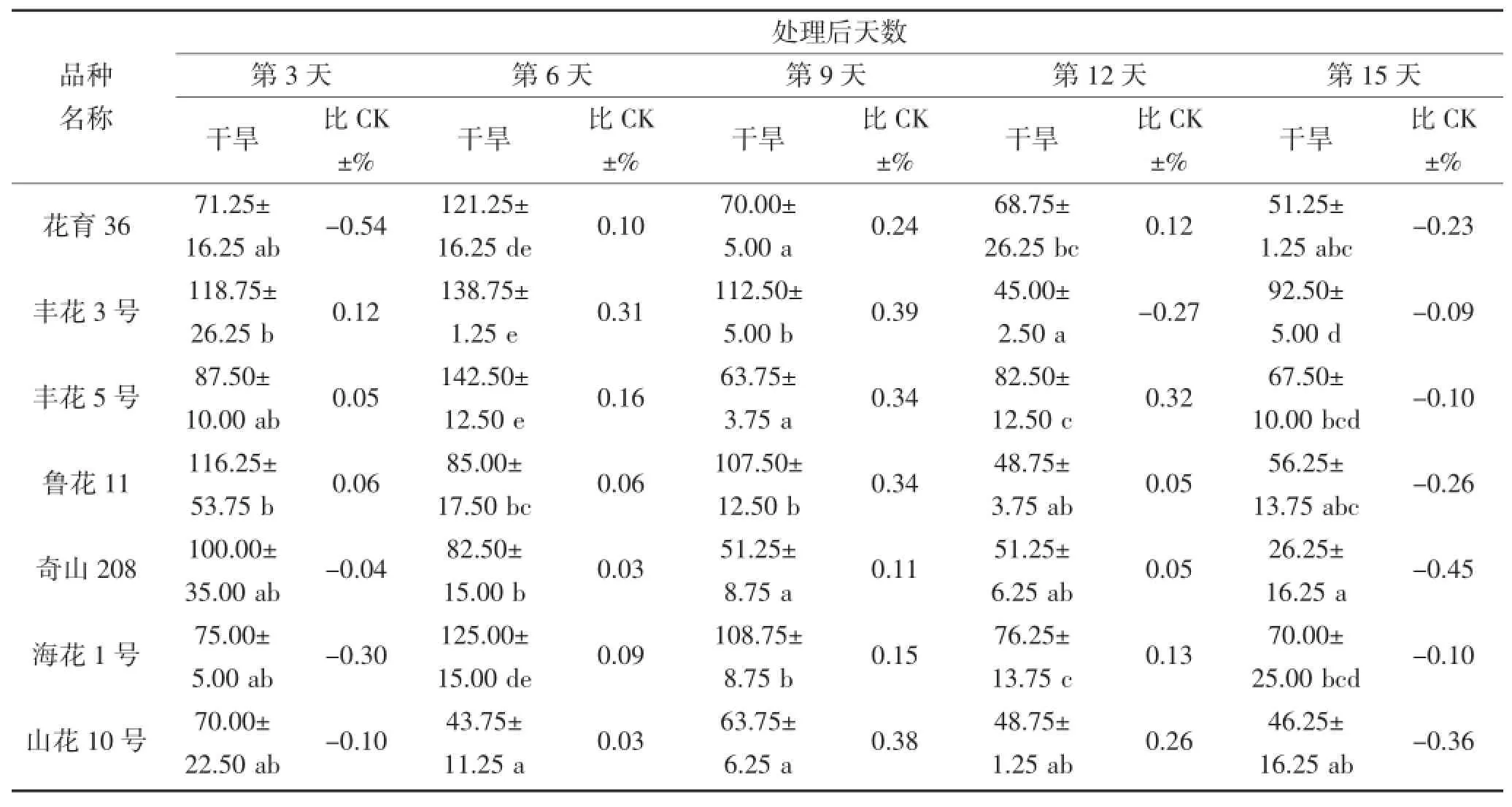
表7 干旱胁迫对不同花生品种根部CAT酶活性的影响(单位:μ·g-1·FW)Table 7 The effect of drought stress on the activity of CAT in the root of different peanut cultivars
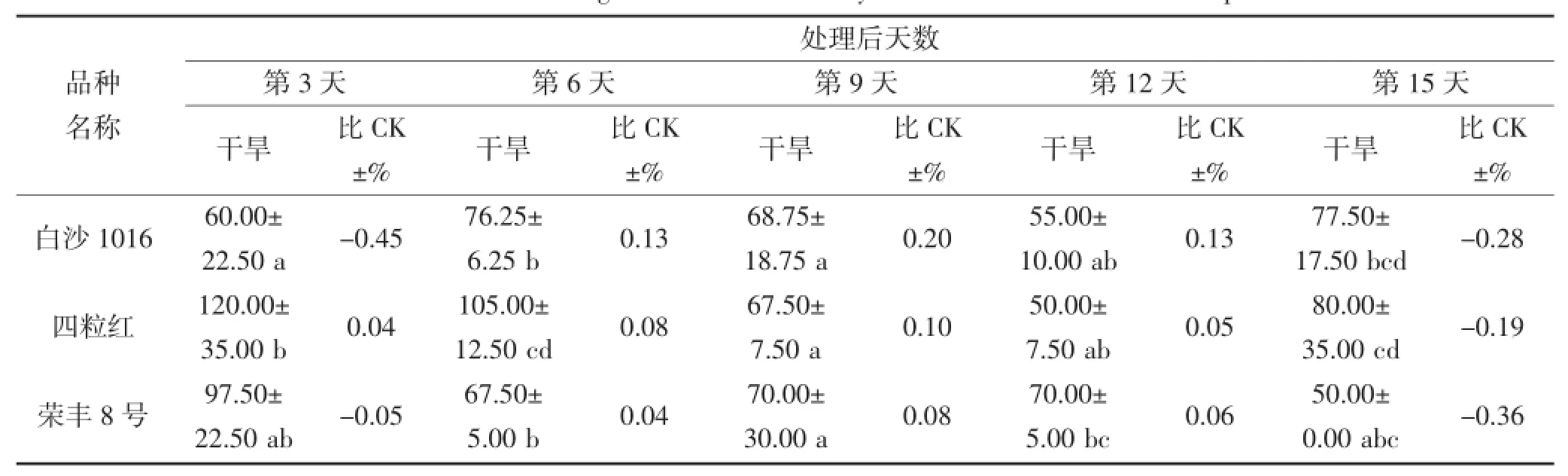
续表7 干旱胁迫对不同花生品种根部CAT酶活性的影响(单位:μ·g-1·FW)Continued table 7 The effect of drought stress on the activity of CAT in the root of different peanut cultivars
2.4 花生苗期各指标的抗旱系数
各指标的相对值能消除品种间所固有的差异,更能准确反映植物抗旱能力的大小[17]。不同品种花生苗期各指标的抗旱系数不同,同一品种不同指标所表现出的该品种的抗旱程度也不同。如表10所示,各品种各指标的抗旱系数都小于1,并且叶片和根部的SOD、POD及CAT活性与对照相比均有所下降,下降幅度也不同,因此用单项指标来评价花生苗期的抗旱性结果各不相同(表8)。
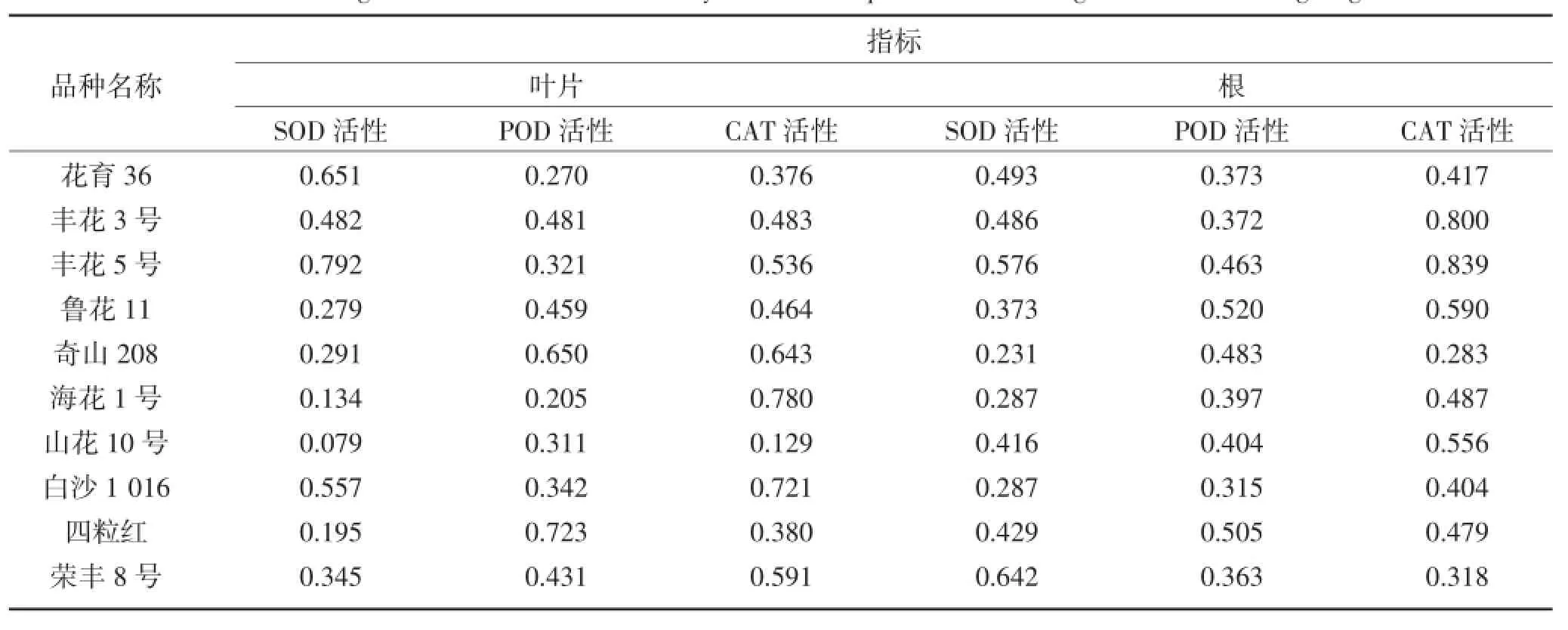
表8 干旱胁迫下花生苗期各指标的抗旱系数Table 8 Drought resistant coefficient of every index of the peanut under drought stress at seedling stage
2.5 综合评价及分类
利用聚类分析中的最大距离法对隶属函数值进行分析,如图1所示。10份花生品种按抗旱性由强到弱可分为四类,分别为抗旱性强、中度抗旱、抗旱性弱、敏感,其中奇山208和四粒红为抗旱性强品种;花育36号和丰花5号中度抗旱品种;海花1号、白沙1016和荣丰8号对干旱性弱;丰花3号、鲁花11和山花10号对干旱敏感。
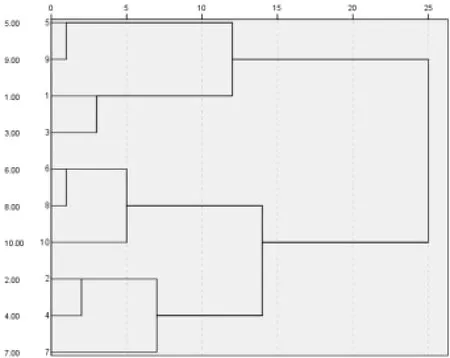
图1 10份品种聚类分析树状图Fig.1 Ten varieties cluster analysis tree
3 讨论
植物处于干旱胁迫条件下,会产生如SOD、POD、CAT等内源酶保护系统以免受活性氧伤害,而SOD酶在该系统中处于核心地位[18]。首先,SOD酶催化超氧阴离子歧化成H2O2和O2,H2O2在POD和CAT酶的催化下进一步分解成H2O和O2[19],POD酶不但可以清除H2O2,而且使脂质的过氧化物转变成正常的脂肪酸。植物中SOD、POD及CAT活性变化与作物的抗旱性强弱相关,研究结果表明,在干旱胁迫初期,花生叶片及根部SOD活性下降,POD和CAT活性上升;在干旱胁迫后期,与干旱初期情况相反。王瑞兰等[20]研究表明,适度干旱胁迫可提高SOD、POD、CAT酶活性,减轻细胞膜脂过氧化对植物细胞、细胞膜结构及胞内物质的毒害作用。陈由强[21]研究也表明高渗透胁迫期SOD、POD和CAT3种酶活性都呈下降趋势。这些结果说明干旱胁迫时间的延长对花生叶片细胞造成伤害,导致叶内及根部活性氧等过氧化物质的积累,从而诱导SOD活性提高,可以清除过氧化物的积累,以保护细胞、减轻逆境带来的伤害。
大多数学者在研究作物抗旱性指标时,分别对抗旱性与各指标的关系进行分析,但这些研究结果无法比较指标与抗旱性关系的大小,用单项指标来评价其抗旱性结果具有片面性和不一致性。因此,试验利用聚类分析将10个供试品种分为不同抗旱性程度的四类,分别为抗旱性强、中度抗旱、抗旱性弱、敏感。其中,奇山208和四粒红为抗旱性强品种;花育36号和丰花5号中度抗旱品种;海花1号、白沙1016和荣丰8号对干旱性弱;丰花3号、鲁花11和山花10号对干旱敏感。
4 结论
根据聚类分析法筛选出奇山208和四粒红2个强抗性花生品种,其叶片及根部SOD、POD和CAT活性与其他供试品种有显著差异;根据抗旱系数分析表明:叶片POD、CAT和根部POD的得分系数均较高。综合分析得出,奇山208和四粒红可作为花生抗旱栽培和育种的优质种质资源。
[1]张俊,刘娟,臧秀旺,等.不同生育时期干旱胁迫对花生产量及代谢调节的影响[J].核农学报,2015,29(6):1190-1197.
[2]张智猛,书波,戴良香,等.不同花生品种对干旱胁迫的响应[J].中国生态农业学报,2011,19(3):631-638.
[3]姜慧芳,任小平.干旱胁迫对花生叶片SOD活性和蛋白质的影响[J].作物学报,2004,30(2):169-174.
[4]姜慧芳.花生的抗旱育种[M].北京:中国农业出版社,1998.
[5]高国庆,周汉群,唐荣华.花生品种抗旱性鉴定[J].花生科技,1995(3):7-9.
[6]姚君平,罗瑶年,杨新道.干旱对花生早熟种籽仁发育及其品质影响研究初报[J].中国油料作物学报,1982(3):50-52.
[7]罗瑶年,姚君平,杨新道,等.花生苗期、花针期土壤临界水分的研究[J].花生科技,1981(4):17-21.
[8]姚君平,罗瑶年,杨新道.花生结荚、饱果期临界水分研究初报[J].花生科技,1981(3):21-26.
[9]张智猛,戴良香,丁红,等.中国北方主栽花生品种抗旱性鉴定与评价[J].作物学报,2012,38(3):495-504.
[10]周西,李林,单世华,等.旱涝急转对不同花生品种生理生化指标的影响[J].中国油料作物学报,2012,34(1):56-61.
[11]厉广辉,万勇善,刘风珍,等.不同抗旱性花生品种根系形态及生理特性[J].作物学报,2014,40(3):531-541.
[12]厉广辉.花生抗旱性状鉴定及不同品种抗旱的生理机制研究[D].泰安:山东农业大学,2014.
[13]倪艳波,闫苗苗,魏光成,等.水分胁迫下花生部分生理指标的变化[J].安徽农业科学,2007,35(34):11004-11005.
[14]严美玲,李向东,王丽丽,等.花生苗期不同程度干旱胁迫对叶片某些酶活性的影响[J].中国油料作物学报,2006,28(4):440-443.
[15]李忠光,李江鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报,2002,22 (6):44-48.
[16]王军,周美学,许如根,等.大麦耐湿性鉴定指标和评价方法研究[J].中国农业科学,2007,40(10):2145-2152.
[17]戴海芳,武辉,阿曼古丽·买买提阿力,等.不同基因型棉花苗期耐盐性分析及其鉴定指标筛选[J].中国农业科学,2014,47(7):1290-1300.
[18]喻敏,陈跃进,萧洪东,等.硼钼对低温下草坪草海滨雀稗活性氧代谢的影响[J].作物学报,2005,31(6):755-759.
[19]金喜军,屈春媛,栗文霞,等.氮素水平对干旱胁迫下红小豆幼苗保护酶活性的影响[J].黑龙江八一农垦大学学报,2015,27(5):30-35.
[20]王瑞兰,汪琼,易俗,等.铀尾沙胁迫对水稻和小麦幼苗叶绿素含量及抗氧化酶的影响[J].作物学报,2005,31 (8):1064-1068.
[21]陈由强.渗透胁迫对花生幼叶活性氧伤害和膜脂过氧化作用的影响[J].中国油料作物学报,2000,22(1):53-56.
Screening of Drought Resistant Peanut Cultivar at Seedling Stage
Qu Chunyuan,Jin Yi,Jin Xijun,Zhang Yuxian,Ren Chunyuan,Zhang Mingcong,Wang Yanhong
(College of Agronomy,Heilongjiang Bayi Agricultural University,Daqing 163319)
In order to study drought stress on protective enzyme activities of different peanut cultivars,the drought stress was studied in ten peanut cultivars at seedling stage,supplying the normal water for reference material,under a simulated drought stress condition by using polyethylene glycol(PEG)in vitro to investigate and analyze the drought resistance of varieties.SOD activity,POD activity and CAT activity in leaves and roots were tested at seedling stage,and the relationship between those protective enzyme activities and drought stress was studied.Drought resistances of varieties were scored with subordinate function value under drought stress.The results showed that the leaves and roots of the SOD activity,POD activity and CAT activity had different degrees of difference as a result of different cultivars with the prolonged drought stress.Drought resistance of 10 peanut varieties were obtained by subordinate function:high-resistance,including Qishan 208 and Silihong;mid-resistance,including Huayu 36 and Fenghua 5;weak-resistance,including Haihua 1,Baisha 1 016 and Rongfeng 8;Sensitivity,including Fenghua 3,Luhua 11 and Shanhua 10.
peanut;drought;protective enzyme activity
S565.2
A
1002-2090(2016)05-0001-08
10.3969/j.issn.1002-2090.2016.05.001
2015-11-15
屈春媛(1992-),女,黑龙江八一农垦大学农学院2014级硕士研究生。
张玉先,男,教授,博士研究生导师,E-mail:zyx_lxy@126.com;金喜军,男,助理研究员,E-mail:shaoxiang1979@163.com。
