氢气对重度脓毒症小鼠肠道损伤的保护作用*
2017-01-11谢克亮于泳浩天津医科大学总医院麻醉科天津300052
史 媛,谢克亮,于泳浩,王 涛(天津医科大学总医院麻醉科,天津300052)
氢气对重度脓毒症小鼠肠道损伤的保护作用*
史 媛,谢克亮,于泳浩,王 涛
(天津医科大学总医院麻醉科,天津300052)
目的观察氢气吸入对重度脓毒症小鼠肠黏膜屏障功能、肠道组织氧化还原状态的影响,并探讨其机制。方法选取美国癌症研究所雄性小鼠56只,体质量20~25 g,均为5周龄,采用随机数字表法将其分为四组:假手术组(A组)、假手术+氢气组(B组)、脓毒症组(C组)和脓毒症+氢气组(D组),每组14只。采用盲肠结扎穿孔(CLP)法制备小鼠脓毒症模型。B组和D组于CLP后1、6 h吸入2%氢气1 h。CLP后24 h进行行为学评分;采集静脉血检测血中生化指标[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)];随后处死小鼠取中段空肠,对肠道组织进行原位末端脱氧核苷酸转移酶标记法(TUNEL)染色,观察肠道组织细胞凋亡情况并评分;检测血液及肠道组织匀浆中丙二醛(MDA)水平及过氧化氢酶(CAT)、超氧化物歧化酶(SOD)的活力。结果与A组比较,C组和D组行为学评分、肠道组织凋亡指数、血生化指标(ALT、AST、BUN、Cr)水平及血清和肠道组织MDA水平升高,SOD和CAT活力降低,差异均有统计学意义(P<0.05),而B组上述指标与A组比较,差异均无统计学意义(P>0.05);与C组比较,D组行为学评分、肠道组织凋亡指数、血生化指标水平及血清和肠道组织MDA水平降低,SOD和CAT活力升高,差异均有统计学意义(P<0.05)。结论氢气吸入对重度脓毒症小鼠肠损伤和肠黏膜屏障功能破坏有明显保护作用,可能与其抗凋亡作用及对内源性氧化还原平衡状态的维持有关。
脓毒症; 肠黏膜; 氢; 氧化性应激; 肠; 细胞凋亡
脓毒症是临床上常见的一种复杂的综合征,病理生理特征为炎症系统过度激活所导致的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、氧化应激损伤、高凝状态、组织低灌注导致的全身组织缺氧、代偿性抗炎反应综合征及最终阶段的多器官功能障碍综合征(multiple organ dysfunction,MODS)[1]。越来越多的研究表明,活性氧簇(reactive oxygen species,ROS)的过量产生及抗氧化防御系统功能的降低在脓毒症的发病过程中起着重要作用[1]。因此,近来研究者们将脓毒症治疗的重点从控制失控的炎性反应转移到对ROS的清除和机体氧化还原平衡的维持方面。
肠道组织在肠腔内容物与机体之间形成2层屏障:物理/解剖屏障和免疫屏障。物理屏障是由一层互相联结在一起的上皮细胞构成,上皮细胞与固有层共同构成肠道黏膜层[2-3]。肠道黏膜一方面负责肠腔内营养物质的吸收,同时把肠腔内多种有毒的物质与身体隔离开。肠道组织内这一微妙的平衡机制的破坏是多种疾病发生的基础[4]。大量动物实验研究已经证实,肠道屏障功能破坏能造成肠腔内抗原、微生物和有害代谢产物向血循环中移位,在多种炎症性疾病的发病过程中起到重要作用,如手术后或创伤后SIRS、脓毒症和MODS[5-9]。前期的研究已经证实,脓毒症中即使通过控制血流的方法改善组织氧合,肠道组织仍是极易受累的器官[5-6]。肠道功能的改变在脓毒症的发生发展中发挥着重要作用,受损的肠道组织通过促进病原微生物的侵袭及细菌毒性代谢产物的移位,在SIRS的发生中起着重要的推动作用[7-8],从而产生了一种新的理论——肠道是脓毒症发病的动力器官[10]。因此,脓毒症患者肠道功能的改变受到特别重视,而肠黏膜屏障功能失调是脓毒症患者最常见的肠道并发症[11]。肠黏膜屏障功能失调可以促进肠道菌群的异常增殖和细菌异位,导致二重感染和MODS的发生[12]。肠黏膜屏障功能失调的机制可能包括脓毒症全身炎症细胞的异常激活与促炎性细胞因子的大量释放,氧自由基的大量产生造成氧化应激状态[11],这也是造成脓毒症患者MODS、脓毒性休克甚至死亡的重要原因。因此,针对肠黏膜屏障功能失调的有效治疗措施有可能为临床脓毒症患者的治疗带来新的希望。
本研究拟利用盲肠结扎穿孔(CLP)法诱导的小鼠重度脓毒症模型,通过全身各主要脏器生化指标[丙二醛(MDA)水平及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活力]的测定证实脓毒症全身损伤的存在,在此基础上给予2%氢气吸入治疗,以明确氢气的抗氧化特性及对机体内源性抗氧化系统功能的影响在模型中发挥的治疗作用。并重点观察给予氢气治疗后重度脓毒症小鼠模型中肠道组织的病理变化和细胞凋亡情况,并进一步探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 选取美国癌症研究所雄性小鼠56只,体质量20~25 g,均为5周龄(购自中国军事医学科学院实验动物中心)。置于清洁环境中,分笼饲养,自由进食,饮自来水,标准饲料喂养,室温18~22℃,相对湿度60%~80%,自然昼夜光线照明,常规饲养观察1周后使用。采用随机数字表法将其分为四组:假手术组(A组)、假手术+氢气组(B组)、脓毒症组(C组)及脓毒症+氢气组(D组),每组14只。
1.1.2 模型建立 参照文献[13]采用CLP法制备小鼠脓毒症模型。腹腔注射2%水合氯醛15 mL/kg麻醉,常规腹部聚维酮碘消毒,备皮,铺无菌洞巾。沿小鼠腹正中线切口约1 cm,用无菌镊探查到盲肠后,用手术缝线在回盲瓣下方盲肠近段1/4处结扎盲肠(避免结扎回肠及盲肠系膜血管),用20 G无菌针头贯通穿刺盲肠,挤压盲肠,使其内容物沿穿孔部位挤出0.3 mL,将盲肠还纳腹腔,逐层关腹。A组和B组仅暴露盲肠。
1.2 方法
1.2.1 氢气治疗 采用GCH-300高纯氢气发生器(天津同普分析仪器科技有限公司)提供氢气,将小鼠放入密闭的树脂玻璃箱内,入气口输入4 L/min的氢气和空气混合气,PG610氢气检测仪(河南英特电器设备公司)监测箱内氢气浓度[14]。B、D组于CLP后1、6 h时吸入2%氢气1 h,A、C组小鼠仅放于玻璃箱内,不吸入氢气。
1.2.2 行为学评分 每组各任选7只小鼠,CLP后24 h进行结膜炎、毛发竖立、腹泻、昏睡程度评分,各项得分为0~3分:0分为无,1分为轻度,2分为中度,3分为重度,总分12分。
1.2.3 血清和肠道组织中MDA、CAT及SOD测定 每组各取7只小鼠采取血浆。方法:沿胸骨正中作一切口,进入胸腔,暴露心脏满意后,将一预先肝素化的1 mL空针刺入左心室,取血1 mL,迅速在4℃、3 000 r/min离心10 min。离心后,取上清液装入冻存管,-80℃冰箱中保存直至氧化指标的测定。采集血样后,处死小鼠取小肠组织匀浆,4℃、10 000 r/min离心15 min,取上清液,同样方法冷冻保存。用分光光度法测定MAD、SOD及CAT(试剂盒购自Cayman Chemical公司),严格按照说明书操作。
1.2.4 血生化指标和肠道组织细胞凋亡指数测定 每组取剩下的7只小鼠采取全血,方法与血浆的采取方法类似,从左心室取血成功后,立即进行生化指标[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)]测定。处死小鼠取小肠组织,用10%甲醛固定6 h,石蜡包埋,制备5 μm厚切片,固定于玻片上。操作流程为制作石蜡切片,切片常规脱蜡,复水;后续过程在湿盒内进行,先用0.5%过氧化氢的磷酸盐缓冲液(PBS)封闭内源过氧化物酶活性,然后将切片在缓冲盐溶液(SSC)中浸泡2次,每次20 min,水温80℃,浸泡后用PBS洗2次;室温下用1~2 μg/mL蛋白酶K的10 mmol/L三羟甲基氨基甲烷盐酸盐缓冲液(pH=8.0)处理玻片10 min,再用PBS清洗3次;之后用补充有150 mmol/L氯化钠的原位末端脱氧核苷酸转移酶标记法(TUNEL)反应缓冲液预孵育切片10 min;加TUNEL反应液后,用荧光显微镜观察并拍照。凋亡细胞核呈绿色荧光,即为TUNEL阳性细胞,正常细胞核无绿色荧光。每张切片随机选取10个不重叠的视野,计算每张切片10个视野的总细胞数和总凋亡细胞数,计算每张切片的凋亡指数(10个视野的总凋亡细胞数占总细胞数的百分比),DeadEndTM荧光测定TUNEL试剂盒购自美国Promega公司。
1.3 统计学处理 应用SPSS 15.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 四组小鼠行为学评分及肠道组织凋亡指数比较 与A组比较,C组和D组行为学评分升高,肠道组织凋亡指数升高,差异均有统计学意义(P<0.05);而B组上述指标与A组比较,差异均无统计学意义(P>0.05);与C组比较,D组行为学评分和肠组织凋亡指数降低,差异均有统计学意义(P<0.05)。见表1。
表1 四组小鼠行为学评分及肠组织凋亡指数比较(±s)

表1 四组小鼠行为学评分及肠组织凋亡指数比较(±s)
注:与A组比较,aP<0.05;与C组比较,bP<0.05。
组别n 行为学评分(分) 肠组织凋亡指数(%)A组B组C组D组7 7 7 7 0.20±0.40 0.20±0.40 9.00±0.60a4.70±2.40ab2.70±0.80 2.30±1.00 61.80±10.90a28.80±6.70ab
2.2 四组小鼠血生化指标水平比较 与A组比较,C组和D组小鼠的ALT、AST、BUN、Cr水平均明显升高,差异均有统计学意义(P<0.05);B组上述各项指标与A组比较,差异均无统计学意义(P>0.05);与C组比较,D组ALT、AST、BUN、Cr水平均降低,差异均有统计学意义(P<0.05)。见表2。
表2 四组小鼠血生化指标水平比较(±s)
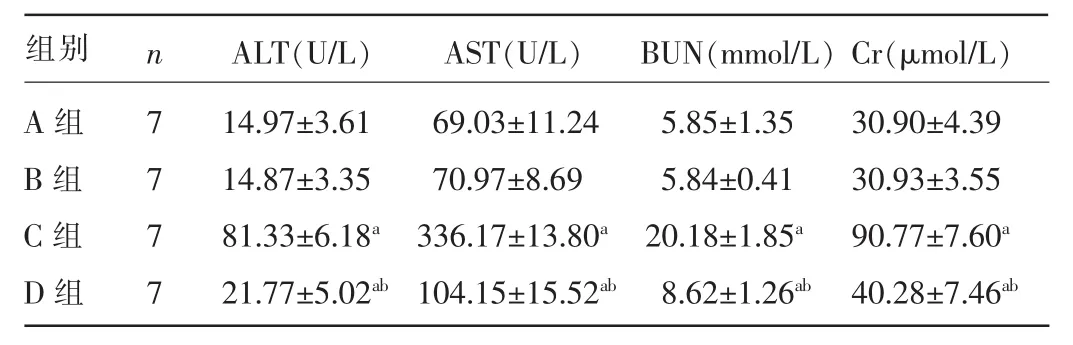
表2 四组小鼠血生化指标水平比较(±s)
注:与A组比较,aP<0.05;与C组比较,bP<0.05。
T(U/L) BUN(mmol/L)Cr(μmol/L)C组D组7 7 81.33±6.18a21.77±5.02ab3±11.24 7±8.69 336.17±13.80a104.15±15.52ab5.85±1.35 5.84±0.41 20.18±1.85a8.62±1.26ab30.90±4.39 30.93±3.55 90.77±7.60a40.28±7.46ab
2.3 四组小鼠血清与肠道组织MDA水平、CAT及SOD活力比较 与A组比较,C组和D组小鼠血清及肠组织MDA水平升高,SOD和CAT活力降低,差异均有统计学意义(P<0.05);B组上述各指标与A组比较,差异均无统计学意义(P>0.05);与C组比较,D组血清及肠组织MDA水平降低,SOD和CAT活力升高,差异均有统计学意义(P<0.05),见表3。
表3 四组小鼠血清与肠组织MDA、CAT及SOD水平比较(±s)
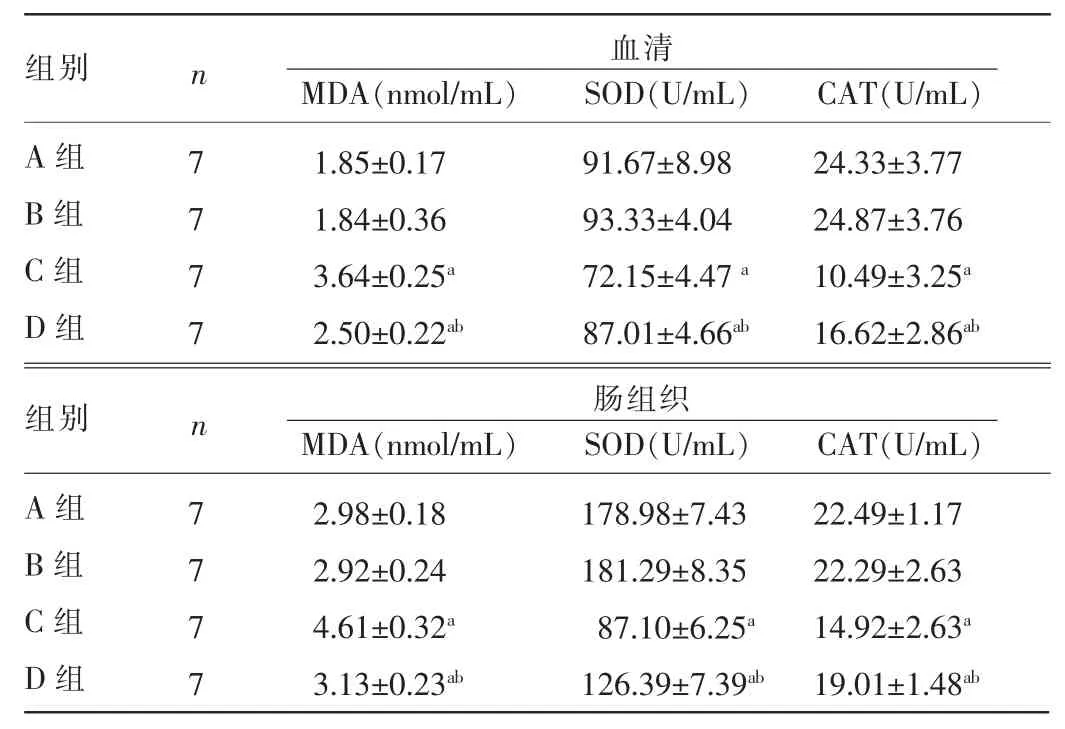
表3 四组小鼠血清与肠组织MDA、CAT及SOD水平比较(±s)
注:与A组比较,aP<0.05,与C组比较,bP<0.05。
组别n 血清MDA(nmol/mL) SOD(U/mL) CAT(U/mL)A组B组C组D组7 7 7 7 1.85±0.17 1.84±0.36 3.64±0.25a2.50±0.22ab91.67±8.98 93.33±4.04 72.15±4.47a87.01±4.66ab24.33±3.77 24.87±3.76 10.49±3.25a16.62±2.86ab组别n 肠组织MDA(nmol/mL) SOD(U/mL) CAT(U/mL)A组B组C组D组22.49±1.17 22.29±2.63 14.92±2.63a19.01±1.48ab7 7 7 7 2.98±0.18 2.92±0.24 4.61±0.32a3.13±0.23ab178.98±7.43 181.29±8.35 87.10±6.25a126.39±7.39ab
3 讨 论
本研究通过CLP法制备小鼠脓毒症模型观察氢气吸入对重度脓毒症小鼠肠黏膜屏障功能、肠道组织氧化还原状态的影响,结果显示,CLP后小鼠行为学评分降低,生化指标出现异常,表明脓毒症模型制备成功;CLP后肠道组织凋亡指数升高,提示脓毒症诱发肠道损伤模型制备成功。
本课题组前期研究表明,CLP后1、6 h吸入2%氢气1 h可提高脓毒症小鼠生存率[14],故本研究选择CLP后1、6 h吸入2%氢气1 h。结果表明,吸入氢气后,脓毒症小鼠行为学评分和相关血生化指标降低,肠道凋亡指数降低,表明氢气减轻了小鼠脓毒症诱发的肠黏膜损伤。
有研究已经证明,在脓毒症的发展过程中,肠道是极易受累的器官[5-6]。受损的肠道组织通过促进肠腔内抗原、微生物和有害代谢产物向血循环中移位,在SIRS的发生中起着重要的推动作用[7-8],进而产生了一种新的观点——肠道是脓毒症病程进展的动力器官[10]。因此,脓毒症患者肠道功能的改变受到越来越多的重视,而肠黏膜屏障功能受损是脓毒症患者最常见的肠道并发症[11]。肠黏膜屏障功能失调可以促进肠道菌群的异常增殖和细菌异位,导致二重感染和MODS的发生[12]。Doig等[15]在危重症患者中开展的一项前瞻性队列研究证实,肠黏膜屏障功能缺陷与重症患者MODS的发生及预后存在显著相关性。肠黏膜屏障功能损伤的机制可能包括脓毒症患者全身炎症细胞的异常激活与促炎性细胞因子的大量释放,氧自由基的大量产生可造成氧化应激状态[11],这也是造成脓毒症患者MODS、脓毒性休克甚至死亡的重要原因。
生理情况下,由于线粒体电子逸出或还原型辅酶Ⅱ、黄嘌呤氧化酶等氧化酶的作用,机体内不断产生具有生理活性的ROS,如超氧离子、过氧化氢等[16],在机体内发挥重要的生理功能;并且能够被SOD、CAT、谷胱甘肽等抗氧化酶类及时清除[17]。在脓毒症的众多发病机制中,氧自由基损伤扮演着重要角色。脓毒症时可激活中性粒细胞、单核/巨噬细胞等产生大量的ROS。有害的ROS大量堆积,通过多种途径对机体造成损伤,直接导致生物膜损伤和各种功能障碍,破坏细胞膜,进而加剧细胞凋亡活动,导致DNA严重损伤,使DNA链发生难以修复的断裂,最终导致细胞死亡。本实验通过测定脂质过氧化产物MDA水平来反映机体氧化应激状态,结果在脓毒症模型组肠组织中发现MDA水平明显增高,氢气吸入后这种增高趋势被抑制,说明肠道组织氧化损伤的存在,以及氢气对有害自由基的选择性清除作用[13]。而抗氧化酶(CAT、SOD等)可以减轻氧化应激对组织、细胞及微结构造成的损伤。从本实验不难看出,与假手术组相比,重度脓毒症小鼠血清及肠组织中SOD和CAT活力显著降低。
综上所述,氢气通过对ROS的选择性清除、对细胞凋亡的抑制,以及对机体抗氧化防御系统的激活,在脓毒症肠道损伤中发挥保护作用。
[1]Biswal S,Remick DG.Sepsis:redox mechanisms and therapeutic opportunities[J].Antioxid Redox Signal,2007,9(11):1959-1961.
[2]Nagler-Anderson C.Man the barrier!Strategic defences in the intestinal mucosa[J].Nat Rev Immunol,2001,1(1):59-67.
[3]Sansonetti PJ.War and peace at mucosal surfaces[J].Nat Rev Immunol,2004,4(12):953-964.
[4]Derikx JP,Luyer MD,Heineman E,et al.Non-invasive markers of gut wall integrity in health and disease[J].World J Gastroenterol,2010,16(42):5272-5279.
[5]Crouser ED,Julian MW,Dorinsky PM.Ileal VO(2)-O(2)alterations induced by endotoxin correlate with severity of mitochondrial injury[J].Am J Respir Crit Care Med,1999,160(4):1347-1353.
[6]Crouser ED,Julian MW,Joshi MS,et al.Cyclosporin a ameliorates mitochondrial ultrastructural injury in the ileum during acute endotoxemia[J]. Crit Care Med,2002,30(12):2722-2728.
[7]Fink MP.Effect of critical illness on microbial translocation and gastrointestinalmucosapermeability[J].SeminRespirInfect,1994,9(4):256-260.
[8]Yu P,Martin CM.Increased gut permeability and bacterial translocation in Pseudomonas pneumonia-induced sepsis[J].Crit Care Med,2000,28(7):2573-2577.
[9]Buchholz BM,Kaczorowski DJ,Sugimoto R,et al.Hydrogen inhalation ameliorates oxidative stress intransplantation induced intestinal graft injury[J].Am J Transplant,2008,8(10):2015-2024.
[10]Hassoun HT,Kone BC,Mercer DW,et al.Post-injury multiple organ failure:the role of the gut[J].Shock,2001,15(1):1-10.
[11]Liu C,Li A,Weng YB,et al.Changes in intestinal mucosal immune barrier in rats with endotoxemia[J].World J Gastroenterol,2009,15(46):5843-5850.
[12]Macfie J,O′boyle C,Mitchell CJ,et al.Gut origin of sepsis:a prospective study investigating associations between bacterial translocation,gastric microflora,and septic morbidity[J].Gut,1999,45(2):223-228.
[13]Xie KL,Yu Y,Pei YP,et al.Protective effects of hydrogen gas on murine polymicrobial sepsis via reducing oxidative stress and HMGB1 release[J]. Shock,2010,34(1):90-97.
[14]Ohsawa I,Ishikawa M,Takahashi K,et al.Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic Oxygen radicals[J].Nat Med,2007,13(6):688-694.
[15]Doig CJ,Sutherland LR,Sandham JD,et al.Increased intestinal permeability is associated with the development of multiple organ dysfunction syndrome in critically ill ICU patients[J].Am J Respir Crit Care Med,1998,158(2):444-451.
[16]Sauer H,Wartenberg M,Hescheler J.Reactive Oxygen species as intracellular messengers during cell growth and differentiation[J].Cell Physiol Biochem,2001,11(4):173-186.
[17]Turrens JF.Mitochondrial formation of reactive Oxygen species[J].J Physiol,2003,552(Pt 2):335-344.
Protective effects of hydrogen on intestinal injury in septic mice*
Shi Yuan,Xie Keliang,Yu Yonghao,Wang Tao
(Department of Anesthesiology,General Hospital,Tianjin Medical University,Tianjin 300052,China)
ObjectiveTo investigate the effect of hydrogen(H2)inhalation on the intestinal barrier function and intesti nal tissue redox status in severe septic mice and its mechanism.MethodsFifty-six male mice of the American Institute for Cancer Research(AICR)were selected,the body mass was 20-25 g and aged 5 weeks,and divided into four groups according to the random number table method:sham operation group(group A),sham operation+H2group(group B),sepsis group(group C)and sepsis+H2group(group D),14 cases in each group.The mouse sepsis model was produced by cecal ligation and puncture(CLP)method.The group B and D received 1 h inhalation of 2%H2at 1 and 6 h after CLP.The behavioral score was conducted at 24 h after CLP;the venous blood was collected for detecting blood biochemical indicators(ALT,AST,BUN,Cr),then the mice were sacrificed for taking the middle section of jejunum.The intestinal tissue was performed the TUNEL staining for observing the apoptosis situation of intestinal tissue cells and conducting the scoring;the levels of MDA and activity of CAT and SOD in blood and intesti nal tissue homogenate were detected.ResultsCompared with the group A,the behavioral score,intestinal tissue apoptosis index,levels of blood biochemical indicators(ALT,AST,BUN,Cr)and serum and intestinal tissue MDA level in the group C and D were increased,while the activityofSOD and CAT were decreased,the differences were statistically significant(P<0.05),but which in the group B had no statistical differences as compared with the group A(P>0.05);compared with the group C,the behavioral score,intestinal tissue apoptosis index,levels of blood biochemical indicators and serum and intestinal tissue MDA level in the group D were decreased,while the activity of SOD and CAT were increased,the differences were statistically significant(P<0.05).ConclusionH2inhalation has obviously protective effect on intestinal injury and intestinal mucosal barrier function destroy in severe septic mice,which may be associated with the anti-apoptotic effect and maintaining endogenous redox equilibrium state.
Sepsis; Intestinal mucosa; Hydrogen; Oxidative stress; Intestines; Apoptosis
10.3969/j.issn.1009-5519.2016.24.003
:A
:1009-5519(2016)24-3747-04
2016-09-13)
国家自然科学基金资助项目(81071533,81101409)。
史媛(1986-),硕士研究生,主要从事临床重症医学与麻醉学研究。
