溶解热测定实验的条件探索
2017-01-10张晓菲
张晓菲
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
溶解热测定实验的条件探索
张晓菲
(赤峰学院 化学化工学院,内蒙古 赤峰 024000)
溶解热测定实验是大学物理化学课程中的一个经典实验.在教学过程中,得到的实验结果往往与文献值不符.本文利用电热补偿法对KNO3进行溶解热的测定,并用做图法得出积分冲淡热.同时分析了用水量、研磨程度、干燥时间对积分溶解热的影响.实验结果表明,充分研磨样品,控制适当的水量,干燥1小时所测得的硝酸钾溶解热值误差最小.
溶解热;电热补偿法;硝酸钾
1 实验原理
“溶解热的测定”是物理化学实验中的一个经典实验,本实验测硝酸钾与氯化钾在水中的溶解热,是一个溶解过程中温度随反应的进行而降低的吸热过程.故实验方法是采用电热补偿法,实验时先测定体系的初始温度,随着样品的溶解,溶液的温度会随之降低,通过电加热的方法使体系再回复至起始温度,根据所消耗的电能求出热效应Q.其Q=UIt.式中U为电阻丝两端所加的电压(V),I为通过电阻丝的电流强度(A),t为通电时间(s).传统手工操作实验存在着一些缺点:在实验过程中,电流电压不稳定,很难得到稳定的功率值;每次样品加入后,到体系恢复至起始温度的时间是用秒表读取的,因而易引入较大的误差;此外,实验中需持续观察起始温度是否到达以及读取加热时间,实验难度较大[4].因此采用微机自动测控系统对实验进行全程的测控,以便解决以上问题.
由于Q=UIt中U和I要求保持不变,所以使用积分计算方法处理数据,即将电压、电流作为随时间变化的函数U(t)和I(t),而不是一个恒定的不变的值,利用计算式:Q=∫U(t)I(t)dt完成积分.计算机在数值计算时,电流电压取一小段时间△t内的平均值U和I.热效应计算式转化为Q=ΣUI△t,这样就克服了因电流、电压的波动而产生的实验误差[5-6].
物质溶解于溶剂过程中所产生的热效应称为溶解热.溶解热分为积分溶解热和微分溶解热两种[7].积分溶解热是指在定温定压下,把1摩尔溶质溶解在n0摩尔的溶剂中时所产生的热效应,由于此过程中溶液的浓度会逐渐改变,因此也称之为变浓溶解热,以Qs来表示.微分溶解热是指在定温定压下,把1摩尔溶质溶解在无限量的某一定浓度的溶液中时所产生的热效应,由于在溶解过程中溶液的浓度实际上可视为不变,因此也称之为定浓溶解热,以表示.
把溶剂加到溶液中使之稀释,其热效应称为冲淡热.它有积分(或变浓)冲淡热和微分(或定浓)冲淡热两种.积分冲淡热是指在定温定压的条件下,把原来含有1摩尔溶质和n1摩尔溶剂的溶液冲淡到含溶剂为n2时的热效应,亦即为某两浓度的积分溶解热之差,以Qd表示.微分溶解热是指1摩尔溶剂加到某一浓度的无限量溶液中所产生的热效应,以表示.

当混合成溶液后
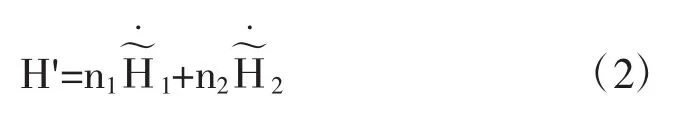
因此溶解过程的热效应为
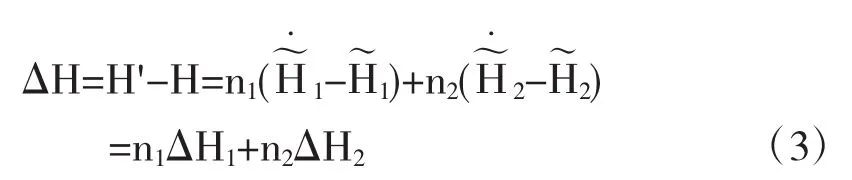
式中△H1为溶剂在指定浓度溶液中溶质与纯溶质摩尔焓的差.即为微分溶解热.△H2为在指定浓度溶液中溶质与纯溶质摩尔焓的差即为微分溶解热.跟据积分溶解热的定义:
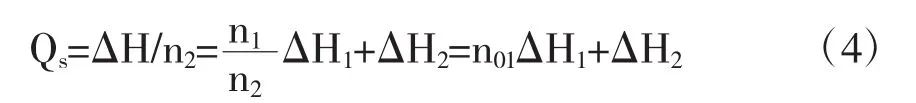
所以在Qs~n0图上,同Qs点的切线斜率为对应于该浓度溶液的微分冲淡热,即
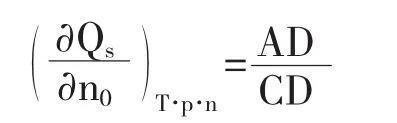
该切线在纵坐标的截距OC,为相应于该浓度溶液的微分溶解热.在含有1摩尔溶质的溶液中加入溶剂使溶剂量由n02摩尔增至n01摩尔过程的积分冲淡热
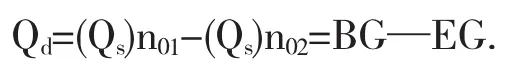
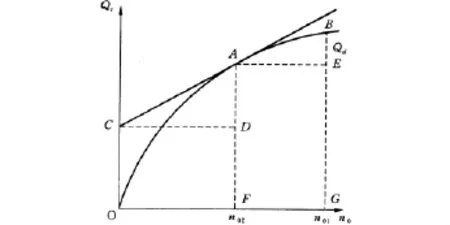
图1 Qs~n0图
2 实验仪器与试剂
实验仪器:ZR-2J溶解热测定装置一套(南京多助科技有限公司生产);量热计(包括杜瓦瓶,加热器);速度可调磁力搅拌器,温度传感器,计算机(选配);称量瓶8只(30×50mm);电子天平一台;台式天平一台;研钵;铁坩埚;温度计;干燥器一个;SL 101FAB-1型电热鼓风干燥箱(上海树立仪器仪表有限公司).
实验试剂:硝酸钾(分析纯AR级,天津市河东区红岩试剂厂);氯化钾(分析纯AR级,天津市福晨化学试剂厂);蒸馏水.
3 实验步骤
(1)将8个称量瓶编号,然后在分析天平上称出准确数据,依次加入样品约2.5、1.5、2.5、3.0、3.5、4.0、4.0和4.5g样品,把称量瓶依次放入干燥器中备用.
(2)在台式天平上称取216.2g蒸馏水于杜瓦内.
(3)将电脑与ZR-2J溶解热装置相连接并打开电源,调节“电流调节”按钮,使功率调节在2.25W左右,并旋动“搅拌调速”旋钮,将搅拌装置转速调节到合适的转速.连接装置图如下:
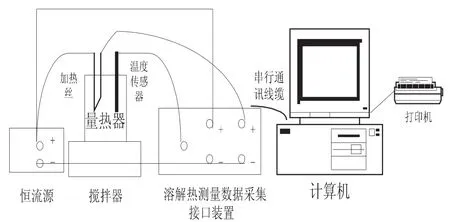
图2 溶解热测定实验装置图
(4)启动软件,输入加热电压、加热电流、溶剂质量 (W水)、溶质分子量、环境温度,Q-n数据表其他数据为生成数据.
(5)选择自动选择通讯端口,绿色指示灯亮说明采集成功.
(6)当实验体系温度高于环境温度0.5℃时,软件将显示可以开始实验提示,反之显示请加热体系温度.
(7)点击开始记录按钮,实验开始,同时测试系统将每秒钟记录一次加热功率数据,并手动输入加入样品的质量(Wi),当实验体系温度高于环境温度0.5℃时,显示提示请加入第一组样品,当温度再次高于环境温度0.5℃时,显示提示请加入第二组样品,以此类推,系统将自动记录实验及Qs数据,当完成8次时,手动点击停止记录,并点击保存数据按钮保存n0-Qs数据表数据,以便以后的数据处理.
(8)实验完成后点可以击数据处理选项,将n0-Qs数据表导入实验处理选项中的n0-Qs数据表,对实验记录的实验数据进行处理.
(9)为了提高数据处理的精度,对已经记录的实验数据进行分组,分组数据原则以实际而定,按住鼠标左键并移动鼠标,可以对实验数据进行选择,被选中的数据点可以在左边的n0-Qs图中看到.
(10)点击曲线拟合按钮对选中的数据进行拟合回归,并通过选择阶数选项改善其拟合精度.
(11)拖动n0-Qs图中黄色的图标,到适当位置,并通过调节n0微调可以精确定位n0坐标.
(12)点击导出按钮将出现一新对话框(含n0值为80,100,200,300,400四个选项),在对话框中选择相应的n0值点击确定改组的溶解焓、微分溶解焓、以及微分稀释焓的数据.
(13)点击消隐曲线、消隐回归、消隐切线,分别对n-Q图中的实验原始点、回归拟合曲线、以及生成的切线进行消隐导入到实验记录表选项的积分溶解焓、微分溶解焓、微分稀释焓表中.
(14)点击载入数据按钮,选择文件,可以对该文件中的数据导入n-Q数据表.
(15)点击浓度n01和n02右边的确定按钮,可以将当前n-Q图光标所在位置n0进行显示,并自动得出n01变化到n02积分冲淡热.
(16)选择实验数据表选项,初始化按钮可以该界面中表和n-Q图已经存在的数据进行归零.
(17)点击打印按钮,出现打印预览界面,按确定打印图表,或按取消按钮返回.
(18)实验结束,关闭电源开关,拆去实验装置.
3 实验结果与分析
3.1 加水量对溶解热实验数据的影响
在实验允许的情况下(如在实验容器容积的范围内、用水量大于样品KNO3溶解水量等),探讨加水量不同对实验结果的影响,本实验功率都是2.25W(电流0.36A,电压6.25V),不同的加水量对实验结果的影响情况如下图.
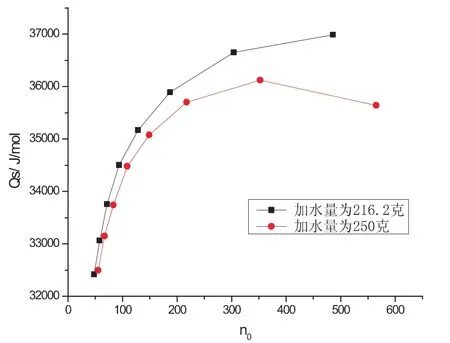
图3 硝酸钾溶于不同量的水中的积分溶解热曲线图
图3是硝酸钾溶于216.2g和250g水后所得的溶解热数据图,由文献可知,当温度为25℃,n0为200时,KNO3的Qs为34.98kJ/mol.由图中n0-Qs数据表可分别求得硝酸钾在n0为200时的积分溶解热分别为36036J/mol和35634J/mol.当加水量为250克时硝酸钾的积分溶解热更接近文献值.
同样,在25℃且n0为200→300时,硝酸钾的积分冲淡热Qd的文献值为523J/mol,由表1所示的积分冲淡热的图解值表明(样品1为加水量216.2克,样品2为加水量250克):样品1积分冲淡热的值更接近文献值,而样品2的值误差较大,且n0为300→400时积分冲淡热的值突然下降.原因可能是体系中的水量较多,样品加入到体系中的速度太快,体系来不及升温,所以造成积分溶解热的值突然下降.所以后面的实验加水量都为216.2克.
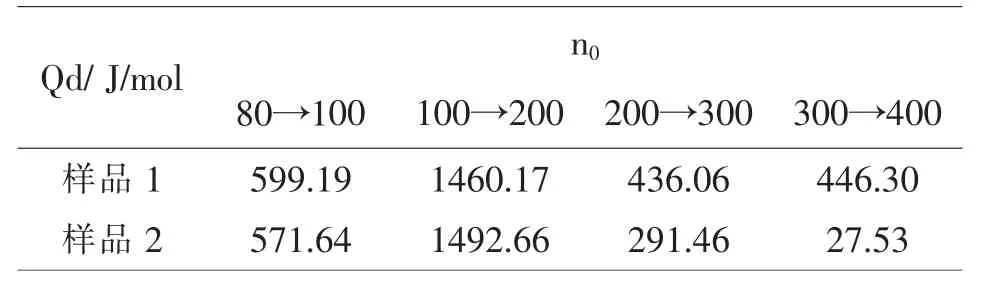
表1 不同加水量的硝酸钾样品的Qd值
3.2药品研磨程度对溶解热实验数据的影响
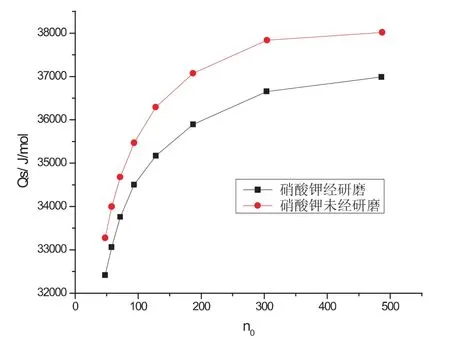
图4 不同研磨程度的硝酸钾溶解热曲线图
图4是研磨后的和未经研磨的硝酸钾溶于216.2g水的溶解热曲线图,由图中n0-Qs数据表可分别求得硝酸钾在n0为200时的积分溶解热分别为36036J/mol和37217J/mol.由得出的积分溶解热值可看出,虽然实验过程中加入的药品都充分溶解,但未研磨的硝酸钾溶解热数值与文献值相差较大,由于未经研磨的药品的粒径很大,因而导致了积分溶解热的偏大,从而引起了与文献的偏差.
同样,在25℃且n0为200→300时,硝酸钾的积分冲淡热Qd的文献值为523J/mol,由表2所示的积分冲淡热的图解值表明(样品1为研磨后的硝酸钾样品,样品2为未研磨的硝酸钾样品):样品1和样品3的积分冲淡热的值较为接近,从积分溶解热的数据来看,研磨后的硝酸钾样品得到的值较好,因为加入的药品粒径小,可以完全溶解.
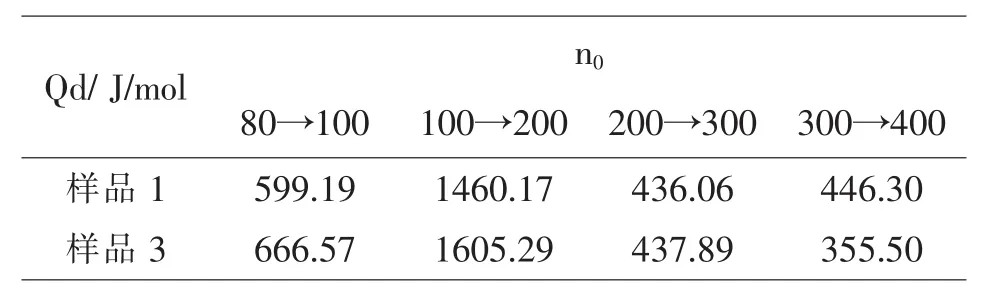
表2 不同研磨程度的硝酸钾样品的Qd值
3.3 药品的干燥程度对溶解热实验数据的影响
在实验开始前,先将药品进行充分研磨并放入铁坩埚中,然后将其放入干燥箱内进行烘干,根据对药品进行烘干的时间长短来讨论其对溶解热数据的影响.体系烘干时采用的温度都为105℃,烘干时间分别进行1h、2h及6h的实验数据结果如下图.
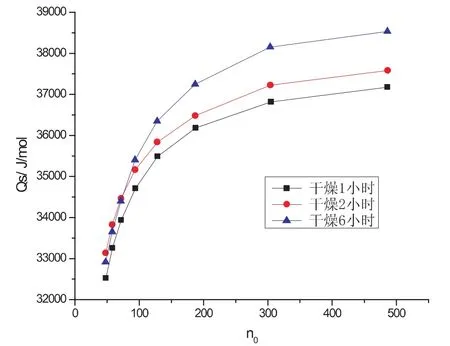
图5 不同干燥时间的硝酸钾的溶解热曲线图
图5是分别对硝酸钾干燥1小时、2小时、6小时得到的溶解热曲线图,由计算得出硝酸钾在n0为 200时的积分溶解热分别为 36302J/mol、36632J/mol、37424J/mol.实验过程中,硝酸钾晶体全部完全溶解,通过所测得的实验数据对比观察可以发现,经1h干燥后的硝酸钾的实验数据与文献值Q=35000J/mol更加接近,而且重复性较好,而干燥2h和6h的相对来说,所得的溶解热数据偏大.但与未经干燥的硝酸钾的溶解热数据相比较来说,经干燥的实验结果更好.因为未干燥的硝酸钾会吸潮,从而引起结果的重复性较差.
同样,在25℃且n0为200→300时,硝酸钾的积分冲淡热Qd的文献值为523J/mol,由表3所示的积分冲淡热的图解值表明(样品4为干燥1h后的硝酸钾样品,样品5为干燥2h的硝酸钾样品,样品6为干燥6h后的硝酸钾样品):样品6的积分冲淡热的值较为接近文献值,因为积分冲淡热是图解值,同时具有作图和计算的误差,所以导致其与文献值有一定误差.
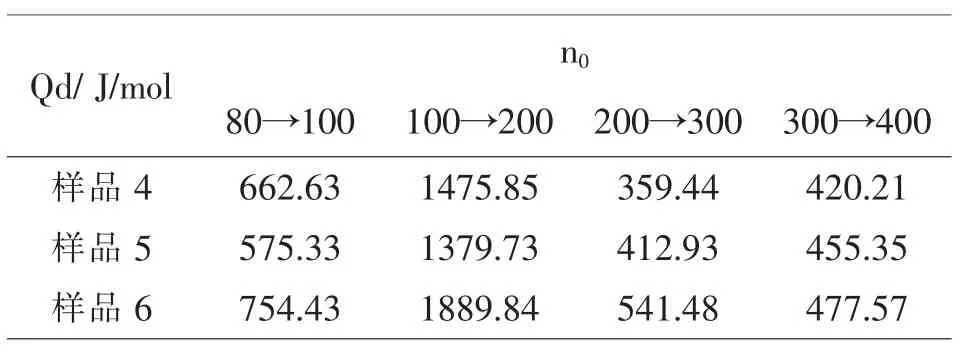
表3 不同干燥时间的硝酸钾样品的Qd值
4 结论
通过实验整体结果来看,对于硝酸钾来说实验的最佳条件是经研磨烘干1h左右加入216.2g水的效果最好.通过上述实验结果可说明,实验过程中一定要将实验药品进行充分研磨并且进行充分干燥,这样才能把使药品完全的溶解,避免实验过程中的药品自身的性质而引起的实验误差.由于杜瓦瓶并不是严格的绝热系统,因此实验过程中系统与环境仍由微小的热交换.实验过程中还应注意搅拌的速度要合适,加入样品时的速度也要适中,确保样品充分的溶解.使得到的溶解热数据与理论值更接近.
〔1〕刘弋潞,胡晓洪,梁舒萍.构建现代物理化学实验教学新体系[J].实验室研究与探索,2009(4).
〔2〕向明礼,刘华,甘斯祚.中断方式下实验信号的实时检测与处理-溶解热的测定[J].中国科技论文统计源期刊,2001.
〔3〕林秋竹,徐嘉祥,杨德盛,等.化学实验教学中接口与传感器技术的应用 [J].大学化学,1995,10 (4):27-30.
〔4〕庞承新,唐文芳,陈今浩.微机控制溶解热的测定研究 [J].广西师范学院学报:自然科学版,2005,22(2):39-42.
〔5〕徐维清,孙尔康,吴奕,等.溶解热测定实验的自动测控系统[J].大学化学,2000(10).
〔6〕张琴,纪圣谋,等.反应热测控系统[J].实验技术与管理,1999(4).
〔7〕郑传明,王良玉,劳捷.溶解热测定实验的改进[J].实验技术与管理,2008,25(12):45-47.
〔8〕沈志农,刘建华,肖利,龚文强,胡洵璞.在溶解焓实验中热效应影响因素分析[J].湖南工业大学学报,2010,24(5).
O64
A
1673-260X(2016)12-0007-04
2016-09-13
