外源性睾酮对雄性小鼠心功能和心脏衰老的影响
2017-01-10朱桂平周玉良李博维林忠伟
朱桂平 张 莉 周玉良 李博维 林忠伟 雷 达
外源性睾酮对雄性小鼠心功能和心脏衰老的影响
朱桂平 张 莉 周玉良 李博维 林忠伟 雷 达
目的:探讨外源性睾酮对雄性小鼠心功能和心脏衰老的影响。 方法:15个月龄C57/BL6雄性小鼠分为4组:安慰剂组、睾酮组、沉默信息调节因子1(Sirt1)抑制剂EX-527组(EX-527组)和睾酮+EX-527组,每组7只。干预3个月后超声心动图检测小鼠心功能指标,ELISA法检测小鼠血清睾酮浓度,分离小鼠左心室,组织化学染色法检测衰老相关β-半乳糖苷酶(SA-β-gal),Western blot检测心肌组织B型利钠肽(BNP)、Sirt1蛋白表达水平,实时定量RT-PCR检测心肌组织肌球蛋白重链(MYH)6、MYH7、肌浆网钙ATP酶2(SERCA2)和α-肌动蛋白1(ACTA1) mRNA表达水平。 结果:睾酮组及睾酮+EX-527组血清睾酮水平较安慰剂组及EX-527组明显升高(P均<0.05)。与安慰剂组相比,睾酮组SA-β-gal染色阳性面积比例明显减少[(17.13±7.12)%对(35.88±10.74)%,P<0.05],BNP蛋白表达水平、MYH7和ACTA1 mRNA表达水平明显降低(P均<0.05),Sirt1蛋白表达水平、MYH6和SERCA2 mRNA表达水平明显升高(P均<0.05)。EX-527组和睾酮+EX-527组上述各指标与安慰剂组相比无统计学差异,与睾酮组相比有显著性差异(P均<0.05)。超声心动图结果示各组左室舒张末期内径、室间隔厚度、左室后壁厚度、左室缩短分数、左室射血分数及E/A值无显著性差异(P均>0.05)。 结论:外源性睾酮可能通过Sirt1途径延缓雄性小鼠心肌细胞衰老,改善心衰相关的基因表达异常。
衰老;睾酮;心功能不全;沉默信息调节因子1
心脏是雄激素作用的靶器官之一,总睾酮或游离睾酮水平降低与充血性心力衰竭死亡率增加有关[1],睾酮治疗已作为心力衰竭(心衰)可选择的治疗措施[2]。心肌细胞衰老可导致心衰的发生发展[3-4],我们前期研究发现低睾酮水平可诱导心肌细胞衰老,睾酮替代治疗可延缓心肌细胞衰老[5]。本研究通过体内实验,探讨外源性睾酮对雄性小鼠心功能和心脏衰老的影响。
1 材料与方法
1.1 实验动物及分组
15个月龄C57/BL6雄性小鼠购自南方医科大学实验动物中心。实验共分4组,每组7只小鼠,SPF条件下分笼饲养。(1)安慰剂组:小鼠肌肉注射芝麻油;(2)睾酮组:小鼠每3 d肌肉注射3 mg/kg丙酸睾酮[5];(3)EX-527组:小鼠每3 d腹腔内注射10 mg/kg沉默信息调节因子1(Sirt1)抑制剂EX-527;(4)睾酮+EX-527组:小鼠肌肉注射丙酸睾酮联合腹腔内注射EX-527。各组干预时间均为3个月。
1.2 超声心动图检测
采用腹腔内注射1.5%戊巴比妥钠对小鼠进行全身麻醉。左前胸脱毛后,左侧卧位固定于温度恒定的操作台上,心率控制在400~500次/min。使用美国GE公司Vivid-7超声仪,30MHz探头行超声心动图分析,显示胸骨旁左室长轴切面,由二维B型超声测量左室舒张末期内径(LVEDd)、室间隔厚度(IVST)和左室后壁厚度(PWT),并计算左室缩短分数(LVFS)和左室射血分数(LVEF)。由心尖四腔切面获得二尖瓣舒张早期最大峰值速度(E峰)和舒张晚期最大峰值速度(A峰),计算E/A值。
各组小鼠在干预及处死前于上午9至11时之间眼球取血,静置30 min后,3 000转/min离心10 min,取血清,ELISA法测定睾酮浓度(试剂盒购自R&D公司)。
1.4 组织化学染色法检测衰老相关β-半乳糖苷酶(SA-β-gal)
小鼠腹腔内注射肝素5 000 U/kg,20 min后行颈椎脱臼法处死小鼠,迅速开胸摘取心脏。37℃ PBS缓冲液中分离左心室心肌组织,去除血液及脂肪组织。心肌组织石蜡包埋、切片,常规脱蜡后,根据SA-β-gal染色试剂盒(上海碧云天公司)说明书对心肌组织进行SA-β-gal染色,显微镜下观察组织染色,每组选取3张心肌组织石蜡切片,用Image-Pro Plus 6.0软件计算每张切片的蓝染面积和总面积,其比值为蓝染阳性面积比例。
1.5 Western blot检测
蛋白提取液提取左心室心肌组织蛋白,BCA法测定蛋白浓度。各组均取20 μg蛋白样品,凝胶电泳、转膜后,室温下用5%脱脂牛奶封闭1 h,加入Sirt1抗体(1∶2 000,abcam公司)、B型利钠肽(BNP)抗体(1∶500,Santa Cruz公司)、GAPDH抗体(1∶5 000,Sigma公司),4℃孵育过夜,洗膜后与辣根过氧化物酶(HRP)标记的二抗(1∶5 000,Invitrogen公司)室温下孵育1 h,洗膜后ECL显影,X线胶片曝光,以目的条带和GAPDH条带吸光度的比值代表蛋白的相对表达量。
1.6 实时定量PT-PCR检测“胎儿”基因表达水平
RNA提取试剂盒(Qiagen公司)提取左心室心肌组织总RNA,分光光度计测定RNA浓度。500 ng RNA用反转录试剂盒(Invitrogen公司)反转录成cDNA。采用SYBR Green I染料(Invitrogen公司)进行定时定量PCR,分析肌球蛋白重链(MYH)6、MYH7、肌浆网钙ATP酶2(SERCA2)和α-肌动蛋白1(ACTA1)mRNA表达水平,H1F0作为内参基因。引物序列如下,MYH6正义序列为5′-TGAGACGGTGGTGGGTTTGT-3′,反义序列为5′-CACCGGTATCAGCAGAAGCATA-3′;MYH7正义序列为5′-TCCTCACATCTTCTCCATCTCT GA-3′,反义序列为5′-TGGACTGATTCTCCCGA TCTG-3′;SERCA2正义序列为5′-CTCTGGAG TTTTCACGGGATAGAA-3′,反义序列为5′-TCC GGCTTGGCTTGTTTG-3′;ACTA-1 正义序列为5′-TCGCTGACCGCATGCA-3′,反义序列为5′-GG GCGATGATCTTGATCTTCA-3′;H1F0正义序列为5′-AGCCACTACAAGGTGGGTGAGA-3′,反义序列为5′-TTGAGAACACCGGTGGTCACT-3′。扩增条件为:95℃预变性10 min,然后进行40个循环,包括95℃变性15 s,60℃退火1 min。计算以H1F0为对照的mRNA相对表达量,安慰剂组设为参考mRNA,其相对表达量为100。
1.7 统计学分析
学者詹姆斯·韦伯·扬曾认为,创意就是“旧元素的新组合”。像案例中的“足球高尔夫”、“地排球”、“嗒嗒球”属于不同元素重组的体育参与方式转型范畴,即“将单一元素重组成多元元素融合”、“将传统元素重组成现代元素”、“将传统项目重组成新鲜项目”等,改变了一些传统的体育项目因没有新鲜感或因难度过高不能满足群众多元需求的现状,吸收了新鲜有趣、入门容易或惊险刺激的项目元素特点,充分彰显了人与生俱来的创意智慧。因此,需要元素重组开发新项目,以满足群众参与体育运动的欲望,实现体育项目元素与活动内容的多元化,体现传统与现代气息的融合。
采用SPSS 13.0软件进行统计学分析,所得数据均采用均数±标准差表示。各组间比较采用单因素方差分析法,组间多重比较方差齐时采用LSD法,方差不齐时采用Dunnett′s T3法,以P<0.05为有统计学差异。
2 结果
2.1 各组小鼠超声心动图结果
超声心动图检查结果示各组间LVEDd、IVST、PWT、LVFS、LVEF、E/A值未见显著性差异(P均>0.05,见表1)。
2.2 各组小鼠血清睾酮水平
干预3个月后,睾酮组及睾酮+EX-527组血清睾酮水平分别为(19.27±3.22) nmol/L和(22.09±4.06) nmol/L,较安慰剂组[(5.26±1.39) nmol/L]和EX-527组[(3.99±1.06) nmol/L]均明显升高(P均<0.05);睾酮组与睾酮+EX-527组血清睾酮水平无明显差异;EX-527组与安慰剂组血清睾酮水平无明显差异。
2.3 各组小鼠心肌组织SA-β-gal化学染色阳性面积比例
SA-β-gal染色后,心肌组织可见胞浆和胞核呈蓝染(见图1)。对各组蓝染阳性面积比例进行计算,睾酮组SA-β-gal 蓝染阳性面积比例与安慰剂组相比明显减少[(17.13±7.12)%对 (35.88±10.74)%,P<0.05];EX-527组和睾酮+EX-527组蓝染阳性面积比例分别为(30.51±10.12)%和(28.21±3.60)%,与睾酮组相比明显增加(P均<0.05);安慰剂组、EX-527组与睾酮+EX-527组之间蓝染阳性面积比例无统计学差异。
2.3 各组小鼠心肌组织Sirt1、BNP蛋白表达水平
与安慰剂组相比,睾酮组心肌组织Sirt1蛋白表达水平明显升高(P<0.05),BNP蛋白表达水平明显降低(P<0.05);与睾酮组相比,EX-527组和睾酮+EX-572组Sirt1蛋白表达水平明显降低(P均<0.05),BNP蛋白表达水平明显升高(P均<0.05);安慰剂组、EX-527组、睾酮+EX-527组之间Sirt1和BNP蛋白表达水平无统计学差异。见图2、表2。
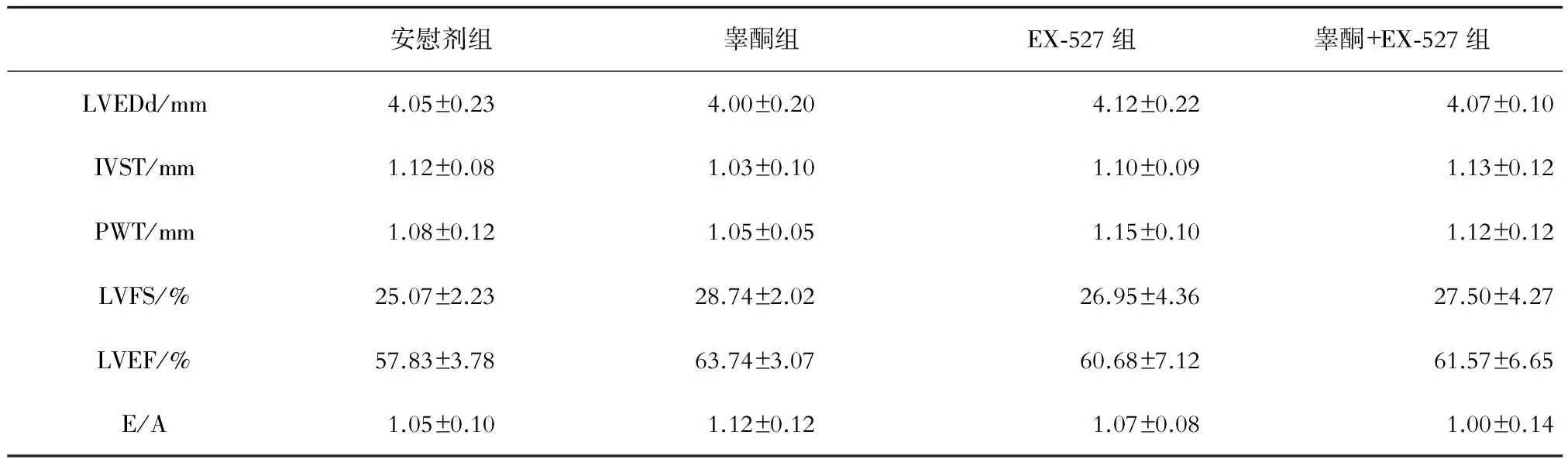
表1 各组小鼠超声心动图检测结果

图1 各组小鼠心肌组织衰老相关β-半乳糖苷酶化学染色(×20)
2.4 各组小鼠心肌组织“胎儿”基因mRNA表达水平
与安慰剂组相比,睾酮组MYH6和SERCA2 mRNA表达水平明显升高(P均<0.05),MYH7和ACTA1 mRNA表达水平明显降低(P均<0.05);与睾酮组相比,EX-527组和睾酮+EX-572组MYH6和SERCA2 mRNA表达水平明显降低(P均<0.05),MYH7和ACTA1 mRNA表达水平明显升高(P均<0.05);安慰剂组、EX-527组、睾酮+EX-527组之间上述“胎儿”基因表达水平无统计学差异。见表3。
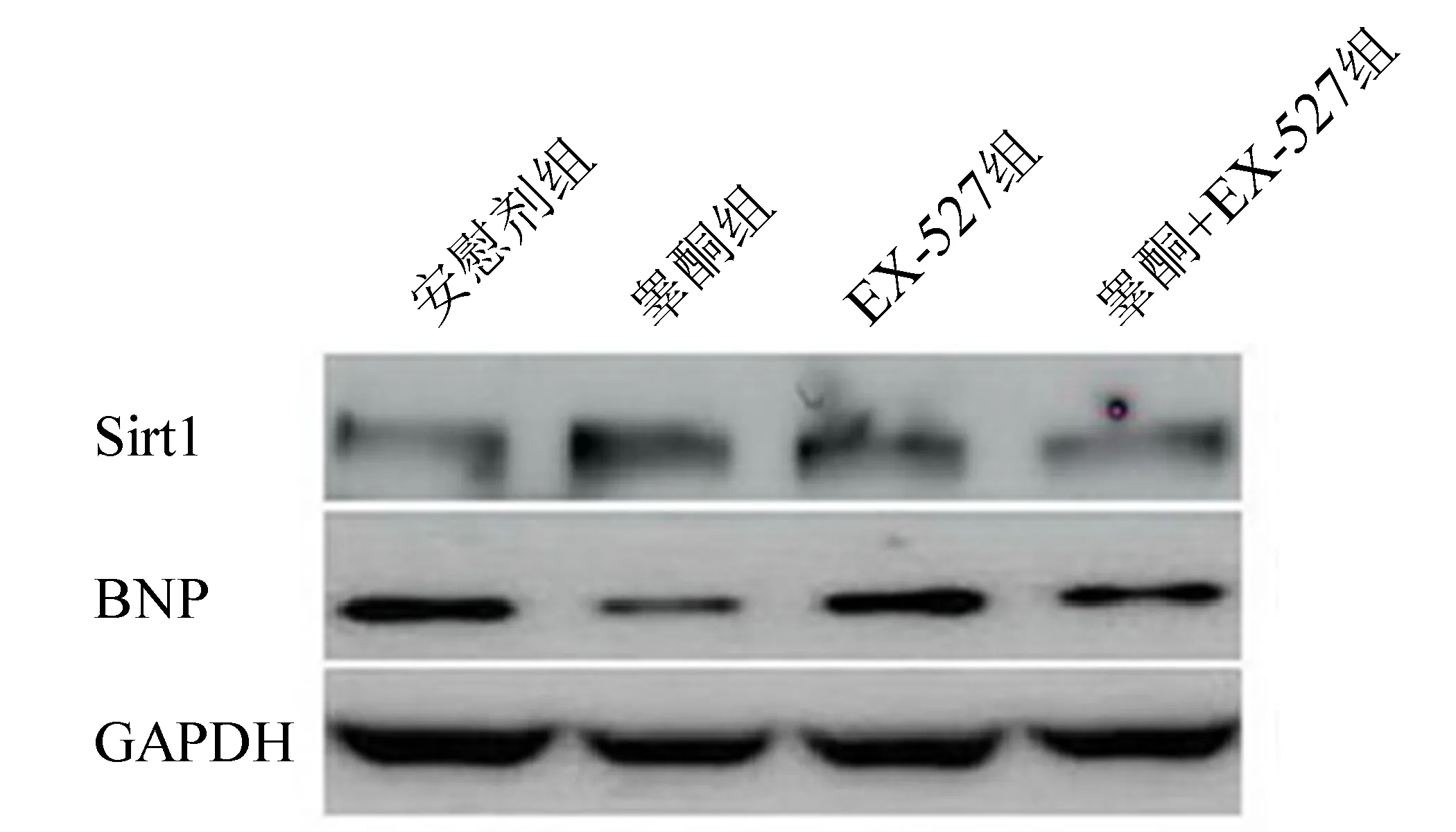
图2 各组小鼠心肌组织Sirt1和BNP蛋白表达水平

安慰剂组睾酮组EX⁃527组睾酮+EX⁃527组SIRT10.25±0.090.63±0.06(1)0.37±0.04(2)0.32±0.07(2)BNP0.79±0.150.41±0.08(1)0.74±0.12(2)0.65±0.06(2)
注:与安慰剂组相比,(1)P<0.05;与睾酮组相比,(2)P<0.05

表3 各组小鼠心肌组织“胎儿”基因mRNA相对表达水平的比较
注:与安慰剂组相比,(1)P<0.05;与睾酮组相比,(2)P<0.05
3 讨论
睾酮水平降低与衰老的许多病理状态如性功能障碍、内脏性肥胖、骨骼和肌肉强度减弱及情绪障碍等相关[6-7]。边瓯等[8]研究显示,高龄男性慢性心衰患者中,发生2型心肾综合征的患者血清睾酮水平降低,可出现血管内皮功能不全、肾动脉硬化和肾脏纤维化。睾酮治疗可改善老年及去势C57BL/6小鼠的脑衰老[9],抑制快速老化模型SAMP8小鼠海马区血管内皮细胞衰老[10]。本研究中睾酮组及睾酮+EX-527组血清睾酮水平较安慰剂组和EX-527组均明显升高,提示外源性睾酮治疗后可使小鼠血清睾酮水平升高。SA-β-gal是衰老细胞的特异性标志物,本研究中睾酮组与安慰剂组相比,心肌组织SA-β-gal蓝染阳性面积比例减少,提示外源性睾酮治疗可延缓心肌组织衰老。
心衰患者血浆睾酮水平下降[11],尤其是老年患者。Pugh等[12]对20例男性心衰患者的研究中发现,12周的睾酮治疗能明显改善患者的生活质量和心衰相关的临床症状。给予76例中重度心衰患者生理剂量睾酮治疗12个月,可使患者运动耐量和心衰症状明显改善[2]。但对于老年男性,睾酮替代治疗纠正心衰是否通过延缓心脏衰老来实现尚不明确。
心肌细胞衰老时,心肌僵硬度增加,收缩与舒张功能下降,其发生与“胎儿”基因表达改变有关,表现为MYH6向MYH7转化、SERCA2表达下降和ACTA1表达增加[13]。这些“胎儿”基因的表达改变同时是成人心衰的典型表现,且心肌细胞损伤及功能障碍时还可出现BNP表达异常。本研究发现睾酮治疗可改善衰老心肌组织中“胎儿”基因的表达改变,下调BNP表达水平,提示睾酮治疗可能通过延缓心肌细胞衰老,改善心功能。
心脏衰老时,超声心动图无特异性改变。心肌细胞衰老可导致左室舒张末期压力升高,舒张早期充盈速度下降,表现为E/A值下降[5]。外源性睾酮治疗对超声心动图指标的影响,目前的研究结果不尽一致。有研究显示,外源性睾酮可改善去势大鼠LVEDd和LVEDs的增加[14]及EF、左心室形成压(LVDP)和左心室压力最大上升速率 (±dp/dtmax)的下降[11,15]。本研究显示,与安慰剂组相比,睾酮治疗后LVEDd、IVST、PWT、LVFS、LVEF、E/A均未见显著性差异。虽然本研究提示睾酮治疗可明显改善心衰相关的基因异常,但并未发现睾酮能够改善与心衰相关的心脏结构,与其他研究不一致的原因可能为衰老程度尚不足以引起小鼠心脏结构变化、样本量少、治疗周期短等。
Sirt1的表达增加可改善衰老相关的心肌肥大、凋亡及心功能不全,使衰老相关标志物表达下调[16]。心脏局部分泌的胰岛素生长因子对氧化应激引起的心肌细胞损害具有保护作用,可调节心肌细胞衰老,而这一作用由Sirt1介导[15]。Kataoka等[17]研究发现皮下注射睾酮可增加大鼠海绵体Sirt1 mRNA的表达。Ota等[10]也发现睾酮干预可增加血管内皮细胞Sirt1的表达;而Sirt1小干扰RNA(siRNA)转染或Sirt1抑制剂预处理内皮细胞可抑制睾酮延缓细胞衰老的作用,提示睾酮通过Sirt1途径延缓血管内皮细胞衰老。目前尚无心肌细胞中睾酮与Sirt1关系的研究。本研究发现,睾酮组心肌组织Sirt1表达水平较安慰剂组明显上调,抑制Sirt1可拮抗睾酮减少SA-β-gal蓝染阳性面积比例的作用,并抑制睾酮对“胎儿”基因及BNP表达的作用,提示睾酮延缓心肌细胞衰老、改善心脏功能的作用可能是通过Sirt1途径来实现的。
综上所述,睾酮可能通过Sirt1途径延缓雄性小鼠心肌细胞衰老,改善心衰相关的基因表达异常。进一步通过体内及体外实验探讨其分子学机制对研究衰老相关的心脏疾病具有重要意义。
[1] Morgentaler A, Miner MM, Caliber M, et al. Testosterone therapy and cardiovascular risk:advances and controversies[J]. Mayo Clin Proc, 2015, 90(2):224-251.
[2] Malkin CJ, Pugh PJ, West JN, et al. Testosterone therapy in men with moderate severity heart failure: a double-blind randomized placebo controlled trial [J]. Eur Heart J, 2006, 27(1): 57-64.
[3] Chimenti C, Kajstura J, Torella D, et al. Senescence and death of primitive cells and myocyteslead to premature cardiac aging and heart failure[J]. Circ Res, 2003,93(7):604-613.
[4] Wong LS, van der Harst P, de Boer RA, et al. Aging, telomeres and heart failure[J]. Heart Fail Rev,2010,15(5): 479-486.
[5] Zhang L, Wu SZ, Ruan YJ, et al. Testosterone therapy delays cardiomyocyte aging via androgen receptor-independent pathway [J]. Braz J Med Bio Res, 2011, 44(11):1118-1124.
[6] Samaras N, Papadopoulou MA, Samaras D, et al. Off-label use of hormones as an antiagingstrategy: a review[J]. Clin Interv Aging, 2014, 23(9): 1175-1186.
[7] Pongkan W, Chattipakorn SC, Chattipakorn N. Role of testosterone replacement in cardiac ischemia-reperfusion injury[J]. J Cardiovasc Pharmacol Ther, 2016, 21(1):27-43.
[8] 边 瓯,马 宁,乔 锐,等.高龄男性2型心肾综合征患者血清睾酮水平的研究[J].国际心血管病杂志,2014,41(5):350-352.
[9] Frye CA, Edinger K, Sumida K. Androgen administration to aged male mice increases anti-anxiety behavior and enhances cognitive performance[J]. Neuropsychopharmacology, 2008, 33(5): 1049-1061.
[10] Ota H, Akishita M, Akiyoshi T, et al. Testosterone deficiency accelerates neuronal and vascular aging of SAMP8 mice: protective role of eNOS and SIRT1 [J]. PLoS One, 2012, 7(1): e29598.
[11] Pongkan W, Chattipakorn SC, Chattipakorn N. Chronic testosterone replacement exerts cardioprotection against cardiac ischemia- reperfusion injury by attenuating mitochondrial dysfunction in testosterone- deprived rats[J]. PLoS One, 2015, 10(3):e0122503.
[12] Pugh PJ, Jones RD, West JN, et al. Testosterone treatment for men with chronic heart failure[J].Heart, 2004, 90(4):446-447.
[13] Vinciguerra M, Santini MP, Martinez C, et al. mIGF-1/JNK1/SirT1 signaling confers protection against oxidative stress in the heart [J]. Aging Cell, 2012,11(1):139-149.
[14] Wang F, Yang J, Sun J, et al. Testosterone replacement attenuates mitochondrial damage in a rat model of myocardial infarction [J].Endocrinol, 2015, 225(2): 101-111.
[15] Eleawa SM, Sakr HF, Hussein AM, et al. Effect of testosterone replacement therapy on cardiac performance and oxidative stress in orchidectomizedrats[J]. Acta Physiol (Oxf), 2013,209(2):136-147.
[16] Alcendor RR, Gao S, Zhai P, et al. Sirt1 regulates aging and resistance to oxidative stress in the heart [J]. Circ Res, 2007, 100(10):1512-1521.
[17] Kataoka T, Hotta Y, Maeda Y, et al. Assessment of androgen replacement therapy for erectilefunction in rats with type 2 diabetes mellitus by examining nitric oxide-related and inflammatory factor[J]. J Sex Med, 2014, 11(4):920-929.
(收稿:2016-05-19 修回:2016-09-11)
(本文编辑:胡晓静)
The effects of exogenous testosterone on cardiac function and myocardial senescence in male mice
ZHUGuiping,ZHANGLi,ZHOUYuliang,LIBowei,LINZhongwei,LEIDa.
DepartmentofCardiology,TheFirstAffiliatedHospitalofGuangdongPharmaceuticalUniversity,Guangdong510080,China
Objective:To investigate the effects of exogenous testosterone on cardiac function and myocardial senescence in male mice. Methods:Twenty-eight 15-month-old male C57/BL6 mice were divided into 4 experimental groups: placebo group, testosterone group, silent information regulator 1 (SIRT1) inhibitor EX-527 group (EX-527 group) and testosterone+EX-527 group. Echocardiography was performed under anesthesia after treatment for 3 months. ELISA was used to detect the serum concentration of testosterone. Senescence associated β galactosidase (SA-β-gal) of left ventricular myocardium was measured by histochemical staining. Western blot was used to estimate the protein expression of B-type natriuretic peptide (BNP) and Sirt1, while real-time RT-PCR was used to assay the mRNA expression of myosin heavy chain (MYH)6、 MYH7、sarcoendoplasmic reticulum Ca2+ATPase 2 (SERCA2) and α-skeletal actin (ACTA1). Results:Serum testosterone levels in testosterone group and testosterone+EX-527 group were significantly higher than those in placebo group and EX-527 group (allP<0.05). Compared with the placebo group, the proportion of SA-β-gal positive areas, protein expression of BNP, and mRNA expression of MYH7 and ACTA1 were significantly decreased, while the protein expression of Sirt1, and mRNA expression of MYH6 and SERCA2 were significantly increased in testosterone group (allP<0.05). These indexes in both EX-527 group and testosterone+EX-527 group had no significant difference as compared with placebo group, but had significant differences as compared with testosterone group (P<0.05). Echocardiography results such as left ventricular end diastolic diameter (LVEDd), interventricular septal thickness (IVST), posterior wall thickness (PWT), left ventricular fractional shortening (LVFS)、left ventricular ejection fractions (LVEF) and E/A value had no significant difference in each gourp (allP>0.05). Conclusion:Exogenous testosterone may retard the process of myocardial senescence and ameliorate the gene expression associsted with cardiac dysfunction in male mice by Sirt1 pathway.
Senescence; Testosterone; Cardiac dysfunction; Silent information regulator 1
广东省公益研究与能力建设专项资金(2014A020212305);广东药学院附属第一医院院内课题
510080 广州,广东药学院附属第一医院心内科
雷 达,Email:gyleida@163.com
10.3969/j.issn.1673-6583.2016.06.014
