经皮主动脉瓣置换临床进展及未来展望
2017-01-10朱政斌张瑞岩
朱政斌 张瑞岩
经皮主动脉瓣置换临床进展及未来展望
朱政斌 张瑞岩
经皮主动脉瓣置入术(transcatheter aortic valve implantation,TAVI)自最初的临床试用至今已十几年。近年来的多项研究显示,TAVI术不仅在高危重度主动脉瓣狭窄患者中逐渐取代甚至超越传统外科主动脉瓣置换术(surgical aortic valve replacement,SAVR),而且在中低危患者中也有较好的应用前景。已有多项研究比较了球囊扩张型和自膨胀型TAVI瓣膜的临床疗效,机械扩张型瓣膜也在近期的临床应用中获得好评。该文主要介绍TAVI的临床应用历程和器械的研发进展。
经皮主动脉瓣置入术;主动脉瓣狭窄;主动脉瓣置换手术
目前全球经皮主动脉瓣置入术(transcatheter aorti cvalve implantation,TAVI)总病例数已近40万。TAVI设计之初的目的是安全有效地治疗因无法耐受外科主动脉瓣置换手术(surgical aortic valve replacement,SAVR)的高危重度主动脉瓣狭窄患者,但近年来研究显示TAVI的应用范围并不局限于高危患者,更有逐渐取代外科治疗单纯主动脉瓣狭窄的希望,因此被广泛关注。
本文围绕近十余年来TAVI的临床应用和器械研发展开讨论,并据此展望其未来发展。
1 TAVI临床应用历程
1.1 初步临床试用阶段
2003年Cribier等[1]发表了全球首例经心尖施行TAVI的临床报告,但由于器械研发滞后,其后数年突破较少,直至2006年Lichtenstien等[2]发表了第一篇真正意义上的临床试用性研究,阐释非体外循环下经心尖施行TAVI的有效性,之后随着器械不断改进,相关临床研究陆续发表。尽管对TAVI的适应证仍存争议[3],但较为统一的认识是TAVI可能是救治无法耐受传统SAVR的高危患者的有效方案。我们姑且将这一阶段称为初步临床试用阶段,其里程碑是2010年Leon等[4]发表的1项包括358例的国际多中心研究,即著名的PARTNER研究,其表明与传统非手术治疗相比,TAVI显著降低高危主动脉瓣狭窄患者1年死亡率(见图1)。
1.2 临床共识阶段
仅时隔1年,Smith等[5]再次发表关于PARTNER研究的论著,指出在高危患者中,TAVI的治疗效果与SAVR相当。该研究进一步分别比较了经股动脉入路和经心尖入路TAVI与SAVR的疗效,结果显示两种入路TAVI均与SAVR疗效相当,经股动脉入路全因死亡率甚至稍低于SAVR(见图2)。
随着TAVI器械的进一步改进,2014年Adams等[6]又一次发表里程碑式的研究,该研究病例数达795例,通过应用一种新型的自膨胀TAVI瓣膜系统,首次证实TAVI在高危重度主动脉瓣狭窄患者中的疗效超过了SAVR,其1年死亡率显著降低(14.2% 对19.1%,非劣效性比较P<0.001,优效性比较P=0.04)。
近期Deeb等[7]公布了为期3年的TAVI和SAVR随机对照临床研究结果,进一步证实了上述观点。国际权威期刊连续数年针对一项新技术发表重要论著在以往是罕见的,这不但极大地推动了医疗界对TAVI的认知,也证明了TAVI的发展前景广阔。国际各大心血管学会也陆续制定了针对TAVI的治疗指南,并不断更新,我们将这一阶段称为临床共识阶段。
1.3 临床突破阶段
在论证了TAVI有效性和安全性的基础上,不断有研究者尝试突破手术适应证的限制,对SAVR中低危患者施行TAVI。2016年8月Reardon等[8]公布了1项美国多中心临床研究,该研究入选750例SAVR中高危的患者,随访2年结果显示,无论STS评分为高危(外科手术死亡风险>7%)或中危(外科手术死亡风险≤7%)的患者,相对于SAVR,均倾向于优选TAVI(2年实际死亡率15.0% 对26.3%,P=0.01),且两组间临床获益无显著差异(P>0.05)。PARTNER2研究也得出了类似结论[9]。由于既往研究明确在低危患者中SAVR风险低[10],且目前尚无针对低危患者的有说服力的TAVI临床研究,因此目前普遍的观点仍推荐在中高危患者人群中施行TAVI。但近期也有观点认为,TAVI的临床疗效和安全性值得肯定,在低危患者中应用至少不劣于SAVR,且随着TAVI应用技术和器械的不断改进,未来的趋势是选择创伤更小的TAVI[11-12]。

注:经皮主动脉瓣置入术(TAVI)与标准治疗对照组相比,术后24个月内全因死亡率(A)、心血管死亡率(B)、全因死亡和再次住院发生率(C)、全因死亡和卒中发生率(D)均显著降低(P均<0.001)图1 PARTNER研究中TAVI与非手术治疗预后比较(图引自参考文献[4])
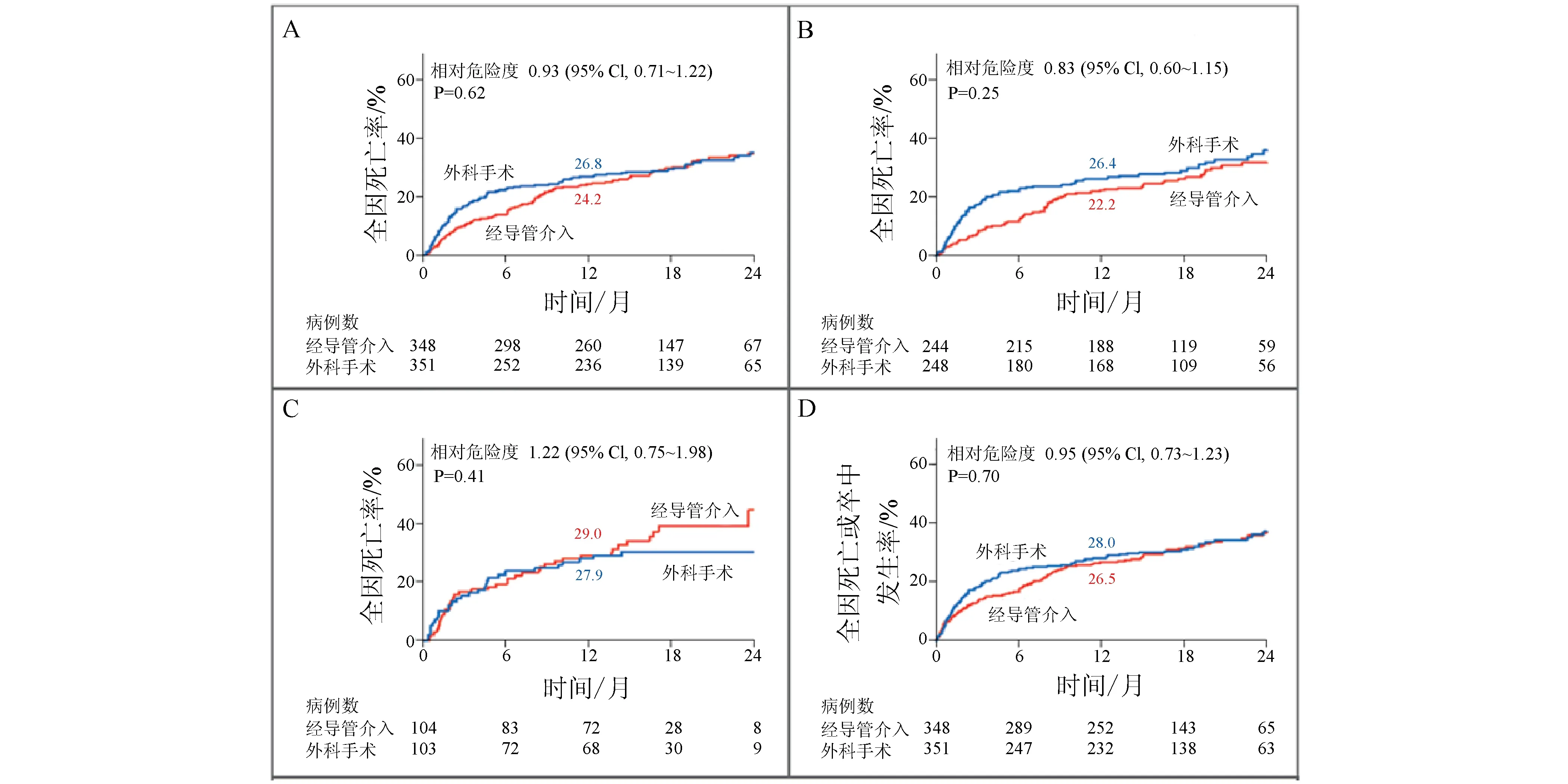
注:经皮主动脉瓣置入术(TAVI)与外科主动脉瓣置换术(SAVR)相比,术后24个月内所有患者全因死亡率(A)、经股动脉入路队列全因死亡率(B)、经心尖入路队列全因死亡率(C)、全因死亡和卒中发生率(D)均无显著差异(P均>0.05)图2 PARTNER研究中TAVI术与SAVR术预后比较(图引自参考文献[5])
有研究者还尝试在既往已接受外科换瓣手术的患者中开展TAVI(即瓣中瓣),结果显示虽然TAVI的瓣周漏风险高于SAVR(3.3% 对0.4%,P=0.022),但出血和卒中风险显著降低(1.9% 对 8.8%,P=0.002;6.9% 对 9.1%,P=0.014),总体死亡率无显著差异(7.9% 对 6.1%,P=0.35)[13]。回顾性研究也得出一致结论[14],但这一观点仍有待于大规模的随机对照非劣效性研究证实。近期Conte等[15]研究指出,在既往接受过冠状动脉旁路血管移植术的患者中,TAVI比SAVR更具优势。2015年Ludman等[16]发表了英国2007年至2012年TAVI注册研究分析报告,结果显示TAVI手术死亡率和并发症发生率有逐年下降趋势,这与手术技术和器械研发都步入了快速发展期有关。我们可以将目前TAVI技术的发展称为临床突破阶段。
2 TAVI器械研发进展
目前已常规应用的TAVI瓣膜系统根据释放方式不同可大致分为3类,即球囊扩张型、自膨胀型和机械扩张型(见图3)[17]。
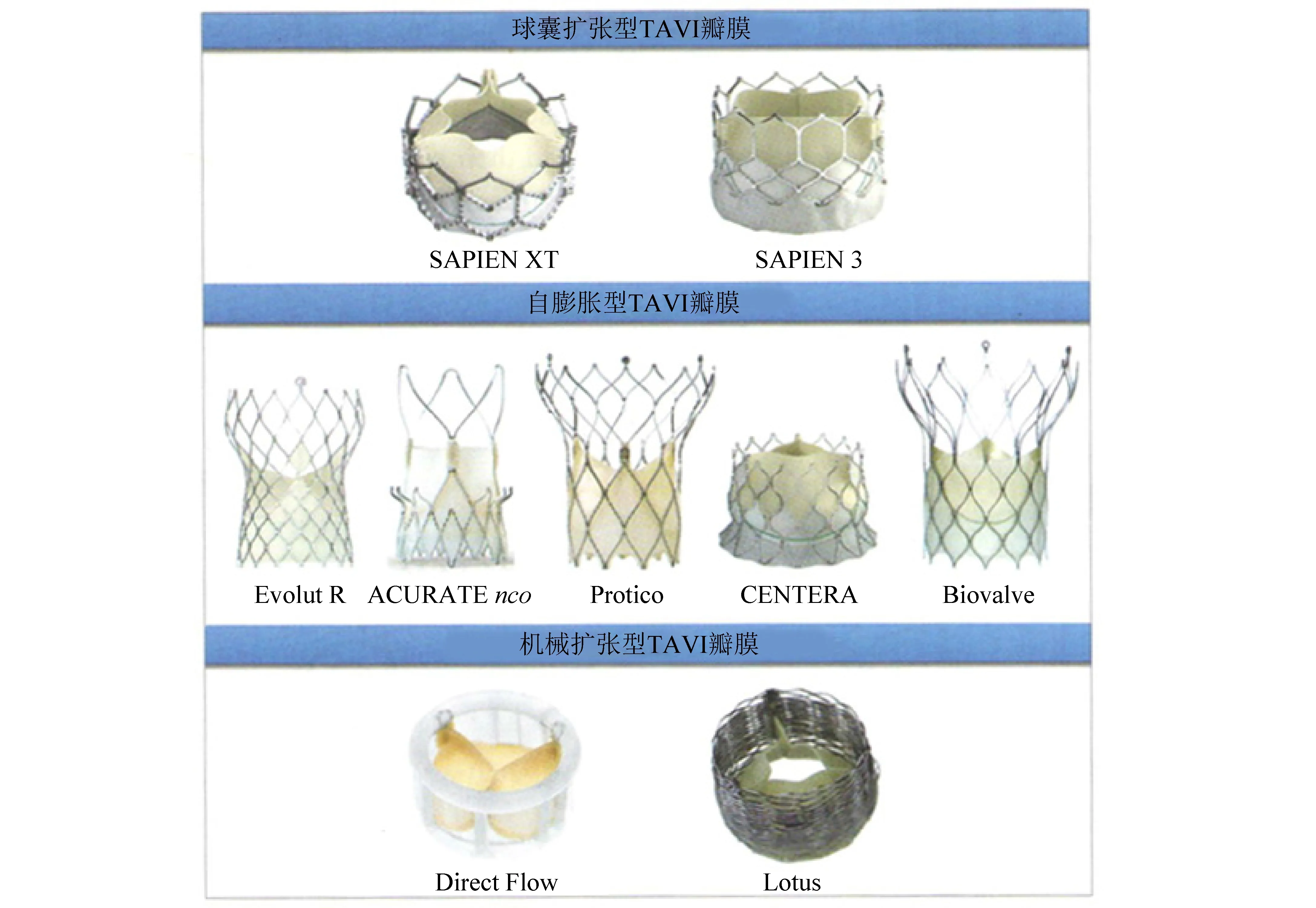
图3 TAVI瓣膜系统分类(图引自参考文献[17])
球囊扩张型TAVI瓣膜和自膨胀型TAVI瓣膜较早应用于临床。CHOICE研究是随机对照研究,结果显示球囊扩张型TAVI瓣膜的器械置入成功率高达95.9%,而自膨胀型TAVI瓣膜的器械置入成功率仅为77.5%;此外,球囊扩张型和自膨胀型TAVI瓣膜组间术后中重度瓣周漏发生率存在显著差异(4.1% 对18.3%,P<0.001),永久性起搏器置入率也存在显著差异(17.3% 对37.6%,P=0.001),但术后30 d心血管死亡率无明显差异(4.1% 对4.3%,P=0.99)[18]。CHOICE研究术后1年的临床终点也无明显差异,自膨胀型TAVI瓣膜的全因死亡率(12.6% 对 17.4%,P=0.33)和心血管死亡率(9.3% 对12.6%,P=0.45)反而略低于球囊扩张型TAVI瓣膜[19]。
值得指出的是,尽管大多数研究均证实球囊扩张型TAVI瓣膜的中重度瓣周漏发生率显著低于自膨胀型TAVI瓣膜,且早期的PARTNER研究和2015年公布的GRAY研究[20]均发现TAVI术后瓣周漏程度与患者近远期生存率呈显著负相关,但近期多项荟萃分析研究结果与CHOICE研究一致,均显示使用球囊扩张型或自膨胀型TAVI瓣膜的临床预后无显著性差异[21-23],这可能与自膨胀型TAVI瓣膜远期仍有自适应效应有关。随着TAVI器械的不断改进,置入成功率的差异正在不断缩小。此外,近年来以Lotus瓣膜为代表的新型机械扩张型瓣膜也在临床应用中有较好的表现。近期发表的REPRISE Ⅱ研究结果显示,在高危患者中,Lotus瓣膜无需高频起搏支持,置入成功率为100%,且1年全因死亡率仅为10.9%[24],但目前总体样本量较少,且缺乏与其他类型TAVI瓣膜的随机对照研究。
此外,TAVI手术的途径也是研究热点之一,多种器械支持经股动脉途径、经外周动脉途径或经心尖途径。随着TAVI输送器械内径的不断减小,常规经股动脉与经心尖途径相比已显示临床预后的显著优势[25],除非股动脉或髂动脉入路存在明显异常,目前多数研究者均推荐经股动脉途径施行TAVI术[26]。
3 我国在TAVI领域的发展
由于器械研发的相对滞后,我国在TAVI领域起步较晚。自2010年报告国内首例TAVI以来,国内多家心血管介入诊治中心陆续尝试这一技术,迄今为止共完成约500例。前文所述的多种类型瓣膜在我国均开展了试用,手术者积累了一定的经验。由于TAVI瓣膜系统尚未获得国家食品药品监督管理局批准用于临床,目前我国总体TAVI手术量远低于欧美国家。
在器械研发方面,我国有数家大型医疗器械生产厂商已设计完成了具有自主知识产权的TAVI瓣膜系统,包括杭州启明医疗器械有限公司的Venus-A、上海微创医疗器械有限公司的Vitaflow等,目前处于临床有效性和安全性验证阶段。
4 展望
目前不同品牌的TAVI瓣膜达20余种,其中有些已经在临床广泛使用,有些尚处于临床试验阶段。新型TAVI瓣膜的设计改进主要集中在以下几个方面:(1)降低输送系统内径,目前广泛使用的输送系统内径已经由最初的24 F(8 mm)降低至14~18 F(4.7~6 mm),新型TAVI瓣膜的设计有可能使输送系统进一步降低至12 F(4 mm),能够有效减少入路血管并发症,提高器械置入成功率;(2)设计辅助定位装置,包括可旋转头端的输送系统,便于在横位心等特殊解剖形态下准确释放;以及主动脉窦底支撑装置(如ENGAGER、ACURATE、Jena Valve等),便于精确定位释放,减少自膨胀型TAVI瓣膜的瓣周漏程度和永久性起搏器置入率;多种新型TAVI瓣膜已不再需要术中高频起搏支持,可以有效减少高危患者的低灌注时间,对临床预后有积极作用;(3)完全释放回收性能,即在最终释放脱离瓣膜之前可完全回收,目前Lotus等机械扩张型TAVI瓣膜已经实现,部分自膨胀型TAVI瓣膜也将在今后的设计改进中增加该功能,以提高定位释放满意度;(4)新型材料的使用,部分新型TAVI瓣膜(例如Direct Flow)已经去除了金属支撑构架,而应用硬化剂辅助支撑结构,未来TAVI瓣膜是否能够应用生物可降解材料值得进一步探索。
由于TAVI涉及的学科较广,包括传统的心血管内科、心血管外科、超声影像学和放射影像学,通过该技术发展促成了心血管团队的形成和交叉领域的技术突破[27]。我们有理由相信,未来将会有更多更新的技术通过心血管团队平台服务于患者。
[1] Cribier A, Eltchaninoff H, Tron C. First human transcatheter implantation of an aortic valve prosthesis in a case of severe calcific aortic stenosis[J].Ann Cardiol Angeiol (Paris), 2003, 52(3):173-175.
[2] Lichtenstein SV, Cheung A, Ye J, et al. Transapical transcatheter aortic valve implantation in humans: initial clinical experience[J]. Circulation, 2006, 114(6):591-596.
[3] Walther T, Chu MW, Mohr FW. Transcatheter aortic valve implantation: time to expand?[J]. Curr Opin Cardiol, 2008, 23(2):111-116.
[4] Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery[J]. N Engl J Med, 2010, 363(17):1597-1607.
[5] Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients[J]. N Engl J Med, 2011, 364(23):2187-2198.
[6] Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis[J]. N Engl J Med, 2014, 370(19):1790-1798.
[7] Deeb GM, Reardon MJ, Chetcuti S, et al. 3-year outcomes in high-risk patients who underwent surgical or transcatheter aortic valve replacement[J]. J Am Coll Cardiol, 2016, 67(22):2565-2574.
[8] Reardon MJ, Kleiman NS, Adams DH, et al. Outcomes in the randomized corevalve US pivotal high-risk trial in patients with a society of thoracic surgeons risk score of 7% or less[J]. JAMA Cardiol, 2016.
[9] Leon MB, Smith CR, Mack MJ, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients[J]. N Engl J Med, 2016, 374(17):1609-1620.
[10] Iturra SA, Suri RM, Greason KL, et al. Outcomes of surgical aortic valve replacement in moderate risk patients: implications for determination of equipoise in the transcatheter era[J]. J Thorac Cardiovasc Surg, 2014, 147(1):127-132.
[11] Jabbour RJ, Pagnesi M, Kawamoto H, et al. Transcatheter aortic valve implantation in intermediate- and low-risk populations: an inevitable progression[J] Int J Cardiol, 2016, 210:35-37.
[12] Castrodeza J, Amat-Santos IJ, Blanco M, et al. Propensity score matched comparison of transcatheter aortic valve implantation versus conventional surgery in intermediate and low risk aortic stenosis patients: a hint of real-world[J]. Cardiol J, 2016.
[13] Phan K, Zhao DF, Wang N, et al. Transcatheter valve-in-valve implantation versus reoperative conventional aortic valve replacement: a systematic review[J]. J Thorac Dis,2016, 8(1):E83-93.
[14] Ejiofor JI, Yammine M, Harloff MT, et al. Reoperative surgical aortic valve replacement versus transcatheter valve-in-valve replacement for degenerated bioprosthetic aortic valves[J]. Ann Thorac Surg, 2016, 102(5): 1452-1458.
[15] Conte JV, Gleason TG, Resar JR, et al. Transcatheter or surgical aortic valve replacement in patients with prior coronary artery bypass grafting[J]. Ann Thorac Surg, 2016, 101(1):72-79.
[16] Ludman PF, Moat N, de Belder MA, et al. Transcatheter aortic valve implantation in the United Kingdom: temporal trends, predictors of outcome, and 6-year follow-up: a report from the UK transcatheter aortic valve implantation (TAVI) registry, 2007 to 2012[J]. Circulation, 2015, 131(13):1181-1190.
[17] John MLasala, Jason H Rogers. Interventional procedure for adult structural heart disease[M].Elsevier, 2014: 73-89.
[18] Abdel-Wahab M, Mehilli J, Frerker C, et al. Comparison of balloon-expandable vs self-expandable valves in patients undergoing transcatheter aortic valve replacement: the CHOICE randomized clinical trial[J]. JAMA, 2014, 311(15):1503-1514.
[19] Abdel-Wahab M, Neumann FJ, Mehilli J, et al. 1-year outcomes after transcatheter aortic valve replacement with balloon-expandable versus self-expandable valves: results from the CHOICE randomized clinical trial[J]. J Am Coll Cardiol, 2015, 66(7):791-800.
[20] Walther T, Hamm CW, Schuler G, et al. Perioperative results and complications in 15,964 transcatheter aortic valve replacements: prospective data from the GARY registry[J]. J Am Coll Cardiol, 2015, 65(20):2173-2180.
[21] Panchal HB, Barry N, Bhatheja S, et al. Mortality and major adverse cardiovascular events after transcatheter aortic valve replacement using Edwards valve versus CoreValve: a meta-analysis[J]. Cardiovasc Revasc Med, 2016, 17(1):24-33.
[22] Bhatheja S, Panchal HB, Barry N, et al. Valvular performance and aortic regurgitation following transcatheter aortic valve replacement using Edwards valve versus CoreValve for severe aortic stenosis: a meta-analysis[J]. Cardiovasc Revasc Med, 2016, 17(4):248-255.
[23] Agarwal S, Parashar A, Kumbhani DJ, et al. Comparative meta-analysis of balloon-expandable and self-expandable valves for transcatheter aortic valve replacement[J]. Int J Cardiol, 2015,197:87-97.
[24] Meredith IT, Walters DL, Dumonteil N, et al. 1-year outcomes with the fully repositionable and retrievable lotus transcatheter aortic replacement valve in 120 high-risk surgical patients with severe aortic stenosis: results of the REPRISE Ⅱ Study[J]. JACC Cardiovasc Interv, 2016, 9(4):376-384.
[25] Biancari F, Rosato S, D'Errigo P, et al. Immediate and intermediate outcome after transapical versus transfemoral transcatheter aortic valve replacement[J]. Am J Cardiol, 2016, 117(2):245-251.
[26] Blackstone EH, Suri RM, Rajeswaran J, et al. Propensity-matched comparisons of clinical outcomes after transapical or transfemoral transcatheter aortic valve replacement: a placement of aortic transcatheter valves (PARTNER)-Ⅰ trial substudy[J]. Circulation,2015, 131(22):1989-2000.
[27] Gualano SK, Kumbhani DJ. At the heart of matters: the role of the heart team in transcatheter aortic valve replacement[J]. Trends Cardiovasc Med, 2015, 25(2):162-163.
(收稿:2016-09-20 修回:2016-10-09)
(本文编辑:丁媛媛)
200025 上海交通大学医学院附属瑞金医院心内科
张瑞岩,Email:zhangruiyan@263.net
10.3969/j.issn.1673-6583.2016.06.002
