利妥昔单抗联合CHOP方案治疗B细胞性非霍奇金淋巴瘤疗效及影响分析
2017-01-10张红霞吴广胜郭蔚玲
张红霞 吴广胜 郭蔚玲
(石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832000)
利妥昔单抗联合CHOP方案治疗B细胞性非霍奇金淋巴瘤疗效及影响分析
张红霞 吴广胜△郭蔚玲
(石河子大学医学院第一附属医院血液风湿科,新疆 石河子 832000)
目的 观察利妥昔单抗联合CHOP方案(R-CHOP)治疗B细胞性非霍奇金淋巴瘤(NHL)的疗效及对细胞免疫、体液免疫的影响。方法 将纳入研究的106例B细胞NHL病例依据化疗方案不同分为2组,分别为R-CHOP组和CHOP组。R-CHOP组给予利妥昔单抗联合CHOP方案,CHOP组给予CHOP方案。6个化疗周期后观察两组疗效及细胞免疫指标(IgA、IgG、IgM)、体液免疫指标(CD3、CD4、CD8、CD4/CD8)的变化。结果 (1)R-CHOP组总有效率88.14%,CHOP组总有效率59.57%,两组总有效率比较差异有统计学意义(P<0.05);(2)化疗2个周期、6个周期后,R-CHOP组IgA、IgG、IgM均较本组化疗前明显下降,差异有统计学意义(P<0.05),而对照组上述指标变化差异无统计学意义(P>0.05),各指标同期比较差异有统计学意义(P<0.05);(3)化疗2个周期、6个周期后,两组CD3、CD4、CD4/CD8均较本组化疗前下降而CD8明显上升差异有统计学意义(P<0.05),但两组各指标同期比较差异无统计学意义(P>0.05)。结论 R-CHOP方案治疗B细胞NHL疗效显著,但对免疫功能的抑制大于CHOP方案。
非霍奇金淋巴瘤; 利妥昔单抗; R-CHOP方案; CHOP方案
非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)是临床常见恶性肿瘤,以起源于B细胞者最为多见,且多伴有CD20阳性,对这些CD20阳性的B细胞NHL患者而言采用R-CHOP是目前主流选择[1],但随着该方案应用普及其毒副作用也逐渐显现。R-CHOP方案存在多种不良反应,免疫抑制即为其中之一[2],但其与CHOP方案比较是否增加免疫抑制尚少有研究。本研究对比了R-CHOP方案和CHOP方案在疗效及对细胞免疫、体液免疫免疫方面的影响差异,以期为临床提供参考。报告如下。
1 资料与方法
1.1 一般资料 全部病例来源于2013年6月至2015年6月我院收治NHL患者,选择经病理组织诊断为B细胞NHL,且CD20阳性的初治病例纳入研究。共106例纳入研究,医师交代化疗方案的优缺点后参考病人意愿选择,依据化疗方案不同分为两组,即R-CHOP组和CHOP组。R-CHOP组59例,其中男23例,女36例;年龄35~76岁,平均年龄(64.63±11.24)岁;临床分期Ⅰ期10例,Ⅱ期16例,Ⅲ期19例,Ⅳ14例。CHOP组47例,其中男19例,女28例;年龄32~80岁,平均年龄(64.53±12.78)岁;临床分期Ⅰ期8例,Ⅱ期12例,Ⅲ期15例,Ⅳ12例。两组性别、年龄以及临床分期无统计学差异(P>0.05),具有可比性。
1.2 治疗方法 R-CHOP组:采用R-CHOP方案,(1)美罗华(利妥昔单抗注射液 规格为500 mg/50 mL,上海罗氏制药有限公司 国药准字J20080053),用法:用量按体表面积375 mg/m2,经0.9%氯化钠稀释至1 mg/mL后静脉滴注,每周期前2天给药。(2)CHOP方案:主要药物为环磷酰胺(江苏瑞恒医药股份有限公司 国药准字H32020857),用量按体表面积750 mg/m2,第1天静脉滴注;多柔比星默沙东(中国)有限公司 国药准字H20090136),用量按体表面积50 mg/m2,第1天静脉滴注;长春新碱(广东岭南制药有限公司 国药准字H20065857),用量按体表面积1.4 mg/m2,第1天滴注;泼尼松(上海信谊药厂有限公司 国药准字H31020675),用量100 mg,第1~5天口服。3周为1个疗程,至少进行6个疗程。CHOP组:采用CHOP方案,具体用药同R-CHOP组中的化疗方案,疗程相同。
1.3 观察指标 (1)细胞免疫指标:主要为T淋巴细胞亚群:CD3、CD4、CD8,并计算CD4/CD8。应用FACS CantoII流式细胞仪检测,所有试剂均由美国Becton Dickinson公司生产。(2)体液免疫1指标主要为免疫球蛋白:IgG、IgA和IgM。采用免疫速率比浊法检测。(3)疗效评价:依据WHO实体瘤疗效标准评价,具体为:完全缓解(CR)为病变完全消失超过1个月;部分缓解(PR)为病变减小至少50%,持续满4周疾病稳定(SD)为肿块减小不足50%,或是增大不超25%;疾病进展(PD)为存在病变增大25%以上,或有新病变。总有效率=(CR+PR)/总例数×100%。
1.4 统计学方法 全部数据均采用SPSS 17.0统计软件处理,计量资料用χ2检验,计量资料用t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 两组疗效比较 R-CHOP组总有效率88.14%,CHOP组总有效率59.57%,两组总有效率比较差异有统计学意义(P<0.05)。见表1。

表1 两组疗效比较[n(%)]
注:与对照组比较,*P<0.05
2.2 两组化疗前后体液免疫指标比较 化疗前,两组体液免疫指标IgG、IgA、IgM水平比较差异无统计学意义(P>0.05);化疗2个周期、6个周期后,R-CHOP组上述指标较化疗前明显下降差异有统计学意义(P<0.05),而CHOP组变化不明显与R-CHOP组比较差异有统计学意义(P<0.05),各指标同期比较差异有统计学意义(P<0.05)。见表2。

表2 两组IgG、IgA、IgM水平比较(g/L)
注:与本组化疗前比较,*P<0.05;与对照组化疗后同期比较,△P<0.05。
2.3 两组化疗前后细胞免疫指标水平比较 化疗前,两组CD3、CD4、CD8、CD4/CD8水平比较差异无统计学意义(P>0.05);化疗2个周期、6个周期,两组CD3、CD4、CD4/CD8均较化疗前明显下降而CD8上升,差异有统计学意义(P<0.05),各指标同期比较,差异无统计学意义(P>0.05)。见表3。
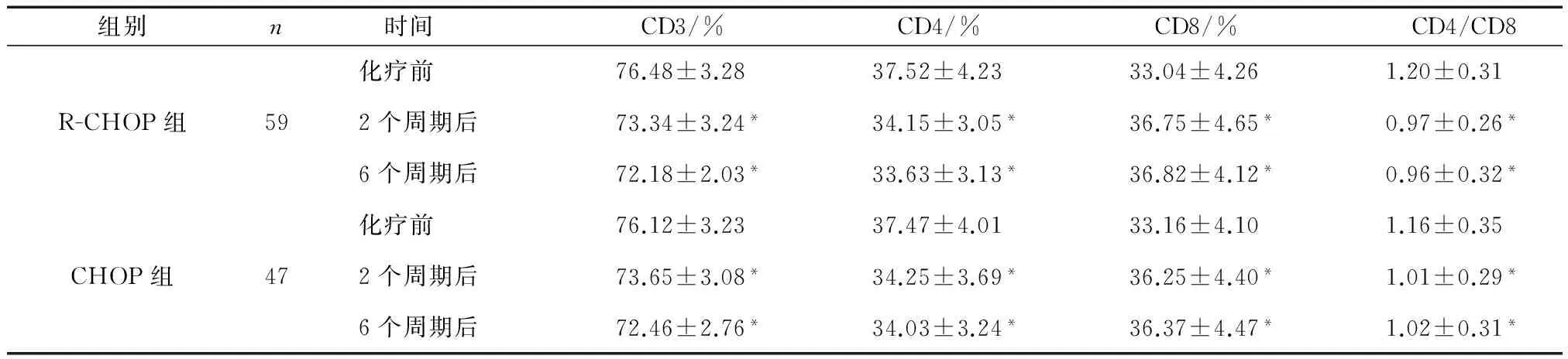
表3 两组化疗前后细胞免疫指标水平比较
注:与本组化疗前比较,*P<0.05
3 讨 论
R-CHOP方案已逐渐成为临床治疗B细胞性NHL的一线方案,将NHL的有效率从CHOP方案的50%~63%大幅提高到80%~95%之间[1],疗效显著,本研究中R-CHOP组和CHOP组的有效率分别为88.14%和59.57%,与之吻合。既往不少研究[3-4]认为CHOP方案联合利妥昔单抗即形成R-CHOP方案后并不增加不良反应发生率,但随着应用经验的积累,临床逐渐认识到原先认识可能存在一定的误区,陆续有报道[5-6]认为R-CHOP方案会造成患者免疫抑制加重的情况。但这些报道多集中在应用R-CHOP方案的NHL患者和正常对照组之间免疫功能的比较,很少有研究其与CHOP方案对免疫功能的影响差异,这一领域有研究价值。
正如其他化疗方案一样,CHOP方案会抑制NHL患者免疫功能已为公论,从已有的报道[7]来看体液免疫、细胞免疫均可能受到影响。CHOP方案中多种化疗药物会影响免疫功能,本研究中所用药物也存在此类问题如:(1)环磷酰胺是常用细胞毒性药物,其对机体免疫应答机制有双向调节作用,小剂量可能刺激免疫活性,大剂量时导致免疫细胞减少,而在体外会抑制T淋巴细胞活性的作用,这已被大量研究[8-9]所证实。(2)长春新碱也对淋巴细胞有毒性,研究[10]显示其对T淋巴细胞、B淋巴细胞的增殖均有抑制,影响体液免疫和细胞免疫功能。(3)泼尼松为糖皮质激素,与其他同类药物一样可使外周血细胞免疫指标诸如CD4、CD4/CD8下降,CD8上升[11]。(4)多柔比星也存在明显的骨髓抑制[12],抑制免疫功能。目前,对CHOP方案存在抑制免疫功能的认识已较为充分,认为其较短的化疗周期内主要影响的是细胞免疫[13],对体液免疫的影响相对较小,本研究结果也显示6个化疗周期内IgA、IgG、IgM均有下降趋势但与化疗前尚未形成差异有统计学意义,而同期CD3、CD4、CD4/CD8显著下降和CD8显著上升(P<0.05)均提示NHL患者细胞免疫已受到明显抑制。R-CHOP方案较CHOP多用了利妥昔单抗,然而利妥昔单抗与CD20结合的同时势必破坏CD20正常的B细胞,这会造成免疫球蛋白合成分泌下降[8],影响体液免疫,但该药对细胞免疫的影响尚不甚明了,其与CHOP联合是否增加对细胞免疫的抑制也鲜有报道。
本研究结果显示,R-CHOP组化疗后2个周期、6个周期时,体液免疫指标IgA、IgG、IgM均明显下降(P<0.05),显著低于同期CHOP组相关指标水平,提示利妥昔单抗与CHOP方案联合抑制体液免疫较为明显,作用大于单用CHOP方案;而两组细胞免疫指标CD3、CD4、CD8、CD4/CD8有类似的变化,同期比较差异无统计学意义,提示利妥昔单抗与CHOP方案联合并不增加细胞免疫抑制。综上所述,R-CHOP方案治疗B细胞性NHL疗效显著优于CHOP方案,与后者比较而言体液免疫抑制作用增加,对细胞免疫影响无差异。鉴于B细胞性NHL时业已存在免疫功能紊乱[14],而R-CHOP方案较CHOP方案会进一步抑制免疫功能,临床应用时需注意检测免疫功能并采取预防感染措施,以保证化疗顺利进行。
[1] 侯思远,杨威.我国美罗华联合CHOP方案化疗对非霍奇金淋巴瘤疗效的Meta分析[J].中国全科医学,2011,14(12):1331-1333.
[2] Ohyagi H,Kume M,Shinohara Y,et al.Non-Hodgkin lymphoma diagnosed by a percutaneous trans-hepatic needle biopsy of portal vein tumor emboli[J].Rinsho Ketsueki,2015,56(12):2483-2487.
[3] Kurokawa T,Hase M,Tokuman N,et al.Immune reconstitution of B-cell lymphoma patients receiving CHOP-based chemotherapy containing rituximab[J].Hematological oncology,2011,29(1):5-9.
[4] Wang Y,Li YJ,Jiang WQ,et al.Expression of BAFF-R,but not BAFF,is an independent prognostic factor in diffuse large B-celllymphoma patients treated with R-CHOP[J].Ann Hematol,2015,94(11):1865-73.
[5] Hirai,Y,Ainoda,Yusuke, et al.Disseminated Cryptococcosis in a Non-Hodgkin′s Lymphoma Patient with Late-Onset Neutropenia Following Rituximab-CHOP Chemotherapy: A Case Report and Literature Review[J].Mycopathologia,2011,172(3):227-232.
[6] 李莉,高贝贝,孙健,等.老年非霍奇金淋巴瘤R-CHOP14治疗方案疗效评价[J].中国公共卫生,2013,29(9):1358-1360.
[7] Nazel K B,Jafari M.Cold Autoimmune Hemolytic Anemia due to High-grade non Hodgkin′s B cell Lymphoma with Weak Response to Rituximab and Chemotherapy Regimens[J].Int J Hematol Oncol Stem Cell Res,2015,9(3):157-160.
[8] Lakshmaiah KC,Viveka BK, Anil Kumar N,et al.Gastric diffuse large B cell lymphoma presenting as paraneoplastic cerebellar degeneration:case report and review of literature[J].J Egypt Natl Canc Inst,2013,25(4):231-235.
[9] 方杰,王琼,江瑞,等.加用利妥昔单抗对B细胞非霍奇金淋巴瘤患者免疫系统的影响[J].中国药业,2015,24(14):61-62.
[10] Emir S,Vezir E,Azkur D,et al.Characteristics of children with non-hodgkin lymphoma associated with primary immune deficiency diseases:descriptions of five patients[J].Pediatr Hematol Oncol,2013,30(6):544-553.
[11] Hardak E,Oren I,Dann E J et al.The increased risk for pneumocystis pneumonia in patients receiving rituximab-CHOP-14 can be prevented by the administration of trimethoprim/ sulfamethoxazole:A single-center experience[J].Acta Haematologica,2012,127(2):110-114.
[12] Miyazaki K.Diffuse large B-cell lymphoma:therapeutic development based on clinical and biological heterogeneity[J].Rinsho Ketsueki,2015,56(10):2047-2055.
[13] Ruiz-Delgado G J ,Gómez-Almaguer D ,Tarín-Arzaga L C,et al.Is there a benefit to adding rituximab to CHOP in the overall survival of patients with B-cell non-Hodgkin′s lymphoma in a developing country[J].Hematology,2012,17(4):193-197.
[14] Büyükkurt N,Özcan MA, ErgeneÜ,et al. The Effect of FcγRIIIA Gene Polymorphism on the Treatment of Diffuse Large B-cell Non-Hodgkin Lymphoma: A Multicenter Prospective Observational Study[J].Turk J Haematol,2015,32(2):152-157.
R453;R551.2
B
1000-744X(2016)12-1268-03
2016-09-28)
△通信作者,E-mail:hematology@126.com
