继发于上神经核团病变的肥大性下橄榄核变性的影像学表现-附6例报告并复习文献及探讨病理机制
2017-01-10中山大学附属第一医院放射科广东广州510080
1.中山大学附属第一医院放射科(广东 广州 510080)
2.中山大学附属第一医院神经外科(广东 广州 510080)
王雨润1 罗安琪2 李竹浩1 罗柏宁1
继发于上神经核团病变的肥大性下橄榄核变性的影像学表现-附6例报告并复习文献及探讨病理机制
1.中山大学附属第一医院放射科(广东 广州 510080)
2.中山大学附属第一医院神经外科(广东 广州 510080)
王雨润1罗安琪2李竹浩1罗柏宁1
目的探讨肥大性下橄榄核变性(hypertrophic olivary degeneration, HOD)影像学征象与病理学机制的关系,旨在提高对本病认识和诊断水平。方法回顾性分析6例经临床及影像证实的肥大性下橄榄核变性的临床特征及MRI表现,并对HOD的临床特征、影像学特征与病理学机制复习文献进行分析。结果1例原发病变位于一侧脑桥被盖束及对侧小脑齿状核/小脑上脚,引起同侧HOD;2例原发病变位于一侧桥脑被盖束,引起同侧HOD;2例原发病变累及双侧桥脑被盖束,其中1例引起双侧HOD,1例引起单侧HOD;1例原发病变累及一侧小脑上脚,引起双侧HOD。6例HOD的MRI均表现为延髓腹外侧局限性体积增大,T2WI及FLAIR均呈高、稍高信号;T1WI等信号者5例,稍高信号者1例。结论肥大性下橄榄核变性有较为特征性的临床表现、发病部位及影像学表现,结合其上游原发病变可作出诊断。
肥大性下橄榄核变性;影像;病理
肥大性下橄榄核变性(hypertrophic olivary degeneration, HOD)是一种涉及小脑齿状核一中脑红核一延髓橄榄核环路并跨神经突触的神经元变性疾病。临床上较为少见。此病多继发于中脑、小脑及桥脑等上神经核团病变(如出血、梗死、炎症等),其结果是使远隔的下橄榄核变性肥大而非萎缩。过去仅在尸解中发现,近年来由于MR技术的普及应用而偶有报道,但由于对本病缺乏认识,仍时有漏诊或误诊。本文通过回顾性分析经临床及影像证实的6例肥大性下橄榄核变性的的临床表现、影像学征象,同时复习文献对其进行分析,旨在提高对HOD的认识、诊断及鉴别诊断的能力。
1 资料及方法
1.1 一般资料回顾性分析本院6例HOD患者,均为男性,年龄19~62岁,平均45岁。3例原发病变为出血,2例为梗死,1例继发于手术。原发病变后8~24月来我院复查MR。
1.2 检查方法及观察内容采用Siemens Magnetom Verio 3.0T MR扫描仪,头线圈采集。所有患者均行头颅横断位T1WI、T2WI及冠状位液体衰减反转恢复序列(FLAIR)。扫描参数:T2WI TR/ TE 4500ms/105ms,Average 1,FA 150°,层厚 6.0mm,FOV 230mm×230mm,像素0.7×0.6。T1WI TR/TE 400ms/9.5ms,Average 1,FA 150°,层厚 6.0mm,FOV 230mm×230mm,像素0.7×0.6。FLAIR TR/TE 9000ms/112ms,Average 1,FA 150°,层厚6.0mm,FOV 230mm×230mm,像素0.7×0.6。采集次数:2次。
所有影像资料均由2名高年资影像科医生共同阅片讨论确定。观察内容为原发病变的部位、范围、性质及下橄榄核的体积、信号。
2 结 果
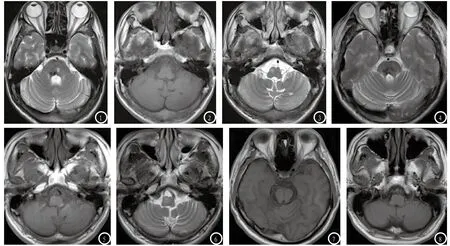
2.1 原发病变性质6例病例中,原发病变为表现为出血者3例,T1WI均表现为高等低混杂信号,T2WI表现为高低混杂信号及极低信号之出血陈旧期含铁血黄素沉积(图1)。原发病变为梗死者2例,其中1例影像表现为软化灶。1例继发于术后。
2.2 HOD的MRI表现6例HOD均表现为一侧或双侧延髓腹外侧下橄榄核局限性体积增大;T2WI 及FLAIR均呈小片状高信号(图1-3);T1WI表现为等信号者5例(图2、图8),表现为稍高信号者1 例(图5)。
2.3 原发病变与继发HOD部位关系6例病例中,2例原发病变位于双侧桥脑中央被盖束,其中1例引起双侧HOD,1例仅引起一侧HOD(图4-6);1例原发病变位于右侧桥脑中央被盖束及左侧小脑齿状核、小脑上脚,引起右侧HOD。1例原发病变位于右侧小脑上脚,引起双侧HOD(图7-9)。2例原发病变位于一侧桥脑中央被盖束,均引起同侧HOD,其中1例位于左侧,1例位于右侧(图4-6)。
2.4 临床特征6例患者位于上神经核团的原发病变治疗后,首次出现临床症状并经MR检查发现HOD时间间隔8-24月,平均为13月。患者均为隐匿起病,5例患者出现临床症状,主要表现有眩晕,眼球震颤,双眼活动受限,视物重影及一侧肢体乏力。仅有1例出现腭肌阵挛。
3 讨 论
肥大性下橄榄核变性(hypertrophic olivary degeneration, HOD)最早由Oppenheim H.[1]提出,是继发于上神经核团所在的格莫三角(Guillain-Mollaret triangle)病变的一种特殊的跨神经突触变性,其结果是使远隔原发灶的下橄榄核顺行性空泡化变性,形态学上表现为延髓下橄榄核局部肥大而非萎缩,与其他变性类疾病不同。临床上常以腭肌阵挛、眼球震颤或眩晕就诊。由于对本病缺乏认识,且HOD下橄榄核的病变在MRI缺乏特异性,如未考虑下橄榄核病变与原发病变的关系,易误诊为延髓梗死、肿瘤等而导致不必要的诊疗措施。
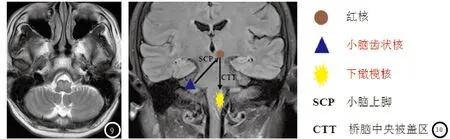
3.1 发病机制及解剖基础格莫三角(Guillain-Mollaret triangle)是联系一侧红核、下橄榄核及对侧小脑齿状核的神经环路,一侧的红核与对侧的小脑齿状核通过对侧小脑上脚相联系,一侧下橄榄核通过同侧的桥脑中央被盖束与同侧的红核相联系,下橄榄核的传出纤维交叉至对侧,经对侧小脑下脚投射至小脑皮层,继而投射至小脑齿状核,形成一个三角形,称为格莫三角(Guillain-Mollaret triangle)[2],如图10所示。该环路是控制精细运动反射弧的一部分,是腭肌阵挛的解剖基础,因此也称肌阵挛三角。
下橄榄核水平以上的格莫三角任何一部位发生病变,如引起下橄榄核的传入神经纤维受损,可引起HOD的发生,而下橄榄核传出神经纤维受损则一般不会引起HOD[3-4]。下橄榄核的传入神经纤维是抑制性γ-氨基丁酸神经能纤维,如发生损害,其下游的下橄榄核处于去神经支配的超敏状态,在临床上可引起腭肌阵挛,在病理学及影像学上可出现下橄榄核肥大、变性。腭肌阵挛仅是HOD可能出现的症状体征,没有腭肌阵挛并不能排除本病,Carrie M.等对HOD大样本量回顾性队列研究发现,有腭肌阵挛症状的病例仅占33%[5]。本组6例病例中仅有一例出现腭肌阵挛。
3.2 原发病变与继发病变的关系根据格莫三角的解剖关系,继发的肥大性下橄榄核变性(HOD)的部位、单侧或双侧由原发病变的部位决定。一侧红核或桥脑中央被盖束的病变可引起同侧的HOD,一侧小脑齿状核或小脑上脚的病变可引起对侧的HOD。双侧红核、桥脑中央被盖束病变或双侧小脑齿状核、小脑上脚病变可引起双侧HOD。若一侧红核、桥脑中央被盖束及同侧的小脑齿状核、小脑上脚同时存在原发病变,则可引起双侧HOD。
本组6例病例中,2例原发病变位于一侧桥脑中央被盖束,引起同侧HOD,如图1所示;1例原发病变位于双侧桥脑中央被盖束,引起双侧HOD;1例原发出血病变同时累及右侧桥脑中央被盖束及左侧小脑齿状核、小脑上脚,引起右侧HOD;上述4例均与理论相符合,并证实了格莫三角的解剖关系。而1例原发病变位于双侧桥脑中央被盖束,但以右侧为著,引起单侧(右)HOD,图2所示,原因可能为仅右侧下橄榄核传入神经纤维受损而左侧并未受损。本组病例中有1例原发病变位于右侧小脑上脚,但引起双侧HOD,图3所示;Tsui等[6]及Hornyak[7]均曾报道单侧桥中脑结合部病灶继发双侧HOD的病例;Uchino A.[8]等报道1例右侧小脑半球出血引起双侧HOD;Shah等[9]曾报道1例右侧桥脑背盖部血管扩张症继发同侧HOD的病例,其DTI纤维束成像显示中脑水平的左侧小脑上脚的横行交叉纤维(与对侧红核相联系)存在,而右侧小脑上脚的横行交叉纤维消失,因此推测本例可能存在类似情况即右侧小脑上脚交叉与左侧红核相联系的横行纤维及未交叉与右侧红核相联系的纤维同时存在,因此一侧小脑上脚的原发病变同时损害了双侧下橄榄核的传入纤维,引起双侧HOD,这或许可以解释一侧原发病变继发双侧HOD的情况。但本例未能行DTI纤维束成像,不能证实此种推测,是为本次研究不足之处。
图1-3 男,45岁,右侧桥脑出血,11月后复查MRI:图1-3分别为T2WI、T1WI、T2WI;原发病变表现为右侧桥脑中央被盖束陈旧性出血(图1),HOD表现为右侧下橄榄核肥大,T1WI呈等信号(图2),T2WI信号增高(图3)。图4-6男,45岁,2年前桥脑出血,现左侧腭肌阵挛,复查MRI:图4-6分别为T2WI、T1WI、T2WI;原发病变显示为双侧桥脑中央被盖束陈旧性出血(图4),HOD表现为右侧下橄榄核肥大,T2WI信号增高(图6),T1WI呈稍高信号(图5)。图7-9 男,62岁,右侧小脑梗死,16月后复查MRI:图7-9分别为T1WI、T1WI、T2WI;原发病变表现为右侧小脑上脚陈旧性梗死(图7),HOD表现为双侧下橄榄核肥大,T2WI信号增高(图9),T1WI呈等信号(图8)。图10 格莫三角解剖关系:一侧的红核与对侧的小脑齿状核通过对侧小脑上脚相联系,一侧下橄榄核通过同侧的桥脑中央被盖束与同侧的红核相联系。
3.3 病理、影像及二者关系HOD发生后,下橄榄核主要的病理变化有神经元空泡变性、星形细胞增生和神经胶质增生[10]。早期光学显微镜下HOD患者下橄榄核神经元呈现2种改变:(1)中央核染色质溶解、尼氏体分解;(2)空泡化变性。空泡化变性在电子显微镜下表现为内质网呈泡状改变,星形细胞则表现为线粒体增多[11]。
Goto等[12-13]根据原发病时间和下橄榄核的病理演变过程将HOD分为6期,分别为:(1)发病24小时内,下橄榄核无变化;(2)发病后2~7天,下橄榄核呈套膜变性(下橄榄核边缘见白质形成囊样结构);(3)发病3周后,下橄榄核轻度肥大,主要是神经元肥大,而胶质细胞无改变;(4)发病8.5月后,下橄榄核增至最大,神经元及星形胶质细胞均增大;(5)发病9.5月后,此阶段神经元崩解,仅有原浆性星形胶质细胞增生,下橄榄核假性肥大;(6)数年后,下橄榄核萎缩,神经元消失。
HOD典型的MRI表现为延髓腹外侧局限性体积增大,T2WI 及FLAIR呈高信号,T1WI呈等信号[14-17]。本组病例中T2WI及FLIAR呈均高信号,T1WI有5例呈等信号,1例呈稍高信号,Kitajima 等[10]也曾报道数例T1WI稍高的HOD病例,经尸解后病理检查发现下橄榄核神经元的粗面内质网存在大量蛋白样物质,可能为T1时间缩短、T1WI信号增高的原因。
与病理分期类似,Goyal M.[3]等在前人研究的基础初上[18-21]根据原发病时间和MR表现将HOD的进程分为4期,分别为:(1)发病1月内,下橄榄核信号及形态均无变化;(2)发病后1-6月,下橄榄核T2WI及质子加权像信号增高,体积不大,对应的为病理学神经元肥大期(3、4期);(3)发病后6 月-3、4年,下橄榄核T2WI及质子加权像信号增高,体积增大,此阶段为典型的MRI表现期,对应病理学真性及假性肥大期(4、5 期);(4)3~4年后,T2WI上残存的稍高信号,而下橄榄核肥大程度减轻-萎缩,其对应的病理改变为神经元崩解消失,此阶段持续时间并不确定,Kitajima M.等[10]认为下橄榄核在T2WI上残存的稍高信号最长可持续到病变后8年。本组6例病例均在典型MRI表现期即第3期。
3.4 鉴别诊断延髓腹外侧的T2WI高信号在延髓病变中并没有特异性,需要与多种疾病进行鉴别,包括梗死、炎症、脱髓鞘、肿瘤等。其中最需要进行鉴别的为延髓梗死。在MR上,延髓梗死T1WI为低信号,而HOD多呈等信号;对于病灶部位,延髓梗死大多位于延髓背外侧(小脑下后动脉闭塞引起),或位于延髓腹侧中线旁(脊髓前动脉或椎动脉穿支闭塞引起)。下橄榄核血供复杂且丰富[22],极少发生局限于下橄榄核的梗死。因此若病变严格定位于一侧或双侧下橄榄核而不影响周围组织,且下橄榄核体积增大,同时注意到格莫三角内存在的原发病灶的后遗病变,则高度提示HOD。
总结:HOD的重要诊断线索为远隔性损害,即下橄榄核病变与同侧红核、桥脑中央被盖束或对侧小脑齿状核、小脑上脚陈旧病变同时存在时,其它诊断的可能性较小,需要考虑本病的可能。熟悉格莫三角的解剖及神经投射关系有助于提高对本病的理解,了解HOD不同时期的病理及影像改变有助于对本病性质及发展过程的认识,可减少误诊以避免不必要的诊疗措施。
[1]Oppenheim H. Uber. Olivendegeneration bei Atheromatese der basalen Himarterien[J]. Berl Klan Wschr 1887,34:638-639.
[2]Guillain GMP. Deux cas de myoclonies synchrones et rhythmes velo-pharyngo-layrngooculo-diaphragmatiques[J]. Rev Neurol 1931,2:545-566.
[3] Goyal M, Versnick E, Tuite P, et al. Hypertrophic olivary degeneration: metaanalysis of the temporal evolution of MR findings[J]. Am J Neuroradaol 2000,21(6):1073-1077.
[4]Trelles JO. La oliva bulvar: su estructura function y patologia[J]. Rev Neuro-Pisquat 1943,6:433-521.
[5] Carr, C.M., et al., Frequency of bilateral hypertrophic olivary degeneration in a large retrospective cohort[J]. J Neuroimaging,2015,25(2):289-295.
[6]Tsui EY,Cheung YK, Mok CK, et al. Hypertrophic olivary degeneration following surgical excision of brain stem cavernous hemangioma: a Case report[J].Clin Imaging,1999,23(4):215-217
[7]Hornyak M, Osborn AG, Couldwell WT. Hypertropbic olivary degeneration after surgical removal of cavernous malformations of the brain stem: report of four cases and review of the literature[J]. Acts Neurochir,2008,150(2):149-156.
[8]Uchino A, Hasuo K, Uchida K, et al. Olivary degeneration after cerebellar or brain stem haemorrhage:MRI[J]. Neuroradiology 1993,35(5):335-338.
[9] Shah R, Markert J, Bag AK, et al. Diffusion tensor imaging in hypertrophic olivary degeneration[J]. AJNR,2010,31(9):1729-1731.
[10]Kitajima M .Korogi Y, Shimomura O, et al. Hypertrophic olivary degeneration: MR imaging and pathologic findings[J]. Radiology,1994,192(2):539-543.
[11]Kurachi M, Nakamura I, Katsukawa K, et al. Olivay hypertmphy in a case with palatal myoclonus: lightand electron-microscopic study. Folia inthe central nervous system[J]. Ann Neurol, 1979,5:72-78.
[12]Goto N, Kaneko M. Olivary enlargement: chronological and morphometric analyses[J].Acza Neuropazhol 1981,54(4):275-282.
[13]Goto N. Kakimi S. Kaneko M. Olivary enlargement: stage of initial astrocytic changes[J]. Clin Neuropathol,1988,7(1):39-43.
[14]Sanverdi, S.E., K.K. Oguz and G. Haliloglu, Hypertrophic olivary degeneration in children: four new cases and a review of the literature with an emphasis on the MRI findings[J]. Br J Radiol, 2012, 85(1013):511-516.
[15]Kosaka, T., C. Asao and S. Tawara, Hypertrophic olivary degeneration with an eggshaped appearance[J].Intern Med,2014,53(23):2751-2752.
[16]Kim, M.K., et al., Holmes' tremor associated with bilateral hypertrophic olivary degeneration following brain stem hemorrhage: a case report[J].J Cerebrovasc Endovasc Neurosurg,2014. 16(3):299-302.
[17]Santos, A.F., et al., Hypertrophic olivary degeneration and cerebrovascular disease: movement in a triangle[J]. J Stroke Cerebrovasc Dis,2015, 24(2):e59-e60.
[18]Birbamer G, Buchberger W Felber S. MR appearance of hypertrophic olivary degeneration: temporal relationships[J].AJNR Am J Neuroradio,1991,13(5):1501-1503.
[19]Birbamer G, Buchberger W Kampfl A. Aichner E Early detection of post traumatic olivary hypertrophy by MRI[J]. J Neurol,1993,240(7):407-409.
[20]Birbamer G, Gerstenbrand E Kofler M, Buchberger W Felber S, Aichner F. Post-traumatic segmental myoclonus associated with bilateral olivary hypertrophy[J].Acza Neurol Scared,1993,87(6):505-509.
[21]Revel MP, Mann M, Brugieres P, et al. MR appearance of hypertrophic olivary degeneration after contralateral cerebellar hemorrhage[J]. AJNR Am J Neuroradiol 1991,12(1):71-72.
[22]Tatu L, Moulin T, Bogousslavsky J. Arterial territories of human brain: brainstem and cerebellum[J].Neurology,1996, 47(5):1127-1135.
(本文编辑: 张嘉瑜)
Imaging Findings of Hypertrophic Olivary Degeneration Secondary to Lesion in Superior Nucleus -Report of Six Cases, Review of Literature and Investigation of Pathologic Mechanism
WANG Yu-run, LUO An-qi, LI Zhu-hao Li,et al., Department of Radiology, The First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, Guangdong Province, China
ObjectiveTo investigate the relationship between imaging properties of hypertrophic olivary degeneration (HOD) and its underlying pathologic mechanism, thus to enhance the cognition and clinical diagnosis performance.Methods6 clinically and radiologically diagnosed cases of HOD were retrospectively observed according to their clinical features and MRI findings. Review the literature to analyze the corresponding clinical manifestations, MRI findings and pathologic mechanism.ResultsHOD was observed ipsilaterally with primary lesions when unilateral pontine central tegment tract was involved (2 cases) and unilateral pontine central tegment tract and contralateral dentate nucleus were both involved (1 case), while bilaterally when primary lesions involved unilateral superior cerebellar peduncle (1 case). Primary lesions of 2 cases involved bilateral pontine central tegment tract, one was observed bilateral HOD while the other unilaterally. All the 6 cases manifested as enlargement of ventral lateral part of medulla.The lesions presented hyper-intensity signal on T2weighted images and fluid-attenuated inversion-recovery (FLAIR) images. The T1weighted images revealed iso-intensity signal in 5 cases and slightly high signal in 1 case.ConclusionHOD has specific clinical and radiological features and usually occurs in particular anatomical sites. Correct diagnosis could be made if the primary lesions are taken into consideration.
HOD; Radiology; Pathology
R445.2;R741
A
10.3969/j.issn.1672-5131.2017.01.010
2016-12-05
罗柏宁
