谷胱甘肽对异育银鲫生长及辛硫磷解毒的影响
2017-01-09任胜杰郑曙明
任胜杰,郑曙明*,宋 艳,朱 龙
(1.西南大学鱼类繁育与健康养殖研究中心,重庆 402460;2.四川省农业科学院农产品加工所,四川 成都 610000)
谷胱甘肽对异育银鲫生长及辛硫磷解毒的影响
任胜杰1,郑曙明1*,宋 艳2,朱 龙1
(1.西南大学鱼类繁育与健康养殖研究中心,重庆 402460;2.四川省农业科学院农产品加工所,四川 成都 610000)
为研究还原性谷胱甘肽(GSH)对异育银鲫生长及辛硫磷中毒后的解毒效果,本试验分别对试验鱼投喂基础饲料和添加GSH的饲料,试验周期为40 d,测定GSH对异育银鲫生长性能、血细胞数目、脏体指数、辛硫磷的解毒效果和肝脏辛硫磷残留量的影响。结果显示:同对照组相比,20 d时各试验组鱼生长出现显著的促进作用(P<0.05)同时饵料系数显著降低(P<0.05);当饲料中添加GSH剂量超过200 mg/kg时,鲫鱼的肝体比、肾体比、脾体比,均呈现升高趋势;各试验组鱼的红细胞,白细胞的数量显著增加(P<0.05);急性攻毒后试验组鱼的死亡率均显著低于对照组(P<0.05),且添加剂量越高死亡率越低(P<0.05);各试验组鱼肝脏中辛硫磷残留量均显著低于对照组(P<0.05),且GSH添加剂量为400 mg/kg时,残留值(0.62±0.01)mg/kg为最低。
还原性谷胱甘肽;异育银鲫;生长性能;解毒
谷胱甘肽包含两种形式:氧化型谷胱甘肽(GSHG)和还原型谷胱甘肽(GSH)。通常在细胞中起生理功能的谷胱甘肽为GSH。还原型谷胱甘肽和氧化型谷胱甘肽在组织中的含量比约为100/1,GSH在机体中起着抗氧化、抗衰老等生理功能,而GSHG则不具有这些功能[1-2]。GSH经谷胱甘肽合成酶、γ-谷氨酰半胱氨酸合成酶和γ-谷氨酰环化转移酶3种酶催化细胞内的甘氨酸、半胱氨酸和谷氨酸经过脱水而成的含有巯基的天然小分子肽[3]。水生动物体内的GSH水平对外界条件的变化很敏感[4],目前国内外水产养殖中关于应用GSH的研究主要包括其对淡水鱼和虾类的促生长、抗病力[5]、相关酶活性[6]、抗氧化[7-8]及鱼体重金属毒性损伤修复[9],抗微囊藻毒素[10]等方面。辛硫磷又名肟硫磷,倍腈松,腈肟磷,是一种高效低毒广谱的有机磷农药,无内吸作用,主要以触杀和胃毒作用为主,目前广泛用于农林渔牧生产[11],在水产养殖中,主要用来杀灭水体中的害虫。辛硫磷对哺乳动物低毒,对鱼类等水生生物具有一定毒性。目前我国对植物性食品和家禽家畜的肌肉中辛硫磷残留量已进行规定并建立相应的国家标准,但对水产品中辛硫磷残留量的检测尚未建立国标[12]。同时,有关GSH对辛硫磷解毒方面的研究也尚未见报道。本试验探讨饲料中添加不同含量的GSH对异育银鲫CarassiusauratusGibelio生长性能,脏体比,红、白细胞数目,急性攻毒死亡率,以及肝脏辛硫磷残留量的影响,从而为GSH对鱼类生长及辛硫磷中毒的解毒效果提供基础数据。
1 材料与方法
1.1 试验设计与试验饲料
试验设置1个对照组和3个试验组,每组3个重复,每个重复随机放入25尾鱼。对试验鱼分别投喂基础饲料和添加200 、400和600 mg/kg GSH的试验饲料。养殖周期为30 d,测定异育银鲫生长性能、红白细胞数目、脏体比。30 d养殖试验结束后,用辛硫磷24 hLC50攻毒,测定死亡率。后将各组攻毒存活试验鱼继续饲喂10 d并统计最终死亡率和测定肝脏中辛硫磷残留量。
基础饲料以菜粕和豆粕等为主要蛋白源,豆油为脂肪源,次粉为主要糖源,具体的配方和营养组成见表1。试验组GSH的添加量分别为200、400、600 mg/kg。饲料原料均经40目筛粉碎,混合均匀后使用小型颗粒饲料机(SLR-150)制成沉性颗粒(直径3 mm),于45 ℃烘箱中快速烘干,随即装入自封袋,-20 ℃保存待用。
1.2 试验用鱼与饲养管理
500尾(42.46±0.37) g异育银鲫均从四川省农业科学院水产研究所获得。试验鱼暂养2周并随机分组。然后分别在12个500 L的玻璃养殖缸中放入无病无伤的异育银鲫25尾。每日补充经充分暴气的自来水约占缸内总水量的1/6。非投喂时间适度曝气,溶氧不低于6 mg/L,水温范围在25.0~28.0 ℃,pH6.9~7.5。氨氮和余氯每周检测1次分别控制低于0.1 mg/L和低于0.05 mg/L。每天投喂两次,日投喂率为2 %。
1.3 测定指标与方法
1.3.1 辛硫磷24 hLC50测定 实验前,多次进行攻毒预试验,找出死亡率在0~100 %辛硫磷剂量的最小范围大致为10~21 mg/L。根据改良寇氏法按等对数间距设置浓度梯度(10.05、12.06、14.47、17.37、20.84 mg/L),求出辛硫磷 24 hLC50=14.73
表1 基础饲料的配方及其营养水平( %干物质)
Table 1 Composition and nutrition levels of the basal diet (dry matter basis, %)

原料Items含量Content鱼粉Fishmeal3.0豆油Soybeanoil2.0豆粕Soybeanmeal18.5维生素预混料Vitaminmix0.1菜粕Rapeseedmeal20.0矿物质预混料Mineralmix0.5麦芽根Rootofmalt10.0磷酸二氢钙Calciumphosphate1.2棉粕Cottonseedmeal12.0纤维素Cellulose2.8次粉Wheatmiddlings24.0统糠Crudericebran5.0磷脂Soybeanlecithin0.5维生素CVitaminC0.1氯化胆碱Cholinechloride0.3粗蛋白(DM)Crudeprotein30.1粗灰分(DM)Crudeash7.5粗脂肪(DM)Crudefat3.6能量(kJ·g-1)(DM)Energy7.7
mg/L。
1.3.2 生长指标测定 试验开始时,随机抽取5尾试验鱼,测定试验鱼测定指标初始值。之后,每10 d测定1次指标,每个重复随机取2尾试验鱼,每个试验处理共取6尾鱼,称重,解剖并快速分离肝、脾、肾脏,并计算试验鱼的肝体比、脾体比、肾体比、增重率、特定生长率、饵料系数。
肝体比(%)=100×肝脏质量/鱼体质量
脾体比(%)=100×脾脏质量/鱼体质量
肾体比(%)=100×肾脏质量/鱼体质量
增重率(%)=100×[(试验末鱼体平均质量-试验初鱼体平均质量)/试验初鱼体平均质量]
特定生长率(%)=100×[(ln试验末鱼体平均质量-ln试验初鱼体平均质量)/试验天数]
饵料系数=投饲质量/(增重质量+死鱼质量)
1.3.3 红细胞、白细胞数目测定 采用尾静脉取血法,取0.5 mL血样立即注入1 %肝素钠抗凝处理过的抗凝管备用。采用显微镜直接计数法来测定血细胞数量。红细胞计数时,用移液枪准确量取20 (l抗凝血。0.65 %生理盐水把所取抗凝血准确稀释100倍,后用血球计数板在显微镜下直接计数。白细胞计数时,用1 %的醋酸龙胆紫将20 (l抗凝血稀释20倍后,用血球计数板显微镜下直接计数。

表2 不同GSH剂量对异育银鲫的生长性能的影响
注:相同天数同列无字母或数据肩标相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05),下同。 Note:The different letters within the same column means significant differences (P>0.05), and the same letters within the same column means not significant differences(P<0.05).The same as below.
1.3.4 急性攻毒 30 d养殖试验结束后,用辛硫磷24 hLC50攻毒,为防止饵料影响,急性攻毒期间不投饵,攻毒24 h后立即换水,正常增氧。测定试验鱼死亡率。继续饲喂10 d并统计最终死亡率。
1.3.5 异育银鲫肝脏辛硫磷残留量检测 急性攻毒试验后,存活试验鱼继续饲喂10 d,参照刘茜、石旺荣[11-12]用基质固相分散-高效液相色谱法对试验鱼的肝脏中的辛硫磷残留量进行测定。
1.4 数据统计
2 结果与分析
2.1 GSH对异育银鲫生长性能的影响
由表2可见,第10天时对照组与各试验组鱼在增重率、特定生长率、饵料系数3个指标上均无显著差异(P<0.05),第20、30天时,GSH添加量为400和600 mg/kg的试验组鱼,在增重率、特定生长率显著高于对照组和200 mg/kg试验组鱼(P<0.05),饵料系数则显著低于对照组和200 mg/kg试验组鱼(P<0.05)。
2.2 GSH对异育银鲫脏体比的影响
从图1~3可知,与对照组相比,各试验组第10、20、30天时肝体比、肾体比、脾体比均出现显著增高(P<0.05)。
2.3 GSH对异育银鲫红、白细胞数目的影响
由图4可知,10、20、30 d时对照组鱼同试验组鱼的红细胞数目出现显著差异(P<0.05),且GSH添加量为600 mg/kg时试验鱼的红细胞数目最多;由图5可知,同对照组相比10、20、30 d时异育银鲫白细胞数目差异显著(P<0.05),30 d时GSH添加量为600 mg/kg时试验鱼的白细胞数目最多。
2.4 攻毒后试验鱼死亡率及肝脏中辛硫磷残留量
由表4可知,对照组攻毒处理后死亡率显著高于各试验组(P<0.05),各试验组间死亡率无显著性差异(P<0.05)。最终死亡率结果,对照组试验鱼的死亡率显著高于各试验组(P<0.05),GSH的添加量为200 mg/kg组死亡率显著高于添加量为400和600 mg/kg的试验组(P<0.05),且添加量为400和600 mg/kg的试验组间无差异显著性(P>0.05)。对照组及各试验组间异育银鲫肝脏辛硫磷残留量均具有显著性差异(P<0.05)且添加量为400 mg/kg的试验组肝脏辛硫磷残留值最低。

相同天数无字母或数据标注相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05),下同The result noted with no letter or different letters means significant differences (P>0.05), and with the same letters means not significant differences(P<0.05).The same as below图1 不同GSH添加量对异育银鲫肝体比的影响Fig.1 Effect of dietary GSH level on the liver to body ratio of the crucian carp

图2 不同GSH添加量对异育银鲫脾体比的影响Fig.2 Effect of dietary GSH level on the spleen to body ratio of the crucian carp
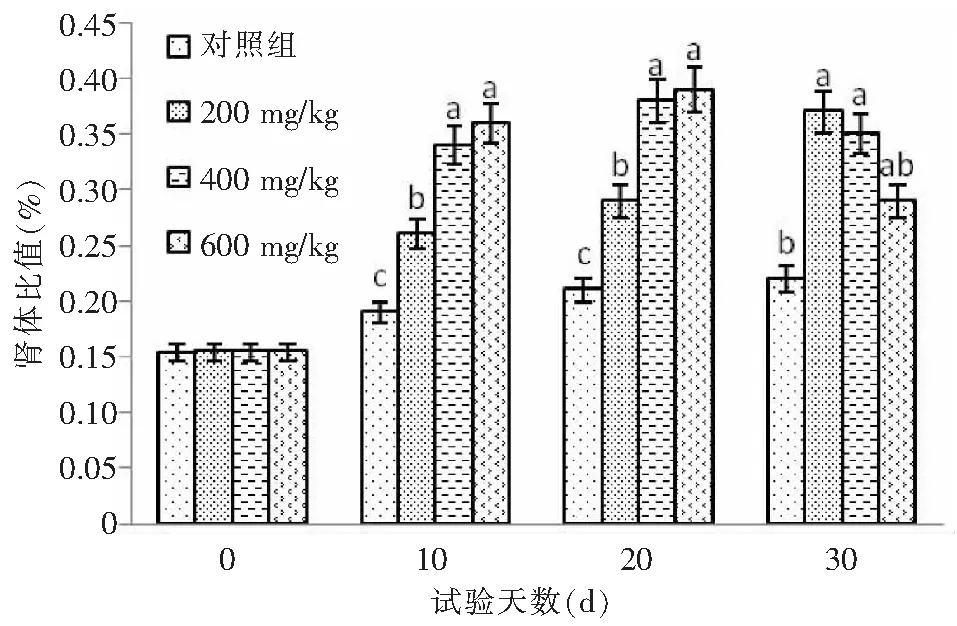
图3 不同GSH添加量对异育银鲫肾体比的影响Fig.3 Effect of dietary GSH level on the kidney to body ratio of the crucian carp
Table 4 The mortality of the text fish after acute attack and the phoxime residual amount in the liver

GSH剂量(mg/kg)GSHdose急性攻毒死亡率Mortalityofacuteattack最终死亡率Finalmortality残留量(mg/kg)Residualcontent0 0.54±0.01a0.63±0.01a1.14±0.04a2000.36±0.05b0.47±0.07b0.93±0.01b4000.33±0.03b0.35±0.03c0.62±0.01d6000.30±0.03b0.39±0.03c0.83±0.03c
3 讨 论
3.1 饲料中添加GSH对水产动物生长性能的影响
研究表明,饲料中添加GSH能够提高草鱼的生长性能[13-14],表现为增重率升高和饲料效率升高,添加GSH各组草鱼的饲料效率和增重率,特定生长率均显著高于对照组。罗非鱼饲料中添加GSH,结果显示适量的GSH可以促进罗非鱼幼鱼的生长,提高饲料的消化率和利用率[15]。这与本试验异育银鲫基础饲料中添加GSH结果相一致,并且本实验还发现基础饲料中添加外源性GSH一定时间后对异育银鲫的生长具有显著的促进作用。且添加剂量在0~400 mg/kg增加效果随添加量的增加而更明显。这可能是因为GSH是广泛存在于细胞内的三肽化合物,对水产动物的内分泌调节具有积极的影响作用,能够促进生长激素的水平在正常范围出现升高,从而进一步对水产动物体内蛋白的合成和细胞的增殖产生促进作用[12]。然而Steven等[16]研究指出GSH在较高的浓度时可以对淋巴细胞产生毒性,并造成DNA损伤。刘晓华等[6]研究发现在饲料中添加过高剂量的 GSH 会显著抑制凡纳滨对虾的生长。所以在饲料中添加适当剂量的GSH 则可以有效的对水产动物增长产生促进作用,剂量过高则会对水产动物的生长产生一定的抑制作用。

图4 不同GSH添加量对异育银鲫红细胞数目的影响Fig.4 Effect of different GSH addition on the erythrocyte number of the crucian carp
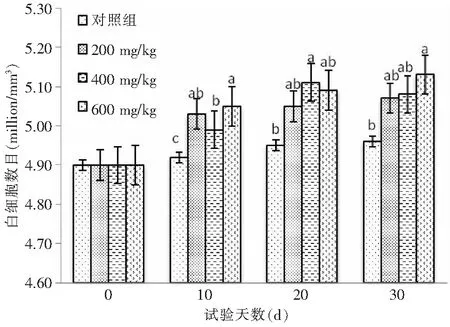
图5 不同GSH添加量对异育银鲫白细胞数目的影响Fig.5 Effect of different GSH addition on the leukocyte number of the crucian carp
3.2 GSH对水产动物肝体比、脾体比、肾体比的影响
肝脏、肾脏、脾脏分别为鱼体内最重要的消化和免疫器官[17]。本试验对试验鱼的肝体比、脾体比,肾体比测定结果显示:基础饲料中添加GSH的剂量在超过200 mg/kg时,试验鱼的各比值出现升高趋势。研究表明,生长激素可使动物的肝脏、肾脏和心脏的质量增加。辅酶A可使生长抑素分子的二硫键断开,使得生长激素等其他促生长激素解除抑制,谷胱甘肽中的半胱胺是辅酶A的重要组成成分[18]。GSH具有促进试验鱼体内生长激素释放的功效,从而促使肝体比、脾体比,肾体比增大,并最终促进异育银鲫体指数呈升高的趋势。
3.3 GSH对异育银鲫红、白细胞数目的影响
研究表明GSH主要是通过提高血细胞数量来增强水产动物的防御能力[20],主要表现在保护红细胞膜蛋白质的巯基处于还原状态,防止溶血,和血红蛋白不受过氧化氢氧化、自由基等氧化转变为高铁血红蛋白,从而使它持续正常发挥运输氧的能力[21]。本试验研究发现,GSH可以使红白细胞的数目增多,结果与赵红霞等[5]用GSH刺激使得草鱼的血液白细胞数目增加从而达到增强其非特异性细胞免疫相一致。白细胞在动物细胞免疫过程中具有非常重要的作用。白细胞在机体内可以通过多种方式来对抗病原体,例如吞噬、包囊、凝聚、沉淀及释放酚氧化物酶和黑色素等[22-23]。红、白细胞是血液的主要组成部分,血液在动物体内起着十分重要的作用,当外界因子变化,而引起鱼体而出现生理变化,都将会在其血液指标中有所体现。
3.4 GSH对异育银鲫急性攻毒死亡率及肝脏辛硫磷残留量的影响
据报道GSH在解毒代谢中有着十分重要的作用,其解毒机理主要表现在能够和化学毒物的代谢中间产物,以亲核结合反应方式进行解毒。此外,GSH在细胞中的高含量也能够更好的竞争结合有毒的亲电子物质。首先,GSH与亲电子代谢物形成结合物,然后经酶的催化反应去掉甘氨酸,再通过N-乙酞化酶的催化反应,最后以惰性产物形式被排出体外[25-26]。除此之外GSH通过其自身的抗氧化特性来有效降低毒物的过氧化能力,从而降低毒物的毒性效应[27]。本试验结果显示,急性攻试验中GSH各添加组的死亡率显著低于对照组,试验鱼肝脏中辛硫磷残留量试验组显著低于对照组,且各试验组间也存在显著差异,添加GSH含量为400 mg/kg时,肝脏中辛硫磷残留值最低可能是因为添加GSH的试验组鱼体内结合辛硫磷代谢中间产物的能力,和机体抗氧化能力强于对照组试验鱼有关[28]。
[1]W R Moore, M E Anderson, A Meister,et al.Increased capacity for glutathione synthesis enhances resistance to radiation in Escherichia coli:a possible model for mammalian cell protection[J]. Proceedings of the National Academy of Sciences of the United States of America,1989, 86 (5):1461-1464.
[2]黄清松, 曾满红, 李红枝,等. 余甘子果汁饮料抗疲劳及抗衰老功效研究[J]. 南方农业学报, 2014, 45(5):840-843.
[3]Kidd P M. Glutathione:systemic protectant against oxidative and free radical damage[J]. Altern Med Rev, 1997, 2(3):155-176.
[4]C Cossu,A Doyotte,M C Jacquin M,et al.Vasseur.Glutathione reductase, selenium-dependent glutathione peroxidase, glutathione levels, and lipid peroxidation in freshwater bivalves, Unio tumidus, as biomarkers of aquatic contamination in field studies[J]. Canadian Metallurgical Quarterly,1997, 38 (2):122-131.
[5]赵红霞,谭永刚,周 萌,等.饲料中添加谷胱甘肽对草鱼生长、生理指标和抗病力的影响[J].中国水产科学, 2007, 14(4):678-683.
[6]曹俊明,刘晓华,周 萌,等.饲料中添加谷胱甘肽对凡纳滨对虾非特异性免疫因子和相关酶活性的影响[J].华中农业大学学报, 2007, 26(4):528-532.
[7]王芳倩,张文兵,麦康森,等.饲料中添加还原型谷胱甘肽对牙鲆生长和抗氧化能力的影响[J].中国海洋大学学报(自然科学版),2011,41(4):51-56
[8]Thomas P, Wofford H W. Effects of cadmium and Aroclor 1254 on lipid peroxidation, glutathione peroxidase activity, and selected antioxidants in Atlantic croaker tissues[J]. Aquatic Toxicology, 1993, 27(1):159-177.
[9]Maracine M, Segner H. Cytotoxicity of metals in isolated fish cells:importance of the cellular glutathione status[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 1998, 120(1):83-88.
[10]张甬元,徐立红,周炳升,等.鱼体中谷胱甘肽对微囊藻毒素的解毒作用的初步研究[J].水生生物学报, 1996, 20(3):284-286.
[11]石旺荣, 刘晓宇, 邱 瑾, 等. MSPD-HPLC 法测定鲫鱼肌肉中辛硫磷残留[C]. 全国农产品质量控制与溯源技术交流研讨会论文集, 2010.
[12]刘 茜, 刘晓宇, 邱朝坤, 等. 基质固相分散-高效液相色谱法测定鲫鱼肌肉中残留的辛硫磷[J]. 色谱, 2009, 27(4):476-479.
[13]赵红霞,曹俊明,朱 选,等.日粮添加谷胱甘肽对草鱼生长性能、血清生化指标和体组成的影响[J]. 动物营养学报, 2008,20(5):540-546.
[14]赵红霞,谭永刚,周 萌,等.饲料中添加谷胱甘肽对草鱼生长、非特异性免疫和抗病力的影响[G]//青岛:第六届世界华人鱼虾营养学术研讨会,2006.
[15]焦彩虹.谷胱甘肽对罗非鱼促生长作用及其作用机制[D].广州:华南农业大学, 2003.
[16]Thomas S, Lowe J E, Hadjivassiliou V, et al. Use of the comet assay to investigate the role of superoxide in glutathione-induced DNA damage[J]. Biochemical and Biophysical Research Communications, 1998, 243(1):241-245.
[17]周小秋. B 族维生素与鱼类消化吸收, 免疫和抗氧化防御能力的关系研究进展[C]. 中国畜牧兽医学会 2009 学术年会论文集 (上册), 2009.
[18]R G Clark,J O Jansson,O Isaksson,et al.Intravenous growth hormone:growth responses to patterned infusions in hypophysectomized rats[J].The Journal of Endocrinology,1985, 104(1):53-61.
[19]温龙岚,姚艳红,王志坚,等. 贝氏高原鳅肾脏发育研究[J]. 西南师范大学学报(自然科学版),2009,34(3):179-183.
[20]周婷婷,曹俊明,赵红霞,等.谷胱甘肽在水产动物中的营养生理作用研究进展[J].水产科学,2012,31(10):630-634.
[21]Camera E, Picardo M. Analytical methods to investigate glutathione and related compounds in biological and pathological processes[J]. Journal of Chromatography B, 2002, 781(1):181-206.
[22]孟凡伦,张玉臻,孔 健,等.甲壳动物中的酚氧化酶原激活系统研究评价[J].海洋与湖沼,1999,30(1):110-116.
[23]徐海圣,徐步进.甲壳动物细胞及体液免疫机理的研究进展[J].大连水产学院学报,2001,16(1):49-56.
[24]黄琼辉.蔬菜农药残留现状及治理对策[J].福建农业科技,2002(5):43-44.
[25]张玉龙. L-半肌氨酸和谷肌甘肤的电化学分析及其电化学性质的研究[D].吉林:延边大学,2008.
[26]Schoenberg M H, Birk D, Beger H G. Oxidative stress in acute and chronic pancreatitis[J]. The American Journal of Clinical Nutrition, 1995, 62(6):1306-1314.
[27]董桂芳,解绶启,朱晓鸣,等.水华蓝藻对鱼类的营养毒理学效应[J].生态学报,2012,32(19):6233-6241.
[28]朱 选,曹俊明,赵红霞,等.饲料中添加谷胱甘肽对草鱼组织中谷胱甘肽沉积和抗氧化能力的影响[J].中国水产科学,2008,15(1):160-166.
(责任编辑 李 洁)
Effect of Dietary Glutathione onCarassiusauratusGibelio Growth Performance and Phoxim Poisoning
REN Sheng-jie1,ZHENG Shu-ming1*,SONG Yan2,ZHU Long1
(1.Fisheries Breeding and Healthy Cultivation Research Centre of Southwest University, Chongqing 402460,China;2.Institute of Agro-products Processing Science and Technology,Sichuan Chengdu 610000,China)
In present study,CarassiusauratusGibelio was fed by basal diet (control group) and 3 kinds of test diets were added 200, 400 and 600 mg/kg GSH. The culture period was 40 days. The effects of GSH on the growth performance to the text fish, the number of blood cells, the weight of the organs and the detoxification of the toxin and the residual amounts of the residues in the liver of the fish were determined. The results showed that:compared with the control group, the 20 days test group of fish growth significantly promoted at the same time the feed coefficient was significantly decreased (P<0.05); when adding dose of GSH more than 200 mg/kg in feed, the index of liver, kidney and spleen were increased in the experimental fish; the number of erythrocyte and leucocyte in the experimental group was significantly increased (P<0.05); the mortality of the fish in the experimental group was significantly lower than that in the control group (P<0.05), and the higher the mortality was lower (P<0.05); in the experimental groups, the residual amount was significantly lower than that of the control group (P<0.05), when the GSH additive was 400 mg/kg, the residual value was the lowest (0.62±0.01).
Glutathione;CarassiusauratusGibelio;Growth performance;Detoxify
1001-4829(2016)12-3009-06
10.16213/j.cnki.scjas.2016.12.042
2015-12-23
国家科技支撑计划(2012BAD25B10-1);重庆市应用开发计划项目(CSTC2014yykfC80001)
任胜杰(1989-),男,硕士研究生,主要从事鱼病防控与水产品食品安全研究, E-mail:601897646@qq.com,*为 通讯作者:郑曙明,教授,硕士生导师,主要从事水产动物医学研究,E-mail:zhsm22@163.com。
S966
A
