基于光谱法的酸性红92结合牛血清白蛋白的研究
2017-01-09曹丽君程正军蒋晓慧
曹丽君,程正军,李 田,蒋晓慧
(西华师范大学 a.化学化工学院;b.四川省化学合成与污染控制重点实验室,四川 南充 637009)
基于光谱法的酸性红92结合牛血清白蛋白的研究
曹丽君,程正军,李 田,蒋晓慧
(西华师范大学 a.化学化工学院;b.四川省化学合成与污染控制重点实验室,四川 南充 637009)
通过荧光光谱、紫外-可见光谱(UV-vis)及傅里叶变换红外光谱法(FT-IR)研究牛血清白蛋白(BSA)与酸性红92(AR92)之间的相互作用。研究表明AR92对BSA的荧光猝灭为静态猝灭。位点标记实验证明AR92结合于BSA上的位点Ⅰ(子域ⅡA)。 热力学参数△G0<0,△H0<0,△S0>0暗示BSA与AR92间结合是以静电力为主要驱动力的自发放热过程。而且,还探讨不同盐浓度和乙醇对其结合作用的影响。此外,分析AR92诱导BSA的构象变化。
光谱法;牛血清白蛋白;酸性红92;荧光猝灭;构象变化
酸性红92(AR92,图1)是一种人造呫吨着色剂,它已被用在食品、药物和化妆品等领域[1]。 Qi等[2]研究发现,过量的AR92会诱导细胞坏死和引发炎症反应。 因此,研究AR92与蛋白质的相互作用具有重要意义。 血清白蛋白(SA)是循环系统中的主要可溶性蛋白成分,作为转运蛋白来转运药物、脂肪酸和末端氨基树枝状聚合物等多种物质[3]。 由于牛血清白蛋白(BSA)易于纯化和成本低,并且它与人血清白蛋白(HSA)有76%的相似性,因此,BSA已被广泛用作一个模型来评估蛋白质与有机小分子间的相互作用[4]。近年来,关于有机小分子与蛋白质相互作用的研究已成为化学生物界研究热点之一。 然而,AR92与BSA结合特性尚不明确。 故本文运用多光谱法探讨BSA和AR92间相互作用,该研究可能为AR92作为食品着色剂等方面提供有用信息。
1 实验部分
1.1 材料
牛血清白蛋白(BSA,纯度98%,Mr=68000)购自Ruibio公司,使用时未纯化。 BSA溶液用0.05 M磷酸盐缓冲液(pH=7.4)配制。 AR92购自麦克林生物化学有限公司(中国,上海)。 其它化学品均为分析纯。 所有溶液均在4 ℃下储存,整个实验使用的水均为二次蒸馏水。
1.2 方法
所有荧光光谱均用配有恒温槽的Cary Eclipse型荧光分光光度计(美国,瓦里安)进行测定。 BSA的浓度为2.0 μM,AR92的浓度从0增加到1.94 μM。 激发和发射狭缝宽均为5 nm,激发波长280 nm,波长范围300~500 nm。 所有荧光滴定实验均用50 μL手动微量注射器完成。
在存在和不存在盐(0.30、0.60、0.90 M)或乙醇(5%和10%,V/V)的磷酸盐缓冲液(0.05 M,pH=7.4)中进行盐和乙醇对BSA与AR92相互作用影响的荧光滴定实验。
同步荧光光谱激发和发射波长的间隔Δλ分别为15 nm和60 nm,波长范围均为250~350 nm。 其它扫描参数与以上荧光滴定实验相同。
采用荧光滴定法研究AR92与BSA结合的位点竞争实验,即在3种位点标记物保泰松(phenylbutazone,PB)、氟芬那酸(flufenamic,FA) 和洋地黄毒苷(digitoxin,DIG)的存在下探讨它们间的相互作用。 BSA和位点标记物的浓度均为2.0 μM(pH 7.4)。
所有UV-vis吸收和FT-IR光谱分别通过UV-3600分光光度计(日本,岛津)和Nicolet-6700 FT-IR光谱仪测定。
2 结果与讨论
2.1 AR92与BSA间相互作用
2.1.1 荧光猝灭机制
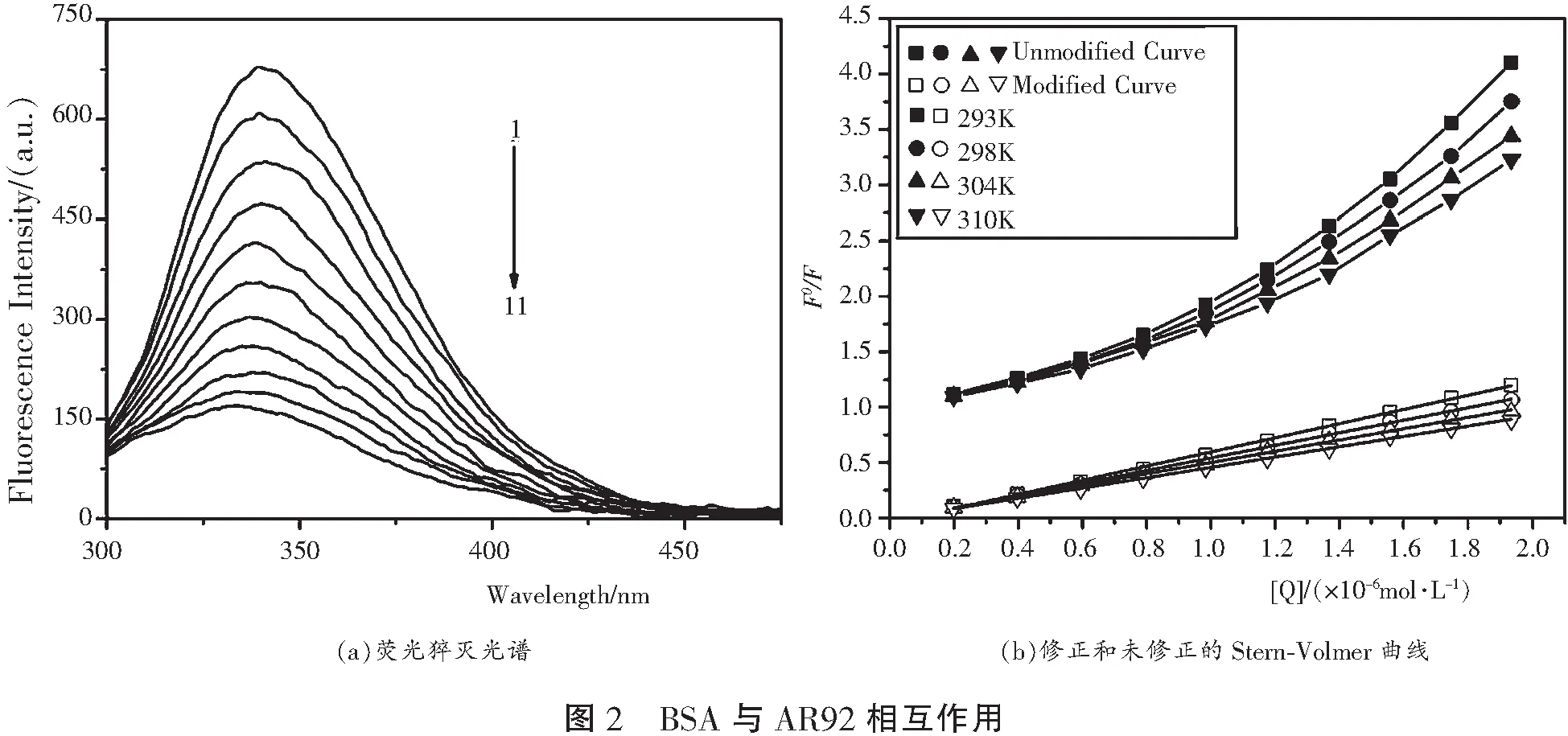
BSA与AR92的结合荧光猝灭图谱见图2(a)。 图2(a)显示,BSA的荧光强度随AR92浓度的增加逐渐下降,且最大发射波长有轻微蓝移,表明AR92与BSA发生相互作用,从而导致BSA中色氨酸残基周围微环境发生变化。
AR92与BSA相互作用所产生的内滤效应不能忽略。 为了消除内滤效应带来的影响,需对所有荧光强度进行校正,校正系数η由下式[5]计算:
(1)
其中,Ax0和Ay0分别表示荧光团的吸光度,Axi=Ax0+△Axi和Ayi=Ay0+△Ayi分别是荧光团和猝灭剂(△Axi和△Ayi)在激发和发射波长的总吸光度。 校正的Stern-Volmer方程如下:
(2)
式中,测得荧光比(F0/F)m乘以校正系数η得到校正的荧光比F0/F;F0和F分别是未加入和加入AR92后BSA的荧光强度;KSV为Stern-Volmer猝灭常数;Kq为双分子猝灭速率常数;τ0是不存在AR92时BSA荧光团的平均寿命,通常对于大多数荧光蛋白分子τ0为10-8s;[Q]为AR92的浓度。 荧光猝灭通常分为动态猝灭和静态猝灭,动态猝灭或碰撞猝灭是激发态荧光分子与猝灭剂碰撞引起的荧光猝灭,而基态荧光分子与猝灭剂结合形成复合物猝灭荧光的现象称为静态猝灭。 若F0/F对[Q]的Stern-Volmer曲线显示出良好的线性关系,通常暗示该荧光猝灭为动态或静态猝灭。 然而,Stern-Volmer曲线显示出正偏差(图2(b)),这表明BSA与AR92的结合可能是动态和静态联合猝灭机制。
若该结合过程是一个联合猝灭,那么它们对应的荧光数据可用下式分析[6]:
F0/F=(1+KD[Q])(1+KS[Q]),
(3)
F0/F=1+Kapp[Q],
(4)
Kapp=[F0/F-1]/[Q]=(KD+KS)+KDKS[Q],
(5)
其中,Kapp是表观猝灭常数;KD和KS分别是动态和静态猝灭常数, 它们的值由Kapp对[Q]线性拟合的 截距和斜率来计算。 结果发现BSA-AR92体系的KD和KS值均为虚数(分别为0.2119+1.4343i和0.2119-1.4343i),表明该作用过程不可能是联合猝灭机制。 故该荧光数据可以用改进的Stern-Volmer等式进行处理:
(6)
式中V是静态猝灭常数。 相应的参数列于表1。 从表1可知,BSA-AR92体系的KSV值与温度呈负相关,且它们的Kq值均大于猝灭剂与生物分子的最大散射碰撞猝灭常数(2.0×1010L·mol-1·s-1),表明BSA与AR92间相互作用导致的荧光猝灭不是动态猝灭,而是静态猝灭[7]。
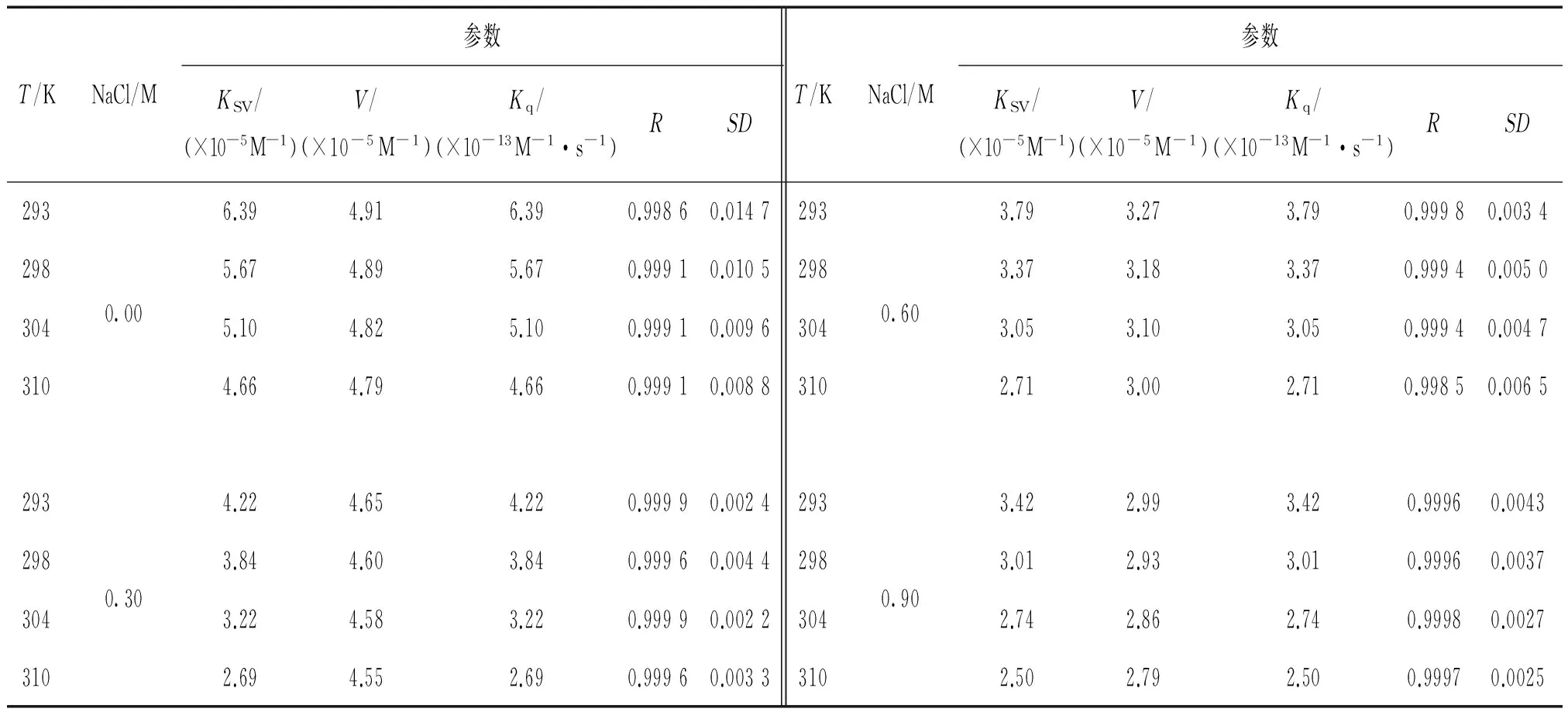
表1 BSA-AR92体系的Stern-Volmer参数
注:R和SD分别是S-V曲线的相关系数和标准偏差。
2.1.2 结合常数和结合位点数
结合常数K和结合位点数n由下式计算:
(7)
对应的值列于表2。BSA-AR92体系的结合常数K值随温度升高而减小,这表明随温度的升高,BSA与AR92间结合作用减弱。 它们间的结合位点数n值近似等于1,表明AR92与BSA间的相互作用存在一个结合位点。

表2 BSA-AR92体系结合常数K、结合位点n和热力学参数

续表2
注:Ra和Rb分别是K值和Van’tHoff曲线的相关系数。
2.1.3 位点标记物竞争实验
为了确定BSA与AR92间的精确绑定位点,我们进行位点竞争实验。BSA是由585个氨基酸残基组成的单一多肽链,具有三个同源α-螺旋结构域(Ⅰ-Ⅲ),每个域包含两个子域(A和B)。它含两个具有固有荧光的色氨酸残基,即Trp134和Trp212,分别位于子域ⅠB的表面和子域ⅡA的疏水结合腔。BSA的内源性和外源性配体主要结合于蛋白质的子域ⅡA或ⅢA的疏水腔。 许多配位体可以与BSA结合,如保泰松(phenylbutazone,PB)和华法林(warfarin,WF)结合于位点Ⅰ,布洛芬(ibuprofen,IP)和氟芬那酸(flufenamic,FA) 结合于位点Ⅱ,洋地黄毒苷(digitoxin,DIG) 结合于位点Ⅲ[8]。 本研究采用DIG、FA和PB三种特定部位探针进行位点竞争实验。
它们的荧光数据由式(7)进行分析,对应的K值列于表3。 显然,DIG-BSA-AR92和FA-BSA-AR92的K值与BSA-AR92的K值相比几乎没有变化,然而,PB-BSA-AR92的K值远小于BSA-AR92的K值。因此,AR92最可能结合BSA的位点I处,即BSA子域IIA中的Trp-212。

表3 存在和不存在位点标记物、不同浓度乙醇时对BSA-AR92体系的结合常数K
2.1.4 驱动结合力
热力学参数ΔG0<0、ΔH0<0和ΔS0>0(表2),表明AR92与BSA主要通过静电力结合[9],且是放热自发反应。
2.2 盐和乙醇对BSA与AR92结合作用的影响
2.2.1NaCl的影响
为进一步证实AR92与BSA间通过静电力相互作用,我们考察不同浓度NaCl对BSA-AR92体系的影响。 离子强度的增加容易对静电引力产生影响,而不易对疏水相互作用产生影响[10]。 图3列出不同浓度盐存在下BSA校正后的Stern-Volmer图,相关参数列于表1和表2。 结合常数随NaCl浓度增加而显著减小,表明AR92对BSA的猝灭程度明显降低,进一步说明较高盐浓度可能减弱HSA对AR92的吸收进而降低其对人体的危害。 此外,Bolel等[11]发现,离子强度对BSA的动态猝灭程度几乎没有任何影响,而对其静态猝灭程度影响显著。 结合本研究中盐对BSA-AR92体系荧光猝灭的影响可推断,BSA与AR92的结合模式不是动态猝灭。
2.2.2 乙醇的影响

乙醇对外源分子在子域IIA的结合有影响,从而导致其周围微环境发生变化[12]。 我们进行不同乙醇含量的荧光猝灭实验来进一步确认BSA与AR92的结合位点,对应的参数列于表3。BSA与AR92的结合常数K值随乙醇含量的升高而明显降低,再次表明AR92结合于BSA的子域IIA。
2.3 AR92诱导BSA构象变化的研究
2.3.1 紫外-可见吸收光谱
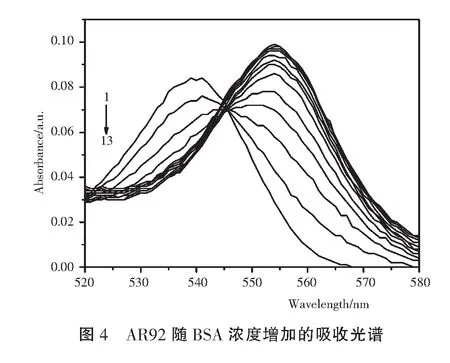
UV-Vis是研究小分子与蛋白相互作用,探讨复合物形成和蛋白构象变化的简便有效的工具,蛋白质分子的构象变化会影响生色氨基酸残基的微环境,进而使生色团的吸收光谱发生改变[13]。 图4显示AR92在540nm附近有强吸收带,在AR92中加入BSA,540nm处的峰值逐渐减小后上升并伴随红移,这表明BSA和AR92之间形成复合物,导致BSA的构象变化。
2.3.2 同步荧光光谱
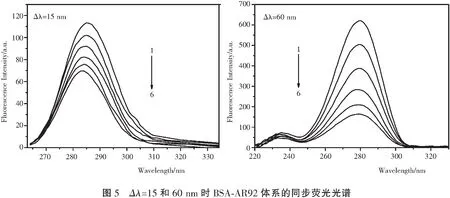
同步荧光光谱通过检测光谱最大发射波长的移动来提供有关蛋白质分子中发色团(如色氨酸和酪氨酸残基)附近微环境的信息[14],进而说明AR92对BSA构象的影响。 它涉及荧光激发和发射单色器的同时扫描,它们之间保持恒定的波长间隔(Δλ)。 当激发和发射波长的间隔Δλ=15nm时,光谱反映的是酪氨酸残基的荧光特性;Δλ=60nm时,光谱反映的是色氨酸残基的荧光特性。BSA随AR92加入时的同步荧光光谱示于图5。 观察到Δλ=15nm和Δλ=60nm时的最大荧光发射波长均发生微弱蓝移,表明BSA的微环境在AR92存在下发生轻微变化。 此外可以明显看出,BSA-AR92体系在Δλ=60nm的猝灭程度强于Δλ=15nm,这表明,与酪氨酸残基相比,色氨酸残基对固有荧光的猝灭贡献更多,即结合位点主要集中在BSA的色氨酸部分。
2.3.3 傅里叶变换红外光谱

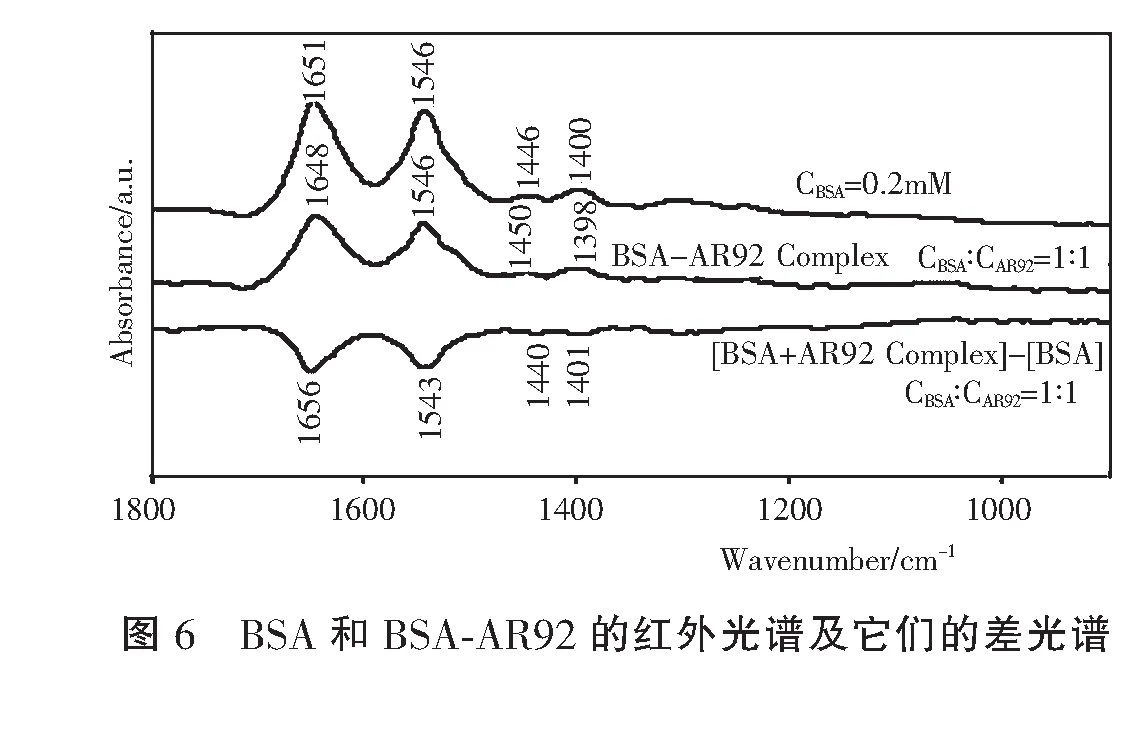
3 结 论
在四个不同温度、三种盐浓度及不同乙醇含量下,采用多光谱技术分别研究BSA与AR92间相互作用。荧光猝灭数据及修正后的S-V图表明BSA与AR92间通过静态猝灭结合。 结合位点数近似等于1、乙醇影响的研究及位点标记物实验结果均证实AR92与BSA子域IIA中的Trp-212相结合。 热力学和盐影响的结果表明BSA与AR92间的结合力主要为静电力。 此外,UV-vis、同步荧光和FT-IR证实AR92与BSA的结合导致BSA的构象发生变化。 这些结果可能为实际应用中设计食品色素配比提供一定的参考价值。
[1] ZHAI H Y,SU Z H,CHEN Z G,et al.Molecularly imprinted coated graphene oxide solid-phase extractio monolithic capillary column for selective extraction and sensitive determination of phloxine B in coffee bean[J].Analytica Chimica Acta,2015,865:16-21.
[2] QI H,TAKANO H,KATO Y,et al.Hydogen peroxide-dependent photocytotoxicity by phloxine B,A xanthene-type food colorant [J].Biochimicaet Biophysica Acta,2011,1810:704-712.
[3] LIU R,CHENG Z J,LI T,et al.Investigation of two blood proteins binding to cantharidin and norcantharidin by multispectroscopic and chemometrics methods [J].Journal of Luminescence,2015,157:398-410.
[4] 李 田,程正军,曹丽君,等.两种食品防腐剂与牛血清白蛋白相互作用[J].西华师范大学学报(自然科学版),2015,30(4):366-373.
[5] BORISSEVITCH I E.More about the inner filter effect:corrections of stern-volmer fluorescence quenching constants are necessary at very low optical absorption of the quencher[J].Journal of Luminescence,1999,81:219-224.
[6] DOBREVA M A,GREEN R J,MUELLER-HARVEY I,et al.Size and molecular flexibility affect the binding of ellagitannins to bovine serum albumin[J].Journal of Agricultural and Food Chemistry,2014,62:9186-9194.
[7] 胡 松,曾 霓,刘英英,等.光谱学技术研究食品着色剂柠檬黄与牛血清白蛋白的结合性质[J].南昌大学学报(工科版),2015,37(7):240-245.
[8] CHENG Z J,LIU R,JIANG X H.Spectroscopic studies on the interaction between tetrandrine and two serumalbumins by chemometrics methods[J].SpectrochimicaActa Part A:Molecular and Biomolecular Spectroscopy,2013,115:92-105.
[9] TIAN Z Y,ZANG F L,LUO W,et al.Spectroscopic study on the interaction between mononaphthalimide spermidine (MINS) and bovine serum albumin(BSA)[J].Journal of Photochemistry and Photobiology B:Biology,2015,142:103-109.
[10] LIANG J,CHENG Y P,HAN H Y.Study on the interaction between bovine serum albumin and cdte quantum dots with spectroscopic techniques[J].Journal of Molecular Structure,2008,892:116-120.
[11] BOLEL P,DATTA S,MAHAPATRA N,et al.Spectroscopic investigation of the effect of salt on binding of tartrazine with two homologous serum albumins:quantification by use of the debye hu ckel limiting Law and observation of enthalpy entropy compensation[J].The Journal of Physical Chemistry B,2012,116:10195-10204.
[12] DATTA S,MAHAPATRA N,HALDER M.pH-insensitive electrostatic interaction of carmoisine with two serum proteins:a Possible caution on its uses in food and pharmaceutical industry[J].Journal of Photochemistry and Photobiology B:Biology,2013,124:50-62.
[13] 马亚娣.几种食品添加剂与蛋白质、DNA相互作用的研究[D].江西:南昌大学,2013.
[14] BI S Y,PANG B,WANG T J,et al.Investigation on the interactions of clenbuterol to bovine serum albuminand lysozyme by molecular fluorescence technique[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,120:456-461.
[15] WANG Y X,LI L,SHENG L J,et al.Spectroscopic study on the inherent binding Information of cationic perfluorinated surfactant with bovine serum albumin[J].Journal of Fluorine Chemistry 2011,132:489-494.
Study on the Mechanism of Acid Red 92 Binding with Bovine Serum Albumin by Spectroscopic Techniques
CAO Lijun, CHENG Zhengjun, LI Tian, JIANG Xiaohui
(a.College of Chemistry and Chemical Engineering,b.Key Laboratory of Chemical Synthesis and Pollution Control of Sichuan Province,China West Normal University,Nanchong Sichuan 637009,China)
The interaction of Acid Red 92 (AR92) with Bovine Serum Albumin (BSA) was investigated via fluorescence,UV-vis and FT-IR spectra.The results showed that the interaction between BSA and AR92 belongs to a static quenching.The binding constant K and the binding-site number n were also calculated.The site marker competition experiments confirmed that AR92 binds to siteⅠ (subdomainⅡA) on BSA.The thermodynamic parametersΔG0<0,ΔH0<0,ΔS0>0 demonstrate that the main driving force of BSA and AR92 interacting with each other spontaneously is static electricity.The influences of salt and alcohol in different concentrations on their binding were studied.Furthermore,AR92-induced conformational changes of BSA were also analyzed.
spectroscopic technique;bovine serum albumin;acid red 92;fluorescence quenching;conformational change
1673-5072(2016)04-0396-07
2015-12-20
四川省教育厅重点项目(12ZA171)
曹丽君(1989—),女,河南许昌人,硕士研究生,主要从事食品分析方面研究。
程正军(1973—),男,陕西镇安人,副教授,主要从事食品和药物分析方面研究。E-mail:ncczj1112@126.com
O65
A
10.16246/j.issn.1673-5072.2016.04.007
