股四头肌创伤性骨化性肌炎的动物模型建立
2017-01-08李亚国邢崇慧唐涛李治刘颖肖壮李连娥李晓云
李亚国 邢崇慧 唐涛 李治 刘颖 肖壮 李连娥 李晓云
1云南省第一人民医院(昆明理工大学附属医院)(云南昆明 650032)
2云南省体育运动创伤专科医院运动医学科
3昆明理工大学医学院
4云南省普洱市中医医院骨伤科(云南普洱 655000)
创伤性骨化性肌炎(traumatic myositis ossificans,TMO)为继发于各类损伤,骨质结构于肌肉、结缔组织内异位生长造成肌肉硬化、关节活动障碍的一种疾病[1]。国内外对创伤性骨化性肌炎虽然已经进行了较多研究报道,但是大多集中在以骨折、手术、关节脱位后导致的TMO研究为主[2],对单纯肌肉损伤后导致的骨化性肌炎研究较少。肌肉损伤是临床中创伤性骨化性肌炎的重要发病原因之一,尤其是反复的运动性肌肉挫伤后形成的创伤性骨化性肌炎会导致严重关节活动障碍,这对优秀运动员的职业生涯影响是致命的[3]。而单纯肌肉损伤常不伴有骨折及脱位情况,容易被人们所忽视。因此加强对单纯肌肉损伤导致的TMO的认识和防治研究非常必要。
建立稳定可靠的动物模型是开展医学基础与临床研究的重要条件。目前仍缺少针对单纯肌肉损伤导致的创伤性骨化性肌炎动物模型。因此我们设想以反复击打动物股四头肌并量化击打力量的方法模拟运动员股四头肌反复损伤机制,建立TMO模型,填补单纯肌肉损伤导致的TMO模型空白。现将实验结果报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
健康级成年新西兰大白兔9只,雄性,体重1.5~2 kg(四川达硕实验动物有限公司提供)。适应性饲养1周后开始实验,实验室温度为20±2℃,相对湿度为70%±5%(昆明理工大学医学院动物房)。
1.1.2 主要试剂及仪器
伊红-苏木精染色剂(hematoxylin-eosin,HE),4%多聚甲醛(paraformaldehyde,PFA),包埋机,光学显微镜(日本OLYMPUS公司),病理切片机(KD-2850,北京佳源兴业科技有限公司),Definition双源CT机(德国西门子公司,云南省第一人民医院)。
1.2 TMO模型制作方法
实验前,用6%硫化钠脱毛剂除去后腿毛。自制钢球以自由落体的方式击打左后肢(模型组)股四头肌肌腹中段(图1A),造成股四头肌肌肉严重挫伤。具体制模过程:首先固定兔子于固定板(仰卧位),将长100 cm、直径3.2 cm、内壁光滑的硬塑料管下口对准左后肢股四头肌中部(膝关节伸直位髌骨上方10 cm处为中心),250 g钢球置于塑料管中,高度100 cm,断电后钢球自由落下,连续打击3次(图1B)。钢球投放均由同一人操作,确保钢球高度和打击位置一致。打击后检查,如有骨折或局部皮肤破损者予以剔除。用U形石膏伸直位固定左膝关节,并露出股四头肌中段以利于多次击打(图1A)。右后肢(对照组)仅伸直位固定(不击打)膝关节。模型组每3天以相同的方式击打股四头肌1次,第4周后停止击打。

图1 模型制作示意图
1.3 实验指标测定
1.3.1 肿胀度测定
以伸直位膝关节髌骨上10 cm为中心,每周用软尺环绕大腿一周,尽量收紧,读取周长,计算自体左后肢(模型组)和右后肢(对照组)周长差(单位:cm),并进行统计分析。
1.3.2 局部影像学检查
于第4、6、8周,分别对兔双后肢(模型组和对照组)行Definition双源CT检查,并对骨化程度进行评级评分。分级方法:0级(未出现骨化病灶);1级(低密度骨化影,呈云雾状);2级(较高密度骨化,边界不清);3级(高密度骨化,边界清晰)。评分标准:0级为1分,1级为2分,2级为3分,3级为4分,评分越高,骨化程度越高。由三位具有副高以上职称的放射科专科医师对影像学显示的骨化程度进行评定,并对模型组和对照组评分进行比较。
1.3.3 肉眼观察
于第4、6、8周时,用空气栓塞法(注射器穿刺心脏)分别处死动物(n=3);取其股四头肌僵硬处(反复击打处),肉眼观察横切面组织形态学改变情况,包括颜色、质地、粗细、钙化程度等。
1.3.4 病理组织学检查
分别于第4、6、8周,取处死的动物左后肢(模型组,n=3)股四头肌击打部位及右后肢(对照组,n=3)相同部位组织,置入4%PFA液中固定24小时(4℃),冲洗干净固定液后,用20%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)脱钙液脱钙4周,经针刺检查标本完全脱钙后,流水冲洗多余脱钙液,随后酒精梯度脱水、二甲苯透明、石蜡包埋、切片(4~5 μm)、60℃烤片、脱蜡、HE染色、封片备查。显微镜下观察细胞核呈蓝色,细胞浆呈粉红色或红色。
1.4 统计学分析
采用SPSS17.0统计软件分析实验结果,数据以均数±标准差表示,计算模型组和对照组的肿胀度差平均值、CT骨化评分,配对t检验比较模型组和对照组是否有差异,P<0.05为具有统计学意义。
2 结果
2.1 局部体征
钢球击打后,检查左后肢股四头肌(模型组),未出现皮肤破损及骨折情况,受击打处皮下出现瘀紫,肿胀;固定2周后,肿胀处逐渐变硬,膝关节强直,伸屈功能明显障碍,活动受限;4周后停止击打,肿胀逐渐减轻,肿块质地变硬,膝关节完全不能弯曲;8周后肌肉肿胀消除,肌肉硬块硬度增大,膝关节完全僵直。右后肢(对照组)股四头肌稍萎缩,关节伸屈功能受限,局部未触及硬块。
2.2 股四头肌肿胀度变化
实验开始后模型组和对照组周径差持续上升,3周时达到峰值,模型组(14.50±0.17 cm,n=9)高于对照组(10.78±0.16 cm,n=9),两组周径比较具有统计学意义(P<0.05);前4周模型组周径持续在较高水平,停止击打后周径逐步降低,仍高于对照组。对照组第1周(10.99 ± 0.21 cm,n=9)到第8周(9.97 ± 0.16 cm,n=3)周径略微减少(表1)。

表1 股四头肌周径变化
2.3 肉眼和病理组织学观察
肉眼观察:对照组肌肉纤维排列正常,无出血点,肌间膜无增生肥厚;模型组肌肉僵硬,肌纤维紊乱,肌间出血,肌间膜明显增粗、硬化、肌肉间见白色钙化点(图2)。
病理组织学观察:第4周,模型组肌纤维束增生明显,肌细胞排列紊乱,肌肉组织间有结缔修复组织形成(图2.A1);对照组肌间隙内无出血,肌纤维无坏死,肌细胞排列整齐(图2.A2)。第6周时,模型组肌肉间形成类骨组织和类软骨组织,见个别骨细胞形成(图2.B1);对照组肌肉组织正常排列,未见骨细胞及类骨组织形成(图2.B2)。第8周时,模型组肌束间增生异位骨化明显,见骨小梁、骨细胞、骨基质呈不规则分布,并见纤维性成骨的移行区(图2.C1);对照组肌肉纤维排列整齐,未见骨组织及类软骨组织出现,无骨化性肌炎形成(图2.C2)。
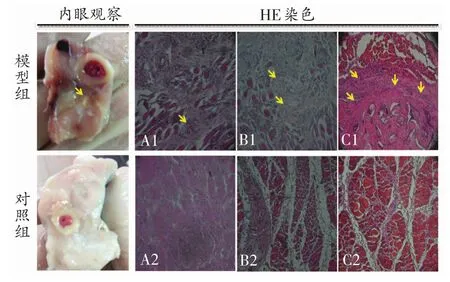
图2 肉眼和组织学观察(×100)
2.4 影像学检测
9只新西兰大白兔全部行Definition双源CT检查,CT显示在左后肢股四头肌反复击打部位出现骨化影(图3)。骨化评分见图4。模型组(左后肢)4周时(n=9),出现局部模糊骨化影,骨化病灶密度低,呈云雾状(图3.A),其中:5只一级骨化,3只二级骨化,1只未骨化,CT骨化评分模型组(2.22±0.67,n=9)高于对照组(1,n=9);6周时,模型组(左后肢,n=6)骨化逐渐明显,骨化病灶密度较高,边界不清(图3.B),4只达到二级骨化,2只一级骨化,CT骨化评分模型组(2.66±0.52,n=6)高于对照组(1,n=6);8周时,模型组(左后肢,n=3)完全骨化,骨化病灶密度高,边界清晰(图3.C),3只均达到三级骨化,骨化评分均为4分。对照组(右后肢,n=3)未见骨化现象。实验中,模型组在不同时间段的影像学检查都出现相应的骨化现象。

图3 CT影像

图4 CT骨化评分
3 讨论
TMO是机体损伤后常见的一种临床并发症,常继发于全关节置换术(total joint replacement,TJR)、骨折、枪伤、肌肉损伤等[4-6]。尤其继发于手术后及反复关节脱位的TMO研究报道较多;而针对反复运动性肌肉损伤引起的TMO研究报道相对匮乏,特别是稳定的反复肌肉损伤导致的TMO模型研究几乎是空白。
建立良好的、稳定的、可量化复制的TMO动物模型是认识TMO病理变化并进行防治研究的基础。目前国内外创伤性骨化性肌炎动物模型有通过中枢神经损伤诱导、创伤诱导、特殊转基因诱导、跟腱切断诱导、脱钙骨基质诱导(decalcified bone matrix,DBM)、骨形成蛋白(bone morphogenetic protein,BMP)诱导及特殊组织细胞诱导等方法[7]。如Rodenberg等[8]将含有BMP-2的骨基质移植在动物肌肉内,成功诱导出骨化性肌炎,但是复杂的操作过程及其成骨机理与临床TMO发病机制无相关性,没有被广泛应用。诸多的TMO动物模型建立以损伤关节的方式居多,如Michelsson等[9]报道暴力刺激和固定膝关节能诱导TMO形成;邓柏杰等[10]用固定与暴力按摩方式也成功建立了骨化性肌炎模型;而Walton等[11]重复用钝力作用于羊大腿诱导创伤性骨化性肌炎的方法仅取得17%的成功率。目前的肌肉损伤TMO造模方式存在不易操作、不能量化、复制不稳定、成功率低等缺点。因此建立一种稳定的单纯反复肌肉损伤TMO动物模型对认识肌肉反复损伤后病理变化和防治骨化性肌炎具有重要临床指导意义。
临床中约有9%~20%的股四头肌严重挫伤会并发TMO。如在对抗性球类运动尤其足球比赛中,运动员之间经常发生相互碰撞,膝部顶撞大腿部肌肉造成肌肉组织严重损伤经常发生,加上运动员受赛程的限制,在肌肉未完全修复的情况下连续比赛并多次受伤造成肌肉反复损伤出血,后期形成创伤性骨化性肌炎。目前外科手术切除是TMO的常用治疗方法,但这会给专业运动员造成严重的损害,甚至提前结束职业生涯[12]。基于上述理由,本实验模拟运动员在剧烈对抗运动中的肌肉受伤机理,选择人体最大的肌肉组织股四头肌作为实验研究对象,以钢球连续撞击动物股四头肌肌肉模拟运动员大腿肌肉相互碰撞,造成肌肉严重损伤,且以每3天击打1次的量,模拟运动员肌肉反复损伤,使实验的机制尽量贴近实际损伤情况。
为了提高实验成功率,同时避免骨折等因素对实验结果的影响,既能造成股四头肌严重损伤,又避免股骨骨折,我们在参考张雪非[13]等的研究(兔股骨冲击弯曲强度为1.08 N·cm/mm2、冲击破坏强度为1.86 N·cm/mm2、横向破坏载荷为131.2 N)基础上,通过反复试验并改进后,最终确定了撞击高度(100 cm)及钢球重量(250 g),击打过程中均未发生骨折及皮肤破损情况。为了尽量减少误差,我们保证同一高度、同一重量、同一人操作,尽量使损伤程度一致,并且对兔自体左右后肢进行对比,减少个体差异性的影响。
TMO的形成是一个成骨细胞增殖后逐渐钙化的过程。虽然对其形成机制仍不十分清楚,一般认为严重损伤或局部反复受损等原因造成血肿,持续血肿是引起骨化的原因之一[14-15]。我们的实验结果显示,反复撞击后股四头肌肿胀周径增大,同时结果显示肌肉损伤程度与骨化性肌炎的程度一致;肉眼观察可见肌纤维紊乱,肌间出血,随时间推移肌间膜逐渐增粗、硬化、甚至见白色钙化点;HE病理组织检查可见肌细胞排列紊乱,肌纤维束间增生,局部类软骨组织、骨小梁组织和异位骨化形成。CT影像学结果显示从局部模糊的云雾状影、低密度的骨化病灶形成,到边界清晰的高密度骨化病灶,直至完全骨化。以上结果均证实TMO的形成是个渐进的过程,本次实验结果与其他TMO模型结果一致[16]。
研究表明反复暴力损伤是建立创伤性骨化性肌炎模型的首要条件[17],反复出血形成的血肿机化钙化和肌肉损伤后局部炎症因子诱导间充质干细胞向成骨细胞转化可能是TMO的形成机制。本次实验成功建立肌肉反复损伤所致的创伤性骨化性肌炎模型。该方法简单可靠、复制性强,可应用于各类肌肉损伤导致的TMO相关临床及基础研究中。由于本次实验重点在造模,对模型的发病机制、防治研究等方面有欠缺,我们在后期的实验研究中会进一步研究。
4 结论
通过反复击打大白兔股四头肌,能在短期内获得稳定的创伤性骨化性肌炎(TMO)模型。
