糖皮质激素诱导大鼠原代培养杏仁核神经元的凋亡
2017-01-07许光明张晓静
许光明,张晓静,刘 艺,张 悦,文 迪,丛 斌
(河北医科大学 1.基础医学院法医学系,2. 临床诊断学教研室,河北 石家庄 050017)
糖皮质激素诱导大鼠原代培养杏仁核神经元的凋亡
许光明1,张晓静1,刘 艺1,张 悦2,文 迪1,丛 斌1
(河北医科大学 1.基础医学院法医学系,2. 临床诊断学教研室,河北 石家庄 050017)
目的 探讨糖皮质激素(GC)对大鼠杏仁核神经元凋亡的影响。方法 原代培养大鼠杏仁核神经元,首先采用免疫荧光技术对培养的原代神经元及其是否存在丰富的糖皮质激素受体分别进行了鉴定,并用流式细胞术检测不同浓度的人工合成糖皮质激素地塞米松(10-9~10-6mol·L-1)对杏仁核神经元细胞凋亡的影响。然后将实验分为4组:对照组(CON)、地塞米松(DEX)刺激组、地塞米松和米非司酮(受体抑制剂)共同刺激组(DEX+MIF)、米非司酮刺激组(MIF)。用TUNEL原位技术检测各组的凋亡情况,并用RT-PCR技术检测各组Bax mRNA的表达变化。结果 (1)与CON组相比,不同浓度的DEX作用于神经元后,神经元凋亡率明显升高(P<0.05),且呈浓度依赖性;(2)TUNEL染色结果显示, DEX组细胞凋亡率明显高于CON组(P<0.05),而与DEX组相比,DEX+ MIF组凋亡率明显降低(P<0.05),MIF组与CON组相比无明显差异(P>0.05);(3)与CON组相比,DEX组Bax mRNA的表达量明显升高(P<0.05),而与DEX组相比,DEX+ MIF组的Bax mRNA的表达量明显降低(P<0.05),MIF组与CON组相比无明显差异(P>0.05)。结论 糖皮质激素可以通过其受体诱导大鼠原代培养杏仁核神经元的凋亡。
应激;糖皮质激素;杏仁核;神经元;凋亡;原代培养
下丘脑-垂体-肾上腺皮质轴(hypothalamus-hypophysis-adrenal cortex axis, HPA)兴奋,外周血糖皮质激素(glucocorticoid, GC)分泌增多是应激主要的神经内分泌反应之一。近年来研究证实,GC浓度持续升高,不仅会抑制HPA轴,导致内分泌紊乱,并且能够透过血脑屏障,作用于中枢神经系统,造成神经元突起的萎缩、神经元可塑性降低、甚至死亡[1-4]。因此GC对中枢神经系统的损伤作用有可能是应激引起中枢神经系统功能障碍的重要机制之一。
杏仁核(amygdala)是边缘系统中最重要的核团之一,它的纤维联系和功能极其广泛,是调节情绪、控制恐惧记忆的神经中枢,在情感的形成和贮存方面起着至关重要的作用,对应激反应十分敏感。研究证实,杏仁核神经元凋亡与创伤后应激障碍等多种精神疾患密切相关。因此研究GC对杏仁核的损伤作用对于揭示心理应激引起精神损伤的机制具有重要科学意义。而目前GC是否可以引起杏仁核神经元凋亡尚不清楚。本研究旨在从细胞水平来探讨GC对原代培养大鼠杏仁核神经元凋亡的影响,为揭示应激对中枢神经系统的损伤作用机制提供基础依据。
1 材料与方法
1.1 动物 新生24 h内SD乳鼠,♀♂不限,由河北医科大学实验动物中心提供。
1.2 主要试剂 DMEM/F12培养基、Neurobasal培养基、B27培养基添加剂、胎牛血清,Hank’s液均购自美国Gibco公司;多聚赖氨酸、0.25%胰蛋白酶、0.05%胰蛋白酶、DNA酶均购自美国Sigma公司; 100×青/链霉素溶液购自奥地利PAA公司; 10×PBS、4%多聚甲醛溶液、抗荧光衰减封片剂和DEPC处理水均购自北京Solarbio有限公司;TRIzol、Plat SYBR Green qPCR SuperMix UDG购自美国Invitrogen公司; Revert Aid First cDNA Synthesis Kit购自美国Thermo公司;Eastep Super总RNA提取试剂盒购自上海Promega有限公司;地塞米松(dexamethasone, DEX)和米非司酮(mifepristone, MIF)购自上海梯希爱公司;抗体稀释液和山羊血清工作液购自北京中杉生物试剂有限公司;兔抗MAP2多克隆抗体购自美国Proteintech公司;兔抗GR多克隆抗体购自美国Affinity公司;TUNEL原位凋亡检测试剂盒购自美国Millipore公司;流式FITC-AnnexinV/PI试剂盒购自美国BD公司;其他生化试剂均为国产分析纯。所用引物由美国Invitrogen公司根据设计合成,见Tab 1。

Tab 1 Sequences for primers
1.3 主要方法
1.3.1 原代杏仁核神经元的培养 根据Colin、Beaudoin等[2,5,6]的文献报道,全程无菌操作,取新生24 h内的乳鼠,75%乙醇全身浸泡消毒3 min,于冰上迅速断头取脑;将脑组织置于预冷的DMEM培养液中,置冰上,解剖显微镜下分离双侧杏仁核,并剥除多余的血管膜、被膜等组织;用显微剪将收集的杏仁核组织剪成大约1 mm3的小块,移入15 mL离心管中;0.125%胰蛋白酶消化,37 ℃,15 min,期间震荡混匀2次;1 200 r·min-1,离心5 min;弃上清,用含10%血清的DMEM/F12完全培养基终止消化,重新悬浮沉淀;1 mL口径的吸管轻柔吹打成单细胞悬液;400目无菌尼龙筛网过滤;1 000 r·min-1,离心5min,并用DMEM/F12完全培养基重新悬浮沉淀吹打成单细胞悬液;细胞计数,按合适浓度接种于多聚赖氨酸包被的细胞培养板中;将培养板放入37℃、5% CO2培养箱内进行培养;3~5 h后,更换DMEM/F12完全培养基为Neurobasal+B27神经元培养液继续培养;3 d换液1次,神经元发育成熟后,用于后续实验。
1.3.2 神经元鉴定 杏仁核神经元培养至d 10,4%多聚甲醛固定20 min;0.2% TritonX-100室温静置15 min;滴加山羊血清工作液正常封闭非特异性结合位点,37℃孵育30 min;加兔抗MAP2(1 ∶200稀释)抗体,4℃过夜;37℃复温30 min后,用0.01 mol·L-1PBS低速摇床上清洗3次,每次5 min;滴加Dylight488标记的山羊抗兔IgG(1 ∶100稀释),37℃避光孵育1 h;抗荧光衰减封片剂封片,共聚焦显微镜下观察MAP2表达并采集图像。
1.3.3 GR检测杏仁核神经元 培养至d 10, 4%多聚甲醛固定20 min;0.2%TritonX-100室温静置15 min;滴加山羊血清工作液正常封闭非特异性结合位点,37℃孵育30 min;加兔抗GR(1 ∶100稀释)抗体,4℃过夜;37℃复温30 min后,用0.01 mol·L-1PBS低速摇床上清洗3次,每次5 min;滴加Dylight594标记的山羊抗兔IgG(1 ∶100稀释),37℃避光孵育1 h;DAPI复染,抗荧光衰减封片剂封片,激光共聚焦显微镜下观察GR表达并采集图像;
1.3.4 流式细胞术FITC-AnnexinV/PI检测细胞凋亡率 6孔板各孔细胞加入不同浓度的DEX(10-9~10-6mol·L-1)作用48 h,用0.05%的胰蛋白酶消化制备成单细胞悬液,各组均加入5 μL FITC标记的AnnexinV和5 μL PI,混匀后室温避光孵育15 min;加入1×Binding buffer补足至500 μL;立即上流式细胞仪检测各组的凋亡率。
1.3.5 实验分组 后续实验分为4组:(1)CON组:用神经元培养液正常培养;(2)DEX组:用10-6mol·L-1的DEX培养;(3)DEX+MIF组:用10-6mol·L-1的DEX和10-6mol·L-1的MIF共同培养;(4)MIF组:用10-6mol·L-1的MIF单独培养。各组加入的培养液量一致,均作用48 h。
1.3.6 TUNEL检测凋亡率 待药物作用48 h后,1%多聚甲醛室温固定10 min;浸洗后再用预冷的乙醇醋酸(2 ∶1配制)溶液于-20℃进行再固定5 min;然后滴加平衡液Equilibration Buffer,室温下反应;加TdT工作液,盖上塑料盖玻片,湿盒中37℃孵育1 h;放入终止液中,摇动15 s后室温放置10 min以终止反应;0.01 mol·L-1PBS低速摇床上清洗3次,每次2 min;滴加荧光抗体工作液,盖上塑料盖玻片,室温湿盒中避光孵育30 min;0.01 mol·L-1PBS低速摇床上清洗3次,每次2 min;DAPI复染,抗荧光衰减封片剂封片,激光共聚焦显微镜下观察染色结果(TUNEL阳性细胞标记为绿色,DAPI标记细胞核为蓝色)。每张切片随机选取5个高倍镜视野(×200),所采集的每幅图像都尽量包含相同的细胞数目,以阳性细胞百分数来表示凋亡率。
1.3.7 Real-time PCR检测BAX mRNA的表达 用Eastep Super总RNA提取试剂盒提取细胞总RNA,用NanoQ微型分光光度计检测仪测定总RNA含量及浓度,并根据定量结果调整RNA浓度为250 mg·L-1。按照Revert Aid First cDNA Synthesis Kit说明书进行反转录。总反应体积为20 μL,各成分为:Oligol(dT)18引物1 μL,RiboLockTM RNA酶抑制剂1 μL,RevertAidTM M-MuLV逆转录酶1 μL,10-2mol·L-1dNTP Mix 2 μL,5×Reaction Buffer 4 μL,RNA2 μL (500 ng),无核酶水9 μL。反应条件为:42℃ 60 min,70℃ 5 min,4℃ forever。得到cDNA后按照Plat SYBR Green qPCR SuperMix UDG试剂盒进行RT-PCR反应。总反应体积为20 μL,各成分为:SYBR Green qPCR SuperMix UDG 10 μL,Forward Primer(10-5mol·L-1)0.5 μL,Reward Primer(10-5mol·L-1)0.5 μL,cDNA 2 μL,无核酶水7 μL。扩增条件为:50℃ 2 min,95℃ 2 min;95℃ 15 s,60℃ 30 s,45个循环,以GAPDH作为内参基因,用△△Ct法分析基因的相对表达。
2 结果
2.1 杏仁核神经元原代培养结果 倒置显微镜下观察,刚接种的杏仁核神经元呈圆形,单个分布,体积较小,细胞透亮;培养4~6 h后,绝大部分神经元已经贴壁,并且个别神经元长出1~2个小的突起,见Fig 1A;培养至d 10时,神经元胞体变大变圆,立体感较强,突起也进一步延长,相互交织形成致密的网络结构,见Fig 1B。此时的神经元发育成熟,可用于后续实验研究。
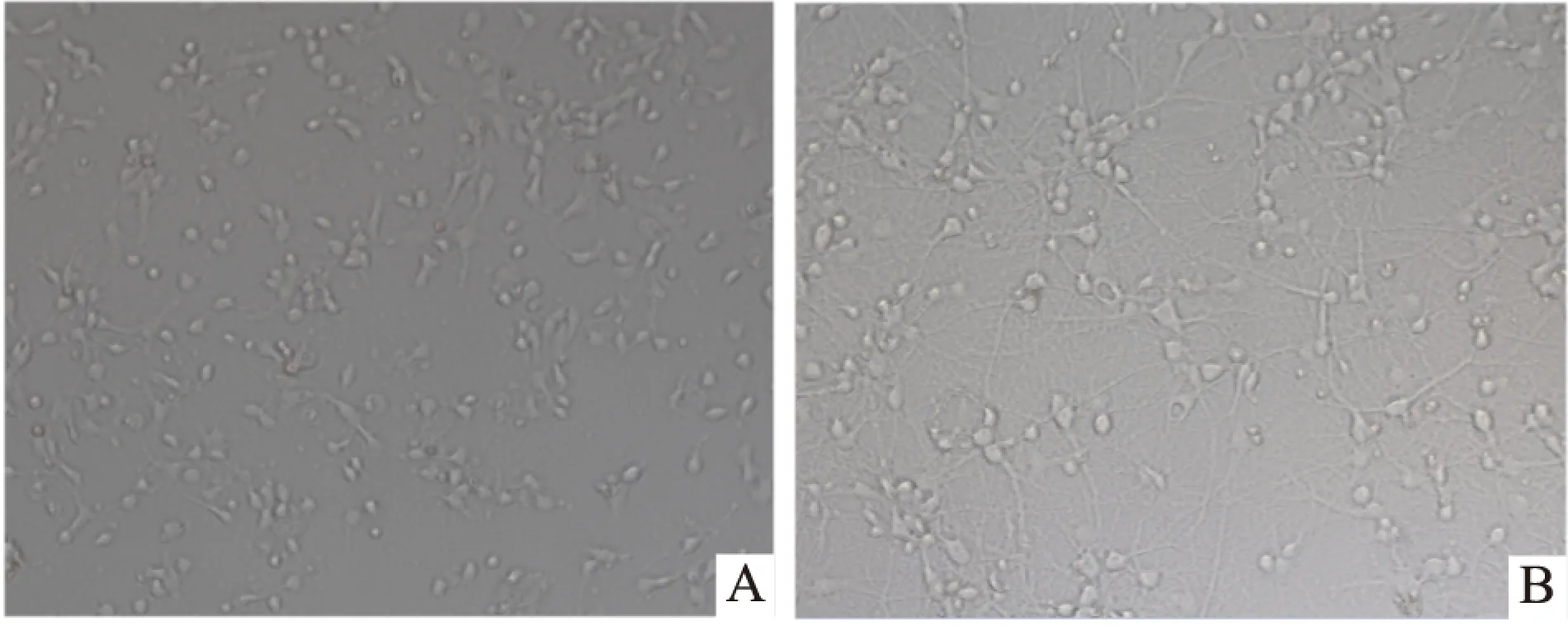
Fig 1 Morphological characteristics of primary cultured amygdaloid neurons
A:Primary cultured amygdaloid neurons on 2 d(×200).B: Primary cultured amygdaloid neurons on 8 d(×200)
2.2 原代培养的杏仁核神经元MAP-2免疫荧光鉴定 用神经元特异性标记物MAP-2多克隆抗体标记神经元,MAP-2阳性细胞胞质及突起呈绿色, DAPI标记的细胞核呈蓝色,神经元突起相互交织成网络。神经元纯度为MAP-2标记的神经元占DAPI标记的神经元总细胞数的比值,结果显示神经元细胞纯度>90%,见Fig 2。
2.3 原代培养的杏仁核神经元GC受体的表达 原代杏仁核神经元培养成熟后,用GR的抗体标记杏仁核神经元内的GR,GR阳性为细胞胞质呈现红色,DAPI标记的细胞核呈蓝色。激光共聚焦显微镜下显示,原代培养杏仁核神经元含有丰富的GR阳性表达,见Fig 3。
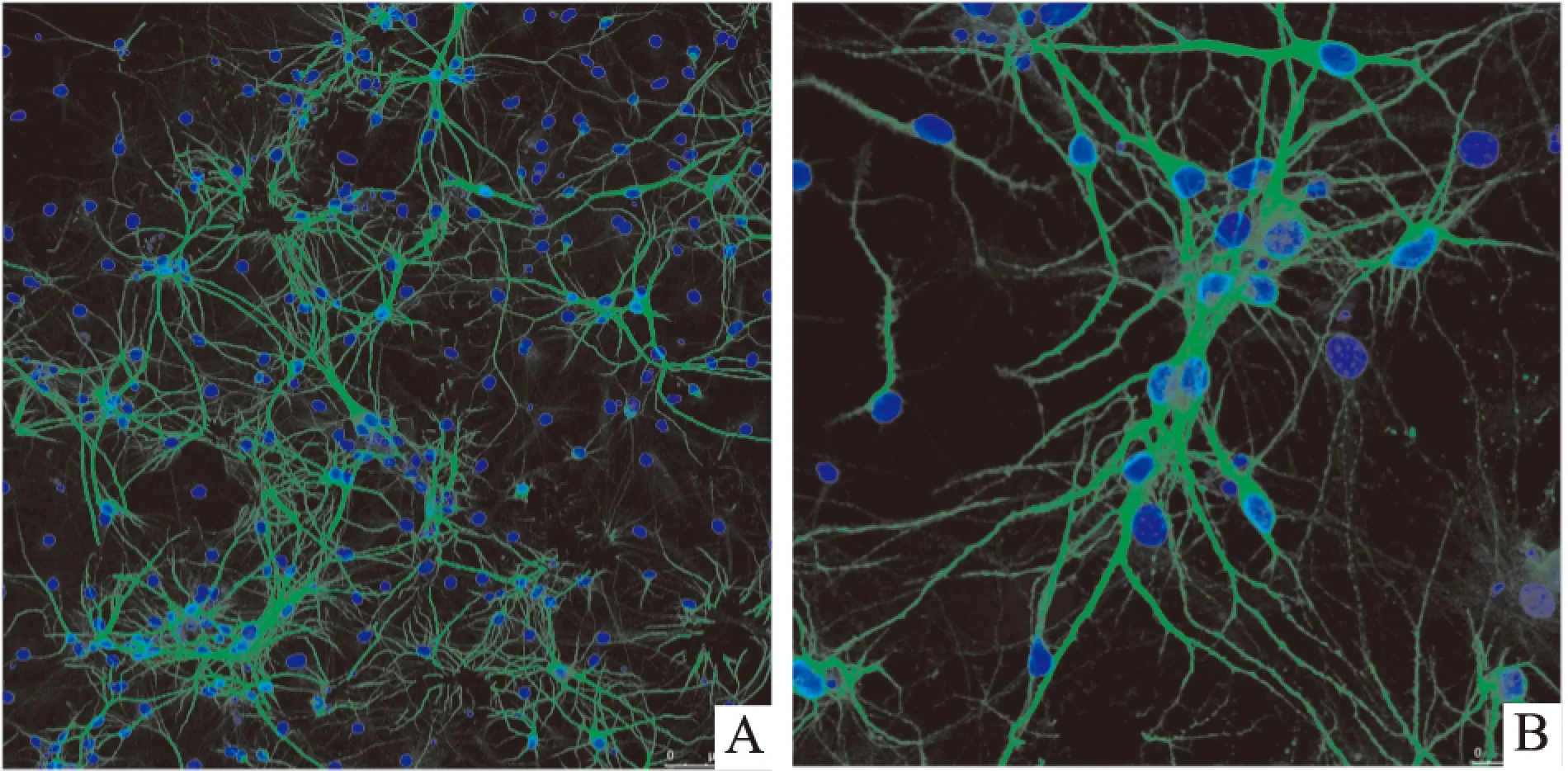
Fig 2 Neuron purity of rat primary cultured amygdaloid neurons
A:×200;B:×400. Immunofluorescence staining with anti-MAP2(green 1 ∶200),with blue fluorescent dyes DAPI(1.25 mg·L-1)used to stain DNA in nucleus. The percentage of amygdaloid neurons to the total cells was neuron purity. Results showed the purity in the present study was more than 90%
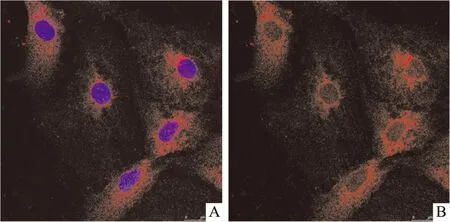
Fig 3 Expression of GC receptor in primary cultured amygdaloid neurons(×400)
A:Two fluorescence channels merge; B: Only one fluorescence channel. Immunofluorescence staining with anti-GR(red 1 ∶100),with blue fluorescent dyes DAPI(1.25 mg·L-1)used to stain DNA in nucleus.
2.4 不同浓度的GC对杏仁核神经元凋亡的影响 流式细胞术AnnexinV-FITC/PI双标法检测不同浓度的DEX(10-9~10-6mol·L-1)对杏仁核神经元细胞凋亡的影响。与CON组相比,10-8mol·L-1至10-6mol·L-1的DEX作用于杏仁核神经元48 h后,神经元凋亡率明显升高(P<0.05),且呈浓度依赖性;10-9mol·L-1组的凋亡率与CON组相比差异无显著性(P>0.05),见Fig 4、Tab 2。
Tab 2 Effect of different concentrations of DEX on apoptosis of amygdaloid ±s,n=3)
*P<0.05vscontrol,**P<0.01vscontrol
2.5 TUNEL检测神经元凋亡率 TUNEL染色可见,DEX组细胞凋亡率明显高于CON组(P<0.05)。而与DEX组相比,DEX+MIF组细胞凋亡率明显降低(P<0.05),MIF组与CON组相比差异无显著性(P>0.05),见Fig 5、Tab 3。
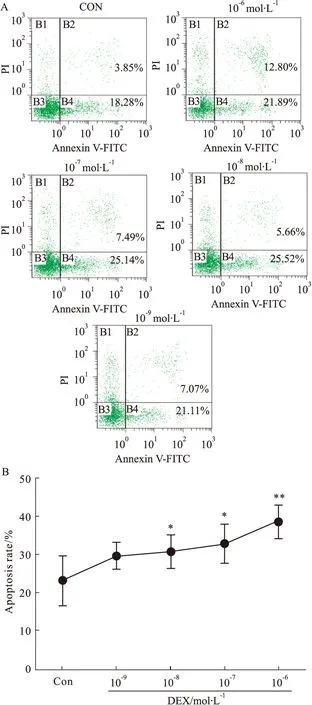
Fig 4 Effect of different concentrations of DEX on apoptosis of amygdaloid neurons
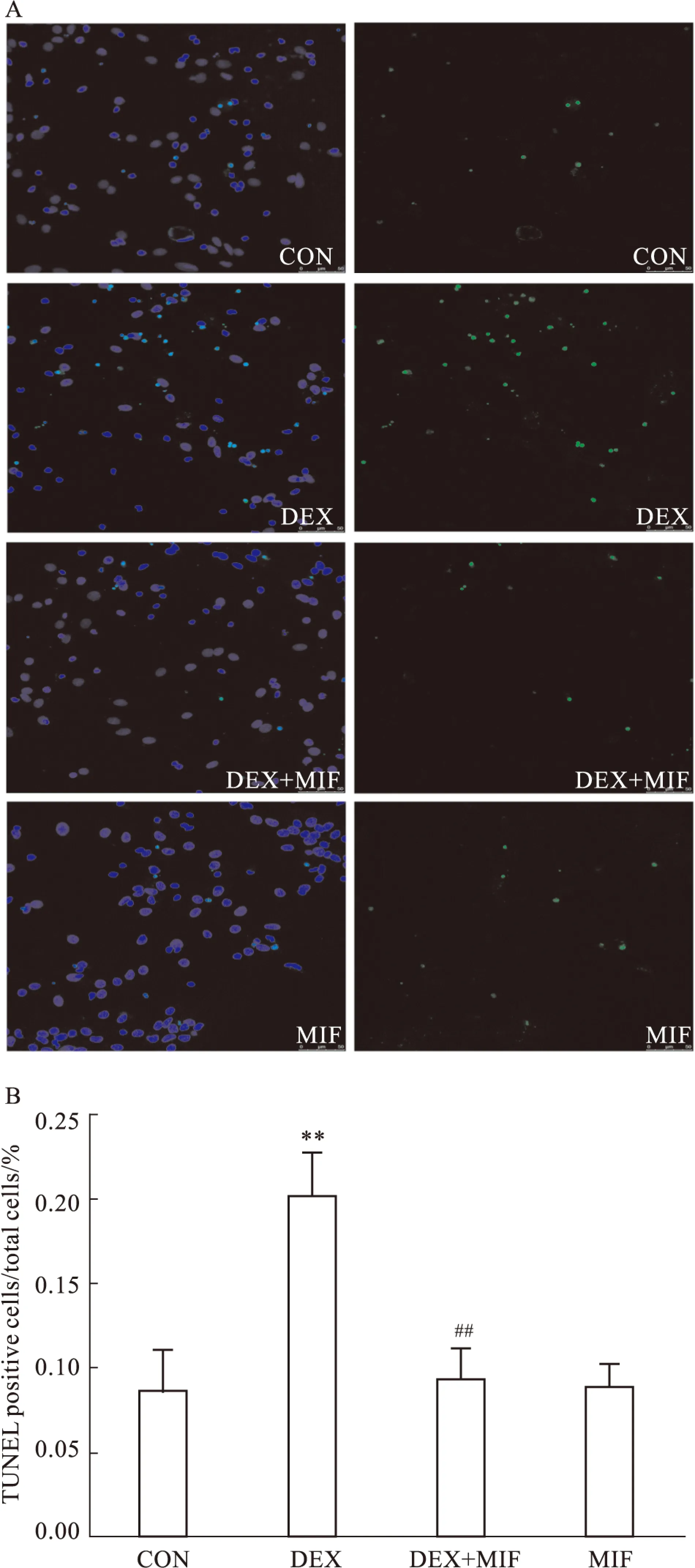
Fig 5 GR participated in GC-induced amygdaloid neuron apoptosis
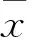
2.6 Real-time PCR检测Bax mRNA的表达 采用Real-time PCR技术检测促凋亡基因Bax mRNA的表达,结果可见,与CON组相比,DEX组BAX mRNA的表达量明显升高(P<0.05);而与DEX组相比,DEX+ MIF组的Bax mRNA的表达量明显降低(P<0.05),而MIF组与CON组相比差异无显著性(P>0.05),见Fig 6、Tab 4。
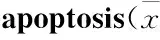
Tab 3 GR participated in GC-induced amygdaloid neuron ±s,n=7)
**P<0.01vscontrol.##P<0.01vsDEX treatment

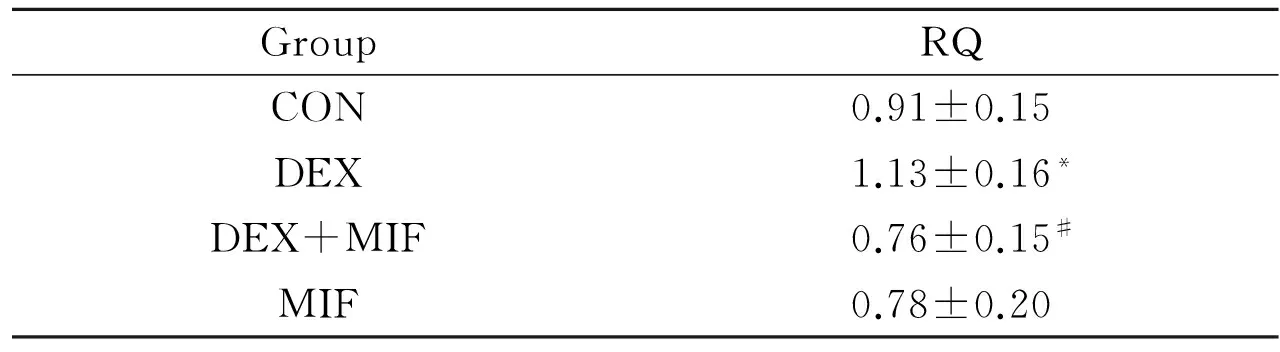
GroupRQCON0.91±0.15DEX1.13±0.16*DEX+MIF0.76±0.15#MIF0.78±0.20
*P<0.05vscontrol.#P<0.05vsDEX treatment
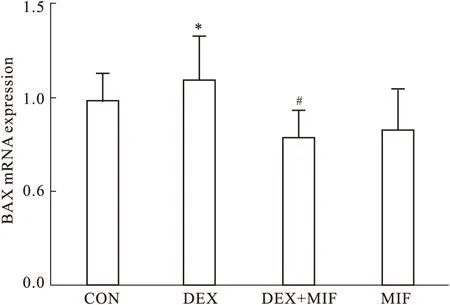
Fig 6 Effect of DEX on mRNA levels of Bax
3 讨论
杏仁核是边缘系统的重要组成部分,在结构上由13个核团组成,它们有着广泛的核团间和核团内的纤维联系。而其重要功能的发挥主要为3个核团:皮质内侧核团(MeA)、基底外侧核团(BLA)和杏仁核中央核(CeA)。其中BLA和CeA是负责恐惧学习和记忆的重要中枢,BLA进行感觉信息的传输与处理,CeA负责恐惧行为的表达[7]。杏仁核参与情绪、记忆的产生、识别以及调节,是控制恐惧记忆的神经中枢,在情感记忆的形成和贮存方面起重要作用,是调节HPA轴活性的高位中枢,对应激反应十分敏感并且容易遭受损伤,从而导致恐惧学习、记忆的缺失,情感记忆障碍。研究证实[8-9],杏仁核的变性和凋亡能够导致PTSD的发生;杏仁核的萎缩和退化能够加剧阿尔茨海默病的发生发展[10]。
有研究表明,束缚应激能够诱导大鼠海马神经元的凋亡,其机制与促肾上腺皮质激素释放激素(CRH)有关[11]。并且应激引起的GC升高能够引起大鼠海马、杏仁核及前皮质的结构发生改变[12]。这些研究均提示HPA轴相关激素对海马、杏仁核等情感脑区的损伤作用可能是应激引起精神损伤的机制之一。因此研究GC对杏仁核的损伤作用对于揭示应激引起的精神损伤机制具有重要科学意义。本研究为了模拟机体束缚应激时HPA轴紊乱,外周血GC水平增高的环境,在离体水平探讨了GC对原代培养杏仁核神经元凋亡的影响。
GC是通过糖皮质激素受体(GC receptor, GR)发挥生物学效应的,目前已知的受体主要包括α受体和变异片段的β受体两种亚型。而糖皮质激素主要是通过与α受体结合,发挥其生理及药理功能,α受体几乎在所有组织和有核细胞中均有表达,尤以神经元和神经胶质细胞分布居多,在绝大多数细胞中其含量远远超过β受体[13]。Morimoto等[14]研究发现,成年SD大鼠杏仁核脑区高表达GRα。本实验成功在体外进行了原代杏仁核神经元的培养,经MAP-2鉴定,神经元纯度>90%,并且采用免疫荧光技术用GRα多克隆抗体对原代培养的杏仁核神经元进行了标记,结果显示,原代杏仁核神经元高表达GRα,这与Morimoto等的研究结果一致。
本课题组在预实验中采用FITC-AnnexinV/PI流式双标染色检测了不同浓度的DEX对杏仁核神经元凋亡的影响,发现DEX作用后,杏仁核神经元会出现不同程度的凋亡。进一步采用TUNEL检测了DEX与MIF共同作用后对杏仁核神经元凋亡的影响,结果显示DEX作用于神经元后,细胞凋亡率明显高于对照组,而MIF作用后,细胞凋亡率明显降低。MIF是一种GR拮抗剂,它可抑制GC与其受体结合,使得GC无法发挥生物学效应[15]。该结果进一步证实了GC能够诱导原代培养杏仁核神经元的凋亡,而GR拮抗剂MIF能够有效的降低杏仁核神经元的凋亡,说明GC通过受体机制诱导杏仁核神经元凋亡。同时用Real-time PCR技术检测了促凋亡基因Bax mRNA的表达水平,结果显示DEX组神经元Bax mRNA的表达水平明显高于对照组,而DEX+MIF共同刺激组Bax mRNA的表达水平又比DEX组明显降低,这与TUNEL结果一致。
综上所述,本研究成功进行了大鼠杏仁核神经元的原代培养,在细胞水平观察了不同浓度的GC对杏仁核神经元凋亡的影响,并通过观察神经元病理学形态变化和Bax mRNA的表达水平的改变,证实 GC通过GC受体可以诱导原代培养杏仁核神经元的凋亡。这一发现为束缚应激致大鼠杏仁核神经元的损伤提供了理论依据,为正确评价GC在应激反应中的作用以及应激所致精神损伤的早期诊断和治疗提供了一定的科学依据。而GC通过GR诱导杏仁核神经元凋亡的具体分子机制有待进一步研究。
(致谢:本实验所有研究内容均在河北医科大学基础医学院法医学系实验室完成,参与人员有许光明、张晓静、刘艺,感谢丛斌教授在课题设计和实验思路中给予的悉心指导,感谢在实验中给予帮助的张晓静老师、张悦老师、文迪老师。)
[1] Park H J, Lee S, Jung J W, et al. Glucocorticoid- and long-term stress-induced aberrant synaptic plasticity are mediated by activation of the glucocorticoid receptor[J].ArchPharmRes, 2015,38(6):1204-12.
[2] Hay C W, Shanley L, Davidson S, et al. Functional effects of polymorphisms on glucocorticoid receptor modulation of human anxiogenic substance-P gene promoter activity in primary amygdala neurones[J].Psychoneuroendocrinology, 2014,47:43-55.
[3] Ghosal S, Bundzikova-Osacka J, Dolgas C M, et al. Glucocorticoid receptors in the nucleus of the solitary tract (NTS) decrease endocrine and behavioral stress responses[J].Psychoneuroendocrinology, 2014, 45:142-53.
[4] Zuloaga D G, Carbone D L, Hiroi R, et al. Dexamethasone induces apoptosis in the developing rat amygdala in an age-, region-, and sex-specific manner[J].Neuroscience, 2011,199: 535-47.
[5] Beaudoin G M, Lee S H, Singh D, et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex [J].NatProtoc, 2012, 7(9): 1741-54.
[6] Mou L, Heldt S A, Ressler K J. Rapid brain-derived neurotrophic factor-dependent sequestration of amygdala and hippocampal GABA(A) receptors via different tyrosine receptor kinase B-mediated phosphorylation pathways[J].Neuroscience, 2011, 176:72-85.
[7] Ressler K J. Amygdala activity, fear, and anxiety: modulation by stress [J].BiologicalPsychiatry, 2010,67(12): 1117-9.
[8] Ding J, Han F, Shi Y. Single-prolonged stress induces apoptosis in the amygdala in a rat model of post-traumatic stress disorder [J].JPsychiatrRes, 2010,44(1):48-55.
[9] Liu H, Wang H T, Han F, Shi Y X. Activity of 5-HT1A receptor is involved in neuronal apoptosis of the amygdala in a rat model of post-traumatic stress disorder [J].MolMedRep, 2011,4(2): 291-5.
[10]Lupton M K, Strike L, Hansell N K, et al. The effect of increased genetic risk for Alzheimer's disease on hippocampal and amygdala volume [J].NeurobiolAging, 2016, 40: 68-77.
[11]Zhang Y, Liu W, Ma C, et al. Endoplasmic reticulum stress contributes to CRH-induced hippocampal neuron apoptosis [J].ExpCellRes, 2012, 318(6): 732-40.
[12]Mcewen B S, Nasca C, Gray J D. Stress effects on neuronal structure: hippocampus, amygdala and prefrontal cortex [J].Neuropsychopharmacology, 2016,41(1):3-23.
[13]王德杰, 刘兴国, 张 东. 糖皮质激素受体的研究进展[J].现代生物医学进展, 2010,10(8):1592-4.
[13]Wang D J, Liu X G, Zhang D. Current views on the glucocorticoid receptor [J].ProgModBiomed, 2010,10(8):1592-4.
[14]Morimoto M, Morita N, Ozawa H, et al. Distribution of glucocorticoid receptor immunoreactivity and mRNA in the rat brain: an immunohistochemical and in situ hybridization study [J].NeurosciRes,1996, 26(3): 235-69.
[15]周 珺,贾正平,邱建国,等. 米非司酮对2型糖尿病大鼠糖脂代谢的影响[J].中国药理学通报,2013,29(5):737-9.
[15]Zhou J, Jia Z P, Qiu J G, et al. Effects of mifepristone on glycolipid metabolism of type 2 diabetes mellitus in rats[J].ChinPharmacolBull, 2013,29(5):737-9.
网络出版时间:2016-12-5 15:14 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.024.html
Glucocorticoid-induced rat primary amygdaloid neuron apoptosis
XU Guang-ming1, ZHANG Xiao-jing1, LIU Yi1, ZHANG Yue2, WEN Di1, CONG Bin1
(1.DeptofForensicMedicine,BasicMedicalCollege;2.DeptofClinicalDiagnostics,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To investigate the role of GC in inducing apoptosis of amygdaloid neurons. Methods Culturing primary neurons of amygdala, the neurons were identified by immunefluorescence techniques with antibody against microtubule associated protein-2(MAP2) and antibody against GC receptor. Using flow cytometry to detect the effects of different concentrations of dexamethasone on the amygdala neuron apoptosis. Then the experiment was divided into four groups: CON, DEX, DEX+MIF and MIF. The rate of apopto-sis of the four groups was detected by TUNEL technique and the expressions of BAX mRNA of four groups by Real-time PCR technique.Results (1) Compared with the control group, the percentage of apoptotic cells increased significantly with DEX(10-8mol·L-1~10-6mol·L-1) treatment in a concentration-dependent manner. (2) the TUNEL test showed that the percentage of apoptotic cells of DEX group increased significantly, compared with control group. While it decreased significantly in DEX+MIF group, compared with DEX group. There was no difference between MIF group and control group. (3) Compared with control group, the expressions of BAX mRNA of DEX group increased significantly. While the expressions of BAX mRNA of DEX+MIF group decreased significantly, compared with the DEX group.There was no difference between MIF group and control group.Conclusion GC can independently induce the apoptosis of primary cultured neurons in the amygdala by combining with GC receptor.
stress; glucocorticoid; amygdala; neuron; apoptosis; primary culture
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.022.html
2016-07-08,
2016-09-20
国家自然科学基金资助项目(No 81430047)
许光明(1989-),男,硕士,研究方向:神经系统疾病,E-mail:fyguangming@163.com; 丛 斌(1957-),男,博士,教授,研究方向:神经系统疾病,通讯作者,Tel:0311-86265602,E-mail:hbydcongbin@126.com
10.3969/j.issn.1001-1978.2016.12.011
A
1001-1978(2016)12-1688-07
R-332;R322.81;R329.25;R392.11;R977.11