代谢综合征患者脂肪组织RBP4表达及其与胰岛素抵抗的关系
2017-01-06王钰
王钰
(西安市第四医院,西安710004)
代谢综合征患者脂肪组织RBP4表达及其与胰岛素抵抗的关系
王钰
(西安市第四医院,西安710004)
目的 检测代谢综合征(MS)患者皮下及大网膜脂肪组织视黄醇结合蛋白4(RBP4)的表达,分析其与胰岛素抵抗(IR)的相关性。方法 选择行腹部手术的患者55例,根据是否合并MS分为MS组38例和对照组17例。术前采集两组空腹静脉血,放免法检测血糖和胰岛素,计算胰岛素抵抗指数(HOMA-IR);术中取两组腹部皮下和大网膜脂肪组织,采用RT-PCR法检测RBP4 mRNA表达。结果 两组大网膜脂肪组织中RBP4 mRNA表达均高于皮下脂肪组织(P<0.05);MS组大网膜脂肪组织RBP4 mRNA表达较对照组升高(P<0.05),且与HOMA-IR呈正相关。结论 MS患者大网膜脂肪组织RBP4 mRNA表达增加,且与IR有关。
代谢综合征;胰岛素抵抗;视黄醇结合蛋白4;葡萄糖转运蛋白4;脂肪因子
代谢综合征(MS)的病理生理基础是胰岛素抵抗(IR)[1]。脂肪组织能够分泌多种具有可调控机体功能的脂肪因子,参与IR的发生发展[2]。视黄醇结合蛋白4(RBP4)是在构建葡萄糖转运蛋白4(GLUT4)基因缺陷导致IR大鼠模型时鉴定出的新的脂肪因子[3]。研究显示,RBP4与IR相关疾病存在密切关联[4,5]。2013年1月~2014年12月,我们通过观察MS患者皮下脂肪组织和大网膜脂肪组织中RBP4 mRNA的表达,分析其与IR的相关性。
1 资料与方法
1.1 临床资料 选择因慢性胆囊炎、肠息肉、胃溃疡、卵巢囊肿行腹部手术的患者55例。根据2005年IDF发布的MS诊断标准[6]将患者分为MS组38例和对照组17例。MS组男22例、女16例,年龄(57.08±8.99)岁,BMI(26.38±2.62)kg/m2,腰臀比0.95±0.02,空腹血糖(7.80±2.08)mmol/L,TG(2.52±0.79)mmol/L,TC(5.35±0.55)mmol/L,HDL(1.12±0.44)mmol/L,LDL(3.02±0.79)mmol/L,SBP(149.18±12.73)mmHg,DBP(83.79±9.07)mmHg。对照组男8例、女9例,年龄(56.05±7.38)岁,BMI、腰臀比、空腹血糖、血脂、血压均在正常范围,无糖尿病史、糖尿病家族史、高血压家族史。排除恶性肿瘤及急性炎症、慢性肝肾功能损害、其他内分泌疾病患者,近3个月体质量无明显变化(<10%),未接受过节食及减肥药物治疗。研究对象均签署知情同意书。
1.2 检测方法
1.2.1 胰岛素抵抗指数(HOMA-IR)的测算 术前采集患者空腹静脉血,采用放免法检测血糖和胰岛素水平,计算HOMA-IR。
1.2.2 RBP4 mRNA检测 采用RT-PCR方法。术中取腹部皮下和大网膜脂肪各约0.5 g,置液氮中保存。TRIzol法提取总RNA,逆转录合成cDNA。根据GenBank报道的人基因序列,引物设计采用Primer 5.0软件,RBP4引物上游:5 ′-CTTCACAGACACCGAGGAC-3 ′,下游:5 ′-AAAGGCAAGCAGATTCACT-3 ′,扩增片段长度为495 bp。使用2×Taq PCR MasterMix试剂盒进行PCR反应。反应体系:2×PCR Master Mix 12.5 μL,cDNA 4.0 μL,RBP4上、下游引物各1 μL,GAPDH上、下游引物各1 μL;dd H2O 6.5 μL。扩增条件:94 ℃ 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 5 min。1.5%琼脂糖凝胶电泳分离PCR产物,凝胶成像分析软件进行分析,测量各条带光密度值,进行图像灰度扫描。以RBP4与内参GAPDH基因电泳条带灰度值之比,作为RBP4 mRNA的相对表达量。
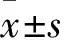
2 结果
2.1 两组HOMA-IR比较MS组HOMA-IR为1.79±0.38,对照组为5.82±2.23,MS组高于对照组(P<0.01)。
2.2 两组皮下与大网膜脂肪组织中RBP4mRNA表达比较 两组BPR4mRNA表达在大网膜脂肪组织均高于皮下脂肪组织,MS组大网膜脂肪组织RBP4mRNA表达较对照组升高(P均<0.01)。见表1。
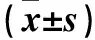
表1 两组皮下与大网膜脂肪组织中RBP4 mRNA表达比较
注:与皮下脂肪组织比较,*P<0.01;与对照组比较,#P<0.01。
2.3 RBP4 mRNA与HOMA-IR的相关性 相关性分析显示,皮下与大网膜脂肪组织RBP4 mRNA表达与体质量、BMI、腰围、臀围、腰臀比、SBP、TG、TCH、LDL、FBG、FINS、HOMA-IR呈正相关,与HDL呈负相关(P<0.05或<0.01)。以脂肪组织RBP4 mRNA表达为因变量,进行多元逐步回归分析,结果显示,腰臀比和HOMA-IR是RBP4 mRNA表达的独立影响因子。
3 讨论
脂肪组织被认为是IR的始发部位,脂肪分泌的脂肪因子如RBP4在IR方面的作用越来越受到重视。在肥胖、冠心病、2型糖尿病、IGT甚至血糖正常的非肥胖但有糖尿病家族史的人群中,血清RBP4均升高[7]。Farjo等[8]提出,RBP4表达升高可激活NADPH氧化酶和NF-κB,诱导内皮细胞发生炎症反应,增加IR及动脉粥样硬化的发病风险。脂肪组织按照部位不同分为皮下脂肪及内脏脂肪。不同部位的脂肪组织对机体的代谢作用各异。Hamdy等[9]认为,内脏脂肪与外周皮下脂肪存在许多生物学和基因遗传学上的差异,内脏脂肪在受体的分布、脂肪因子、酶的活性等方面与皮下脂肪有显著差异,在代谢上远比皮下脂肪活跃[10]。皮下脂肪与内脏脂肪在肥胖相关疾病如糖尿病、心血管代谢疾病的发病机制上也存在不同。内脏脂肪增多引起中心性肥胖,被认为与IR有更密切的关系[11]。
本研究MS组与对照组大网膜脂肪组织中的RBP4 mRNA表达均显著高于皮下脂肪组织,提示不同部位的脂肪组织功能可能存在差异[12]。MS组大网膜脂肪组织中RBP4 mRNA表达较对照组明显增加,提示RBP4可能与中心型肥胖有关。
RBP4与IR等相关的机制可能与GLUT4的作用有关。GLUT4是胰岛素信号通路中关键的信号蛋白,GLUT4表达减少或活性下降可引起胰岛素敏感组织严重的IR[13]。RBP4是在构建GLUT4基因缺陷导致IR大鼠模型时鉴定出的脂肪因子,GLUT4基因缺陷大鼠的血清RBP4升高。血清RBP4升高与脂肪组织GLUT4表达减少共同参与了IR的发生。PI3K依赖性的信号通路是GLUT4转位的一个关键环节。在RBP4转基因鼠中,肌肉组织在胰岛素刺激下PI3K活性下降30%,而RBP4基因敲除纯合子和杂合子小鼠肌肉组织PI3K活性增强了80%。因此推测,MS患者RBP4在大网膜组织的表达升高与GLUT4表达降低共同参与了IR的发生发展过程。
[1] Scott M.Grundy.Metabolic syndrome update[J]. Trends Cardiovasc Med, 2016,26(4):364-373.
[2] Fasshauer M, Blüher M. Adipokines in health and disease[J]. Trends Pharmacol Sci, 2015,36(7):461-470.
[3] Christou GA, Tselepis AD, Kiortsis DN. The metabolic role of retinol binding protein 4: an update[J]. Horm Metab Res,2012,44(1):6-14.
[4] Park SE, Park CY, Sweeney G. Biomarkers of insulin sensitivity and insulin resistance: Past, present and future[J]. Crit Rev Clin Lab Sci, 2015,52(4):180-190.
[5] Sun Q, Kiernan UA, Shi L, et al. Plasma retinol-binding protein 4 (RBP4) levels and risk of coronary heart disease: a prospective analysis among women in the nurses′ health study[J]. Circulation, 2013,127(19):1938-1947.
[6] Alberti KG, Zimmet P, Shaw J. The metabolic syndrome: a new worldwide definition[J]. Lancet, 2005,366(9491):1059-1062.
[7] Graham TE, Yang Q, Bluher M, et al. Retinol-binding protein 4 and insulin resistancein lean, obese, and diabetic subjects[J]. N Engl J Med, 2006,354(24):2552-2563.
[8] Farjo KM, Farjo RA, Halsey S, et al. Retinol-binding protein 4 induces inflammation in human endothelial cells by an NADIPH oxidase and nuclear factor kappa B-dependent and retinol independent mechanism[J]. Mol Cell Biol, 2012,32(24):5103-5115.
[9] Hamdy O, Porramatikul S, Al-Ozairi E. Metabolic obesity: the paradox between visceral and subcutaneous fat[J]. Curr Diabetes Rev, 2006,2(4):367-373.
[10] 邵欣宇,贾伟平.腹内脂肪与代谢综合征[J].中华内分泌代谢杂志,2004,20(3):279-282.
[11] Zabetian-Targhi F, Mahmoudi MJ, Rezaei N, et al. Retinol binding protein 4 in relation to diet, inflammation, immunity, and cardiovascular diseases[J]. Adv Nutr, 2015,6(6):748-762.
[12] Cheng KH, Chu CS, Lee KT, et al. Adipocytokines and proinflammatory mediators from abdominal and epicardial adipose tissue in patients with coronary artery disease[J]. Int J Obes (Lond), 2008,32(2):268-274.
[13] Graham TE, Wason CJ, Bluher M, et al. Shortcomings in methodology complicate measurements of serum retinolbinding protein (RBP4) in insulin-resistant human subjects[J]. Diabetologia, 2007,50(4):814-823.
10.3969/j.issn.1002-266X.2016.46.013
R589
B
1002-266X(2016)46-0047-02
2016-06-30)
