椎动脉颅内近远段粥样硬化狭窄患者的后循环缺血梗死区域、临床症状及伴发脑动脉狭窄对比分析
2017-01-06白雪张晶晶
白雪,张晶晶
(赤峰市医院,内蒙古赤峰024000)
椎动脉颅内近远段粥样硬化狭窄患者的后循环缺血梗死区域、临床症状及伴发脑动脉狭窄对比分析
白雪,张晶晶
(赤峰市医院,内蒙古赤峰024000)
目的 观察椎动脉颅内近远段粥样硬化狭窄患者的后循环缺血梗死区域、临床症状及伴发脑动脉狭窄是否有不同。方法 单侧椎动脉颅内段粥样硬化性狭窄≥50%的后循环缺血患者134例,根据椎动脉颅内段狭窄部位不同分为近段组和远段组,对比分析两组的后循环缺血梗死区域、临床症状及伴发脑动脉狭窄情况。结果 近段组74例、远段组60例。近段组、远段组多发梗死者分别占63.0%、33.3%,两组相比,P<0.05。近段组、远段组临床表现为头痛者分别占16.2%、3.3%,临床表现为偏瘫者分别占21.6%、40.0%,两组相比,P均<0.05。近段组、远段组伴发椎基底动脉狭窄者分别占2.7%、26.7%,两组相比,P<0.01。结果 椎动脉颅内近远段粥样硬化狭窄患者的后循环缺血区域、临床症状及伴发脑动脉狭窄有不同,椎动脉颅内段近段狭窄患者多发梗死及头痛较远段狭窄患者多见,而远段狭窄患者伴发基底动脉狭窄及偏瘫较近段狭窄患者多见。
椎动脉;椎动脉颅内段;椎动脉狭窄;后循环缺血;脑梗死;基底动脉狭窄
后循环缺血包括短暂性脑缺血发作(TIA)和脑梗死,椎动脉颅内段动脉粥样硬化狭窄或闭塞是后循环缺血的重要原因[1],且椎动脉颅内段狭窄导致的后循环缺血复发率非常高[2,3]。既往研究[4]多从整体上分析椎动脉颅内段粥样硬化病变与后循环缺血的关系,而对椎动脉颅内近远段粥样硬化性狭窄导致的后循环缺血梗死的差异性研究极少[5]。由于椎动脉重要分支小脑后下动脉的存在,椎动脉颅内段近段与远段的供血区域不同,且近段与远段粥样硬化狭窄的发生率也不同[6]。我们推测,由于解剖部位的不同,以小脑后下动脉为界,颅内椎动脉近段与远段病变导致的后循环缺血梗死模式可能不同。为此,我们对椎动脉颅内近远段粥样硬化性狭窄导致的后循环缺血梗死区域、临床症状及伴发脑动脉狭窄进行了对比观察。现将结果报告如下。
1 资料与方法
1.1 临床资料 2012年1月~2016年3月赤峰市医院收治的后循环缺血患者134例,男116例、女18例;年龄(60.4±9.0)岁;经头颈部CT血管成像(CTA)、磁共振血管成像(MRA)或DSA检查证实单侧椎动脉狭窄≥50%。134例患者中,TIA 30例、TIA后脑卒中66例、脑卒中38例。纳入标准:①依据WASID法[7]测量单侧椎动脉V4段狭窄≥50%;②有完整的头颅MRI检查结果;③年龄≥45岁;④至少有一项粥样硬化危险因素(高血压、糖尿病、高血脂、吸烟)。排除标准:非动脉粥样硬化性狭窄(夹层、纤维肌性发育不良、血管炎、放射诱导的血管病)患者;明确或可疑心源性栓塞(如房颤、人工心脏瓣膜、感染性心内膜炎、左心房或心室血栓、心房黏液瘤、心脏射血分数<25%的心肌病)患者;既往有脑血管介入治疗史的患者;椎动脉颅外段狭窄患者;椎动脉闭塞患者;伴有对侧椎动脉狭窄≥50%或闭塞的患者;小脑后下动脉起源异常(如起源于基底动脉)的患者。
1.2 患者分组及资料收集方法 以椎动脉小脑后下动脉发出点为界限,将椎动脉颅内段分为包含小脑后下动脉起点的近段和自小脑后下动脉起点以后至汇合成基底动脉前的远段(见图1)。依据颅内椎动脉狭窄部位,将134例患者分为近段组和远段组。收集全部患者的脑血管病危险因素、临床表现及影像检查资料。
1.3 资料分析方法 对比分析两组患者的脑血管病危险因素、临床表现及影像检查资料。依据新英格兰医学中心后循环登记库中使用的后循环供血区分段标准[8]评价影像资料,将后循环脑梗死区域分为近端供血区(椎动脉颅内段及小脑后下动脉供血区)、中部供血区(小脑上动脉以下基底动脉分支及小脑前下动脉供血区)、远端供血区(基底动脉尖端、双侧小脑上及大脑后动脉供血区);近端、中部、远端供血区中2个或2个以上区域梗死视为多发脑梗死。同时观察两组患者是否伴有颈内动脉、大脑中动脉及基底动脉狭窄≥50%或闭塞。
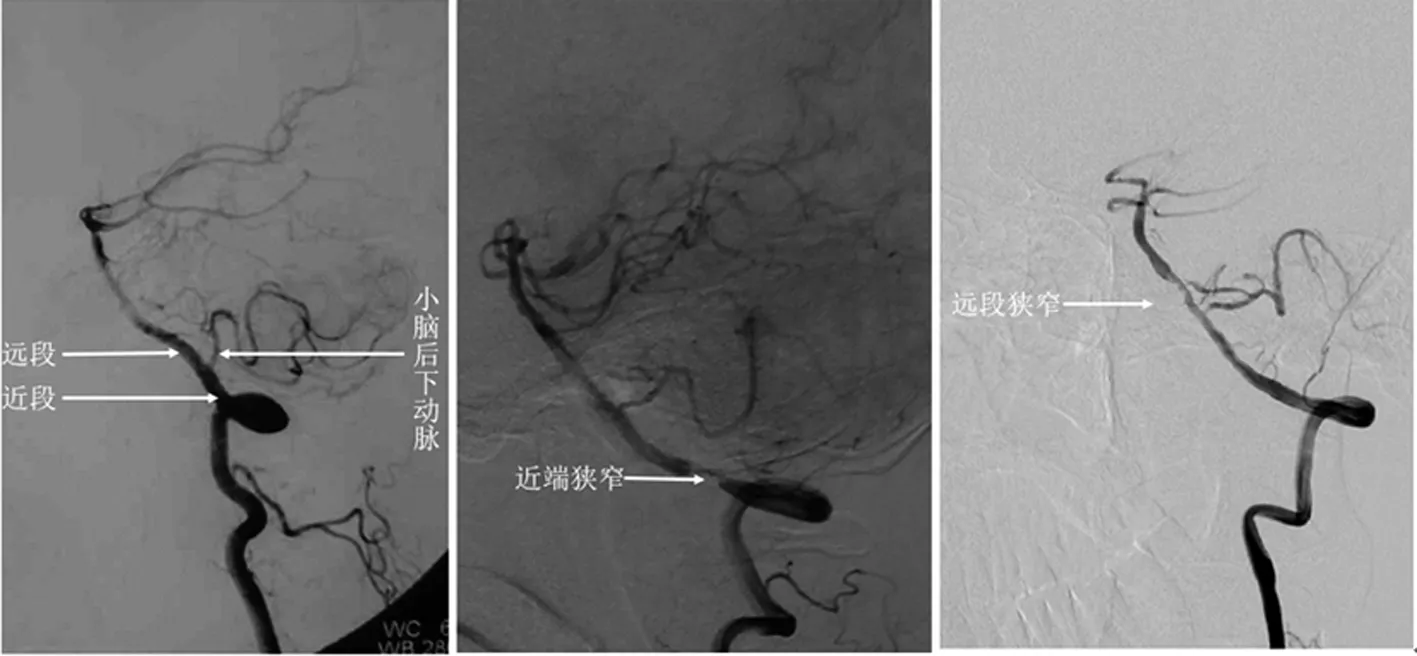
图1 椎动脉颅内段分段及狭窄部位示例(椎动脉颅内段DSA图像)

2 结果
134例患者中,左侧椎动脉颅内段狭窄90例(67.2%),右侧椎动脉颅内段狭窄44例(32.8%);近段组74例(55.2%),远段组60例(44.8%)。
近段组年龄(60.7±9.4)岁,男64例、女10例,有高血压68例、糖尿病20例、高血脂18例、冠心病8例、吸烟54例、饮酒36例、脑卒中史10例;远段组年龄(60.2±8.6)岁,男52例、女8例,有高血压54例、糖尿病18例、高血脂22例、冠心病10例、吸烟40例、饮酒26例、脑卒中史12例;两组上述各指标相比,P均>0.05。
近段组表现为TIA 18例、TIA后脑梗死38例、脑梗死18例,远段组TIA 12例、TIA后脑梗死28例、脑梗死20例。排除TIA患者后,依据后循环供血区域,近段组脑梗死患者中,下端供血区梗死6例(11.1%),中端供血区梗死6例(11.1%),远端供血区梗死8例(14.8%),多发梗死34例(63.0%);远段组脑梗死患者中,下端供血区梗死10例(27.8%),中端供血区梗死8例(22.2%),远端供血区梗死6例(16.7%),多发梗死12例(33.3%);两组多发梗死发生率相比,P<0.05。
近段组临床表现为头晕70例、偏瘫16例、言语不清22例、视物双影26例、恶心呕吐16例、肢体麻木12例、走路不稳18例、饮水呛咳10例、视物不清10例、头痛12例、面部麻木6例,远段组临床表现为头晕54例、偏瘫24例、言语不清18例、视物双影12例、恶心呕吐18例、肢体麻木18例、走路不稳8例、饮水呛咳12例、视物不清8例、头痛2例、面部麻木2例;近段组和远段组偏瘫及头痛发生率(21.6%和40.0%、16.2%和3.3%)相比,P均<0.05。
近段组伴颈内动脉狭窄14例、大脑中动脉狭窄16例、基底动脉狭窄2例,远段组伴颈内动脉狭窄8例、大脑中动脉狭窄8例、基底动脉狭窄16例,近段组与远段组颈内动脉及大脑中动脉狭窄发生率(18.9%和13.3%、21.6%和13.3%)相比,P均>0.05;近段组与远段组基底动脉狭窄发生率(2.7%、26.7%)相比,P<0.01。
3 讨论
椎动脉颅内段狭窄是后循环TIA及脑梗死的重要原因,其主要病理改变为动脉粥样硬化,此处病变既可造成栓塞,又可以形成血栓,甚至血栓可延伸进入基底动脉[6]。在单纯药物治疗情况下,椎动脉颅内段狭窄致后循环缺血卒中者1 a内的复发率为8.5%~22.8%[7~9],其支架及手术治疗效果尚有争议[10,11]。因此,有必要加强对椎动脉颅内段狭窄后循环缺血模式及机制的研究,以便选择合理的治疗方案。
随着医学影像检查手段的进步,对于椎动脉颅内段狭窄的诊断愈发便捷、准确[12,13]。有学者[8]结合影像表现将椎动脉颅内段分为近、中、远三段,结果显示远段最容易出现狭窄(66%),其次为近段(24%)。考虑到椎动脉颅内段在发出小脑后下动脉后除脊髓动脉外,没有其他较大的分支,我们将椎动脉颅内段分为穿寰枕后膜及硬脑膜后到小脑后下动脉的近段,以及小脑后下动脉起始处以远至与对侧椎动脉汇合前的远段。并且因为部分椎动脉颅内段闭塞为颅外来源栓子阻塞所致,且闭塞的颅内段有时不易区分原狭窄部位,在本研究中我们排除了椎动脉颅内段闭塞患者。虽然椎动脉颅内段狭窄容易出现双侧病变,但由于部分患者双侧椎动脉颅内段病变可能出现不一致的病变部位,影响分组,我们也排除了此类患者。本研究结果显示,近段组和远段组患者的脑血管病危险因素差异无统计学意义,远段组更容易合并基底动脉狭窄,可能是此处粥样硬化斑块更容易随着血流冲击向远段的基底动脉延伸所致。
我们对椎动脉颅内段狭窄致后循环缺血患者的临床表现进行了分析,发现多个供血区的梗死最多见,并且中部、远端、多发梗死相加后的比例明显高于近端梗死区域,由此可以推测椎动脉颅内段狭窄多通过栓塞机制致病,这与既往的研究[14]一致。对近段组和远段组患者的临床表现进行比较后发现,近段组患者更容易出现多发性梗死,具体原因不清,推测可能与椎动脉颅内段近段狭窄不仅能通过原位血栓形成阻塞小脑后下动脉,而且可以通过微栓子脱落栓塞到远端有关。
既往有研究[15,16]统计了椎动脉颅内段狭窄致后循环缺血的常见症状有别于前循环缺血症状,后循环缺血患者以头晕最常见,其次为偏瘫及恶心呕吐。本研究结果与此类似,但我们发现,远段组患者更容易出现偏瘫,而近段组患者更容易出现头痛,推测原因可能与椎动脉狭窄部位供血范围有关,虽然栓塞是后循环缺血的主要原因,但原位血栓形成也不能忽视。在椎动脉颅内段近段狭窄时,原位血栓有阻塞椎动脉脑膜支的可能,并且有时需要脑膜支代偿供血,可能会导致硬脑膜相对缺血而出现头痛;椎动脉颅内段远段发出供应延髓内侧的延髓支,此处缺血可以表现为偏瘫。
总之,椎动脉颅内近远段粥样硬化狭窄导致的后循环缺血区域、临床症状及伴发脑动脉狭窄不同,椎动脉颅内段近段粥样硬化狭窄者多发梗死及头痛较远段粥样硬化狭窄者多见,而远段粥样硬化狭窄者伴发基底动脉狭窄及偏瘫较近段粥样硬化狭窄者多见。对椎动脉颅内段粥样硬化狭窄导致的后循环缺血,选择治疗手段时应适当参考椎动脉颅内段病变的部位。
[1] Caplan LR, Wityk RJ, Pazdera L, et al. New England Medical Center Posterior Circulation Stroke Registry Ⅱ.vascular lesions [J]. J Clin Neurol, 2005,1(1):31-49.
[2] The Warfarin-Aspirin Symptomatic Intracranial Disease (WASID) Study Group. Prognosis of patients with symptomatic vertebral or basilar artery stenosis [J]. Stroke, 1998,29(7):1389-1392.
[3] Perue GL, Narayan R, Zangiabadi AH, et al. Prevalence of vertebral artery origin stenosis in a multirace-ethnic posterior circulation stroke cohort: miami stroke registry [J]. Int J Stroke, 2015,10(2):185-187.
[4] 刘清萍,陈俊抛,吴宏.后循环梗死与椎基底动脉狭窄的相关性分析[J].中国实用神经疾病杂志,2011,14(15):6-9.
[5] Liu LH, Chen CC, Chang MH. Clinical findings of intracranial vertebral artery disease using magnetic resonance angiography [J]. Acta Neurologica Taiwan, 2004,13(3):120-125.
[6] Caplan LR. The intracranial vertebral artery: a neglected species[J]. Cerebrovasc Dis, 2012,34(1):20-30.
[7] Kasner SE, Lynn MJ, Chimowitz MI, et al. Warfarin vs aspirin for symptomatic intracranial stenosis: subgroup analyses from WASID [J]. Neurology, 2006,67(7):1275-1278.
[8] Caplan LR, Chung CS, Wityk RJ, et al. New England Medical Center Posterior Circulation Stroke Registry: methods, data base, distribution of brain lesions, stroke mechanisms, and outcomes [J]. J Clin Neurol, 2005,1(1):14-30.
[9] Voetsch B, Dewitt MS, Caplan LR. Basilar artery occlusive disease in the New England Medical Center Posterior Circulation Registry [J]. Arch Neurol, 2004,61(4):496-504.
[10] Jr ST, Whisnant JP, Piepgras DG, et al. Intracranial bypass grafts for vertebral-basilar ischemia [J]. Mayo Clin Proc, 1978,53(1):12-18.
[11] Zaidat OO, Fitzsimmons BF, Woodward BK, et al. Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis: the VISSIT randomized clinical trial [J]. JAMA, 2015,313(12):1240-1248.
[12] 史壮宏, 信宏,孙启东,等.64层螺旋CTA与DSA在颅内外动脉狭窄中的应用[J].中风与神经疾病杂志,2013,30(4):362-364.
[13] Bodle JD, Feldmann E, Swartz RH, et al. High-resolution magnetic resonance imaging: an emerging tool for evaluating intracranial arterial disease [J]. Stroke, 2013,44(1):287-292.
[14] Müllerküppers M, Graf KJ, Pessin MS, et al. Intracranial vertebral artery disease in the New England Medical Center Posterior Circulation Registry[J]. Eur Neurol, 1997,37(3):146-156.
[15] Searls DE, Pazdera L, Korbel E, et al. Symptoms and signs of posterior circulation ischemia in the new England Medical Center Posterior Circulation Registry [J]. Arch Neurol, 2012,69(3):346-351.
[16] Compter A, Kappelle LJ, Algra A, et al. Nonfocal symptoms are more frequent in patients with vertebral artery than carotid artery stenosis [J]. Cerebrovasc Dis, 2013,35(4):378-384.
白雪(E-mail: 1036516668@qq.com)
10.3969/j.issn.1002-266X.2016.43.019
R743
B
1002-266X(2016)43-0060-03
2016-06-08)
