耧斗菜的组织培养
2017-01-06杜艳
杜艳
(运城农业职业技术学院,山西运城044000)
耧斗菜的组织培养
杜艳
(运城农业职业技术学院,山西运城044000)
以耧斗菜幼嫩叶片及叶柄为外植体,研究了不同生长调节物质对外植体愈伤组织诱导、不定芽分化和生根的影响。结果表明,在培养基MS+2,4-D1.0 mg/L+6-BA0.5 mg/L上诱导叶柄产生愈伤效果最好,诱导率为80.5%;在培养基MS+NAA 0.5 mg/L+6-BA 1.0 mg/L上叶片愈伤诱导效果最好,诱导率为92.7%。继代培养基为MS+2,4-D 0.5 mg/L+6-BA 0.5 mg/L和MS+NAA 0.5 mg/L+6-BA 2.0 mg/L。在培养基MS+NAA 0.5 mg/L+6-BA 0.5 mg/L中分化芽;分化的芽在MS+NAA 0.1 mg/L+6-BA 0.5 mg/L中增殖。生根培养基为1/2 MS+NAA 0.1 mg/L或1/2 MS+IBA0.2 mg/L。
组织培养;愈伤组织诱导;不定芽分化;生根;外植体
耧斗菜(Aquilegia viridiflora)是毛茛科(Ranunculacea)耧斗菜属(Aquilegia)的多年生草本植物,品种繁多,资源丰富,在我国广为分布[1]。耧斗菜不仅具有奇特花型,而且花色丰富、色泽明艳,在园林中经常作为花坛、花境的配置材料,亦可丛植于花园、篱边、庭院,应用十分广泛[2]。耧斗菜对栽培环境要求不严,性强健而耐寒[3],具有适应性强、抗性强、观赏性状好等优点[4],管理相对粗放,适宜在园林中推广应用。其营养丰富,含有人体所需的氨基酸和多种营养元素。陈四保等[5]从蒙药耧斗菜中测出17种氨基酸,其中,7种为人体必需氨基酸。邢爱英等[6]对华北楼斗菜的生物学特性进行了研究,并分析了其营养成分。冯卫生等[7]以华北耧斗菜为研究对象,从中分离鉴定得到13种化合物。巩红冬[8]研究表明,甘肃耧斗菜族植物具有药用价值,在治疗心血管疾病、消化道疾病、子宫出血等方面具有一定功效。朱蕊蕊等[9]研究表明,耧斗菜根含有糖类,可制饴糖或酿酒;种子含油,可供工业使用。因此,耧斗菜不仅具有园林应用价值,而且具有药用和营养价值。
随着耧斗菜的园林应用及营养药用价值逐渐被人们所关注,其栽培管理及繁殖方法的研究也开始增多。耧斗菜除了通过传统的播种、分株等繁殖方法进行育苗以外,组织培养作为一种常用的快繁方式也开始应用于耧斗菜上。组织培养除了具有快速、大量繁殖的优点外,还可以通过组织培养获得无病毒苗。朱蕊蕊等[9]以耧斗菜为试验材料,从不同外植体和生长调节物质对其愈伤组织和不定芽再生的影响等方面进行了研究,李群等[10]、李春玲等[11]以园艺品种耧斗菜的叶片为外植体建立了繁殖体系,王非等[12]以尖萼耧斗菜叶片建立了繁殖体系。
本试验以耧斗菜幼嫩叶片及叶柄为外植体,从不同生长调节物质对外植体愈伤组织诱导、不定芽分化和生根的影响等进行研究,旨在筛选出最佳培养基配比,建立以叶片和叶柄为外植体的繁殖体系。
1 材料和方法
1.1 试验材料
供试耧斗菜品种为泛美八音鸟,种子从美国泛美种子公司分销处购买。
1.2 基本培养基及培养条件
基本培养基为MS,蔗糖3%,琼脂0.65%,pH值为6.0。培养条件:光照强度1 000 lx,每日光照16 h,黑暗8 h,室温25℃。
1.3 无菌材料的获得
取耧斗菜种子,在1/2 MS培养基上进行播种,待长出4~5片真叶时,取其叶片和叶柄作为外植体,设为A组。从具有4~5片真叶的露地栽培苗上剪切嫩叶叶片、叶柄作为外植体。先用流水将外植体表面污物冲洗掉,再用洗洁精进行清洗,并用流水冲洗2h,然后对外植体进行消毒处理。处理方法:先将外植体置于无菌操作台上,用75%酒精消毒20 s,并用无菌水冲洗2~3次,再用0.1%升汞消毒处理,叶片处理3 min,叶柄处理5 min,最后用无菌水冲洗4~5次,外植体表面水分用无菌滤纸吸干。处理后的叶片剪去叶缘,叶柄剪成约2cm,设为B组。
1.4 愈伤组织诱导和增殖试验
愈伤组织诱导和增殖培养基:(1)MS+2,4-D(0.2,1.0,2.0)mg/L+6-BA(0.5,1.0,2.0)mg/L;(2)MS+NAA(0.2,0.5,1.0)mg/L+6-BA(0.5,1.0,2.0)mg/L。继代培养基:MS+2,4-D 0.5 mg/L+6-BA 0.5 mg/L和MS+NAA0.5 mg/L+6-BA2.0 mg/L。
将A,B组外植体接种于培养基(1),(2)上,置于光照培养室中培养。观察比较不同浓度的激素配比及外植体对愈伤组织的影响,分析得出诱导叶柄、叶片产生愈伤效果最佳的培养基。在继代培养基上增殖,然后将愈伤组织转入不定芽分化培养基中。
1.5 不定芽分化及增殖试验
不定芽分化及增殖培养基:(3)MS+NAA(0.2,0.5,1.0)mg/L+6-BA 0.5 mg/L;(4)MS+NAA(0.1,0.3,0.5)mg/L+6-BA0.5 mg/L。
选取质地致密的愈伤组织,将其切分成1 cm× 1 cm大小,继代于培养基(3)中,分析得出诱导分化芽效果最佳的培养基。然后将分化出的芽点转移至培养基(4)中,分析得出最佳增殖培养基。
1.6 生根试验
生根培养基:(5)1/2MS+NAA(0.1,0.5,1.0)mg/L;(6)1/2 MS+IBA(0.2,0.5,1.0)mg/L。
芽长约5 cm高时,将其切下转接到培养基(5),(6)中进行生根培养,找出最佳生根培养基。
1.7 试管苗的炼苗与移栽
幼苗在生根培养基中培养约30 d,待生长健壮时开始进行炼苗、移栽。移栽的混合基质配比为:珍珠岩∶草炭∶园土=8∶1∶1[13]。
2 结果与分析
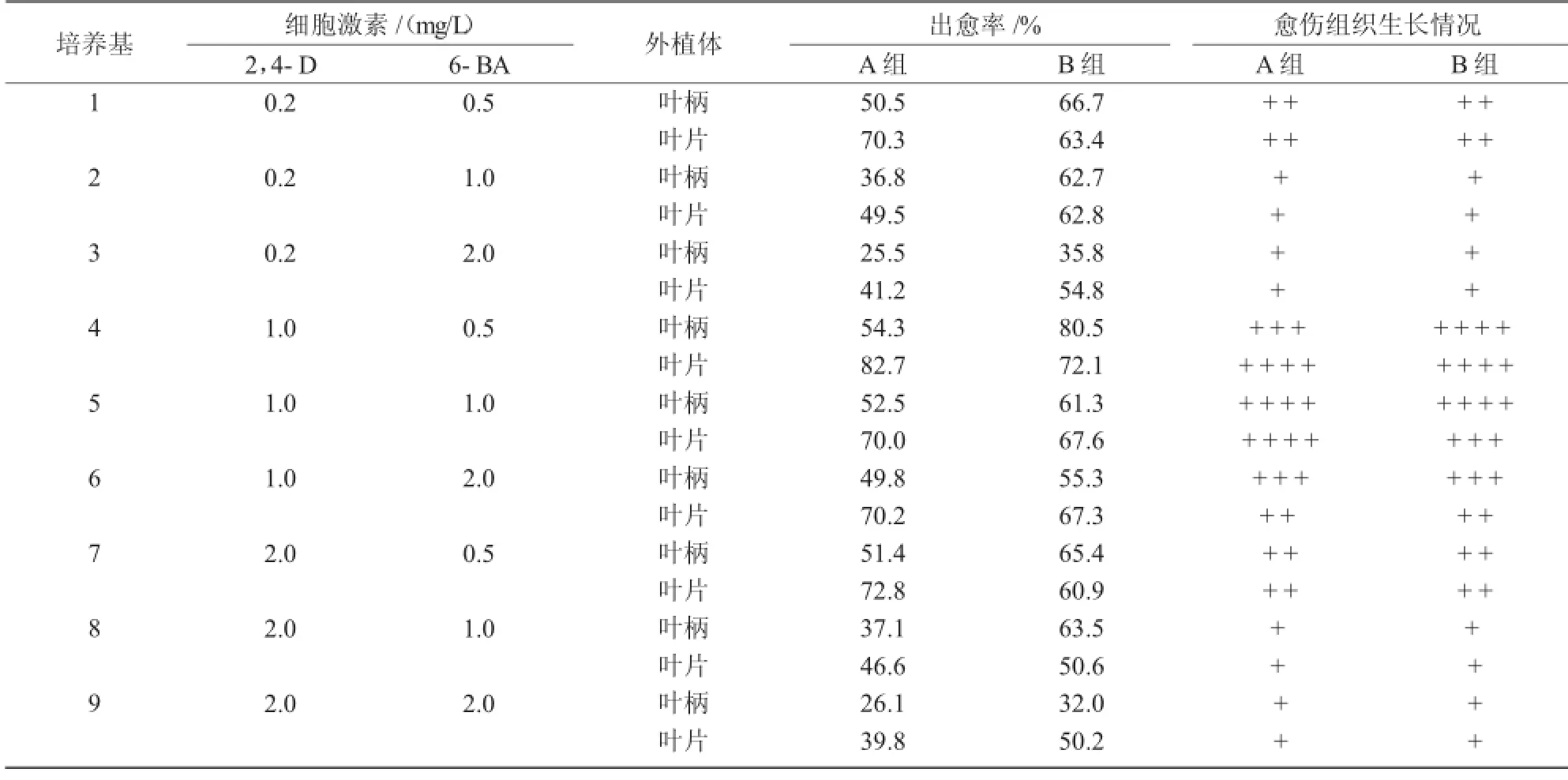
表1 不同质量浓度的激素配比及外植体对愈伤组织的影响
2.1 不同培养基对愈伤组织的诱导和增殖的影响
外植体培养5 d左右时,叶柄两端开始膨大,叶片出现皱缩;培养10 d左右时,叶片边缘及叶柄两端陆续形成愈伤组织,愈伤组织的出现方式同毛茛科大花飞燕草[14]和花毛茛的方式相同[15]。
由表1,2可知,比较培养基(1),(2)中的愈伤组织生长情况,首先,叶片的出愈率显著大于叶柄的;其次,B组叶柄(室外采摘)形成愈伤组织能力强于A组(组培苗),A组叶片形成诱导愈伤组织能力强于B组;第三,2,4-D对于诱导叶柄形成愈伤组织更有利,NAA对于诱导叶片形成愈伤组织效果更好;第四,培养基(1)上出现愈伤组织相对较晚,且愈伤量小,愈伤组织呈现黄色。
总之,愈伤组织诱导的试验结果表明,在培养基MS+2,4-D 1.0 mg/L+6-BA 0.5 mg/L上诱导叶柄产生愈伤效果最好,诱导率为80.5%;在培养基MS+NAA 0.5 mg/L+6-BA 1.0 mg/L上,诱导叶片产生愈伤效果最好,诱导率为92.7%。继代每20 d左右进行一次,愈伤组织增殖较快,质地密集紧实。继代增殖3~4次后将愈伤组织转入不定芽分化培养基中。
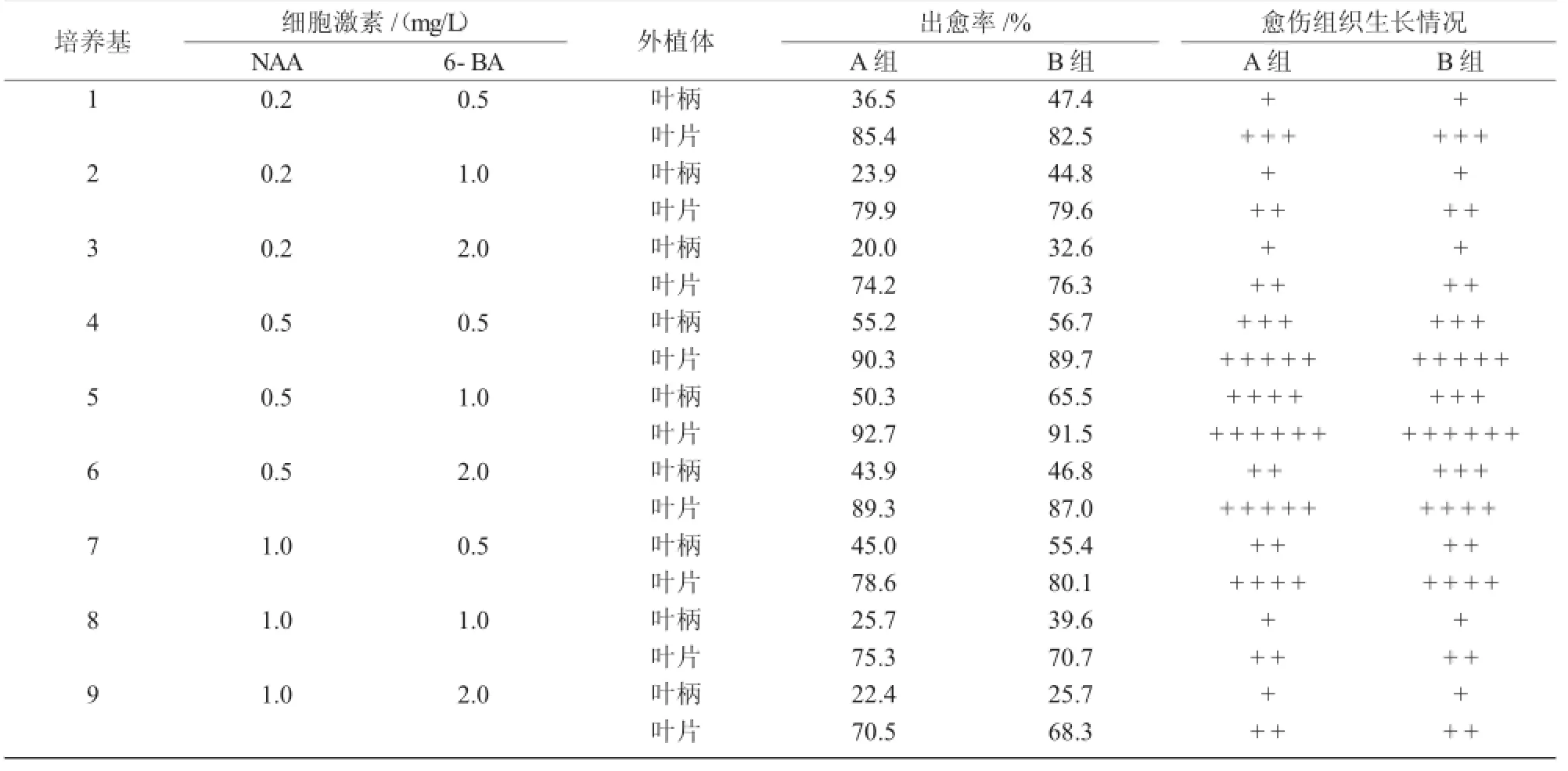
表2 不同质量浓度的激素配比及外植体对愈伤组织的影响
2.2 不同培养基对不定芽的分化和增殖的影响
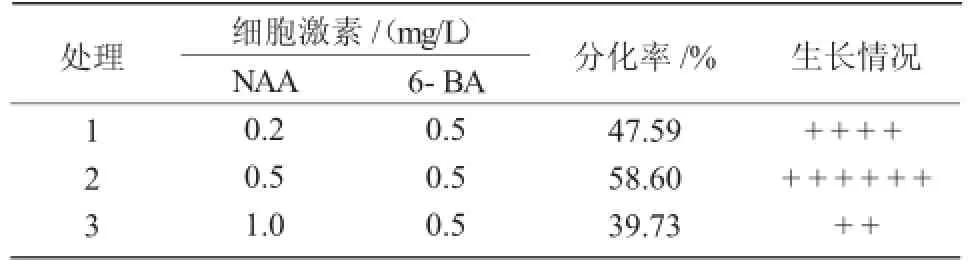
表3 不同质量浓度NAA与6-BA对不定芽分化的影响
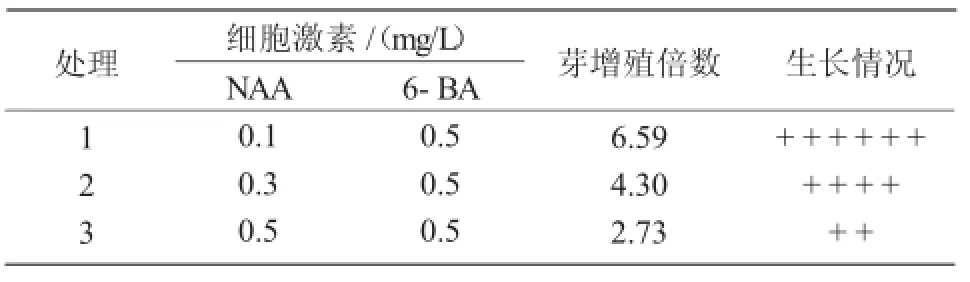
表4 不同质量浓度NAA与6-BA对不定芽增殖的影响
愈伤组织继代于培养基(3)中15 d后,分化出绿色芽点。在培养基MS+NAA 0.2 mg/L+6-BA 0.5 mg/L中,芽分化时亦出现根的分化;在培养基MS+NAA 1.0 mg/L+6-BA 0.5 mg/L中,出现愈伤组织褐化现象,甚至有畸形的叶和芽分化。在培养基MS+NAA 0.5 mg/L+6-BA 0.5 mg/L中,诱导分化芽的效果最好,分化率达58.60%(表3)。在培养基MS+NAA 0.1 mg/L+6-BA 0.5 mg/L中,芽的长势好,分化较快,20 d后增殖倍数达6.59(表4)。随着NAA质量浓度的增加,芽的增殖倍数下降,且不定芽叶片出现黄色,当NAA质量浓度达0.5 mg/L时,少许叶片逐渐呈现枯萎状,而新生丛生芽生长状态较差。
2.3 不同培养基对生根的影响
生根培养20 d后,所有幼苗基部均生出白色根系。随着NAA,IBA质量浓度的增加,幼苗基部须根生成数量减少,叶片逐渐枯萎,并且有愈伤组织出现。
从表5,6可以看出,在培养基1/2 MS+NAA 0.1 mg/L或1/2 MS+IBA 0.2 mg/L上,幼苗基部均产生较多的丛生根,无显著差异。
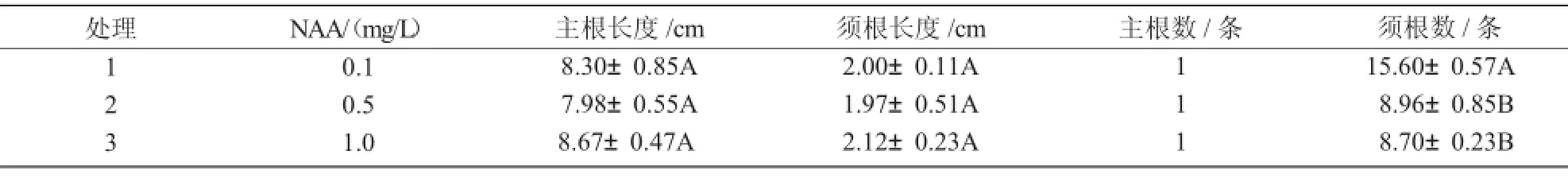
表5 NAA对耧斗菜生根的影响
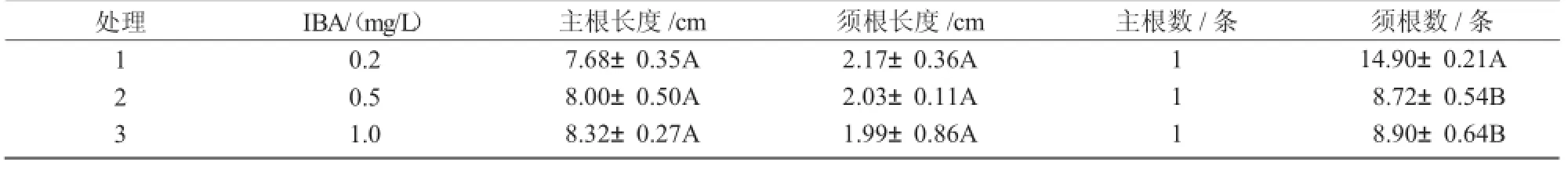
表6 IBA对耧斗菜生根的影响
2.4 试管苗的炼苗与移栽
首先,将培养瓶绳头解开,1 d后打开培养瓶密封膜,在温室内自然光下进行炼苗3~5 d;其次,从培养瓶中取出试管苗,用清水将根系表面的培养基冲洗干净;最后将幼苗移栽到混合基质中,注意保湿遮阴。本试验的移栽成活率高达80%以上。
3 结论
本研究表明,在培养基MS+2,4-D1.0 mg/L+6-BA 0.5 mg/L上诱导叶柄产生愈伤效果最好,诱导率为80.5%;在培养基MS+NAA0.5 mg/L+6-BA 1.0mg/L上,叶片愈伤诱导效果最好,诱导率为92.7%。最适不定芽分化培养基为MS+NAA 0.5 mg/L+6-BA 0.5 mg/L中分化芽;分化的芽在MS+NAA 0.1 mg/L+6-BA0.5 mg/L中增殖。最适生根培养基为1/2 MS+NAA0.1 mg/L或1/2 MS+IBA0.2 mg/L。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1979:490.
[2]程金水.园林植物遗传育种学[M].北京:中国林业出版社,2000.
[3]李晓博,李宁毅.耧斗菜的栽培管理[J].辽宁农业科学,2008(4):55.
[4]陈菲,刘晓东,栗辉.耧斗菜属植物在城市园林中开发应用研究[J].国土与自然资源研究,2010(2):96-97.
[5]陈四保,王立为,杨峻山,等.耧斗菜族药用植物化学成分及资源利用概况[J].中草药,2001,32(11):附3-4.
[6]邢爱英,于桂琴,张林,等.华北耧斗菜的生物学特性及其营养成分[J].山东林业科技,1998(3):16-17.
[7]冯卫生,苏芳谊,郑晓珂,等.华北耧斗菜的化学成分研究[J].中国药学杂志,2011,46(7):496-499.
[8]巩红冬.甘肃耧斗菜药用植物资源研究[J].甘肃科技,2007,7(7):23.
[9]朱蕊蕊,杨姗姗,明晓,等.耧斗菜愈伤组织和不定芽诱导的初步研究[J].江西农业学报,2009,21(7):85-86.
[10]李群,赵富群,陈丽萍,等.耧斗菜的组织培养[J].植物生理学通讯,2009,45(1):45-46.
[11]李春玲,蒋钟仁.早春野生花卉组织培养研究初报[J].园艺学报,1992,10(3):277-278.
[12]王非,姜思佳,李忠才,等.尖萼耧斗菜外植体消毒及愈伤组织诱导的研究[J].安徽农业科学,2010,38(35):19922-19924.
[13]杜艳.不同基质对耧斗菜幼苗质量的影响[J].山西农业科学,2012,40(4):375-377.
[14]何小玲,王金发.大花飞燕草的组织培养及植株再生[J].植物生理学通讯,1998,34(1):39.
[15]李洪忠,彭世勇,于艳,等.花毛茛叶片组织培养的初步探索[J].辽宁农业职业技术学院学报,2004,6(3):4.
The Tissue Culture ofAquilegia
DUYan
(YunchengAgriculture Vocational and Technical College,Yuncheng044000,China)
To study the effect on the callus induction adventitious buds differentiation and rooting in different growth regulating substances,the paper chose leaves and petioles of Aquilegia as explants.The result showed that in the medium MS+2,4-D 1.0 mg/L+6-BA0.5 mg/L,the petiole could produce the best callus induction,the induction rate was 80.5%.In the mediumMS+NAA0.5 mg/L+6-BA 1.0 mg/L,the leaf could produce the best callus induction,the induction rate was 92.7%.Subculture medium were MS+2,4-D 0.5 mg/L+6-BA 0.5 mg/L and MS+NAA 0.5 mg/L+6-BA 2.0 mg/L.In the medium MS+NAA 0.5 mg/L+6-BA 0.5 mg/L,callus induction turned tobud differentiation.The bud proliferate was in MS+NAA 0.1 mg/L+6-BA 0.5 mg/L.Rootingmediumwas 1/2 MS+NAA0.1 mg/Lor 1/2 MS+IBA0.2 mg/L.
tissue culture;callus induction;adventitious buds differentiation;rooting;explant
S682.1
A
1002-2481(2016)12-1776-04
10.3969/j.issn.1002-2481.2016.12.09
2016-08-28
杜艳(1980-),女,山西运城人,讲师,主要从事花卉植物栽培与应用研究工作。
