茶树紫阳种RbcL基因片段的克隆与序列分析
2017-01-06张妍杨金宏
张妍,杨金宏
(安康学院现代农业与生物科技学院,陕西省蚕桑重点实验室,陕西安康725099)
茶树紫阳种RbcL基因片段的克隆与序列分析
张妍,杨金宏
(安康学院现代农业与生物科技学院,陕西省蚕桑重点实验室,陕西安康725099)
RbcL基因是绿色植物进行光合作用的关键基因,其序列是分子系统学研究中使用最为广泛的分子标记之一。利用PCR扩增和测序,获得了茶树紫阳种RbcL基因744 bp的序列。对来自山茶科7个样品的RbcL序列进行比对和系统聚类分析。结果显示,山茶属的白毛变种、金花茶和丹寨秃茶首先与紫阳茶聚合,其他山茶科植物位于核心聚类群的外围。以大头茶RbcL基因为参照,进行山茶属植物SNP位点的分析,结果显示,在所比对的744 bp的序列中,山茶属共存在10个SNP位点,其中,同义替换4个,非同义替换6个。
茶树紫阳种;RbcL基因;序列分析
DNA条形码(DNA barcoding)是根据生物的遗传物质序列种内变异小于种间变异而实现物种鉴定的一种方法[1]。通过利用1个或几个DNA片段序列对物种进行识别和鉴定,具有快速、准确、客观性强的特点,可以避免在传统鉴定方法中人为因素所造成的主观误判,能够提高鉴定的效率和准确性。RbcL基因的编码蛋白是1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCo)的活性中心,在光合和光呼吸过程中起重要作用,其含量占绿色植物叶片总蛋白的50%,是自然界中含量最丰富的蛋白质[2]。RbcL基因不具有内含子,位于叶绿体基因组的大单拷贝区(LSC),以单拷贝形式存在,已经被广泛应用在绿色植物的系统进化研究中。迄今为止,已经测定了被子植物、裸子植物、苔藓、海藻、光合细菌等多种不同材料中的RbcL基因序列[3]。
陕西安康的紫阳茶产区以紫阳县为中心,地处秦岭南坡,大巴山北麓,具有适宜种茶的土壤条件、气候和品种资源优势,是我国长江以北的重要产茶区之一[4]。紫阳群体种原产地包括安康的紫阳、平利、汉阴、旬阳、汉滨、石泉、岚皋、镇坪等县区,以及汉中的镇巴、西乡等地区,主要分布在海拔1 000 m以下的河谷、丘陵、低山等地带,是该茶区分布最广的一个群体。紫阳种选育自紫阳群体种中叶类槠叶种,是全国推广的良种,各种有益成分高,自然品质好,硒含量丰富,现人工种植已经遍布陕西全省,其产量约占陕西省总产量的3/4[5]。
微量元素硒与人体免疫功能、抗氧化能力、抗癌作用等密切相关[6]。近年来,因紫阳地处富硒带,紫阳富硒茶发展势头十分强劲,2014年全县产茶4 565 t,实现产值7.5亿元,市场前景广阔[7]。但同时以非紫阳茶冒充紫阳茶等的不良市场行为也日益突出,严重损害了紫阳茶的信誉及消费者的利益。茶叶品种是成品茶品质的基础,因此,对茶叶品质有效鉴别的前提是对成品茶的茶树品种进行鉴别。如何从技术上对成品茶进行有效鉴别、维护茶叶市场的正常秩序、促进紫阳茶产业的健康发展,具有重要的现实意义。
本研究成功地克隆了茶树紫阳种RbcL基因片段,并利用多序列比对技术对不同茶叶品种的SNP位点进行了分析,找到了紫阳种特有的SNP位点,并进一步对RbcL基因的适应性进化进行研究,旨在为紫阳群体种的来源和紫阳茶的鉴定提供参考。
1 材料和方法
1.1 材料
试验材料为紫阳种陕茶一号茶叶成品,购自安康市汉水韵茶叶有限公司[8]。
1.2 主要试剂
大肠杆菌DH5α由陕西省蚕桑重点实验室保存,琼脂糖购自Biowest公司,HP植物DNA提取试剂盒购自OMEGA公司,EcoR I限制酶、Taq DNA聚合酶、DNA凝胶回收试剂盒、DNA marker(DL2 000,λ-EcoT14Ⅰdigest)等购自大连宝生物工程有限公司,pGEM-T Easy Vector购自Promega公司,其他试剂均为国产分析纯。
1.3 方法
1.3.1 紫阳茶基因组DNA提取和RbcL基因的PCR扩增称取茶叶干燥成品50 mg,加液氮冷冻研磨,后使用植物DNA提取试剂盒提取茶叶总DNA;同时用同样的方法提取鲜叶基因组作为质量对照。根据常用的RbcL基因序列扩增引物和NCBI登录的茶叶叶绿体基因组序列设计引物,其序列分别为RbcLF:5′-TTATGTCACCACAAACAGAAAC-3′;RbcLR:5′-TTCGCATGTACCTGCAGTAGC-3′。以提取的干燥成品基因组DNA为模板和设计的引物进行PCR扩增,PCR反应程序为:94℃预变性3 min;94℃变性30 s,55℃退火40 s,72℃延伸50 s,30个循环;72℃终延伸10 min。1.5%琼脂糖凝胶电泳对PCR扩增产物进行检测。
1.3.2 紫阳茶叶RbcL基因的克隆鉴定和测序利用DNA凝胶回收试剂盒回收纯化目的条带,并与T载体连接,转化大肠杆菌DH5α感受态细胞,重组质粒经酶切鉴定,送上海生工武汉测序部进行测序。所有步骤均按试剂使用说明书进行。
1.3.3 RbcL基因的序列分析NCBI在线BLAST对紫阳种茶叶的RbcL基因序列进行比对,并下载山茶科的相关序列(表1),采用Clustal X1.83软件分别进行多序列比对[9],采用BoxShade 3.21[10]对比对的序列文件进行描影和打印,统计山茶属内植物的SNP位点。采用Mega 5.0软件构建山茶科内基于RbcL基因的NJ系统发育树,计算1 000次的自展支持值[11]。

表1 所使用的序列及其登录号
2 结果与分析
2.1 紫阳种成品茶RbcL基因PCR扩增和克隆测序结果
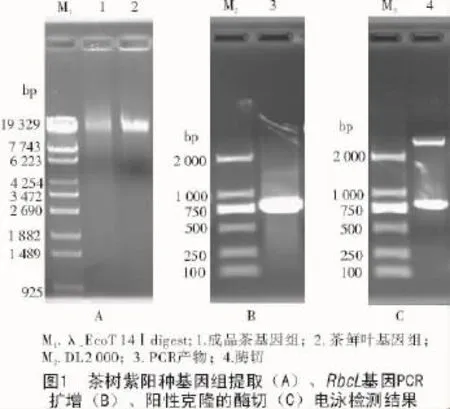
HP植物DNA提取试剂盒(OMEGA)是基于CTAB法[12]的植物基因组提取试剂盒,利用该试剂盒可以成功地提取茶叶成品中的基因组DNA,与鲜叶比较发现,虽然有部分基因组的降解,但主带明显,可以用于PCR等下游实验(图1-A)。以提取的紫阳种成品茶叶基因组DNA为模板,利用RbcLF和RbcLR引物进行PCR扩增。扩增产物经1.5%琼脂糖凝胶电泳检测,在约750 bp处出现单一扩增条带(图1-B),与预期大小相符。回收该条带并进行克隆,阳性克隆经限制性酶切鉴定,电泳结果显示,出现载体和目的片段条带(图1-C),表明克隆成功。对阳性克隆进行测序,结果显示,获得了RbcL基因自起始密码子起始的长744 bp的序列(Genbank登录号:KR296794),表明利用该方法可以成功获得成品茶叶RbcL基因的序列。
2.2 RbcL基因的多序列比对SNP分析
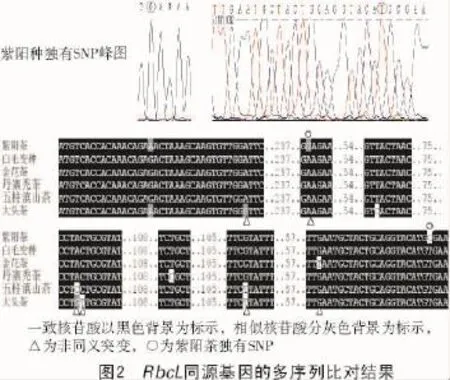
在线BLAST比对分析结果显示,茶树紫阳种RbcL基因与其他山茶属植物的同源区域的相似性在98%以上,保守性较高。以大头茶属大头茶的RbcL基因为参照,分析山茶属植物的SNP位点,结果显示,在所比对的744 bp序列中,本研究的6个山茶科植物中共存在10个SNP位点,其中,发现2个紫阳种独有的SNP位点(图2)。在所有SNP位点中,没有造成氨基酸变化的同义替换(Ks)位点有4个,造成氨基酸变化的非同义替换(Ka)位点有6个,多于Ks位点数,显示其进化可能受到正选择压力。
2.3 RbcL基因的系统进化分析
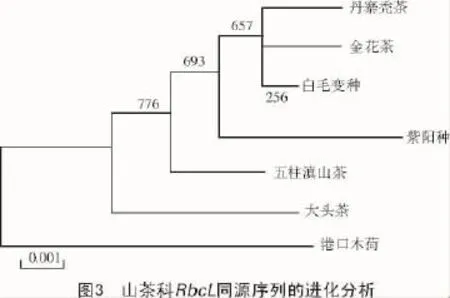
下载其他山茶科植物的RbcL基因同源区域的序列进行Clustal X比对和系统聚类分析,结果显示,来自山茶科山茶属的白毛变种、金花茶和丹寨秃茶首先与紫阳茶聚合,然后与生于海拔2 200 m以上的五柱滇山茶聚合,来自大头属的大头茶和木荷树属的港口木荷分别位于核心聚类群的外围(图3);金花茶和白毛变种树枝分歧的分值低于500,说明该基因非常保守,可能经历回复突变;靠近根部的自展支持值普遍高于树枝末梢,说明该基因适合用于属间的遗传进化分析,不适合用于属内亲缘关系近的物种的遗传分析。
3 讨论与结论
DNA条形码作为一种新的分类系统,可以弥补传统进化和分类方法的不足,加快全球生物物种系统进化和鉴定的步伐,其自Hebert于2003年提出后,已经在动物、植物、真菌和藻类等的鉴定和系统发育研究中发挥了重要作用。在植物中,RbcL,MatK,ITS是目前使用较多的DNA条形码候选序列,但对每一植物科、属或种内都需进行针对性的研究和探索[13]。茶树是典型的异花授粉植物,容易发生杂交和网状进化,经过长期的人工和自然选择,遗传背景非常复杂,各品种间拥有丰富的遗传多样性[14]。本研究结果表明,金花茶和白毛变种树枝分歧的分值仅为256,低于500,不具有统计学意义;而且靠近进化树根部的自展支持值普遍高于树枝末梢,说明在分歧较晚的物种间,该基因的进化位点较少,不适合单独用于系统发育分析,需要联合其他条形码序列。
茶叶品种是形成成品茶品质的关键,但“挂羊头卖狗肉”的不良行为屡见不鲜,如以红茶代替金骏眉、以岩茶代替大红袍、以普通绿茶冒充紫阳富硒绿茶,严重破坏了茶叶市场,因此,如何进行有效的茶叶品种鉴定是急需解决的问题。陈海军等[15]应用随机引物扩增多态性技术(RAPD)对目前浙江推广的10个优良茶树品种进行分析,结果表明,引物S16能在各个品种扩增后产生特异性的分子标记,可以用来鉴别这些品种。陈春梅[16]利用叶绿体基因psbA,ycf15和trnL-F间隔区对山茶属植物13个种进行鉴别发现,ycf15和psbA基因序列在所选材料中SNP位点并不丰富,不适合用于山茶属植物种间的鉴定,trnL-F间隔区序列进化速率较快,可用于山茶属不同种间的亲缘关系研究。本研究成功获得了紫阳种成品RbcL基因744 bp的核苷酸序列,可以通过一个Sanger测序获得该片段DNA信息,在山茶科内,该片段具有明显的种间变异,发现了10个SNP位点,而且2个是紫阳种特有的SNP位点,符合理想DNA条形码的条件,可以用于紫阳种和紫阳茶的鉴定。
Ks一般不受选择的影响,Ka的突变则因选择压力的不同而差异较大。在蛋白质水平上,Ks/Ka的值可以用来判断该基因的进化是否受到自然选择的影响[17]。RbcL基因蛋白是世界上最丰富的蛋白质,其进化和起源具有重要的意义。有研究针对水龙骨科49种植物所进行的相似分析中得到了7个位点受到正选择压力[18]。陈洁等[19]基于分支模型对42种蕨类植物的RbcL基因所受到的选择压力进行了分析,结果检测到4个分支处于正选择压力下。本研究结果表明,山茶科6个种中存在10个SNP位点,其中,6个为非同义突变,4个为非同义突变,说明该基因受到正选择压力是一个普遍的现象。
[1]Hebert PDN,Cywinska A,Ball S,et al.Biological identifications through DNAbarcodes[J].Proc R Soc Lond B,2003,270:313-321.
[2]Andersson I,Backlund A.Structure and function of Rubisco[J]. Plant Physiol Biochem,2008,46:275-291.
[3]Frézal L,Leblois R.Four years of DNA barcoding:current advances and prospects[J].Infect Genet Evol,2008,8:727-736.
[4]程良斌.紫阳富硒茶研究与开发[M].西安:陕西出版集团,2010:103-112.
[5]李瑞.陕南茶区茶树种质资源鉴定与评价[D].杨凌:西北农林科技大学,2011:16-39.
[6]宁婵娟,吴国良.微量元素硒与人体健康及我国富硒食品的开发状况[J].山西农业科学,2009,37(5):88-90.
[7]程渭.今年紫阳茶叶收入12亿元[EB/OL].[2014-12-11].http: //www.zyx.gov.cn/content/detail/554ab722f9313f268ce5c874.html.
[8]余有本,王衍成,纪昌中,等.优良茶树新品种陕茶1号的选育[J].西北农业学报,2013(7):173-177.
[9]Thompson J D,Gibson T J,Plewniak F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided byqualityanalysis tools[J].Nucleic Acids Res,1997,25(24):4876-4882.
[10]Hofmann K,Baron M.Pretty printing and shading of multiple-alignment files[EB/OL].[2016-08-12].http://www.ch.embnet.org/software/BOX_form.html.
[11]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[12]王嘉荟,王琳,王金胜,等.连翘生晒果实和干燥叶片总DNA提取方法比较[J].山西农业科学,2015,43(12):1594-1597.
[13]Chase MW,Salamln N,Wilkinson M,et al.Land plants and DNA barcods:short-term and long-term goals[J].Philos Trans R Soc Lond BBiol Sci,2005,360:1889-1895.
[14]张宏达.茶树的系统分类[J].中山大学学报:自然科学版,1981(1):87-99.
[15]陈海军,赵东,刘祖生.浙江部分茶树良种的RAPD分子鉴定[J].茶叶,2002,28(3):119-121.
[16]陈春梅.基于cpDNA序列的茶树及其近缘植物的亲缘关系研究[D].北京:中国农业科学院,2014:41-48.
[17]Kryazhimskiy S,Plotkin J B.The population genetics of dN/dS[J]. PLoSGenet,2008,4(12):e1000304.
[18]苏应娟,王艇.水龙骨科附生蕨类Rubisco大亚基的适应性进化:正向选择位点的鉴定[J].中山大学学报:自然科学版,2008,47(5):74-80.
[19]陈洁,张丽君,王艇.蕨类植物rbcL基因正选择和负选择位点的鉴定[J].西北植物学报,2009,29(12):2391-2400.
Clonging and Sequence Analysis ofRbcLGene inCamellia sinensiscv.Ziyang
ZHANGYan,YANGJinhong
(College ofMordern Agriculture and Biotechnology,AnkangUniversity,the KeySericultural LaboratoryofShaanxi,Ankang725099,China)
The RbcL is the key gene to carry out photosynthesis and its sequence is widely used in molecular phylogenetic studies in green plants.UsingPCR amplification and sequencing,the paper obtained the RbcL 744 bp sequence ofCamellia sinensis cv.Ziyang. The RbcL sequences of 7 samples within Theaceae Camellia were compared and cluster analysis.The results showed that Camellia sinensis cv.Ziyang,Camellia petelotii,Camellia sinensis var.pubilimba and Camellia danzaiensis voucher preferred polymerization at the same branch,other Theaceae was in the distant branch.Polyspora axillaris as a reference,SNP analysis of RbcL gene was analyzed within Camellia L..The results showed that in the comparison of 744 bp,10 SNP loci,4 synonymous and 6 nonsynonymous replacement were detected.
Camellia sinensis cv.Ziyang;RbcL gene;sequence analysis
S571.1
A
1002-2481(2016)12-1772-04
10.3969/j.issn.1002-2481.2016.12.08
2016-07-31
陕西省大学生创新创业训练计划项目(2016sxjy026)
张妍(1995-),女,陕西渭南人,在校学生,研究方向:植物分子标记。杨金宏为通信作者。
