滹沱河沿岸野生大豆种子β-伴大豆球蛋白表型的多样性
2017-01-06郭志芳田怀东
郭志芳,田怀东
(山西大学生命科学学院,山西太原030006)
滹沱河沿岸野生大豆种子β-伴大豆球蛋白表型的多样性
郭志芳,田怀东
(山西大学生命科学学院,山西太原030006)
山西省原平市境内滹沱河沿岸分布有大量野生大豆。野生大豆种子蛋白质类型丰富,是重要的蛋白质资源。大豆种子蛋白质主要包括β-伴大豆球蛋白(7S球蛋白)和11S球蛋白,其中,β-伴大豆球蛋白主要由76 kD的α′,72 kD的α和52~54 kD的β亚基组成。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)技术,筛选400份滹沱河沿岸野生大豆种质,发掘出5种关于β-伴大豆球蛋白的系列表型:对照型、α′亚基分子量偏高型、α′亚基分子量偏低型、β亚基上位缺失型、β亚基缺失型。结果表明,滹沱河沿岸野生大豆种子β-伴大豆球蛋白性状的多样性,揭示出野生大豆种子β-伴大豆球蛋白具有复杂的分子构成和遗传机制。
野生大豆;β-伴大豆球蛋白;多样性
大豆种子是重要的蛋白质资源,其蛋白质的主要成分是β-伴大豆球蛋白(7S球蛋白)和11S球蛋白,占种子总蛋白含量的70%~80%[1],对大豆蛋白的营养品质起着决定性作用。11S球蛋白由G1~G5亚基组成,分别由Gy1~Gy5基因所编码。β-伴大豆球蛋白主要由76 kD的α′,72 kD的α和52~54 kD的β亚基组成,分别由聚合在大豆基因组6个位点上至少15个成员(CG-1~CG-15)的基因编码而成。11S球蛋白在发育胚细胞的糙面内质网以约60 kD的前体多肽链被合成后,经过翻译后修饰与输送过程,在PSV中被内切为37~45 kD的酸性和18~20 kD的碱性多肽,形成11S六聚体形态。7S球蛋白前体在糙面内质网上合成后,在内质网膜腔内形成立体构造,经由高尔基体被输送到蛋白储藏液泡(PSV)中,进一步被加工成7S三聚体,最终都蓄积在液泡型蛋白体[2-5]。Teraishi等[6-7]研究认为,α′,α和β亚基分别由Cgyl,Cgy2与Cgy3这3个不同的基因控制,而单一显性基因scg-1控制着它们的蓄积。蓄积的β-伴大豆球蛋白约占大豆种子蛋白含量的30%左右,其生化性状与理化性质一定程度上决定着大豆蛋白质的营养品质[8-11]。为了全面开展大豆蛋白质营养品质的遗传育种研究,有必要发掘多样的大豆蛋白质遗传资源。
我国是大豆种质资源大国,保有大量的栽培和野生大豆种质资源。这些种质资源是可供多样球蛋白遗传资源发掘的有用素材。其中,野生大豆种质资源在性状多样性、抗逆抗病性以及适应性等方面,具有栽培大豆无可比拟的优势。野生大豆起源于我国,是国家重点保护的野生植物资源。从北纬24°左右的广东、广西北部地区开始到北纬52°左右的黑龙江畔均有野生大豆的分布[12]。山西省原平市滹沱河流域野生大豆原生境保护区项目于2011年由农业部正式立项[13],成为国家级野生大豆资源保护区。该区域的野生大豆分布广、数量多、密度大,主要分布于原平市区东北滹沱河沿岸。截至目前,对该区域野生大豆种子蛋白质的遗传多样性研究还未见报道。
近年来,山西大学生命科学学院实验室启动了对原平市滹沱河沿岸野生大豆资源状况及其原生态环境的调查研究。本研究采用SDS-PAGE技术,评价了该区域的400份野生大豆种质资源,旨在发掘出关于β-伴大豆球蛋白的系列表型,为大豆蛋白营养品质的遗传育种研究提供有用材料。
1 材料和方法
1.1 试验材料
在山西省原平市滹沱河沿岸采集400份野生大豆(HTWS1~HTWS400)作为供试材料(表1)。这些材料的种子呈椭圆形,籽粒较小,多为黑色,也有棕色与黄褐色(图1)。试验在山西大学进行。

1.2 试验方法
1.2.1 野生大豆种子全蛋白的提取参照Tian等[14]的方法提取种子全蛋白。从400份野生大豆种子中每份各取1粒洗净、烘干,每份种子取1粒粉碎后放入离心管中并按一定比例加入适量的全蛋白提取缓冲液;在漩涡混合仪上振荡混匀后,12℃,120~150 r/min条件下振荡6 h;4℃,5 000 r/min条件下离心20 min后取上清液稀释2.5倍备用。
1.2.2 野生大豆种子β-伴大豆球蛋白的提取参照Liu等[15]的方法,进行β-伴大豆球蛋白的提取。对已通过全蛋白筛选发掘出的特异性代表材料进行β-伴大豆球蛋白的提取。将种子粉碎后按一定比例加入正己烷连续脱脂2次后,在脱脂粉末中加入0.03 mol/L的Tris-HCl(pH值8.5),45℃下振荡1 h;离心后取出上清液,沉淀在相同条件下重复提取,将2次提取的上清液混在一起;加入1 mol/L SBS至0.03 mol/L,混匀后调pH值至6.4,4℃静置贮存过夜后离心,取离心后的上清液加入NaCl至0.25 mol/L,调pH值至5.5,室温下振荡0.5 h;离心后取上清液,加入等量的超纯水混匀;再次离心后,取上清液调pH值至4.8,于冰浴中静置,看到有沉淀析出后离心,去掉上清液;所得蛋白用超纯水清洗后,用全蛋白提取液溶解备用。
1.2.3 SDS-PAGE分析参照文献[12]的方法,用32%丙烯酰胺、0.8%甲叉双丙烯酰胺制备凝胶,将上述提取好的全蛋白液适量加样、电泳。用50%甲醇、10%冰乙酸、0.1%R-250的溶液进行凝胶染色,用25%甲醇、10%冰乙酸的溶液脱色,电泳结束后进行凝胶成像和图像分析。
2 结果与分析
2.1 基于种子全蛋白SDS-PAGE的原平市滹沱河沿岸野生大豆种质的筛选
通过对400份野生大豆种子全蛋白进行筛选,电泳结果如图2所示。选取野生大豆种子β-伴大豆球蛋白主要亚基对应条带无缺失且染色程度相对均匀的种质HTWS-176等作为对照,并发掘出具有5种β-伴大豆球蛋白多样性表型的系列种质资源:对照型、α′亚基分子量偏低型、α′亚基分子量偏高型、β亚基上位缺失型、β亚基缺失型。
从表2可以看出,大部分为对照型种质,发生频度最大,为96.25%;HTWS-386的α′亚基分子量偏低,HTWS-395的α′亚基分子量偏高,发生频度最小,均为0.25%;HTWS-8,HTWS-86,HTWS-79,HTWS-163,HTWS-164的β亚基缺失,发生频度为1.25%;HTWS-42,HTWS-65,HTWS-70,HTWS-96,HTWS-198,HTWS-241,HTWS-367,HTWS-368的β亚基上位缺失型,发生频度为2%。供试材料中特异亚基多态性种质发生的频度较小,为了避免我国大豆蛋白质资源多样性的消失,有必要在分子水平上对大豆种质种子蛋白质性状进行更加全面的发掘。
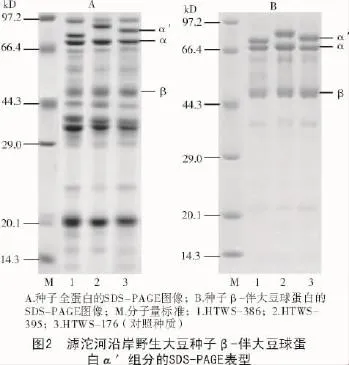

表2 滹沱河沿岸野生大豆种质β-伴大豆球蛋白的多样表型
2.2 代表性野生大豆种质种子β-伴大豆球蛋白性状的表征
为了证实这些多样带型源于β-伴大豆球蛋白表征的多样性,提取相关代表性种质的种子β-伴大豆球蛋白进行表型分析,获得了具有与β-伴大豆球蛋白分子量对应的5种蛋白质带型的多样种质(图3)。结果表明,野生大豆种质种子β-伴大豆球蛋白在亚基组成上具有的多样性与全蛋白显示的多样性一致。进一步使用凝胶成像系统及图像分析软件对β-伴大豆球蛋白进行表征,发现对照种质中α′亚基分子量为76 kD,而HTWS-395的α′亚基分子量为77.4 kD,HTWS-386的α′亚基分子量为75.2 kD。对照种质中β亚基相对含量为27%,而HTWS-8的β亚基相对含量为0,HTWS-42的β亚基相对含量12.5%。这些结果可以得出,HTWS-395具有α′亚基分子量偏高、HTWS-386具有α′亚基分子量偏低,HTWS-8具有β亚基缺失,HTWS-42具有β亚基上位缺失的突变性状。

3 讨论与结论
从大豆种质资源中发掘具有不同球蛋白性状的种质是大豆蛋白质遗传资源开发的有效途径。郭顺堂等[16]研究发现了β亚基缺失的大豆品种。Hajika等[17]报道了β-伴大豆球蛋白中α′,α和β亚基全部缺失的大豆种质。Takahashi等[18-19]发现了α′和α亚基缺失的种质,还发现了α亚基和β亚基的表达量减少的种质材料。本研究从400份滹沱河沿岸原生态野生大豆种质资源中发掘出5种大豆球蛋白表型,分别为:对照型、α′亚基分子量偏低型、α′亚基分子量偏高型、β亚基上位缺失型、β亚基缺失型。这些表型的变化可能起因于调控β-伴大豆球蛋白合成或蓄积的基因突变。表明大豆球蛋白具有复杂的分子构成及遗传机制,指出原平市滹沱河沿岸野生大豆种子球蛋白性状的遗传多样性。本研究结果有望为阐明调控β-伴大豆球蛋白性状表达的遗传机制及大豆蛋白营养品质的遗传育种研究提供借鉴。
[1]MengXX.Summarization about breedingofsoybean qualification[J].Chinese Agricultural Science Bulletin,1992,8(2):14-17.
[2]Barton K A,Thompson J F,Madison J T,et al.The biosynthesis and processing of high molecular weight precursors of soybean glycinin subunits[J].Journal of Biological Chemistry,1982,257(11):6089-6095.
[3]Dickinson CD,Hussein E H,Nielsen NC.Role ofpost-translational cleavage in glycinin assembly[J].The Plant Cell,1989,1(4):459-469.
[4]Okita T W,Rogers J C.Compartmentation of proteins in the endomembrane systemofplant cells[J].Annual Reviewof Plant Biology,1996,47(1):327-350.
[5]Utsumi S,Kitagawa S,Katsube T,et al.Synthesis,processing and accumulation of modified glycinins of soybean in the seeds,leaves and stems of transgenic tobacco[J].Plant Science,1993,92(2):191-202.
[6]Teraishi M,Takahashi M,Hajika M,et al.Suppression of soybean β-conglycinin genes bya dominant gene,Scg-1[J].Theoretical and Applied Genetics,2001,103(8):1266-1272.
[7]Kitamura K.Genetic improvement of nutritional and food processing quality in soybean[J].Japan Agricultural Research Quarterly,1995,29:1-11.
[8]Krivoruchco D,Kaba H,Sambucetti ME,et al.Maturation time and some seed composition characters affecting nutritive value in soybean varieties[J].Cereal Chemistry,1979,56:217-219.
[9]Murphy P A,Chen H P,Hanck C C,et al.Soybean storage protein composition and tofu quafity[J].Food Technology,1997,51:86-88.
[10]MurphyP A,Resurreceion A P.Varietal and environmental differences in soybean glycinin and β-conglycinin content[J].Journal of Agricultural and Food Chemistry,1984,32:911-915.
[11]Cai T,Chang K C.Processing effect on soybean storage proteins and their relationship with tofu quality[J].Journal of Agricultural and Food Chemistry,1999,47:720-727.
[12]原平市农业委员会.山西省原平市滹沱河流域野生大豆原生境保护区项目简介[J].农业工程技术:新能源产业,2013,34(11):15.
[13]李福山.中国野生大豆资源的地理分布及生态分化研究[J].中国农业科学,1993,26(2):47-55.
[14]Tian H D,Satoh H,Takemoto Y.Inheritance of novel 57H mutations in rice and their effect on compartmentation of endosperm storage proteins[J].International Journal of Plant Sciences,2004,165(4):537-544.
[15]Liu C,Wang H L,Cui Z M,et al.Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein [J].Food Chemistry,2007,102:1310-1316.
[16]郭顺堂,孟岩,张雪梅,等.中国大豆蛋白亚基构成分析与缺失部分亚基的特异大豆品种的筛选[J].作物学报,2006,32(8):1130-1134.
[17]Hajika M,Takahashi M,Sakai S,et al.Dominant inheritance of a trait lacking β-conglycinin detected in a wild soybean line[J]. BreedingScience,1998,48(4):383-386.
[18]Takahashi K,Banaba H,Kikuchi A,et al.An induced mutant line lacking the α-subunit of β-conglycnin in soybean[J].Breeding Science,1994,46:251-255.
[19]Ladin B R,Doyle J J,Beachy R N.Molecular characterization of a delection mutation affecting the α'subunit of β-conglycnin of soybean[J].Molecule Applied Genetics,1984,2:372-380.
Diversity of Phenotypes of β-conglycinin in Seeds of the Wild Soybeans along the Hutuo River
GUOZhi-fang,TIANHuai-dong
(College ofLife Sciences,Shanxi University,Taiyuan 030006,China)
The wild soybeans along the Hutuo River located in Yuanping city of Shanxi province are important protein resources. The main components ofsoybean seed proteins include β-conglycinin(7S globulin)and 11S globulin.β-conglycinin mainly consists of α′subunit of76 kD,α subunit of72 kD and β subunit of52-54 kD.In this study,5 types phenotypes of β-conglycinin,the control type of β-conglycinin,high molecular weight of α′subunit,low molecular weight of α′subunit,upper lacked type of β subunit and lacked type of β subunit,are sought performing SDS-PAGE technique,by analysising 400 wild soybeans germplasms along Hutuo River.The results indicate that the diversityphenotypes ofβ-conglycinin in seeds ofwild soybeans alongthe HutuoRiver and reveale the complexity for molecular-composition and genetic-mechanismofβ-conglycinin in seeds ofwild soybeans.
wild soybean;β-conglycinin;diversity
S565.1
A
1002-2481(2016)04-0452-04
10.3969/j.issn.1002-2481.2016.04.07
2016-01-29
山西省科技攻关项目(20130311006-3)
郭志芳(1990-),女,山西朔州人,在读硕士,研究方向:植物种质创新。田怀东为通信作者。
