微小RNA-29c在胶质瘤中的表达及其对细胞分裂周期蛋白42的调控作用和对细胞增殖的影响
2017-01-06韩福新张蕊马善波王彦刚
韩福新,张蕊,马善波,王彦刚
(第四军医大学第一附属医院西京医院,a.神经外科,b.耳鼻喉头颈外科,c.药剂科,陕西 西安 710032)
微小RNA-29c在胶质瘤中的表达及其对细胞分裂周期蛋白42的调控作用和对细胞增殖的影响
韩福新a,张蕊b,马善波c,王彦刚a
(第四军医大学第一附属医院西京医院,a.神经外科,b.耳鼻喉头颈外科,c.药剂科,陕西 西安 710032)
目的 探究微小RNA-29c(miRNA-29c)在胶质瘤中的表达水平以及表达水平对胶质瘤增殖的影响。方法 选取手术切除的胶质瘤组织标本80例,根据世界卫生组织肿瘤分类分级标准,将组织标本进行分级,同时收集非胶质瘤组织标本25例作为对照组。将上述收集的组织标本制作为微组织阵列。同时切取5 μm×5 μm组织切片留用蛋白细胞分裂周期蛋白42(CDC42)免疫组化检测以及miRNA-29c原位杂交检测。结果 非胶质瘤组织标本miRNA-29c表达水平明显高于胶质瘤组织标本表达,miRNA-29c表达水平随着肿瘤分化级别的提升而降低;非胶质瘤组标本CDC42表达水平明显低与胶质瘤组,且随着胶质瘤分化级别提高CDC42水平明显增加;miRNA-29c靶mRNA生物信息学预测结果提示人CDC42mRNA是miRNA-29c潜在的靶mRNA;人胶质瘤细胞U87MG经过miRNA-29c mimics 转染48 h后,转染组细胞miRNA-29c表达水平明显高于空白对照组以及Scr转染对照组,通过转染方式可将miRNA-29c mimics成功转入人胶质瘤细胞U87MG,并且能够成功表达;miRNA-29c mimics转染组CDC42表达明显低于两对照组,在人胶质瘤细胞U87MG中miRNA-29c可以降解CDC42 mRNA的表达,从而降低CDC42蛋白的表达水平;miRNA-29c mimics转染组人胶质瘤细胞增殖活性在48、72、96 h明显低于空白对照组与Scr转染对照组,miRNA-29c可以有效的抑制人胶质瘤细胞U87MG增殖活性。结论 miRNA-29c是人胶质瘤的有效抑瘤miRNA之一,miRNA-29c表达水平可作为临床上判断胶质瘤分化分级的参考依据,miRNA-29c表达水平的降低减少了对其下游基因CDC42的抑制作用,引起CDC42表达的异常增加,导致肿瘤细胞的异常增殖。研究结果显示miRNA-29c在胶质瘤的发生发展过程中起着重要的调控作用。
胶质瘤;微小RNA-29c;细胞分流周期蛋白42;细胞增殖
微小RNA(microRNA,miRNA)是一种长度在20~25 nt范围内,具有高度保守特性,非编码的小分子单链RNA[1]。miRNA可以有效的沉默下游基因的表达,以起到调控基因表达与蛋白翻译,调控人体多种生理、病理功能,对人体正常功能与病理状态调控具有重要作用[2]。已知多种肿瘤的发生于发展与促瘤miRNA(Onco-miRNA)的异常表达增高以及抑瘤miRNA(TS-miRNA)的异常表达降低有密切的关系[3]。miRNA-29s所在的miRNA家族包括有由1q32.2与7q32.3两个基因片段编码的三个miRNA成员,分别为hsa-miRNA-29a、hsa-miRNA-29b以及hsa-miRNA-29c[4]。目前,有研究报道显示,作为TS-miRNA中一种重要成员miRNA-29c,在某些颅脑肿瘤的发生发展过程中其表达的异常降低起着重要的调控作用[5]。小G蛋白家族所属蛋白细胞分裂周期蛋白42(CDC42),能在细胞信号通路过程中发挥重要的开关作用,利用其GTP酶活性,作用于多种细胞信号通路,参与细胞增殖、凋亡等生理生化过程。本研究小组前期研究结果显示,miRNA-29a在胶质瘤细胞中的表达水平与胶质瘤分化程度呈现相关关系,另外miRNA-29a可通过降低下游基因CDC42的表达,抑制胶质瘤细胞的增殖、分化和转移。但miRNA-29c的表达异常是否存在与胶质瘤中,通过改变miRNA-29c的表达能否改变胶质瘤细胞的增殖、分化和转移情况。为探究miRNA-29c在胶质瘤中的表达水平以及表达水平对胶质瘤增殖的影响,对不同人胶质瘤组织及细胞系进行研究,现将结果报告如下。
1 资料与方法
1.1 临床资料
1.1.1 组织标本 选取第四军医大学第一附属医院西京医院2012年1月至2015年6月神经外科胶质瘤手术切除治疗患者80例,其中男性45例,女性35例,年龄13~46岁,平均年龄(33.47±13.19)岁,收集手术切除胶质瘤组织标本。根据世界卫生组织肿瘤分类分级标准,将收集的组织标本进行分级,其中I~II级组标准25例,III级组标本25例,IV级组标本25例。同时收集非胶质瘤组织标本25例作为研究的对照组。将上述收集的组织标本制作为微组织阵列。同时切取5 μm×5 μm组织切片留用CDC42免疫组化检测以及miRNA-29c原位杂交检测。本研究由我院医学伦理委员会批准通过并进行监督。
1.1.2 细胞系 研究所用U87MG人胶质母细胞瘤细胞购买自中国科学院细胞库,细胞状态良好,形态正常。
1.1.3 研究试剂 ABC检测试剂盒,miRNA-29c寡核苷酸探针,细胞增殖分析(MTS)试剂盒,Trizol试剂,兔抗人CDC42多克隆抗体,小鼠抗人β-actin单克隆抗体,miRNA无义对照序列,罗丹明标记抗地高辛抗体,辣根过氧化物酶标记的山羊抗兔IgGⅡ抗,细胞培养基,PVDF膜,Lipofectamine 2000试剂,胎牛血清,miRNA反转录试剂盒,实时定量PCR试剂盒,miRNA-29c mimics 及Hairpin-it miRNA实时定量检测试剂盒,Opti MEM试剂,辣根过氧化物酶标记的山羊抗小鼠IgGⅡ抗。
1.2 方法
1.2.1 寡核苷酸探针原位杂交 原位杂交所用寡核苷酸探针序列以及无义对照探针序列5′端连接均有地高辛标记序列。切片脱腊、入水、常规探针杂交、孵育罗丹明标记抗地高辛抗体、DAPI复染、甘油封片。使用荧光显微镜采集图像,使用Image Pro Plus 5.0软件分析所得结果。
1.2.2 免疫组化 切片脱腊、入水、常规免疫组化染色(CDC42抗体稀释比例1∶150)、苏木精复染、树胶封片。显微镜采集图像,分析所得结果。
1.2.3 生物信息学预测 采用miTarBase和miRanda生物信息学分析软件,预测CDC42 mRNA 3′非翻译序列(3′-UTR)中miRNA-29c种子序列的互补序列。
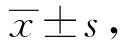
2 结果
2.1 miRNA-29c原位杂交检测结果 DAPI复染经荧光显微镜激光激发后可使组织细胞核呈现蓝色荧光,miRNA-29c杂交信号在染色后激光激发后可呈现出红色荧光。miRNA-29c信号阳性细胞中可在蓝色荧光细胞核周围见大量红色miRNA-29c信号荧光,miRNA-29c信号阴性细胞内仅可见蓝色细胞核荧光,无可见红色荧光信号。研究检测结果显示,4组组织标本均可见不同程度的红色荧光信号,即非胶质瘤组织与各级胶质瘤组织均有不同程度的miRNA-29c表达,同时结果显示,非胶质瘤组织标本miRNA-29c表达水平明显高于胶质瘤组织标本表达,miRNA-29c表达水平随着肿瘤分化级别的提升而降低,4组组织标本miRNA-29c表达水平差异有统计学意义(P<0.001)。
2.2 CDC42免疫组化检测结果 苏木精复染可使细胞核呈现蓝色,在包浆中CDC42被染色呈现棕黄色显色。CDC42阳性细胞可见蓝色细胞核以及棕黄色包浆,CDC42阴性细胞仅可见蓝色细胞核。免疫组化检测结果显示四组胶质瘤标本均可见不同程度CDC42染色,非胶质瘤组标本CDC42表达水平明显低与胶质瘤组,且随着胶质瘤分化级别提高CDC42水平明显增加,4组组织标本CDC42表达水平差异有统计学意义(P<0.001)。
2.3 miRNA-29c靶mRNA生物信息学预测结果 miRNA-29c靶mRNA生物信息学预测结果显示,长度为1 426 bp的人CDC42 mRNA的3′UTR片段,人CDC42 mRNA的3′UTR片段中包含有3个miRNA-29c靶序列基因序列区域,3个靶序列基因序列区域分别位于靶序列基因序列区1:581~587 bp,靶序列基因序列区2:946~953 bp,靶序列基因序列区3:999~1 006 bp。这3个靶序列基因序列区均存在有与miRNA-29c相互互补的靶基因序列,靶序列基因序列区1、2为相对保守靶序列基因,靶序列基因序列区3为高度保守靶序列基因。以上miRNA-29c靶mRNA生物信息学预测结果提示人CDC42 mRNA是miRNA-29c潜在的靶mRNA,图1。
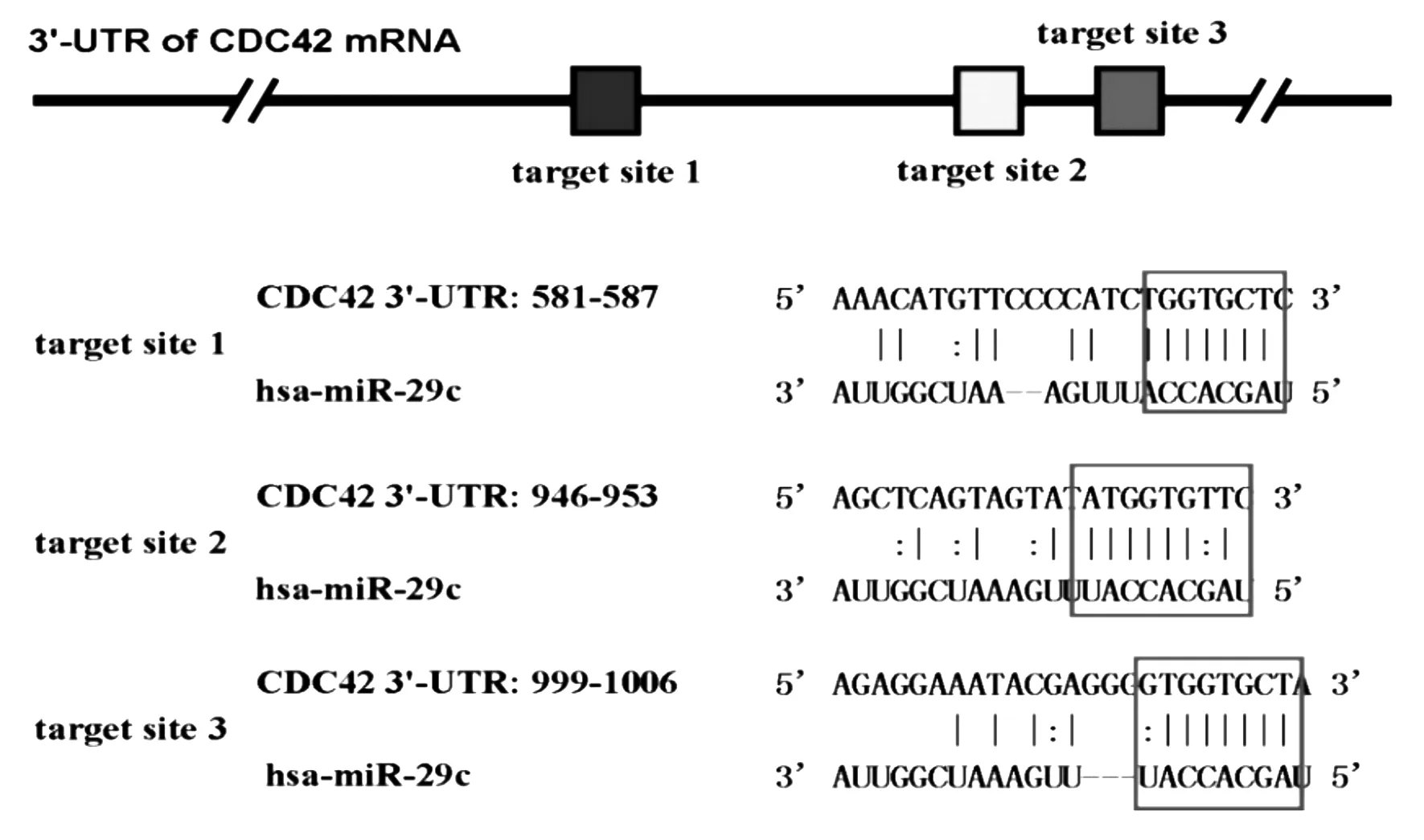
图1 人CDC42mRNA中miRNA-29c靶点生物信息学预测
2.4 人胶质瘤细胞miRNA-29c转染效率检测 通过Hairpin-it miRNA实时定量PCR检测结果显示,人胶质瘤细胞U87MG经过miRNA-29c mimics 转染48 h后,转染组细胞miRNA-29c表达水平明显高于空白对照组以及Scr转染对照组,转染结果差异有统计学意义(F=84.21,P<0.001)。研究结果表明通过转染方式可将miRNA-29c mimics成功转入人胶质瘤细胞U87MG,并且能够成功表达。
2.5 miRNA-29c对U87MG细胞CDC42表达的调控作用 通过实时定量qRT-PCR和Western blot检测,结果显示,miRNA-29c mimics转染组CDC42表达明显低于两对照组(F=37.38,P<0.001;F=14.26,P=0.005)。研究结果表明在人胶质瘤细胞U87MG中miRNA-29c可以降解CDC42 mRNA的表达,从而降低CDC42蛋白的表达水平。见图2。
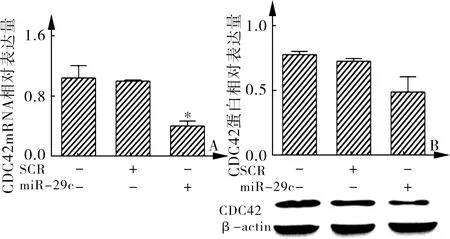
A.CDC42 mRNA相对表达量 B.CDC42蛋白相对表达量
图2 空白对照组和Scr对照组及 miRNA-29c mimics转染组CDC42 mRNA和蛋白相对表达量的比较
2.6 miRNA-29c对人胶质瘤细胞细胞增殖的影响 通过MTS试剂盒检测人胶质瘤细胞细胞增殖水平,绘制MTS曲线,检测结果显示miRNA-29c mimics转染组人胶质瘤细胞增殖活性在48、72、96 h明显低于空白对照组与Scr转染对照组,差异有统计学意义(F=8.25,P=0.02;F=13.25,P=0.008;F=74.78,P<0.001)。结果表明miRNA-29c可以有效的抑制人胶质瘤细胞U87MG增殖活性。见图3。
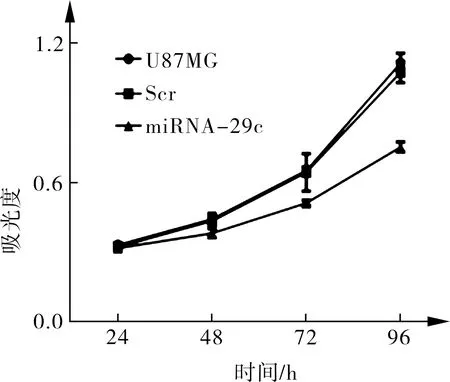
图3 miRNA-29c转染对人胶质瘤细胞U87MG细胞增殖的影响
3 讨论
作为神经外科最常见的颅脑原发性肿瘤的胶质瘤,按照世界卫生组织胶质瘤肿瘤分级标准可以分级为I、Ⅱ、Ⅲ、Ⅳ四个级别[6]。有文献报道,根据临床随访研究显示,同一分级级别胶质瘤患者治疗后预后效果具有较大差异[7]。近年来有大量报道证实,分子学水平诊断在临床诊断、分级判定、预后预测等具有重要的指导意义[8]。miRNA可以有效的沉默下游基因的表达,以起到调控基因表达与蛋白翻译,调控人体多种生理、病理功能,对人体正常功能与病理状态调控具有重要作用[9]。已知多种肿瘤的发生于发展与Onco-miRNA的异常表达增高以及TS-miRNA的异常表达降低有密切的关系[10]。TS-miRNAs表达异常是对某些恶性肿瘤的发生、发展具有重要的影响。作为TS-miRNA中一种重要成员miRNA-29c,在某些颅脑肿瘤的发生发展过程中其表达的异常降低起着重要的调控作用[11]。同时已有研究报道表明,miRNA-29c在多种其他肿瘤,例如肺癌、肝癌、白血病等颅脑外肿瘤中异常降低,与肿瘤的发生发展有着密切联系[12]。本研究miRNA-29c原位杂交检测结果显示,非胶质瘤组织标本miRNA-29c表达水平明显高于胶质瘤组织标本表达,miRNA-29c表达水平随着肿瘤分化级别的提升而降低。结果提示miRNA-29c是人胶质瘤的有效抑瘤miRNA之一,miRNA-29c表达水平可作为临床上判断胶质瘤分化分级的参考依据。
小G蛋白家族所属蛋白细胞分裂周期蛋白42(CDC42),能在细胞信号通路过程中发挥重要的开关作用,利用其GTP酶活性,作用于多种细胞信号通路,参与细胞增殖、凋亡等生理生化过程[13]。研究表明,p21激活激酶(p21-activated kinases,PAKs)是目前研究得最为清楚的CDC42下游效应分子,通过激活AKT、Raf-MAPK等信号通路在细胞增殖、凋亡等方面具有重要的调控作用[14-15]。CDC42免疫组化检测结果显示非胶质瘤组标本CDC42表达水平明显低与胶质瘤组,且随着胶质瘤分化级别提高CDC42水平明显增加。实时定量qRT-PCR和Western blot检测结果显示,在人胶质瘤细胞U87MG中miRNA-29c可以降解CDC42 mRNA的表达,从而降低CDC42蛋白的表达水平。MTS试剂盒检测人胶质瘤细胞细胞增殖水平结果显示miRNA-29c可以有效的抑制人胶质瘤细胞U87MG增殖活性。
综上所述,miRNA-29c是人胶质瘤的有效抑瘤miRNA之一,miRNA-29c表达水平可作为临床上判断胶质瘤分化分级的参考依据,miRNA-29c表达水平的降低减少了对其下游基因CDC42的抑制作用,引起CDC42表达的异常增加,导致肿瘤细胞的异常增殖。研究结果显示miRNA-29c在胶质瘤的发生发展过程中起着重要的调控作用。
[1] 石翠娟,王影,于士柱,等.胶质瘤miR-29c表达异常减少及其对肿瘤细胞增殖的影响[J].中国肿瘤临床,2015,42(1):47-52.
[2] Li X,Lian L,Shen Y,et al.MicroRNA-26a modulates transforming growth factor beta-1-induced proliferation in human fetal lung fibroblasts[J].Biochem Bioph Res Co,2014,454(4):512-517.
[3] 王影.miR-29异常减少在胶质瘤发生发展中的作用及其机制研究[D].天津:天津医科大学,2013.
[4] Fan Y,Song X,Du H,et al.Cullin1 regulates proliferation,migration and invasion of glioma cells[J].Med Oncol,2014,31(10):1-8.
[5] Li C,Lei B,Huang S,et al.H19 derived microRNA-675 regulates cell proliferation and migration through CDK6 in glioma[J].Am J Transl Res,2014,7(10):189.
[6] 杨学军.解读《世界卫生组织中枢神经系统肿瘤分类(2007年)》[J].中国神经精神疾病杂志,2007,33(9):513-517.
[7] 孟伟.microRNA参与脑肿瘤干细胞凋亡的研究[D].广州:南方医科大学,2012.
[8] 孙静.胶质瘤miR-29s表达异常减少对其DNMT3A/3B的影响及其机制研究[D].天津:天津医科大学,2014.
[9] 余纯亦.mir-29家族对同一靶基因调控的热力学性质及其实验研究[D].武汉:华中师范大学,2012.
[10] Lee S,Craig BT,Romain CV,et al.Silencing of CDC42 inhibits neuroblastoma cell proliferation and transformation[J].Cancer Lett,2014,355(2):210-216.
[11] Sun JY,Xiao WZ,Wang F,et al.MicroRNA-320 inhibits cell proliferation in glioma by targeting E2F1[J].Mol Med Rep,2015,12(2):2355-2359.
[12] 刘辉.干性相关Has-miR-21-3p与食管癌的关系研究[D].南京:东南大学,2012.
[13] 唐海林.以LRRC4为核心的多相调控环路在脑胶质瘤中的作用机制研究[D].南京:中南大学,2011.
[14] Baosheng Z,Guoyun B,Yipin Z,et al.Knockdown of CDC2 expression inhibits proliferation,enhances apoptosis,and increases chemosensitivity to temozolomide in glioblastoma cells[J].Med Oncol,2015,32(1):1-8.
[15] Li C,Holmstrφm K,Qiu W,et al.MicroRNA-34a Inhibits Osteoblast Differentiation and In Vivo Bone Formation of Human Stromal Stem Cells[J].Stem Cells,2014,32(4):902-912.
Expression of microRNA-29c in gliomas and its effect on cell division cycle protein 42 and cell proliferation
HAN Fuxina,ZHANG Ruib,MA Shanboc,et al
(a.DepartmentofNeurosurgery;b.DepartmentofHeadandNeckSurgery;c.DepartmentofPharmacy,TheFirstAffiliatedHospitalofTheFourthMilitaryMedicalUniversity,Xi′an,Shaanxi710032,China)
Objective To explore the expression of miRNA-29c in gliomas and its effecton the proliferation of glioma cells.Methods Eighty samples of surgical resection of glioma were collected in the Department of Neurosurgery in The First Affiliated Hospital of The Fourth Military Medical University,thenglioma tissue specimens were classified according to WHO Tumor Classification Standards and 25 specimens of non glioma tissues were collected as the control group.Tissue samples were fabricated as micro arrays.Simultaneous removal of 5 μm×5 μm tissue section was retained cell protein division cycle protein 42(CDC42)immunohis to chemical detection and in situ miRNA-29c hybridization detection.Results The expression level of miRNA-29c in non glioma tissue specimen was significantly higher than that in glioma tissue specimen,which decreased with the increase of tumor differentiation level.The expression of CDC42 in non glioma group wassignificantly lower than that in glioma group,which increased significantly with the increase of tumor differentiation level.miRNA-29c target mRNA bioinformatics prediction results suggested that human CDC42 mRNA was the potential target mRNA of miRNA-29c.Forty-eight hours after human glioma cells U87MG were transfected by miRNA-29c mimics,the expression level of miRNA-29c transfected cells was significantly higher than the control group and Scr transfection group.miRNA-29c mimics could be successfully transfected into human glioma cells U87MG,and couldbe successfully expressed;the expression of CDC42 in miRNA-29c mimics transfection group was significantly lower than the two control groups.In human glioma cells U87MG miRNA-29c could degrade CDC42 mRNA expression,thereby reducing the expression level of CDC42 protein.In miRNA-29c mimics transfected group the proliferation activitiesof humanglioma cell in 48 hours,72 hours and 96 hours were significantly lower than those of blank control group and Scrtransfection control group.miRNA-29c could effectively inhibit the proliferation activity of human glioma U87MG cells.Conclusions miRNA-29c can effectively inhibitshuman glioma,the expression of which can be used as a clinical reference for the differentiation of glioma.The decreased expression of miRNA-29c reduces its inhibition of CDC42,which results in the abnormal increase in CDC42 and the abnormal proliferation of tumor cells.The results indicate that miRNA-29c plays an important role in the occurrence and development of gliomas.
Glioma;MiRNA-29c;Cell division cycle 42;Proliferation
王彦刚,男,副主任医师,硕士生导师,研究方向:脑、脊髓肿瘤、癫痫,功能性神经系统疾病,E-mail:yg-wang@163.com
10.3969/j.issn.1009-6469.2016.11.016
2016-04-13,
2016-06-20)
