2型糖尿病合并肾性高血压模型的建立及评价
2017-01-06孙丽薇张巧香张世玉罗烘权顾为望
万 斌,孙丽薇,张巧香,张世玉,罗烘权,顾为望*
(1.南方医科大学实验动物中心,广东广州 510515;2.中山大学中山医学院医学遗传学教研室,广东广州 510080;3.南方医科大学南方医院超声科,广东广州 510515)
2型糖尿病合并肾性高血压模型的建立及评价
万 斌1,孙丽薇2,张巧香1,张世玉3,罗烘权1,顾为望1*
(1.南方医科大学实验动物中心,广东广州 510515;2.中山大学中山医学院医学遗传学教研室,广东广州 510080;3.南方医科大学南方医院超声科,广东广州 510515)
制备一种发病过程类似于人类2型糖尿病合并肾性高血压疾病的大鼠模型。大鼠高脂高糖膳食4周后,予快速腹腔注射链脲佐菌素(STZ)溶液28 mg/kg,制作成2型糖尿病模型。2周后,连续3 d均测得空腹血糖(FBG)≥7.8 mmoL/L或随机血糖(RBG)≥16.7 mmol/L,为2型糖尿病成模标准。待血糖稳定后,再用改良的“两肾一夹法”结扎肾动脉,造成一侧肾动脉狭窄,形成肾性高血压。 2周后,连续3 d均测得大鼠收缩压(SBP)≥140 mmHg,同时FBG≥7.8 mmol/L或RBG≥16.7 mmol/L,确定为2型糖尿病合并肾性高血压模型制作成功。4周后,模型大鼠血糖、血压稳定。与空白对照组相比,复合模型组大鼠出现体重减轻、空腹血糖升高、糖化血红蛋白值升高(P<0.01),血压升高(P<0.01);与糖尿病组和假手术组相比,复合模型组大鼠血肌酐,尿素氮变化不明显(P>0.05),但血压明显升高(P<0.01);同时,彩超结果显示,复合模型组大鼠左侧肾脏、肾动脉直径均变小,血流速增快。大鼠高脂高糖膳食后,用低剂量链脲佐菌素(STZ)溶液腹腔注射,再用改良的“二肾一夹”法制备的2型糖尿病合并肾性高血压大鼠模型,在一定程度上较好地模拟出该疾病的发病特点,可为2型糖尿病合并肾性高血压后的临床及试验研究提供一个稳定、实用、有效的新模型。
高脂高糖; 链脲佐菌素(STZ );2型糖尿病;肾性高血压;大鼠
糖尿病(DM)是一种慢性代谢性疾病,主要以慢性高血糖为主要表现。按发病类型,临床上一般将糖尿病分为1型和2型两大类。2型糖尿病又被称为非胰岛素依赖型糖尿病,几乎占了糖尿病患者的90%以上。持续高血糖和长期代谢紊乱可导致全身组织器官,特别是眼、肾、心血管、神经系统的损害及其功能障碍,而最严重的属动脉粥样硬化后形成血栓,堵塞人体的重要血管。血栓停留在肾动脉将导致肾动脉主干或分支狭窄或阻塞,使肾血流量减少而引起肾性高血压[1]。
目前单纯制备2型糖尿病模型、肾性高血压模型的文献较多,但是还缺少能建立两者复合模型的方法。因此,本研究采用先建立大鼠糖尿病模型,再在糖尿病模型的基础上手术结扎大鼠单侧肾动脉,造成肾动脉狭窄,最后制作出了2型糖尿病合并肾性高血压模型。该模型与临床上2型糖尿病合并肾性高血压病病人的症状体征较吻合,且具有经济、方便、实用等优点,更适合应用于2型糖尿病合并肾性高血压病的临床治疗及基础研究。现将模型制作的方法及评价详述如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 8月龄~10月龄、体重为360 g±20 g的SPF级Wistar雄性大鼠,50只,由南方医科大学实验动物中心提供(许可证号:SCXK[粤]2011-0015),符合国际动物伦理学标准。大鼠饲养于南方医科大学动物实验中心SPF级动物实验室,室温20℃~26℃,相对湿度55%~70%,自由饮水、饮食。
1.1.2 主要试剂及药品 链脲佐菌素(STZ),Sigma公司产品;胆固醇、胆酸钠、蛋黄粉等,河南祥盛食品添加剂有限公司产品;糖化血红蛋白(GHbA1c)试剂盒,上海广锐生物科技有限公司产品。
1.1.3 主要仪器及设备 0.25 mm针灸针,北京汉医医疗器械中心产品;稳豪型血糖仪及试纸,美国强生公司产品;pH计,德国赛多利斯产品;酶标仪,美国赛默飞公司产品;CODA无创血压测定分析系统Kent scientific 公司产品;iu22彩色多普勒超声诊断仪及12-5探头,德国飞利浦公司产品。
1.2 方法
1.2.1 模型建立及分组
1.2.1.1 2型糖尿病大鼠模型制作 按如下配方比例配置高脂高糖饲料,用于造模大鼠的常规饲养。蔗糖15%、胆固醇3.5%、胆酸钠0.3%、猪油14%、蛋黄粉5%、基础饲料62.2%,混合、搅拌均匀,加水适量,装机塑性烘干。将50只雄性Wistar大鼠随机抽取10只,作为空白对照组,余下40只大鼠均用于造模。造模大鼠给予高脂高糖膳食,空白对照组大鼠给予普通膳食。4周后对造模大鼠进行口服葡萄糖耐量试验(OGTT) ,待其形成胰岛素抵抗后,按STZ溶液28 mg/kg剂量腹腔注射(冰浴避光下,将STZ溶于pH4.2~4.5的柠檬酸-柠檬酸钠缓冲液中,配置浓度为10 g/L)[2-5]。空白对照组大鼠注射等体积的柠檬酸-柠檬酸钠缓冲液。2周后,连续3 d均测得FBG≥7.8 mmol/L或RBG≥16.7 mmol/L[6],为2型糖尿病模型成模标准,最后稳定成模大鼠共36只。
1.2.1.2 2型糖尿病合并肾性高血压大鼠模型制作及试验分组 将上述2型糖尿病模型大鼠随机分为糖尿病组(即糖尿病大鼠)、假手术组(即糖尿病开腹未手术的大鼠)、复合模型组(即糖尿病后肾动脉结扎手术的大鼠),每组各12只。复合模型组大鼠麻醉后固定,保持右侧卧位,消毒备皮后铺巾。在左侧肋弓下缘平行于脊柱约1 cm处向下剪开约2.0 cm左右切口,逐层剪开至腹腔,将生理盐水打湿后的纱布包裹裸露的肾脏。充分暴露肾脏及腹主动脉,同时确保肾蒂不能出现扭转,用棉签轻轻擦拭包裹肾动、静脉外侧的筋膜,然后在腹主动脉与肾动脉的分叉处用玻璃分针将肾动、静脉分开,剥离约0.5 cm~1.0 cm的长度,穿单线备用,把0.25 mm直径的针灸针置于肾动脉一侧并与肾动脉平行,用3-0号缝合线结扎肾动脉后抽出针灸针,术后常规抗炎一周[7-8]。假手术组除不结扎左肾动脉外,其余操作均同复合模型组。2周后,连续3 d均测得大鼠SBP≥140 mmHg[9],同时FBG≥7.8 mmol/L或RBG≥16.7 mmol/L,确定为2型糖尿病合并肾性高血压模型制作成功(图1)。

1~5.分别代表左肾、左肾静脉、左肾动脉、0.25 mm针灸针、缝合线
1-5. Which represent respectively the left kidney,left renal vein,left renal artery,0.25 mm acupuncture needle and sutures
图1 具体的解剖位置
Fig.1 Specific anatomical location
1.2.2 一般行为观察 所有大鼠均用干性饲养笼饲养,观察大鼠精神状态、体重变化、大小便情况。造模完成后计算大鼠存活率及成模率。
1.2.3 体重测量 测定各组大鼠在造模前、高脂高糖膳食4周后及糖尿病模型完成后的体重变化。
1.2.4 口服葡萄糖耐量(OGTT)、FBG及糖化血红蛋白(GHbA1c)值测定 高脂高糖膳食4周后,所有大鼠均进行口服葡萄糖耐量试验。OGTT试验:禁食12 h后,250 g/L葡萄糖溶液按1 g/kg剂量灌胃,测 0、0.5、1、2 h的尾静脉血糖浓度;糖尿病成模2周后,测所有大鼠FBG和GHbA1c值。FBG测定:禁食12 h后,尾静脉采血后经血糖仪测得;GHbA1c值的测定:麻醉大鼠后,眼眶静脉丛采血1 mL左右,分离血清用作待测样品。GHbA1c ELISA检测试剂盒用于待测样品的分析,酶标仪测得样品OD值后根据标准曲线方程计算各大鼠血清GHbA1c浓度。
1.2.5 血压值测定 复合模型完成2周后,采用CODA无创血压测定分析系统测量各组大鼠的血压值。将大鼠放于配套的大鼠固定器内,置于37℃预热箱上使大鼠适应10 min,待大鼠安静后,再选择合适的血流阻断套管和脉搏感受套管,将血流阻断套管套住大鼠尾根部,脉搏感受套管套住大鼠尾中部固定,打开无创血压测量软件,设置15个循环和5 min的检测时间后开始测量。当5个循环后规律性的脉搏波出现,则系统自动计数。当加压套内压力升高到脉搏波完全消失时,仪器自动放气,出现第一个脉搏波时所对应的压力值即为收缩压(SP),当两波型交叉时所对应的压力值即为舒张压(DP),每只大鼠血压均重复测量3次后取其平均值。
1.2.6 彩超检查 复合模型完成2周后,各组大鼠进行彩超检查。麻醉大鼠后,使大鼠保持俯卧位,检查部位剃毛(背部及两侧腹部)并涂上耦合剂,超声探头探查双侧肾脏大小及肾动脉血流速度。
1.2.7 血肌酐(Cr)、尿素氮(BUN)值测定 待所有试验结束,从每组随机抽取6只大鼠,用30 g/L戊巴比妥钠腹腔注射麻醉后,开腹从下腔静脉采血3 mL,分离血清。全自动血液生化分析仪测得各组大鼠血肌酐、尿素氮值。
1.2.8 组织病理学观察 将以上6只大鼠行心脏灌注,待血液基本排出,采集胰腺、左肾组织,用100 mL/L甲醛固定后制作石蜡切片,进行HE染色。观察各组大鼠胰腺和左肾脏组织病理学变化[10]。

2 结果
2.1 一般行为观察
空白对照组大鼠,毛发顺滑干净有光泽,精神状态良好,体重随饲养周期变化明显增大;与空白对照组相比,其他3组大鼠采食、饮水及大小便均增多,体重增长较缓慢,部分出现体重减轻。与糖尿病组和假手术组大鼠相比,复合模型组大鼠精神较紧张,毛色缺少光泽,局部毛发变黄易脱落,抓持时遗尿排便现象较普遍,大便质软甚至稀便,腐臭味明显,尿量及粪量均增加。
2.2 大鼠体重变化
造模前各组大鼠体重无差异,当给予造模大鼠高脂高糖膳食后,其体重较普通饲料饲养的空白对照组大鼠有明显增加(P<0.05)。STZ造模后,空白对照组大鼠体重继续增加,造模大鼠体重则逐渐降低,各组间差异显著(P<0.05)(图2)。
2.3 OGTT,FBG及GHbA1c值的变化
空白对照组大鼠0.5、1、2 h血糖先升高后降低,2 h后血糖降为正常值,造模大鼠血糖也是先升高后降低,2 h血糖也降为正常,但造模大鼠不同时间点的血糖有差异(P<0.05)(图3)。 大鼠FBG的变化:造模前及高脂高糖膳食4周后,两组大鼠空腹
血糖均无明显差异(P>0.05);STZ造模后,造模组血糖较空白对照组明显升高,两者之间有显著性差异(P<0.01)(表1)。大鼠GHbA1c的变化: 所有大鼠眼眶静脉采血后,分离血清测定糖化血红蛋白浓度。造模大鼠较空白对照组大鼠糖化血红蛋白浓度值明显升高(P<0.01)(图4)。

图2 STZ造模前后各组大鼠的体重比较
Fig.2 Comparison of rats' weight before and after the establishment of model using STZ

图3 STZ造模前后各组大鼠口服葡萄糖耐量变化
Fig.3 Comparison of rats’ ogtt before and after the establishment of model using STZ
表1 STZ造模前后各组大鼠空腹血糖变化(mmol·L-1)
Table 1 Fasting blood glucose of rats in each group before and after STZ(mmol·L-1)
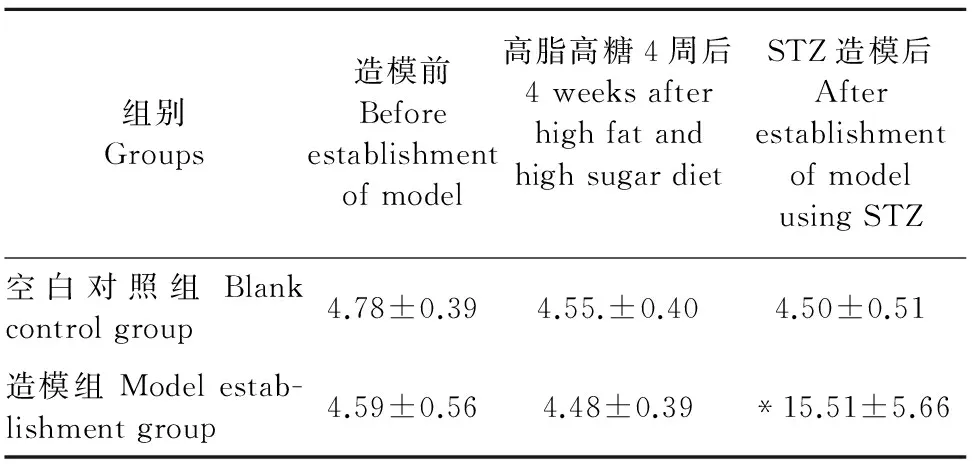
组别Groups造模前Beforeestablishmentofmodel高脂高糖4周后4weeksafterhighfatandhighsugardietSTZ造模后AfterestablishmentofmodelusingSTZ空白对照组Blankcontrolgroup4.78±0.394.55.±0.404.50±0.51造模组Modelestab-lishmentgroup4.59±0.564.48±0.39*15.51±5.66
注:与空白对照组相比,“*”P<0.01。
Note:Compared with blank control group,“*”P<0.01.

图4 STZ造模前后各组大鼠糖化血红蛋白值比较
Fig.4 The comparison of rats’ GHbA1c before and after the establishment of model using STZ
2.4 血压测量结果
与前3组相比,复合模型组大鼠收缩压和舒张压数值明显升高(P<0.01);而空白对照组、糖尿病组及假手术组之间收缩压和舒张压均无明显差异(P>0.05)(图5)。
2.5 彩超检查
A、B、C、D的肾脏大小分别为2.19 cm×1.01 cm,2.32 cm×1.08 cm,2.15 cm×1.06 cm和1.39 cm×0.70 cm;明显前3组的肾脏大小大于复合模型组,提示复合模型组大鼠肾动脉结扎后肾脏出现萎缩变小。编号E、F、G、H中PSV、EDV为血流速度,RI为血管阻力,前3组血流速度大于复合模型组,而血管阻力则小于复合模型组,提示复合模型组大鼠结扎肾动脉后,肾动脉血管直径变小,血流量减少(图6)。
2.6 血肌酐(Cr)、尿素氮(BUN)值比较
所有大鼠采血后测定Cr,BUN值。各组之间的肾功能(Cr、BUN)均无明显差异(P>0.05)(表2)。
2.7 病理学观察
2.7.1 胰腺HE染色 结果显示(编号ABCD):空白对照组胰岛为椭圆形细胞团,细胞数量较多,胞浆丰富;其余3组均发现胰岛细胞体积增大,且均出现不同程度的空泡变性,部分细胞发生核固缩坏死(图7)。
2.7.2 左肾的HE染色 结果显示(编号EFGH):复合模型组肾小管及肾小球均出现不同程度的萎缩,以肾小管萎缩较明显,同时伴有肾间质纤维化;而其余3组均未见明显的肾小管及肾小球萎缩现象。
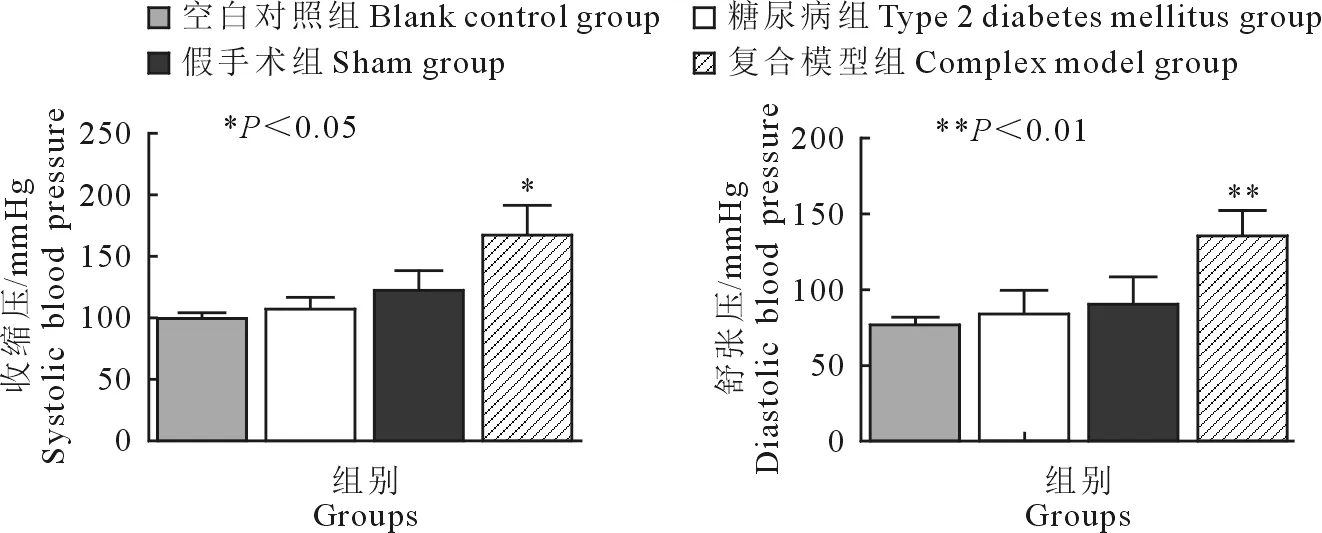
图5 各组血压值比较
Fig.5 Comparison of blood pressure among groups

A、E.空白对照组;B、F.糖尿病组;C、G.假手术组;D、H.复合模型组。A~D.左肾大小;E~H.肾动、静脉脉血流速
A and E. Blank control group;B and F. Diabetes group;C and G. Sham group;D and H. Complex model group; A-D. Left renal size;E-H. Blood flow velocity of renal artery and vein
图6 彩超检查结果
Fig.6 The results of color doppler ultrasonography
表2 不同组别的大鼠肾功能指标变化
Table 2 Renal function changes in each groups of rats

组别GroupsBUN/(mmol·L-1)Cr/(mmol·L-1)空白对照组Blankcontrolgroup6.658±0.48532.664±7.472糖尿病组Type2diabetesmellitusgroup6.384±0.85930.637±4.694假手术组Shamgroup6.640±0.78530.037±5.862复合模型组Complexmod-elgroup6.360±1.02332.475±3.996
2.8 大鼠存活率及成模率
本试验研究观测持续到造模完成后4周末,12只复合模型大鼠中存活11只,成模10只。其中1只麻醉过深术后24 h内即死亡,考虑为麻醉过度;1只术后4周血压恢复至正常水平,为未成模,成模大鼠收缩压稳定在 22.26 kPa±3.12 kPa,舒张压稳定在18.07 kPa±2.21 kPa。经计算复合模型组大鼠存活率和成模率分别为91.7%和83.3%。

A~D.分别代表空白对照组、糖尿病组、假手术组和复合模型组大鼠的胰腺HE染色结果;E~H.分别代表空白对照组、糖尿病组、假手术组和复合模型组大鼠的左肾HE染色结果
A-D.Represent HE staining results of rat pancreas in the blank control group,diabetes group,sham group and complex model group,respectively;E-H.Represent HE staining results of rat left kidney in the blank control group,diabetes group,sham group and complex model group,respectively
图7 胰腺和左肾组织HE染色结果(200×)
Fig.7 The HE staining results of pancreas and left kidney tissues(200×)
3 讨论
国际糖尿病联盟(IDF)统计,2011年全球糖尿病患病人数已达3.66 亿,比2010年增加了近30%;IDF最新预测,世界糖尿病患者在2030年将达到近5亿。而在糖尿病的发病人群中,又以2型糖尿病为主,它常见于中老年人人群,是临床常见的内分泌疾病,近年来糖尿病的发病率正在逐年上升,发病年龄在持续下降[5]。
2型糖尿病常会导致多种并发症,如高血压、白内障、微血管及大血管病变等。在这些并发症中,又以大血管病变的危害性最大。糖尿病并发大血管病变后形成血栓,极易造成肾动脉堵塞,形成肾性高血压并快速发展为肾衰竭,威胁患者的生命。临床上单纯糖尿病和高血压病的治疗,通过规律服药基本能够控制。但是,当糖尿病合并高血压或伴其他血管病病变时,治疗起来却极其麻烦,这就迫切需要建立一个动物模型用于此类疾病的研究,从基础研究中来达到控制疾病的目的,并最终达到增加患者生存率及生活质量,减少威胁患者生命的并发症发生。
试验中选用8月龄~10月龄的中年大鼠进行试验,与大多数2型糖尿病造模文献中选用的2月龄~3月龄大鼠相比更能模拟出人类2型糖尿病发病年龄的特点。同时本试验通过给予大鼠高脂高糖膳食4周后,再予低剂量STZ溶液腹腔注射,最后形成的2型糖尿病模型较其他直接腹腔注射高剂量STZ溶液制作的糖尿病模型更加稳定,且大鼠死亡量更低。同时,又与其他造模方法得出的2型糖尿病模型的典型症状一致,大鼠都表现出“三多一少”的主要症状和血糖升高。另外,试验结果表明本试验选用的2K1C(一侧肾动脉狭窄,另一侧肾保留)结扎法较1K1C(一侧肾动脉狭窄,另一侧肾切除)结扎法和2K2C(双肾动脉均狭窄)结扎法所制备的大鼠肾性高血压模型的存活率及成模率更高[11-12]。另外,肾动脉狭窄制备肾性高血压的方法众多,如U型银夹夹合和针灸针结扎等方法,但是通过反复的预试验,最后确定从腹部开口丝线结扎左肾动脉来制作肾性高血压大鼠模型的制作方法效果更好。除此之外,由于U型夹价格昂贵,且动物血管个体差异大,其直径难以控制,造模过程中很容易造成肾动脉狭窄过度或狭窄过松而导致成模率下降;而用丝线结扎,不仅材料容易获得,而且丝线没有伸缩性,结扎之后使肾动脉血流量比较恒定,成模率更高。
综上所述,本试验方法制作的2型糖尿病合并肾性高血压模型,一定程度上较好地模拟出该疾病的发病特点,同时表现出与临床病人一致的症状和体征,各种检测结果也均与糖尿病合并肾性高血压病病人相符合。所以本试验方法的确立,可为2型糖尿病合并肾性高血压疾病的临床研究和试验研究提供一个稳定、实用、有效的新模型。
[1] Nekooeian A A,Khalili A,Khosravi M B.Effects of oleuropein in rats with simultaneous type 2 diabetes and renal hypertension:a study of anti h ypertensive mechanisms[J]. J Asian Nat Prod Res,2014,16(9):953-962.
[2] Nayak Y,Hillemane V,Daroji V K,et al. Antidiabetic activity of benzopyrone analogues in nicotinamide-streptozotocin induced type 2 diabetes in rats[J]. Sci World J,2014,2014:854-867.
[3] Liu X,Xu Q,Wang X,et al. Irbesartan ameliorates diabetic cardiomyopathy by regulating protein kinase D and ER stress activation in a type2 diabetes rat model[J]. Pharmacol Res,2015,93:43-51.
[4] He J,Yang Z,Yang H,et al.Regulation of insulin sensitivity,insulin production,and pancreatic beta cell survival by angiotensin-(1-7) in a rat model of streptozotocin-induced diabetes mellitus[J]. Peptides,2015,64C:4 9-54.
[5] Ghasemi A,Khalifi S,Jedi S.Streptozotocin-nicotinamide-induced rat model of type 2 diabetes [J].Acta Physiol Hung,2014,101(4):408-420.
[6] Lu Y,Liu Y,Li H,et al. Effect and mechanisms of zinc supplementation in protecting against diabetic cardiomyopathy in a rat model of type2 diabe tes[J]. Bosn J Basic Med Sci,2015,15(1):14-20.
[7] Santuzzi C H,Tiradentes R V,Mengal V,et al. Combined aliskiren and L-arg inine treatment has antihypertensive effects and prevents vascular endothe lial dysfunction in a model of renovascular hypertension[J]. Braz J Med Biol Res,2015,48(1):65-76.
[8] Kasacka I,Janiuk I, Piotrowska Z. Evaluation of CART-,glucagon-,and insulin-immunoreactive cells in the pancreas of an experimental rat model of unilateral renal artery stenosis[J]. Histol Histopathol,2014,30(4):445-452.
[9] Tiradentes R V,Santuzzi C H,Claudio E R,et al.Combined aliskiren and L-a rginine treatment reverses renovascular hypertension in an animal model[J]. Hypertens Res,2015,38(7):471-477.
[10] 罗烘权,袁 进,徐名衬,等.口服百草枯建立帕金森病模型及其评价研究[J]. 动物医学进展,2015,36(9):88-92.
[11] 秦秋华,蒋伟哲,施晓霞,等.肾性高血压大鼠模型制备方法的改进[J]. 广西医科大学学报, 2011,28(5):671-673.
[12] Ergur B U,Yilmaz O. The effects of α-lipoic acid on aortic injury a nd hypertension in the rat remnant kidney (5/6 nephrectomy) model[J]. Anatolian J Cardiol,2015,15(16):443-449.
Establishment and Assessment of Model of Type 2 Diabetes Mellitus(T2DM) Complicated Renal Hypertension
WAN Bin1,SUN Li-wei2,ZHANG Qiao-xiang1,ZHANG Shi-yu3,LUO Hong-quan1,GU Wei-wang1
(1.LaboratoryAnimalCenter,SouthernMedicalUniversity,Guangzhou,Guangdong,510515,China;2.DepartmentofMedicalGenetics,ZhongshanMedicalCollegeofSunYat-senUniversity,Guangzhou,Guangdong,510080,China;3.DepartmentofUltrasound,NanfangHospitalofSouthernMedicalUniversity,Guangzhou,Guangdong,510515,China)
The rat model was induced to simulate the pathogenic process of type 2 diabetes mellitus(T2DM) complicated renal hypertension of human.The type 2 diabetic model of rats was prepared by the quick intraperitoneal injection of STZ at 28 mg/kg after high calorie and high sugar diet for 4 weeks.The type 2 diabetic model was established by the measurement FBG≥7.8 mmol/L or RBG≥16.7 mmol/L for successive 3 days after 2 weeks. After the blood sugar reached a steady value,the modeled of renal hypertention was prepared by using the improved method of "tow kidney one clip" to produce the renal artery stenosis of one side. The model of type 2 diabetes mellitus(T2DM) complicated renal hypertension was successfully replicated by the 3 days′ measurement,which showed that the rats′ blood pressure SBP≥140 mmhg and FBG≥7.8 mmol/L or RBG≥16.7 mmol/L two weeks latter. After 4 weeks,the blood sugar and blood pressure of the model rats reached a steady level. Compared with the blank control group,the body weight of the complex model group were decreased,and the fasting glucose,GHbA1c and blood pressure significantly rosed (P<0.01). Compared with the diabetes group and the sham group,serum creatinine and urea nitrogen of the complex group showed no significant changes(P>0.05),but a significant increase occurred in blood pressure occurred(P<0.01).The result of color ultrasonography showed a shrink of the left kidney and renal artery and a faster blood flow velocity.The model of type 2 diabetes mellitus (T2DM) complicated renal hypertension established by injecting low-dose STZ intraperitoneally after high fat and high glucose feed and by applying the improved method of "tow kidney one clip" can simulate the pathogenic characteristics of disease and provide a stable,practical and effective model for the clinic and experiment researches of type 2 diabetes mellitus(T2DM) complicated renal hypertension.
high fat and high glucose;STZ;T2DM;renal hypertension;rat
2015-11-16
广东省科技基础条件建设项目(2013B060300001)
万 斌(1989-),男,湖南常德人,硕士研究生,主要从事人类疾病动物模型研究。*通讯作者
S852.3
A
1007-5038(2016)05-0053-07
