在离子液体介质中催化合成β-羰基膦酸酯
2017-01-06向建南朱永钢杨世平
向建南,朱永钢,杨世平
(1. 湖南大学 化学化工学院,湖南 长沙 410082;2. 湖南医药工业研究所,湖南 长沙 410014)
在离子液体介质中催化合成β-羰基膦酸酯
向建南1*,朱永钢1,杨世平2
(1. 湖南大学 化学化工学院,湖南 长沙 410082;2. 湖南医药工业研究所,湖南 长沙 410014)
报道了一种由炔基膦酸酯制备β-羰基膦酸酯的简便、高效新合成方法. 该方法以离子液体为反应介质,质子酸为催化剂催化炔基膦酸酯水合制备β-羰基膦酸酯.优化实验条件为:反应温度为60 ℃,离子液体用量3.5 mmol,浓硫酸用量3.5 mmol, 0.5 mmol炔基膦酸酯与1 mmol水反应20 h,β-羰基膦酸酯的产率达到98%.该合成方法具有无金属催化剂、β-羰基膦酸酯产率高以及多种基团适用性等特点.本文合成的化合物2p未见文献报道.
合成;水合反应;β-羰基膦酸酯;离子液体
有机磷化合物在有机合成、医药研究方面一直有着重要的应用,β-羰基膦酸酯是一类十分重要的有机磷化合物,具有广泛的生物活性[1-2],可以作为其他很多有机合成反应的原料[3-4].β-羰基膦酸酯是通过霍纳尔-沃兹沃思-埃蒙斯反应[5]制备α,β不饱和羰基化合物的一种不可缺少的底物之一. 同时β-羰基膦酸酯也是制备手性β-氨基[6]和手性β-羟基[7]膦酸化合物的前体.由于β-羰基膦酸酯在化学领域研究中的重要作用,多个实验室报道了其制备β-羰基膦酸酯的方法[8-12]. 但这些制备β-羰基膦酸酯的方法存在着一些缺点:严苛的反应条件,复杂的实验操作步骤,需要使用昂贵的且对环境有害的金属催化剂. 其中使用过渡金属催化炔基磷酸酯水合成β-羰基膦酸酯的方法操作相对简单[13-14],且水合反应的原子利用率高[15]. 随着不断的改进,此类水合反应所用金属催化剂从最初的汞盐[8]到此后的钯盐[9]、金化合物[10]及银盐[11],但此类方法所使用的金属催化剂将不可避免地对环境造成一定污染.
基于此前实验室对合成β-羰基膦酸酯所做的工作[10-12],我们发现了一种绿色无污染的方法来制备β-羰基膦酸酯. 离子液体[16]是一种不易损耗且可循环使用的低熔点盐,很多有机反应在离子液体介质中都能很好地进行[17]. Wong实验组报道了一种新型的离子液体催化介质,此种介质包含有少量的硫酸,能够在温和的条件下催化炔烃水合转化成酮类化合物[18].本文探讨了一种在温和无金属催化剂参与的条件下高效地制备β-羰基膦酸酯的方法.
1 实验部分
1.1 试剂与仪器
乙酸乙酯和正己烷及其他部分药品和试剂均购自九鼎化学试剂公司,药品和试剂均为分析纯,离子液体(N ·(HSO4)2) (结构式见图1)参照Wong实验组的方法[18]制备,薄层和柱层析用硅胶均为青岛海洋化工厂产品;1H NMR,31P NMR和13C NMR(内标为TMS, 溶剂为CDCl3)用Brucker ARX 400 FT型核磁共振仪测定;IR用FD-5DX型红外仪测定;MS用GCT-TOF型高分辨质谱仪测定.
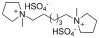
图1 离子液体结构式
1.2 目标产物的合成
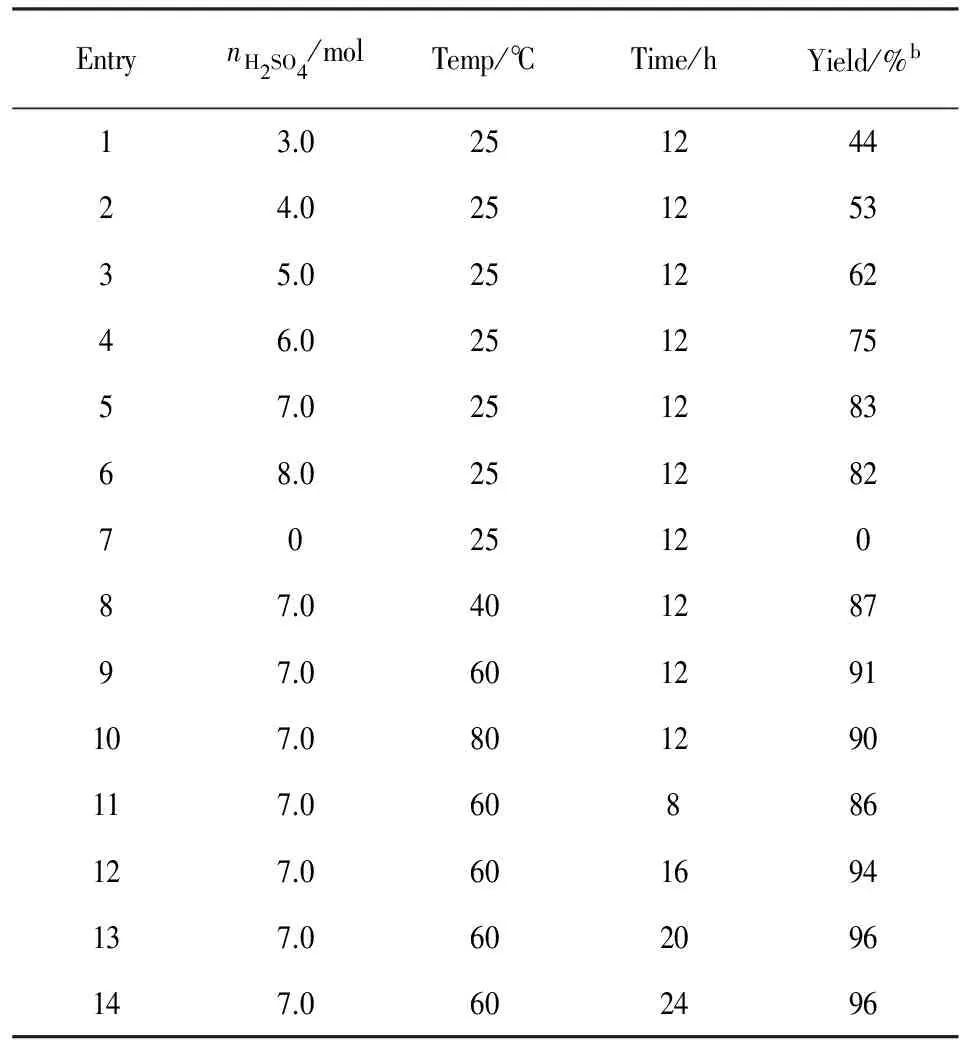
在圆底烧瓶中依次加入离子液体N·(HSO4)2(3.5 mmol, 1 565 mg),炔基膦酸酯(0.5 mmol)和水(1.0 mmol, 18 mg). 搅拌5 min后,向混合液中缓慢滴加浓硫酸(3.5 mmol, 98% H2SO4, 350 mg),然后将反应体系温度逐步提升到60 ℃,持续搅拌20 h,用薄层色谱法监测反应进程. 反应结束后,向反应混合物中加入6 mL水,并用二氯甲烷萃取所得的混合物,水层保留用作循环使用. 有机层用15 mL水洗涤一次,15 mL饱和食盐水洗涤2次,分离出的水相用15 mL二氯甲烷萃取3次,合并有机相用无水硫酸钠干燥,过滤,减压蒸馏去除溶剂,得到残留黏稠液体,经过柱层析法分离提纯得到目标产物2a-2p.
为证明离子液体的良好活性和可回收性,将含有浓硫酸的离子液体体系循环5次作为反应催化体系,每次循环过程中,将反应产物萃取出,分离提纯,计算反应产率. 剩余部分加入新的反应底物炔基膦酸酯和水,继续循环. 循环反应的产物平均产率达到94%,这个结果证明了离子液体的体系能够循环使用.
(2-氧代-2-苯乙基)膦酸二乙酯(2a)[10]:黄色油状物,产率96% (123 mg),1H NMR (400 MHz, CDCl3)δ7.97 (d,J= 7.2 Hz, 2H), 7.57~7.53 (m, 1H), 7.46~ 7.42 (m, 2H), 4.14~4.06 (m, 4H), 3.60 (d,J= 22.8 Hz, 2H), 1.24 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ191.8 (d,J= 6.5 Hz), 136.3, 133.5, 128.9, 128.4, 62.5 (d,J= 6.6 Hz), 38.3 (d,J= 129.1 Hz), 16.1 (d,J= 6.6 Hz);31P NMR (162 MHz, CDCl3)δ20.0.
[2-氧代-2-(4’-甲基苯乙基)]膦酸二乙酯(2b)[11]:黄色油状物,产率97% (131 mg),1H NMR (400 MHz, CDCl3)δ7.86 (d,J= 8.4 Hz, 2H), 7.24 (d,J= 8.0 Hz, 2H), 4.12~4.05 (m, 4H), 3.56 (d,J= 22.8 Hz, 2H), 2.36 (s, 3H) , 1.23 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ191.3 (d,J=6.5 Hz), 144.5, 134.0, 129.1, 129.0, 62.5 (d,J= 6.6 Hz), 38.1 (d,J= 129.0 Hz), 21.5, 16.0 (d,J= 6.6 Hz);31P NMR (162 MHz, CDCl3)δ20.3.
[2-氧代-2-(4’-甲氧基苯乙基)]膦酸二乙酯(2c)[11]:黄色油状物,产率98% (140 mg),1H NMR (400 MHz, CDCl3)δ7.95 (d,J= 8.4 Hz, 2H), 6.90 (d,J= 8.4 Hz, 2H), 4.13~4.06 (m, 4H), 3.83 (s, 3H), 3.55 (d,J= 22.8 Hz, 2H), 1.24 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ190.1 (d,J= 6.5 Hz), 163.9, 131.3, 129.4, 113.6, 62.5 (d,J= 5.8 Hz), 55.4, 38.0 (d,J= 129.0 Hz), 16.1 (d,J= 5.9 Hz);31P NMR (162 MHz, CDCl3)δ20.6.
[2-氧代-2-(4’-乙酰氧基苯乙基)]膦酸二乙酯(2d)[12]:黄色油状物,产率90% (140 mg),1H NMR (400 MHz, CDCl3)δ8.04 (d,J= 8.8 Hz, 2H), 7.20 (d,J= 8.8 Hz, 2H), 4.15~4.08 (m, 4H), 3.60 (d,J= 22.8 Hz, 2H), 2.30 (s, 3H), 1.26 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ190.6 (d,J= 6.6 Hz), 168.6, 154.7, 133.9, 130.6, 121.7, 62.6 (d,J= 6.6 Hz), 38.4 (d,J= 129.1 Hz), 21.0, 16.1 (d,J= 6.6 Hz);31P NMR (162 MHz, CDCl3)δ19.9.
[2-氧代-2-(4’-氟苯乙基)]膦酸二乙酯(2e)[12]:黄色油状物,产率87% (118 mg),1H NMR (400 MHz, CDCl3)δ8.05~8.02 (m, 2H), 7.15~7.10 (m, 2H), 4.15~4.08 (m, 4H), 3.58 (d,J= 22.8 Hz, 2H), 1.26 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ190.2 (d,J= 6.5 Hz), 166.0 (d,J= 254.4 Hz), 132.8, 131.4 (d,J= 9.5 Hz), 115.6 (d,J= 21.9 Hz), 62.6 (d,J= 6.5 Hz), 38.5 (d,J= 129.1 Hz), 16.1 (d,J= 6.5 Hz);31P NMR (162 MHz, CDCl3)δ19.7.
[2-氧代-2-(4’-乙酰基苯乙基)]膦酸二乙酯(2f)[12]:黄色油状物,产率86% (128 mg),1H NMR (400 MHz, CDCl3)δ8.08 (d,J= 8.0 Hz, 2H), 8.02 (d,J= 8.0 Hz, 2H), 4.16~4.09 (m, 4H), 3.64 (d,J= 22.8 Hz, 2H), 2.63 (s, 3H), 1.27 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ197.3, 191.4 (d,J= 6.6 Hz), 140.4, 139.5, 129.2, 128.3, 62.7 (d,J= 6.5 Hz), 38.8 (d,J= 128.4 Hz), 26.8, 16.1 (d,J= 5.8 Hz);31P NMR (162 MHz, CDCl3)δ19.2.
[2-氧代-2-(4’-三氟甲基苯乙基)]膦酸二乙酯(2g)[11]:黄色油状物,产率81% (131 mg),1H NMR (400 MHz, CDCl3)δ8.12 (d,J= 8.4 Hz, 2H), 7.74 (d,J= 8.4 Hz, 2H), 4.17~4.10 (m, 4H), 3.64 (d,J= 23.2 Hz, 2H), 1.28 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ191.0 (d,J= 6.5 Hz), 139.0, 134.7 (dd,J= 32.8 Hz, 32.6 Hz), 129.3, 125.5 (q,J=3.7 Hz), 122.0, 62.7 (d,J= 6.5 Hz), 38.7 (d,J= 128.3 Hz), 16.0 (d,J= 6.5 Hz);31P NMR (162 MHz, CDCl3)δ19.0.
[2-氧代-2-(3’-甲基苯乙基)]膦酸二乙酯(2h)[10]:黄色油状物,产率90% (120 mg),1H NMR (400 MHz, CDCl3)δ7.76 (d,J= 7.6 Hz, 2H), 7.36~7.29 (m, 2H), 4.12~4.05 (m, 4H), 3.57 (d,J= 22.8 Hz, 2H), 2.36 (s, 3H), 1.23 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ191.9 (d,J= 6.6 Hz), 138.2, 136.4, 134.3, 129.2, 128.3, 126.1, 62.4 (d,J= 6.6 Hz), 38.2 (d,J= 129.1 Hz), 21.1, 16.0 (d,J= 5.8 Hz);31P NMR (162 MHz, CDCl3)δ20.1.
[2-氧代-2-(2’-甲基苯乙基)]膦酸二乙酯(2i)[11]:黄色油状物,产率75% (100 mg),1H NMR (400 MHz, CDCl3)δ7.67 (d,J= 7.6 Hz, 1H), 7.34~7.30 (m, 1H), 7.23~7.17 (m, 2H), 4.08~4.00 (m, 4H), 3.52 (d,J= 22.8 Hz, 2H), 2.44 (s, 3H), 1.19 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ195.0 (d,J= 6.6 Hz), 138.8, 137.1 (d,J= 2.2 Hz), 131.9, 131.8, 129.5, 125.6, 62.4 (d,J= 6.6 Hz), 40.9 (d,J= 128.3 Hz), 21.2, 16.1 (d,J=5.8 Hz);31P NMR (162 MHz, CDCl3)δ20.2.
(2-氧代-2-萘乙基)膦酸二乙酯(2j)[12]:黄色油状物,产率83% (126 mg),1H NMR (400 MHz, CDCl3)δ8.53 (s, 1H), 8.03 (d,J= 8.8 Hz, 1H), 7.96 (d,J= 8.0 Hz, 1H), 7.88~7.83 (m, 2H), 7.60~7.51 (m, 2H), 4.16~4.09 (m, 4H), 3.74 (d,J= 22.8 Hz, 2H), 1.25 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ191.7 (d,J= 6.6 Hz), 135.6, 133.7, 132.2, 131.3, 129.6, 128.7, 128.3, 127.6, 126.8, 124.0, 62.6 (d,J= 6.6 Hz), 38.4 (d,J= 129.1 Hz), 16.1 (d,J= 6.5 Hz);31P NMR (162 MHz, CDCl3)δ20.2.
[2-氧代-2-(2’-乙基噻吩基)]膦酸二乙酯(2k)[12]:黄色油状物,产率84% (109 mg),1H NMR (400 MHz, CDCl3)δ7.79 (d,J= 3.6 Hz, 1H), 7.66 (d,J= 4.8 Hz, 1H), 7.12~7.10 (m, 1H), 4.14~4.07 (m, 4H), 3.51 (d,J= 22.8 Hz, 2H), 1.25 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ184.1 (d,J= 6.6 Hz), 143.7, 135.0, 134.1, 128.2, 62.6 (d,J= 6.6 Hz), 39.2 (d,J= 129.1 Hz), 16.1 (d,J= 6.5 Hz);31P NMR (162 MHz, CDCl3)δ19.4.
[2-氧代-2-(3’-乙基噻吩基)]膦酸二乙酯(2l)[10]:黄色油状物,产率87% (113 mg),1H NMR (400 MHz, CDCl3)δ8.16~8.15 (m, 1H), 7.50 (d,J= 5.2 Hz, 1H), 7.25~7.24 (m, 1H), 4.10~4.03 (m, 4H), 3.46 (d,J= 22.8 Hz, 2H), 1.22 (t,J= 7.2 Hz, 6H);13C NMR (100 MHz, CDCl3)δ185.5 (d,J= 6.6 Hz), 141.7, 134.2, 127.1, 126.3, 62.5 (d,J= 6.5 Hz), 39.8 (d,J= 128.4 Hz), 16.0 (d,J= 6.6 Hz);31P NMR (162 MHz, CDCl3)δ19.9.
2-氧代癸基膦酸二乙酯(2m)[10]:无色油状物,产率30% (43 mg),1H NMR (400 MHz, CDCl3)δ4.17~4.09 (m, 4 H), 3.05 (d,J= 22.8 Hz, 2 H), 2.60 (t,J= 7.2 Hz, 2 H), 1.56 (t,J= 7.2 Hz, 2 H), 1.34~1.25 (m, 16 H), 0.86 (t,J= 7.2 Hz, 3 H);13C NMR (100 MHz, CDCl3)δ202.2 (d,J= 5.8 Hz), 62.5 (d,J= 5.9 Hz), 44.0, 42.2 (d,J= 126.9 Hz), 31.7, 29.2, 29.0, 28.9, 23.4, 22.5, 16.2 (d,J= 5.8 Hz), 14.0;31P NMR (162 MHz, CDCl3)δ20.1.
(2-氧代-2-新戊酰氧基丙基)膦酸二乙酯(2n)[11]:无色油状物,产率35% (52 mg),1H NMR (400 MHz, CDCl3)δ4.77 (s, 2 H), 4.18~4.10 (m, 4 H), 3.09 (d,J= 22.8 Hz, 2 H), 1.32 (t,J= 7.2 Hz, 6 H), 1.24 (s, 9H);13C NMR (100 MHz, CDCl3)δ195.2 (d,J= 5.8 Hz), 177.6, 68.0, 62.8 (d,J= 5.9 Hz), 39.0 (d,J= 128.3 Hz), 38.6, 27.0, 16.2 (d,J= 6.6 Hz);31P NMR (162 MHz, CDCl3)δ18.4.
(2-氧代-2-苯乙基)膦酸二异丙酯(2o)[12]:黄色油状物,产率96% (136 mg),1H NMR (400 MHz, CDCl3)δ7.96 (d,J= 7.6 Hz, 2H), 7.53~7.50 (m, 1H), 7.42~7.39 (m, 2H), 4.71~4.62 (m, 2H), 3.54 (d,J= 22.8 Hz, 2H), 1.21 (q,J= 4.0 Hz, 12H);13C NMR (100 MHz, CDCl3)δ191.9 (d,J= 6.5 Hz), 136.4, 133.3, 128.9, 128.3, 71.3 (d,J= 7.3 Hz), 39.4 (d,J=129.8 Hz), 23.7 (d,J= 4.3 Hz), 23.5 (d,J=5.1 Hz);31P NMR (162 MHz, CDCl3)δ17.7.
(2-氧代-2-苯乙基)膦酸二异丁酯(2p):黄色油状物,产率94% (146 mg),1H NMR (400 MHz, CDCl3)δ7.94 (d,J= 7.2 Hz, 2H), 7.53~7.50 (m, 1H), 7.42~7.38 (m, 2H), 3.78~3.74 (m, 4H), 3.58 (d,J= 23.2 Hz, 2H), 1.86~1.76 (m, 2H), 0.80 (d,J= 6.8 Hz, 12H);13C NMR (100 MHz, CDCl3)δ191.8 (d,J= 6.6 Hz), 136.5, 133.5, 128.9, 128.5, 72.3 (d,J= 7.3 Hz), 38.0 (d,J= 129.1 Hz), 29.0 (d,J= 6.6 Hz), 18.5 (d,J= 1.5 Hz);31P NMR (162 MHz, CDCl3)δ19.7; IR (neat): 2 958, 1 685, 1 594, 1 465, 1 273, 1 026, 1 004, 905 cm-1; HRMS (ESI):m/z[M + H]+calcd for C16H26O4P: 313.156 9, found: 313.156 4.
2 结果与讨论
2.1 反应条件的优化
为高产率地合成目标产物,我们进行了一系列的实验,寻找最佳反应条件. 2-苯乙炔基膦酸二乙酯(1a)作为模型底物来进行实验,得到目标产物(2a)的分离产率为44% (Table 1, Entry 1). 当加入的浓硫酸的量由3摩尔逐渐提高到7摩尔时目标产物(2a)的产率逐渐提高到了83% (Entries 2~6). 不向反应体系中加入浓硫酸时,反应不能正常进行,没有目标产物生成,回收物为初始投入原料(Entry 7), 因而浓硫酸加入的量对反应的产率有很大影响. 温度的变化也会影响反应的进程,对反应温度进行了筛查,将反应温度由25 ℃升高至60 ℃,产率由83%升高到91% (Entries 5, 8, 9). 但继续将温度提高到80 ℃,产率没有继续升高(Entry 10).从表1中的条目8~10的结果可以看出,最佳反应温度为 60 ℃. 同时筛选了反应时间 (Entries 11~14),反应时间缩短到8 h时,产率下降到86%(Entry 11). 当反应时间逐渐延长时,反应产率在逐渐升高,反应时间超过20 h,反应产率趋于平稳(Entries 12~14),因而最佳反应时间为20 h(Entry14).
在最优的反应条件下,我们对各种芳香族和脂肪族的炔基膦酸酯进行探究,来考察底物上取代基团对于反应的影响. 这些反应的结果都统计在表2中.
表1 反应条件优化a
Tab.1 Examination of reaction conditions
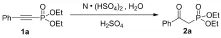
EntrynH2SO4/molTemp/℃Time/hYield/%b13.025124424.025125335.025126246.025127557.025128368.0251282702512087.040128797.0601291107.0801290117.060886127.0601694137.0602096147.0602496
a反应条件:0.5 mmol炔基膦酸酯,3.5 mmol离子液体,1.0 mmol水. b柱层析法得到分离产率.
供电子基团取代的β-羰基膦酸酯都能容易地合成且产率高(Tab.2, Entries 1~3),同时吸电子基团取代的β-羰基膦酸酯也能够在较高的产率下制备(Entries 4~6),但其产率略低于供电子基团取代. 然而由于位阻效应间位取代和邻位取代的β-羰基膦酸酯的产率都比对位取代的β-羰基膦酸酯的产率低(Entries 7, 8). 萘环取代的β-羰基膦酸酯也能顺利地制备(Entry 9),十分重要的、具有生物活性的噻吩取代的β-羰基膦酸酯也同样能够合成(Entries 10, 11). 结果表明,尽管β-羰基膦酸酯的产率会受到取代基的电子效应和位阻效应的影响,但很多芳香取代的β-羰基膦酸酯都能容易地合成(Entries 1~11). 脂肪族取代的炔基膦酸酯也同样能进行此反应,但反应的产率偏低(Entries 12, 13).其他的膦酸酯底物也能顺利地进行水合反应得到相应的β-羰基膦酸酯(Entries 14, 15).
为了探讨大量反应的可行性,将模型反应底物的量增大到20 mmol,同样也得到了92%的高产率,结果与预想的一致,能够用离子液体体系制备大量的β-羰基膦酸酯产物.
表2 反应范围a
Tab.2 Substrate scope of the reaction
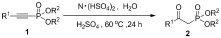
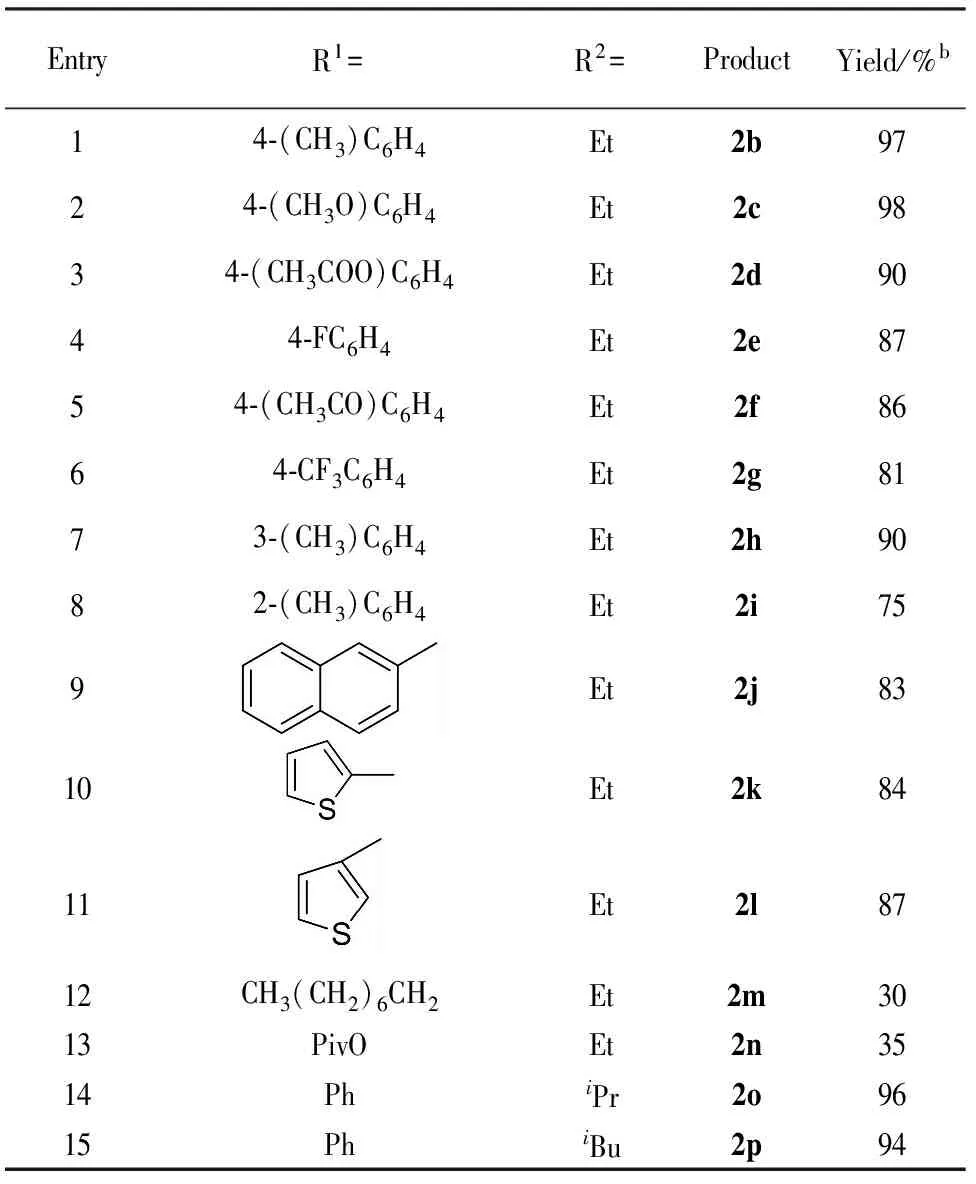
EntryR1=R2=ProductYield/%b14⁃(CH3)C6H4Et2b9724⁃(CH3O)C6H4Et2c9834⁃(CH3COO)C6H4Et2d9044⁃FC6H4Et2e8754⁃(CH3CO)C6H4Et2f8664⁃CF3C6H4Et2g8173⁃(CH3)C6H4Et2h9082⁃(CH3)C6H4Et2i759Et2j8310Et2k8411Et2l8712CH3(CH2)6CH2Et2m3013PivOEt2n3514PhiPr2o9615PhiBu2p94
a反应条件:0.5 mmol炔基膦酸酯,3.5 mmol离子液体,1.0 mmol水,3.5 mmol浓硫酸. b柱层析法得到分离产率.
2.2 机理探究
此反应的机理一般认为是通过碳碳三键的限速质子化,然后水快速地连接上来,形成烯醇结构,通过烯醇结构的转换最终得到羰基化合物[19-20]. 我们的实验结果及得到的相应产物也印证了这一反应机制.
3 结 论
我们成功地发展了一种利用酸性离子液体在温和的条件下合成β-羰基膦酸酯的绿色、实用的方法.该方法对于反应底物的取代基团具有很好的兼容性,在体系中无论是缺电子还是富电子的芳香族取代炔基磷酸酯都能得到非常高的产率. 更值得一提的是,这种方法避免了使用昂贵且复杂的金属催化剂,是一种环境友好的合成方法.
[1] BALG C, BLAIS S P, BERNIER S,etal. Synthesis of beta-ketophosphonate analogs of glutamyl and glutaminyl adenylate, and selective inhibition of the corresponding bacterial aminoacyl-tRNA synthetases[J]. Bioorganic & Medicinal Chemistry, 2007,15(1):295-304.
[2] PERUMAL S K, ADEDIRAN S A, PRATT R F. Beta-ketophosphonates as beta-lactamase inhibitors: Intramolecular cooperativity between the hydrophobic subsites of a class D beta-lactamase[J]. Bioorganic & Medicinal Chemistry, 2008,16(14):6987-6994.
[3] DEBROUWER W, HEUGEBAERT T S, VAN HECKE K,etal. Synthetic entry into 1-Phosphono-3-azabicyclo[3.1.0]hexanes[J]. The Journal of Organic Chemistry, 2013,78(17):8232-8241.
[4] ESSID I, TOUIL S. β-Ketophosphonates as substrates in the Biginelli multicomponent reaction: an efficient and straightforward synthesis of phosphorylated dihydropyrimidinones[J]. ARKIVOC, 2013,4:98-106.
[5] WADSWORTH W S, EMMONS W D. The utility of phosphonate carbanions in olefin synthesis[J]. Journal of the American Chemical Society, 1961,83(7):1733-1738.
[6] RYGLOWSKI A, KAFARSKI P. Preparation of 1-aminoalkylphosphonic acids and 2-aminoalkylphosphonic acids by reductive amination of oxoalkylphosphonates[J]. Tetrahedron, 1996,52(32):10685-10692.
[7] KITAMURA M, TOKUNAGA M, NOYORI R. Asymmetric hydrogenation of .beta.-keto phosphonates: a practical way to fosfomycin[J]. Journal of the American Chemical Society, 1995, 117(10): 2931-2932.
[8] POSS A J, BELTER R K. Diethyl 3-iodopropynylphosphonate: an alkylative .beta.-keto phosphonate equivalent[J]. The Journal of Organic Chemistry, 1987,52(21):4810-4812.
[9] LI X, HU G, LUO P,etal. Palladium(II)-catalyzed hydration of alkynylphosphonates to β-Ketophosphonates[J]. Advanced Synthesis & Catalysis, 2012,354(13):2427-2432.
[10]XIE L, YUAN R, WANG R,etal. Gold(I)-catalyzed hydration of alkynylphosphonates: efficient access to β-ketophosphonates[J]. European Journal of Organic Chemistry, 2014,2014(13):2668-2671.
[11]XIANG J, YI N, WANG R,etal. Synthesis of β-ketophosphonates via AgNO3-catalyzed hydration of alkynylphosphonates: a rate-enhancement effect of methanol[J]. Tetrahedron, 2015,71(4):694-699.
[12]YI N, WANG R, ZOU H,etal. Copper/iron-catalyzed aerobic oxyphosphorylation of terminal alkynes leading to β-ketophosphonates[J]. The Journal of Organic Chemistry, 2015, 80(10):5023-5029.
[13]BAIDOSSI W, LAHAV M, BLUM J. Hydration of alkynes by a PtCl4CO catalyst[J]. The Journal of Organic Chemistry, 1997, 62(3): 669- 672.
[14]SUZUKI T, TOKUNAGA M, WAKATSUKI Y. Ruthenium complex-catalyzed anti-Markovnikov hydration of terminal alkynes[J]. Organic Letters, 2001,3(5):735-737.
[15]HINTERMANN L, LABONNE A. Catalytic hydration of alkynes and its application in synthesis[J]. Synthesis, 2007(8):1121-1150.
[16]STEINRÜCK H P, WASSERSCHEID P. Ionic liquids in catalysis[J]. Catalysis Letters, 2014,145(1):380-397.
[17]PLECHKOVA N V, SEDDON K R. Applications of ionic liquids in the chemical industry[J]. Chemical Society Reviews, 2008,37(1):123-150.
[18]WONG W L, HO K P, LEEL Y S,etal. Sulfuric acid-catalyzed conversion of alkynes to ketones in an ionic liquid medium under mild reaction conditions[J]. ACS Catalysis, 2011,1(2):116-119.
[19]MAMEDA N, PERAKA S, MARRI M R,etal. Solvent-free hydration of alkynes over Hβ zeolite[J]. Applied Catalysis A: General, 2015,505:213-216.
[20]NOYCE D S, SCHIAVELLI M D. Acid-catalyzed hydration of phenylacetylene. evidence for the vinyl cation intermediate[J]. Journal of the American Chemical Society, 1968,90(4):1020-1022.
A Simple and Efficient Strategy to Synthesis ofβ-Ketophosphonates Based on Ionic Liquids
XIANG Jian-nan1†, ZHU Yong-gang1, YANG Shi-ping2
(1. College of Chemistry and Chemical Engineering, Hunan Univ, Changsha, Hunan 410082, China; 2. Hunan Institute of Pharmaceutical Industry, Changsha, Hunan 410014, China)
A simple and efficient synthesis ofβ-ketophosphonates was described. The hydrolysis reactions of alkynylphosphonates in the presence of sulphuric acid (3.5 mmol) as a catalyst in the recyclable ionic liquid N·(HSO4)2afforded the desiredβ-ketophosphonates in excellent yields(98%). This method has the advantages of metal-free and tolerance of multifunctional groups. Synthesized compound 2p has not been reported.
synthesis; hydration reaction;β-ketophosphonates; ionic liquid
1674-2974(2016)12-0076-05
2016-04-21 基金项目:湖南省科技计划项目(2015WK3003) 作者简介:向建南(1958-),男,湖南南县人,湖南大学教授,博士生导师 †通讯联系人,E-mail:jnxiang@hnu.edu.cn
O622.4
A
