高盐饮食增强内皮细胞TRPV4与cPLA2的空间偶联作用
2017-01-06孙春原谢茗旭刘愈颖蔡燕飞
孙春原,谢茗旭,刘愈颖,蔡燕飞,张 鹏,金 坚,马 鑫
(江南大学药学院,江苏 无锡 214122)
高盐饮食增强内皮细胞TRPV4与cPLA2的空间偶联作用
孙春原,谢茗旭,刘愈颖,蔡燕飞,张 鹏,金 坚,马 鑫
(江南大学药学院,江苏 无锡 214122)
目的 探究内皮细胞中香草素受体4型瞬时感受器电位通道(TRPV4通道)与胞浆型磷脂酶A2(cPLA2)在空间上的偶联作用。方法 通过设定梯度盐(培养基中外源加入20、40、80、160 mol·L-1NaCl)确定高盐处理内皮细胞的最适盐浓度;在细胞水平上,通过免疫荧光能量共振转移(immuno-FRET)技术检测人微血管内皮细胞(HMEC)和小鼠胸主动脉原代内皮细胞中TRPV4与cPLA2的空间偶联作用;在动物组织水平,通过同样的技术检测正常小鼠与高盐诱导的高血压小鼠的胸主动脉血管环上的内皮细胞中TRPV4与cPLA2的空间偶联情况。结果 高盐诱导内皮细胞的最适盐浓度为40 mol·L-1NaCl;在细胞水平和动物组织水平上,高盐处理的HMEC、小鼠胸主动脉原代内皮细胞和高盐诱导的高血压小鼠胸主动脉血管环上的内皮细胞中,TRPV4与cPLA2的空间偶联作用均明显增强。结论 在细胞和组织水平上,高盐饮食能增强内皮细胞中TRPV4与cPLA2的空间偶联作用,这种空间偶联可能进一步引起两者的功能偶联,为血管内皮功能紊乱的研究提供了新的思路。
TRPV4;cPLA2;高盐;胸主动脉;免疫荧光能量共振转移;空间偶联
香草素受体4型瞬时感受器电位通道(transient receptor potential vanilloid 4 channel,TRPV4通道)属于非选择型阳离子通道,对Ca2+具有中等通透性,激活TRPV4受体导致细胞内钙离子浓度增高,进而调节各种生理或病理过程[1-3]。高盐饮食是诱发许多心血管疾病中的关键因素,如高血压等。Gao等[ 4]通过喂食♂ Wistar大鼠高盐饲料发现,当高盐饮食导致血压上升幅度较大时,内皮细胞中TRPV4介导的血管舒张功能减弱,甚至被完全抑制。上述文献表明TRPV4在高盐饮食诱发的内皮功能紊乱过程中起着重要作用。
胞浆型磷脂酶A2(cPLA2)是磷脂酶A2(PLA2)超家族的主要成员之一,在细胞内通过受体介导的Ca2+信号转导,经磷酸化被激活,选择性识别细胞膜甘油磷脂的sn-2位脂肪酸水解并释放花生四烯酸(arachidonic acid ,AA),AA在体内主要经过3种代谢途径的代谢物均是血管中调节血管张力或炎症的活性分子[ 5-7];上述文献表明cPLA2在调节血管张力过程中起着重要作用。
TRPV4和cPLA2在调节血管张力的过程中都起着重要作用,然而两者之间的关系还是未知的,在此我们推测TRPV4与cPLA2通过近距离的物理偶联实现信号转导。因此,我们在细胞和动物组织水平上对TRPV4与cPLA2的空间偶联作用进行了研究,发现高盐饮食能够增强两者间的空间偶联作用。TRPV4与cPLA2空间上的靠近,可能会导致两者之间功能上的相互作用,进而共同调节血管内皮功能紊乱。
1 材料与方法
1.1 实验动物及高盐模型构建 健康的野生型C57小鼠40只,体质量20~25 g,由上海斯莱克实验动物有限责任公司提供。动物饲养在SPF级动物房,环境湿度保持在50%,温度维持在25 ℃左右,自由进食饮水,通过灯光控制系统使其生活在每天50%光照时间,50%黑夜时间交替中。将40只小鼠随机均分成两组,对照组喂食正常饲料,高盐组喂食含有8% NaCl的高盐饲料;分组前3 d开始通过尾套法监测小鼠血压,连续观察并记录16 d,并统计数据。
1.2 主要试剂及仪器 ECM(1001)培养基购于美国ScienCell公司;Paraformaldehyde(PFA)(16005),Collagenase (Clostridium histolyticum)(C9891)购于Sigma公司;山羊源TRPV4抗体(SC-4752),兔源cPLA2抗体(SC-1724)购于美国Santa Cruz公司; CD31抗体(ab9498) 购于美国Abcam公司; Donkey anti-Rabbit 荧光二抗(波长488,1723019)和Donkey anti-Goat 荧光二抗(波长546,1714714),LipofectamineTM 2000(11668-027),Opti-MEM(31985-070)购自美国Invitrogen公司;cPLA2-GFP质粒购于上海和元生物有限公司;OCT冷冻切片包埋剂Tissue-Tek(4583)购于美国SAKURA公司。
1.3 高盐梯度处理细胞 HMEC细胞复苏在ECM培养基中,生长2~3 d后,消化传代,并将细胞铺在激光共聚焦小皿中,2 h细胞贴壁,分别加入20、40、80、160 mol·L-1的NaCl,并培养3 d。
1.4 原代细胞分离及培养 颈椎脱臼法处死小鼠并固定,打开小鼠胸腔,沿小鼠脊椎用剪刀急性分离胸主动脉,置于4 ℃ PBS中,移至超净工作台中,PBS清洗3~5次;去除血管周围组织,将分离出胸主动脉血管组织剪成4 mm左右的碎块,PBS清洗以除去血球和脂肪组织,将洗净的组织置于50 mL离心管中;加入0.02%胶原酶(ECM基础培养基配置),摇匀,至于37 ℃的水浴锅中消化45~60 min;待消化完成后,加入ECM完全培养基终止消化,吹打悬浮;将组织悬液吸入10 mL离心管中,3 000×g离心5 min;弃去上清,加入1 mL ECM完全培养基重悬,悬浮液转移至细胞培养瓶中,补加适当ECM完全培养基至5 mL,置于37 ℃,5% CO2及饱和湿度条件的培养箱中培养。
1.5 细胞转染 将处于对数期的HMEC细胞用0.25%胰酶消化后,按每孔1.0×105个铺于激光共聚焦小皿中;取2 μL lipofectamineTM 2000以及1 μg质粒分别与50 μL MEM混合,室温孵育5 min;将上述两种混合液混合,室温下孵育25 min;将混合液充分混匀后加入激光共聚焦培养皿中;4~6 h后更换培养基。
1.6 细胞免疫荧光染色 在共聚焦培养皿中铺入适量的原代胸主动脉血管内皮细胞,待细胞生长汇合度到70%~80%后,PBS清洗3次,洗去漂浮的死细胞;加入200 μL 4% PFA,室温固定30 min;PBS清洗干净,然后在共聚焦培养皿中加入200 μL 0.2% Triton X-100,室温通透10 min;PBS清洗干净,加入200 μL 5% BSA,37 ℃封闭1 h;用PBS清洗干净,在共聚焦培养皿中添加200 μL一抗(TRPV4抗体和cPLA2抗体混合稀释液),4 ℃孵育过夜;PBS清洗干净,在共聚焦培养皿中加入200 μL二抗( Donkey anti-Rabbit 荧光二抗和Donkey anti-Goat 荧光二抗混合稀释液),37 ℃避光孵育2 h;PBS清洗干净,在共聚焦培养皿中加入200 μL PBS,共聚焦显微镜下观察。
1.7 组织冰冻切面的制作 取显微镜下分离干净的小鼠胸主动脉血管,PBS清洗干净,洗去血管中的残留血液;4%多聚甲醛固定过夜;依次用20%及30%蔗糖溶液进行脱水;取出固定血管,置于OCT胶浸润1 h而后放置在-80 ℃ 冷冻过夜;将冷冻好的血管组织块放置在组织支撑架上,取出将其夹紧在与切片机持承器上,启动粗进退键,旋转旋钮,将组织修平;调好10 μm厚度、防卷板;切片时,速度保持匀速,切片可以均匀的通过刀防卷板间的通道,在持刀器的铁板与防卷板之间,将防卷板轻轻掀起,取1片载玻片,正面向下将其粘附在载玻片上,做好标记,置于-30 ℃冰箱中保存。
1.8 免疫组化 将切好的冰冻切片放置在PBS缓冲液中浸泡5 min,去除组织上的OCT胶;用免疫组化笔圈出组织位置;将切片放置在湿盒中,在组织上加入适量的10% BSA,37 ℃封闭1 h;PBS清洗干净,在组织上加入适量稀释好的一抗,4℃湿盒中孵育过夜;PBS清洗干净;在组织上加入适量稀释好的二抗,37 ℃湿盒中闭光孵育2 h;PBS清洗干净;在组织上加入适量30%的甘油,盖上盖玻片封片;指甲油封边;共聚焦显微镜观察。

2 结果
2.1 高盐环境对内皮细胞系中TRPV4与cPLA2的空间偶联作用的影响 梯度高盐处理HMEC结果显示:20 mol·L-1NaCl处理HMEC细胞3 d后,细胞中的TRPV4与cPLA2的空间偶联作用没有差异;而40、80 mol·L-1NaCl处理后,细胞中的TRPV4与cPLA2的空间偶联作用明显提高,40、80 mol·L-1NaCl处理后,TRPV4与cPLA2的FRET效率分别增加了57.8%(P<0.05,n=20),56.5%(P<0.05,n=20),且差异有统计学意义(Fig 1);80 mol·L-1NaCl处理后,细胞死亡率很高,细胞形态变化明显;160 mol·L-1NaCl处理后,细胞基本死亡。故在不影响细胞生长状态的情况下,40 mmol·L-1NaCl能明显增强TRPV4与cPLA2的空间偶联作用。
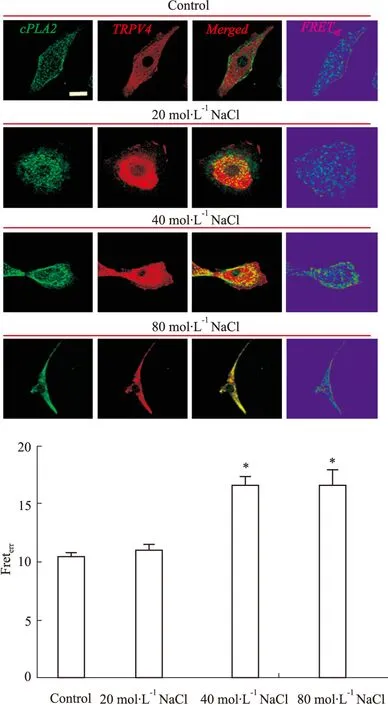
Fig 1 Effect of high salt on physical coupling of TRPV4 and cPLA2 in HMEC
*P<0.05vsControl.(Scale bar,10 μm)
2.2 外源性增加cPLA2对TRPV4与cPLA2的空间偶联作用的影响 将cPLA2-GFP质粒转染HMEC细胞,并用免疫荧光共振能量转移(FRET)方法检测,结果显示:cPLA2-GFP导入HMEC细胞,对细胞中的TRPV4与cPLA2的空间偶联作用基本没有影响;而40 mol·L-1NaCl处理后的cPLA2-GFP组细胞,其TRPV4与cPLA2的空间偶联作用,其FRET效率较cPLA2-GFP组细胞增加了38.2%(P<0.05,n=20),差异具有统计学意义(Fig 2)。该结果表明,在细胞水平上,外源性增加cPLA2的表达对TRPV4与cPLA2的空间偶联作用无明显影响,而高盐诱导内皮细胞能明显提高两者的空间偶联作用。
2.3 高盐诱导的高血压小鼠中胸主动脉原代内皮 细胞中TRPV4与cPLA2的空间偶联作用 尾套法测量小鼠血压结果表明:在d 4,高盐组小鼠给予8% NaCl高盐饲料,喂养7 d后,根据统计结果显示高盐组小鼠MAP基本稳定,△MAP为(12.4±0.2) kPa(n=20,Fig 3A)。
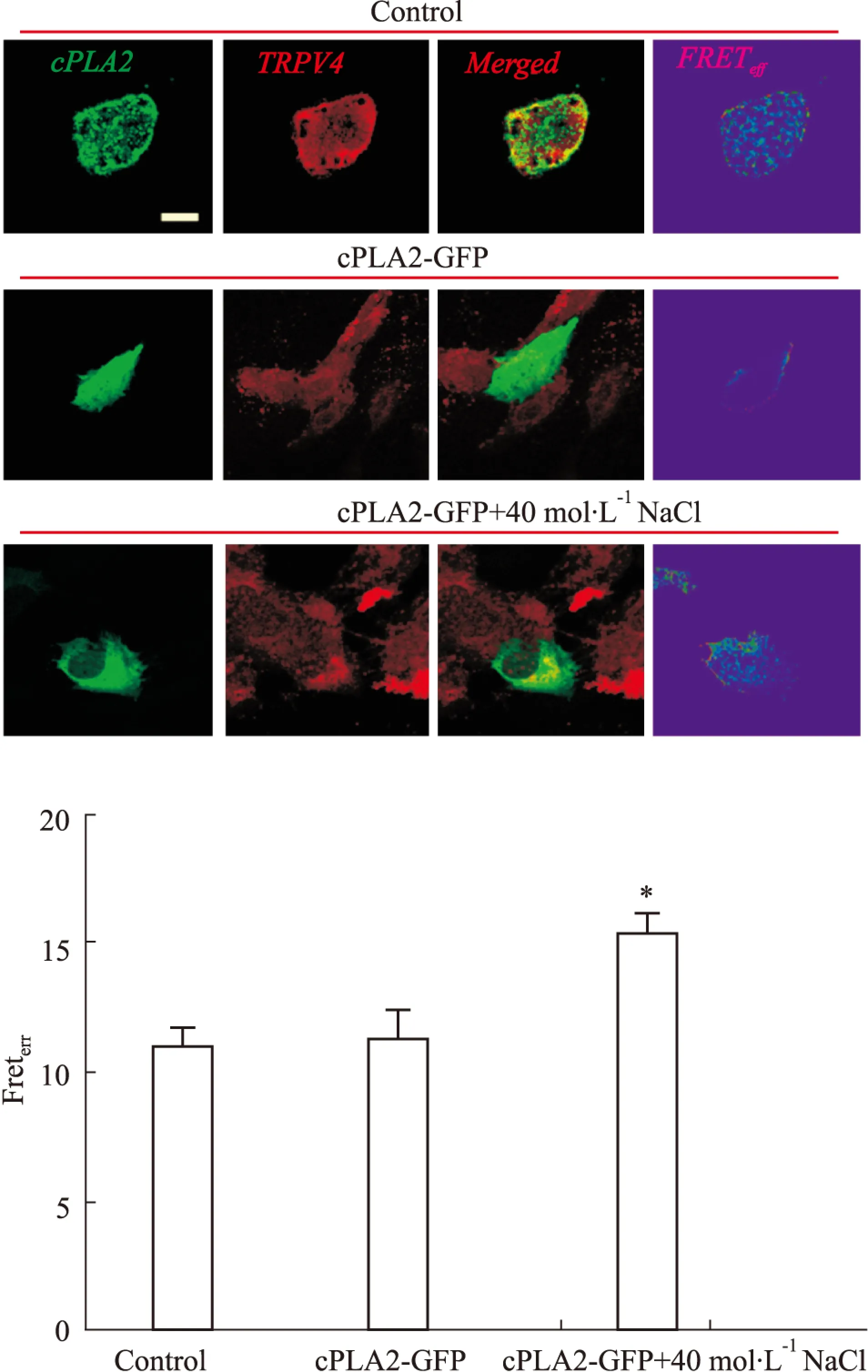
Fig 2 Effect of cPLA2 on physical coupling of TRPV4 and cPLA2 in HMEC
*P<0.05vscPLA2-GFP(Scale bar,10 μm)
原代分离小鼠胸主动脉内皮细胞后,其FRET结果显示:High-salt组小鼠胸主动脉原代细胞的TRPV4与cPLA2的空间偶联作用较野生型小鼠有明显提高,其FRET效率增加了59.3%(P<0.05,n/N=20/10),差异具有统计学意义(Fig 3B)。表明在动物组织水平上,高血压状态下内皮细胞中的TRPV4与cPLA2的空间偶联作用增强。
2.4 高盐诱导的高血压小鼠胸主动脉血管环中TRPV4与cPLA2的空间偶联作用 对小鼠胸主动脉环冰冻切片,按照步骤进行免疫组化实验,然后在激光共聚焦扫描显微镜下检测其FRET效率,结果显示:内皮细胞标记物CD31在血管环的内侧一层表达;高盐诱导的高血压小鼠的胸主动脉环上的内 皮细胞中TRPV4与cPLA2的空间偶联作用较野生型小鼠有明显增强,FRET效率增加了45.9%(P<0.05,n/N=20/10),见Fig 4。表明在动物组织水平上,高血压状态下内皮细胞中的TRPV4与cPLA2的空间偶联作用增强。
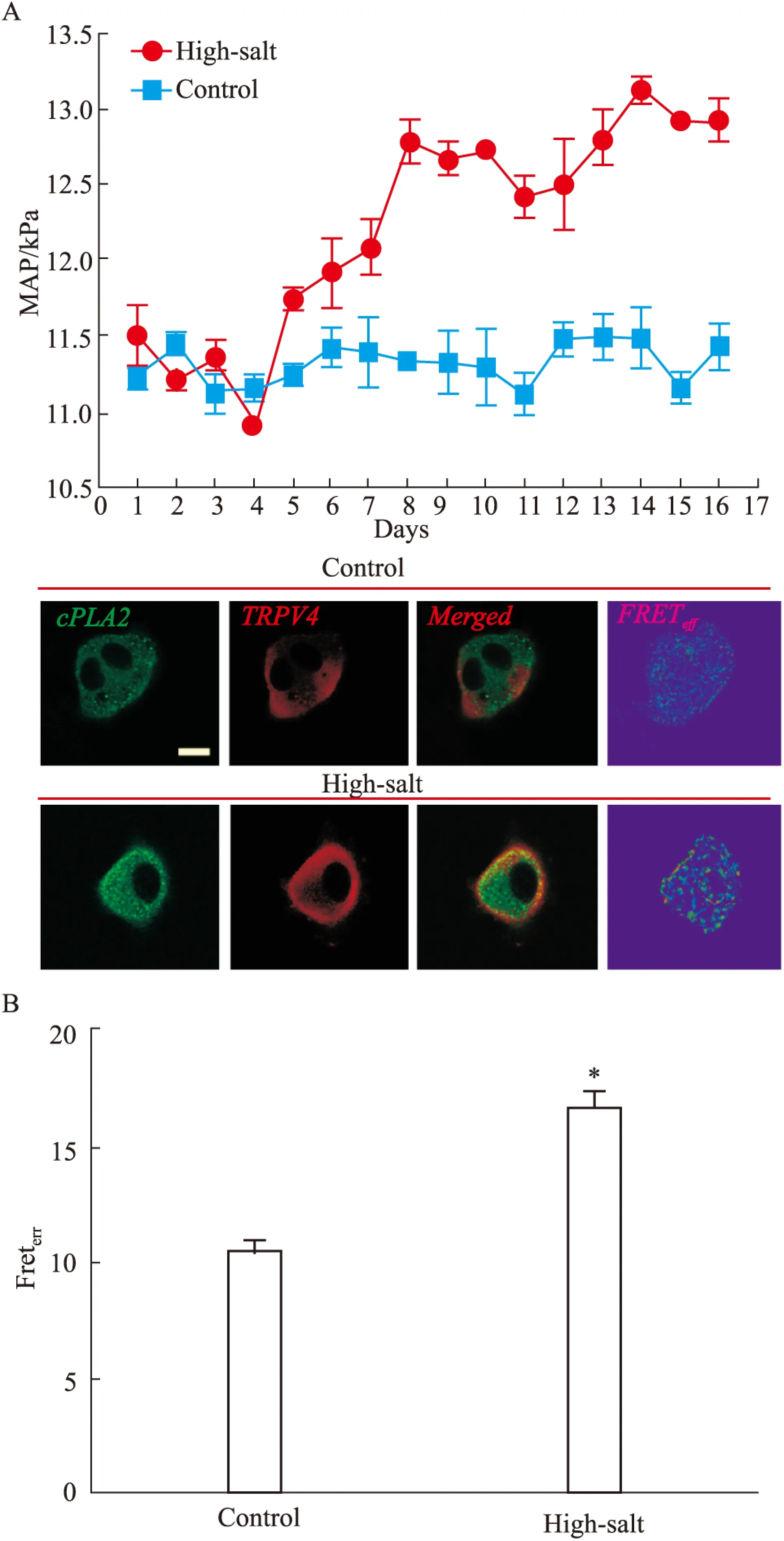
Fig 3 The physical interaction of TRPV4 and cPLA2 in primary cultured endothelial cells in mice on a high-salt diet (8% NaCl)
*P<0.05vsControl(Scale bar,10 μm)
3 讨论
研究表明[4],高盐饮食诱发的心血管疾病(如高血压)中TRPV4与血管张力的调节密切相关;在高血压大鼠主动脉内皮细胞中,Ca2+激活cPLA2,经过一系列信号转导释放内皮依赖性收缩因子(EDCF),从而导致血管的收缩[ 8]。两者均参与了血管张力的调节,然而两者之间的相互作用不明,因此本文研究了两者之间的空间偶联作用。近期有文献报道了TRPV4通道与其它蛋白之间产生相互作用共同调节各种生理或病理过程[ 9],TRPV4通道与瞬时感受器电位通道C型成员1(TRPC1)相互形成异聚体离子通道,两者不仅空间上形成通道聚合体,并且功能上发生相互作用,在血流剪切力的作用下共同调节血管的舒张作用[ 10],并且TRPV4通道与大电导钙激活钾选择性通道(KCa1.1)[ 11]及重要蛋白的小窝丰富的区域产生相互作用[ 12]。本研究结果表明高盐饮食可以增强TRPV4通道与cPLA2蛋白的空间偶联作用,结果与上述文献报道相似,为研究调节血管内皮功能紊乱提供了新思路。
Zhang等[ 13]报道了高盐饮食是诱发许多心血管疾病中关键性因素,并通过盐浓度梯度处理内皮细胞,在细胞水平模拟病理状态。因此本研究通过设定盐浓度梯度(培养基中外源加入20、40、80、160 mol·L-1NaCl)处理人微血管内皮细胞(HMEC)确定不影响细胞正常生长状态的最适诱导浓度为40 mol·L-1。Adebiyi等[ 14]通过immuno-FRET的方法证明了内源性的IP3R1与TRPC3在空间上发生 相互偶联作用,但是并没有和TRPC6或TRPM4在空间上发生偶联作用。因此本研究在细胞水平上,通过immuno-FRET方法检测人微血管内皮细胞中TRPV4与cPLA2的空间偶联作用,较充分地论证了高盐诱导的内皮细胞系病理状态下,内皮细胞中TRPV4与cPLA2的空间偶联作用明显增强。然后在高盐饮食的动物模型水平上,通过原代培养胸主动脉内皮细胞和胸主动脉组织段水平上,通过immuno-FRET技术证明了高盐饮食的动物模型中,内皮细胞中TRPV4与cPLA2的空间偶联作用明显增强,此结果与高盐诱导的HMEC细胞系结果一致。Ma等[ 15]报道的在糖尿病大鼠体内,不仅内皮细胞中TRPV4与KCa2.3空间偶联作用发生了改变,而且两者之间的功能偶联同样发生了改变,TRPV4-KCa2.3信号传导途径在乙酰胆碱诱导的平滑肌细胞超极化和大鼠肠系膜微动脉血管的松弛中起着关键性作用。本研究结果表明,高盐饮食增强内皮细胞中TRPV4与cPLA2的空间偶联作用,而通过上述文献我们可以合理推断TRPV4与cPLA2可能在功能上共同调节了高盐饮食诱导的内皮细胞功能紊乱,下一步我们可以通过小鼠血管张力实验进行验证两者功能上的相互作用。
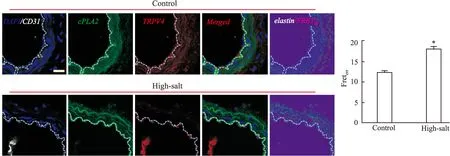
Fig 4 The physical interaction of TRPV4 and cPLA2 in arterial segments in mice on a high-salt diet (8% NaCl).
*P<0.05vsControl(Scale bar,10 μm)
综上所述,本研究通过探究高盐饮食对内皮细胞中TRPV4与cPLA2空间偶联作用的影响,发现高盐饮食增强了内皮细胞中TRPV4与cPLA2的空间偶联作用,这可能揭示着两者在功能上也相互作用,共同调节血管张力,但其机制尚待进一步研究探讨,此研究为血管内皮功能紊乱提供了新的方向。
(致谢:本文实验在江南大学药学院药物设计及分子药理学实验室完成,感谢我的导师金坚教授,感谢马鑫教授。感谢所有实验参与人员的大力帮助!)
[1] Ramsey I S, Delling M, Clapham D E. An introduction to TRP channels[J].AnnuRevPhysiol, 2006, 68: 619-47.
[2] 王兰兰. LPS致大鼠发热过程中下丘脑TRPV4对体温及cAMP含量、[Ca2+]i浓度的影响[J]. 中国药理学通报, 2007, 24:1174-7.
[2] Wang L L. Effects of TRPV4 on LPS-induced fever the content of cMAP and the concentration of [Ca2+]iin rat hypothalamus[J].ChinPharmacolBull, 2007, 24:1174-7.
[3] 王胜兰, 戴 毅, 刘晓丽,等. TRP通道与偏头痛[J]. 中国药理学通报, 2013, 29(10):1352-4.
[3] Wang S L, Dai Y, Liu X L, et al. TRP channels and migraine[J].ChinPharmacolBull, 2013, 29(10):1352-4.
[4] Gao F, Sui D, Garavito R M, et al. Salt intake augments hypotensive effects of transient receptor potential vanilloid 4 functional significance and implication[J].Hypertension, 2009, 53(2): 228-35.
[5] Boonstra J, Van Rossum G S. The role of cytosolic phospholipase A2 in cell cycle progression[J].ProgCellCycleRes, 2003, 5: 181-90.
[6] Das S, Rafter J D, Kim K P, et al. Mechanism of group IVA cytosolic phospholipase A2 activation by phosphorylation[J].JBiolChem, 2003, 278(42): 41431-42.
[7] Ramanadham S, Ali T, Ashley J W, et al. Calcium-independent phospholipases A2 and their roles in biological processes and diseases[J].JLipidRes, 2015, 56(9): 1643-68.
[8] Spitler K M, Takayuki M, R Clinton W. Suppression of endoplasmic reticulum stress improves endothelium-dependent contractile responses in aorta of the spontaneously hypertensive rat.[J].AmJPhysiolHeartCircPhysiol, 2013, 305(3):85-93.
[9] Tomilin V, Mamenko M, Zaika O, et al. Role of renal TRP channels in physiology and pathology[C〗//Seminars in immunopathology[J].SeminImmunopagthol, 2016,38(3): 371-83.
[10] Ma Y,Zhang P,Li J,et al. Epoxyeicosatrienoic acids act through TRPV4-TRPC1-KCa1.1 complex to induce smooth muscle membrane hyperpolarization and relaxation in human internal mammary arteries[J].BiochimBiophysActa,2015,1852(3):552-9.
[11] Hdud I M, Mobasheri A, Loughna P T. Effect of osmotic stress on the expression of TRPV4 and BKCa channels and possible interaction with ERK1/2 and p38 in cultured equine chondrocytes[J].AmJPhysiolCellPhysiol, 2014, 306(11): C1050-7.
[12] Filosa J A, Yao X, Rath G. TRPV4 and the regulation of vascular tone[J].JCardiovascPharmacol, 2013, 61(2): 113-9.
[13] Zhang T, Fang S, Wan C, et al. Excess salt exacerbates blood-brain barrier disruption via a p38/MAPK/SGK1-dependent pathway in permanent cerebral ischemia[J].SciRep, 2015, 5:16548.
[14] Adebiyi A, Zhao G, Narayanan D, et al. Isoform-selective physical coupling of TRPC3 channels to IP3 receptors in smooth muscle cells regulates arterial contractility[J].CirculationRes, 2010, 106(10): 1603-12.
[15] Ma X, Du J, Zhang P, et al. Functional role of TRPV4-KCa2.3 signaling in vascular endothelial cells in normal and streptozotocin-induced diabetic rats[J].Hypertension, 2013, 62(1): 134-9.
High salt diet enhances the physical coupling between TRPV4 and cPLA2
SUN Chun-yuan,XIE Ming-xu,LIU Yu-ying,CAI Yan-fei,ZHANG Peng,JIN Jian,MA Xin
(SchoolofPharmaceuticalSciences,JiangnanUniversity,WuxiJiangsu214122,China)
Aim To observe the physical coupling between transient receptor potential channel vanilloid type 4 (TRPV4) and cPLA2 in endothelial cells. Methods We investigated the physical association of TRPV4-cPLA2 coupling by immunofluorescence resonance energy transfer (immuno-FRET) to assess the spatial proximity between TRPV4 and cPLA2 in human microvascular endothelial cells (HMEC), primary cultured endothelial cells and in thoracic aortas rings from high salt-induced hypertension mice. Results At the cellular level,with high salt treatment, the physical interaction of TRPV4 and cPLA2 was significantly enhanced in primary vascular endothelial cells and HMEC. Furthermore, in thoracic aortas rings from high salt-induced hypertension mice, we found an increases interaction between TRPV4 and cPLA2 in endothelial cells from arterial segments . Conclusion High-salt treatment increases the endothelial TRPV4-cPLA2 coupling, indicating that this coupling may provide a new target for vascular endothelial dysfunction.
TRPV4;cPLA2;high salt; thoracic aorta; immune-fluorescence resonance energy transfer; spatial proximity
时间:2016-12-5 15:14
http://www.cnki.net/kcms/detail/34.1086.R.20161205.1514.032.html
2016-07-21,
2016-09-08
国家自然科学基金资助项目(No 91439131)
孙春原(1991-),男,硕士生,研究方向:药理学,E-mail:15261593122@163.com; 马 鑫(1981-),男,博士,教授,研究方向:药理学,通讯作者,E-mail:maxin@jiangnan.edu.cn
10.3969/j.issn.1001-1978.2016.12.016
A
1001-1978(2016)12-1718-06
R-332;R322.121;R348.1;R329.25;R331.32;R345.61;R544.1