豆粕发酵菌株筛选和鉴定及发酵条件优化❋
2017-01-06张蓓莉皮雄娥麦康森周慧慧
张蓓莉, 何 艮, 皮雄娥, 王 欣, 麦康森, 周慧慧
(1.中国海洋大学教育部海水养殖重点实验室,山东 青岛 266003; 2.浙江省农科院植物保护与微生物所,浙江 杭州 310021)
豆粕发酵菌株筛选和鉴定及发酵条件优化❋
张蓓莉1, 何 艮1, 皮雄娥2❋❋, 王 欣2, 麦康森1, 周慧慧1
(1.中国海洋大学教育部海水养殖重点实验室,山东 青岛 266003; 2.浙江省农科院植物保护与微生物所,浙江 杭州 310021)
为筛选出能够高效降解豆粕碳水化合物和蛋白的菌株,并优化菌株发酵条件。以纤维素酶、果胶酶、木聚糖酶和蛋白酶活力为指标,从真菌A-1、A-2、O-1、M-4 、Y-11和细菌KC 6株菌株中筛选出1株产酶丰富的菌株。利用18S rRNA基因序列法鉴定该菌株,通过单因素实验优化菌株的发酵条件。研究表明:A-1和M-4纤维素酶活力显著高于其它菌株(P<0.05), A-2木聚糖酶活力显著性高于其它菌株(P<0.05),A-1和A-2果胶酶活力显著高于其他菌株(P<0.05),A-1蛋白酶活力显著高于其它菌株(P<0.05)。综合比较,选择A-1作为发酵豆粕菌株。经基因序列鉴定,A-1菌株为泡盛曲霉(Aspergillusawamori)。其最适的发酵条件为:料水比为1∶1.1,发酵温度为31 ℃,发酵时间为37 h,添加的营养因子为2‰K2HPO4、2‰NaCl、2‰(NH4)2SO4、1%葡萄糖、2‰尿素。在此发酵条件下,豆粕中蛋白质含量从50.8%提高到61.7%,可溶性氮指数(TCA-NSI)从3.9%提高到19.8%,胰蛋白酶抑制因子含量从2 mg/g降到0.4 mg/g以下,水苏糖含量从32.52 mg/g降到0.39 mg/g,棉籽糖含量从12.09 mg/g降到0.73 mg/g。大豆球蛋白含量从94 mg/g降到1.4 mg/g以下,β-伴球蛋白含量从109.2 mg/g降到2.8 mg/g以下。研究结果表明:泡盛曲霉能显著提高豆粕蛋白质含量,降低抗营养因子,提高豆粕的营养价值。本研究为利用微生物发酵豆粕替代鱼粉提供了理论基础。
豆粕;发酵;纤维素酶;木聚糖酶;果胶酶;蛋白酶;发酵条件
水产品脂肪含量低、蛋白质含量高、营养平衡、味道鲜美。随着国民生活水平的提高和健康饮食观念的普及,水产品已成为必不可少的膳食构成成分。1989年以来,我国水产品产量已连续22年居世界首位。为满足国民对水产品日益增长的需求,我国水产养殖规模逐年扩大,水产品年产量不断提高。水产养殖离不开鱼油和鱼粉。水产养殖业的发展导致鱼油和鱼粉价格不断上扬。因此,用植物蛋白替代鱼粉备受关注。研究表明[1-2],植物蛋白部分替代鱼粉是可行的。但是,过量植物蛋白会急剧降低水生动物生长[3]。因此,亟待寻找能媲美鱼粉的蛋白源。
豆粕是主要植物蛋白源之一,来源广,价格低,易储存,营养较均衡。用豆粕替代饲料鱼粉已有许多研究报道[4-5]。豆粕含有大量碳水化合物、胰蛋白酶抑制因子、大豆寡糖、抗原蛋白、植酸、凝集素和大豆皂甙等抗营养因子,其在水产饲料特别是天然“糖尿病”的肉食性鱼饲料中的应用受到限制。肉食性鱼不能降解糖类也不耐受糖类,而豆粕含35%左右的碳水化合物。细胞壁纤维素将豆粕蛋白包裹起来,阻碍了鱼类利用蛋白质。美国国家研究委员会(NRC)指出植物蛋白含大量碳水化合物和粗纤维等,肉食性鱼类难消化这些组分[6]。豆粕中的抗营养因子阻碍鱼类消化吸收其营养物质。另外,大豆抗原蛋白具有致敏性,易引发炎症反应。在虹鳟(Oncorhynchusmykiss)[7]和大西洋鲑(Salmosalar)[8]饲料中,高比例豆粕替代鱼粉导致肠道炎症,不同程度损伤黏膜。许多研究表明,微生物发酵能降低豆粕抗营养因子含量、释放游离氨基酸,改善豆粕营养价值[9],提高水产动物的饲料利用率[10]。以往的研究[11-12]发现豆粕的微生物发酵不能彻底分解碳水化合物,是豆粕不能高比例替代鱼粉的原因之一。本研究筛选高效降解碳水化合物和蛋白质的真菌菌株,并优化发酵条件,以降低豆粕碳水化合物含量,提高豆粕蛋白利用率。
1 材料与方法
1.1 材料
1.1.1 微生物菌株 真菌O-1和M-4由本实验室保藏。真菌A-1和A-2,酵母Y-11和细菌枯草芽孢杆菌KC由浙江省农业科学院植物保护与微生物所保藏。原料豆粕(干物质蛋白质含量50.8%)由山东六和集团有限公司提供。
1.1.2 察氏琼脂培养基含硝酸钠(NaNO3)3g,磷酸氢二钾(K2HPO4)1g,硫酸镁(MgSO4·7H2O)0.5g,氯化钾(KCl)0.5g,硫酸亚铁(FeSO4·7H2O)0.01g,蔗糖30g,琼脂20g,蒸馏水1000mL,pH值不做调整,121℃灭菌20min。PDA琼脂培养基含马铃薯(去皮)200g,葡萄糖20g,琼脂20g,水1000ml,pH值不做调整,121℃灭菌20min。LB琼脂培养基含胰蛋白胨(Tryptone) 10g/L,酵母提取物(Yeast extract) 5g/L,氯化钠(NaCl) 10g/L,琼脂20g,水1000mL,pH值不做调整,121℃灭菌20min。菌种扩繁培养基含麸皮9g,豆粕1g,K2HPO40.1g,水10mL,pH不做调整,121 ℃灭菌20min。豆粕发酵培养基:豆粕40g,pH不做调整,121 ℃灭菌20min。
1.2 实验方法
1.2.1 菌种的保藏及处理 将毛霉O-1、M-4接种至察氏琼脂斜面培养基,曲霉A-1、A-2,酵母Y-11接种至 PDA琼脂斜面培养基,枯草芽孢杆菌KC接种至LB琼脂斜面培养基,并在对应培养条件下活化、培养,活化后在4℃保存备用。
1.2.2 菌株的筛选 将各菌株接种至豆粕发酵培养基。真菌置于28℃,细菌置于37℃培养2d,55℃烘干粉碎,检测纤维素酶、果胶酶、木聚糖酶和蛋白酶的酶活力。
1.2.3 菌株鉴定及保藏 菌株采用18S rRNA基因序列测定法进行菌株鉴定,由上海美吉公司执行。所述菌株已于2015年3月24日保藏在中国典型培养物保藏中心,保藏编号为CTCC NO:M2015155。
1.2.4 发酵条件优化 用无菌生理盐水将菌种扩繁培养基上的孢子洗脱下来,调节孢子密度至1×108个/mL,接种于发酵培养基,接种量为1mL。设置4个因素,以不接种的豆粕发酵培养基为对照,3个重复,分别优化料水比、发酵温度、营养因子和发酵时间。
料水比7个,分别为:1∶0.7、1∶0.8、1∶0.9、1∶1、1∶1.1、1∶1.2和1∶1.3,发酵条件pH不调节、28℃、40h。固定料水比 1∶1.1,设置发酵温度5个,分别为25、28、31、34和37℃。 固定料水比1∶1.1和31℃发酵温度,设置营养因子5个:1%K2HPO4+1%NaCl、2%(NH4)2SO4、2%葡萄糖、2%尿素和2‰K2HPO4+2‰NaCl+2‰(NH4)2SO4+1%葡萄糖+2‰尿素。固定料水比1∶1.1,添加完整营养因子(2‰K2HPO4、2‰NaCl、2‰(NH4)2SO4、1%葡萄糖、2‰尿素),固定发酵温度31 ℃,设置发酵时间6个:22、28、31、34、37和40 h。
发酵结束后, 55 ℃烘干,粉碎后密封备用。
1.2.5 检测方法 纤维素酶活力测定参照王琳等[13]的检测方法;木聚糖酶活力测定参照费迪波[14];果胶酶活力测定参照陈小湘[15];蛋白酶酶力测定参考赵彩艳[16];蛋白质用凯氏定氮法,可溶性氮总含量的测定用TCA-NSI法[17]。
1.2.6 数据处理 用SPSS16.0 for windows 对数据进行单因素方差分析。若差异显著,则用Duncan检验法进行多重比较,显著水平为P<0.05。
2 结果与分析
2.1 菌株筛选
不同菌株产酶种类和所产酶的活力不同。比较纤维素酶、木聚糖酶、果胶酶、蛋白酶酶活力筛选菌株。由图1可知, A-1木聚糖酶活力低于A-2(P<0.05),但其纤维素酶、果胶酶和蛋白酶活力显著高于其他菌株(P<0.05)。因此,从整体角度考虑,我们选取A-1为豆粕发酵菌株。
2.2 菌株A-1的鉴定结果
菌株A-1在PDA平板上的菌落呈橄榄褐色,菌落反面为土黄色至黄褐色,绒毛状,放射性分布,成熟后产生黄褐色孢子。对A-1的18S rRNA基因序列进行测定后再在NCBI中使用Blast进行比较,发现菌株A-1的18S rRNA基因序列与Aspergillus awamori (KF922319.1, GenBank)和Aspergillus niger(KF758784.1, GenBank)的基因序列同源性为100%,结合菌株的形体学特征,确定菌株A-1为泡盛曲霉(Aspergillusawamori)。
2.3 发酵条件优化
研究结果表明料水比显著影响A-1发酵豆粕性能(P<0.05)。料水比从1∶0.7到1∶1.3, A-1先提高发酵豆粕蛋白质含量后降低其含量。料水比1∶1.1时,发酵性能最好,发酵豆粕蛋白含量最高(见图2)。因此,料水比1∶1.1最佳。最佳料水比时,温度显著性影响A-1豆粕发酵性能P<0.05)。从25~37℃, A-1先显著提高豆粕蛋白质含量,然后降低。28和31℃时,发酵性能最好,显著提高豆粕蛋白含量(P<0.05)。31比28℃更显著缩短发酵时间。因此, 31℃为最佳发酵时间。

图1 不同菌株的酶活力
不同营养盐也显著性影响A-1发酵豆粕性能。2%尿素和全营养成分时,A-1显著增加豆粕蛋白质含量,全营养盐时可溶性氮指数(TCA-NSI)最高(见图3)。因此,最佳营养因子为全营养盐。发酵时间显著影响A-1发酵豆粕性能。从22~40h,豆粕蛋白质含量呈现先升高后降低趋势。34和37h时,发酵豆粕蛋白质含量显著高于时间。37~40h时,发酵豆粕可溶性氮指数显著高于其他时间(P<0.05)。因此,最佳发酵时间为37h。
综上,泡盛曲霉的最适发酵条件为:料水比为1∶1.1,发酵温度为31℃,发酵时间为37h,添加的营养因子为2‰K2HPO4、2‰NaCl、2‰(NH4)2SO4、1%葡萄糖、2‰尿素。
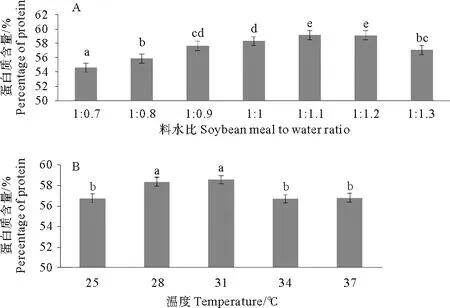
图2 料水比和温度对A-1发酵豆粕蛋白质含量的影响

图3 营养因子(A)和时间(B)对A-1发酵豆粕蛋白质含量和可溶性氮指数(TCA-NSI)的影响
2.4 发酵前后豆粕品质变化
优化发酵条件下,豆粕发酵前后蛋白质含量从50.8%提高到61.7%,TCA-NSI从3.9%提高到19.8%。必需氨基酸含量也有不同程度的提高(见表1)。发酵前后,豆粕中胰蛋白酶抑制因子含量从2mg/g降到<0.4mg/g,水苏糖含量从32.52mg/g降到0.39mg/g,棉籽糖含量从12.09mg/g降到0.73mg/g。大豆蛋白中,抗原蛋白分子量分布在35~60kD(见图4)。豆粕经发酵后这部分蛋白几乎全部被分解。分子量在11~35 kD的蛋白也得到了有效的降解。发酵豆粕的蛋白质分子量多在11kD以下。发酵后, 大豆球蛋白由94 mg/g降到<1.4mg/g,β-伴球蛋白由109.2mg/g降到<2.8mg/g。由此可见,豆粕经A-1发酵后,品质有了显著提升。

表1 A-1发酵前后豆粕必需氨基酸含量变化
①Essential amino acid;②Soybean meal;③Fermented soybean meal

(Maker:蛋白质标准品Protein standard;SBM:豆粕Soybean meal;FSBM:发酵豆粕Fermented soybean meal.)
图4 豆粕的蛋白质SDS-PAGE图
Fig.4 The protein profiles of soybean meal by SDS-PAGE
3 讨论
豆粕是大豆榨油副产品,是水产饲料重要植物性蛋白源之一。然而,其碳水化合物大约占35%,难消化,降低了肉食性鱼类植物蛋白消化率[6]。目前,发酵豆粕研究热点集中在抗营养因子的钝化或降解[18],而对其难消化的碳水化合物研究较少,特别是在肉食性水产动物饲料领域。本研究用泡盛曲霉A-1在37h内有效降解豆粕碳水化合物和大分子蛋白质,获得与Song等[19]和严鹤松等[20]的研究相似的结果。
与液体发酵不同,固态发酵物料的含水量非常重要,料水比不仅影响微生物从培养基中获取营养物质的能力,还影响培养系统气体流动及微生物获取氧气进行自身生长代谢的能力[21]。本研究中,泡盛曲霉A-1在料水比为1∶1.1~1∶1.2,即含水110%~120%时,对豆粕中的碳水化合物有最佳降解。其原因可能是发酵基质含水量低时,基质表面形成水膜小,不能溶解足够泡盛曲霉生长所需要的无机盐及代谢产物,影响了泡盛曲霉的生长。而当含水量过高时,发酵基质的多孔性降低,影响了基质内气体的体积和气体交换,难以控温控湿,不利于耗氧的泡盛曲霉的生长。本研究结果也表明在料水比为1∶0.7时,对豆粕碳水化合物降解效果最差。这与刘建峰等[22]在用响应面分析法优化豆粕固态发酵的料水比1∶1类似。然而,杨玉芬[23]在用乳酸菌、酵母菌及枯草芽孢杆菌发酵豆粕时发现水分对豆粕蛋白质含量的影响不大。这可能是与菌种有关。乳酸菌和酵母菌对氧气的需求量不大,发酵所需要的水分也低。王晓东等[24]的研究发现初始水分含量为200%时,黑曲霉对双低菜粕中的植酸和单宁有更好的降解效果。这可能是由于不同的物料发酵水分消耗不同。菜粕较其他物料吸水性更强,菌种生长所需要的水分就更多。同时,发酵后期菌株的快速生长产生大量的热,会蒸发掉菜粕中的水分,影响发酵。
不同菌株适应温度不同,对原料的利用和分解速度也不同。因此,在发酵过程中温度是必须优化的条件之一。本研究发现,泡盛曲霉A-1在28和31 ℃时发酵豆粕蛋白质含量最高(P<0.05)。莫重文等[25]用米曲霉(A3.042)和啤酒酵母在28 ℃时混合发酵豆粕,发酵豆粕蛋白含量显著增高,增加了12.1%。也有研究发现混合菌株在35 ℃时,发酵豆粕的蛋白质含量最高[26]。这可能与菌株的耐热性有关。菌株生长时会产生大量的热,若菌株的耐热性差,就会导致发酵失败。

4 结论
泡盛曲霉是一株产纤维素酶、木聚糖酶、果胶酶等酶类,能有效降解豆粕多糖、低聚糖及细胞壁等碳水化合物成分,进而提高豆粕蛋白质含量的菌株。用该菌株发酵豆粕,豆粕蛋白质含量由50.8%提高至61.7%。该菌株也能有效降解大分子蛋白质,使豆粕中的可溶性氮指数由3.9%提高至19.8%。发酵降低了大豆寡糖(水苏糖和棉籽糖等)抗营养因子含量。降解大分子蛋白质的同时也降低了致敏性抗原蛋白(大豆球蛋白和β-伴球蛋白)和其他抗营养因子(胰蛋白酶抑制因子)的含量,提高了必需氨基酸的含量和豆粕营养价值,为发酵豆粕替代鱼粉,拓展肉食性水产动物的饲料蛋白源提供了认知依据。
[1] Carter C G, Hauler R C. Fish meal replacement by plant meals in extruded feeds for Atlantic salmon,Salmosalar[J]. Aquaculture, 2000, 185(3), 299-311.
[2] 艾庆辉,谢小军. 水生动物对植物蛋白源利用的研究进展 [J]. 中国海洋大学学报(自然科学版), 2005, 36(6): 929-935. Ai Q H, Xie X J. Advance in Utilization of Plant Proteins by Aquatic Animals [J]. Periodical of Ocean University of China, 2005, 36(6): 929-935.
[3] Aksnes A, Hope B, Albrektsen S. Size-fractionated fish hydrolysate as feed ingredient for rainbow trout (Oncorhynchusmykiss) fed high plant protein diets. II: Flesh quality, absorption, retention and fillet levels of taurine and anserine [J]. Aquaculture, 2006, 261(1): 318-326.
[4] Kokou F, Sarropoulou E, Cotou E, et al. Effects of Fish Meal Replacement by a Soybean Protein on Growth, Histology, Selected Immune and Oxidative Status Markers of Gilthead Sea Bream,Sparusaurata[J]. Journal of the World Aquaculture Society, 2015, 46(2): 115-128.
[5] Li Y, Ai Q, Mai K, et al. Comparison of high-protein soybean meal and commercial soybean meal partly replacing fish meal on the activities of digestive enzymes and aminotransferases in juvenile Japanese seabass,Lateolabraxjaponicus(Cuvier, 1828) [J]. Aquaculture Research, 2014, 45(6): 1051-1060.
[6] National Research Council (NRC). Nutrient Requirement of Fish[M]. Washington,DC: National Academy Press, 2011: 335.
[7] Burrells C, Williams P D, Southgate P J, et al. Immunological, physiological and pathological responses of rainbow trout (Oncorhynchusmykiss) to increasing dietary concentrations of soybean proteins [J]. Veterinary Immunology and Immunopathology, 1999, 72(3): 277-288.
[8] Van den Ingh T, Krogdahl Å, Olli J J, et al. Effects of soybean-containing diets on the proximal and distal intestine in Atlantic salmon (Salmosalar): A morphological study [J]. Aquaculture, 1991, 94(4): 297-305.
[9] Yamamoto T, Iwashita Y, Matsunari H, et al. Influence of fermentation conditions for soybean meal in a non-fish meal diet on the growth performance and physiological condition of rainbow trout Oncorhynchus mykiss [J]. Aquaculture, 2010, 309(1): 173-180.
[10] Md. Abdul Kader, ShunsukeKoshio, Manabu Ishikawa, et al. Growth, nutrient utilization, oxidative condition, and element composition of juvenile red sea breamPagrusmajor fed with fermented soybean meal and scallop by-productblend as fishmeal replacement [J]. Aquaculture, 2011, 77(1): 119-128.
[11] Refstie S, Sahlström S, Bråthen E, et al. Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon (Salmosalar) [J]. Aquaculture, 2005, 246(1): 331-345.
[12] Azarm H M, Lee S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea breamAcanthopagrusschlegeli[J]. Aquaculture Research, 2014, 45(6): 994-1003.
[13] 王琳, 刘国生, 王林嵩, 等. DNS 法测定纤维素酶活力最适条件研究 [J]. 河南师范大学学报(自然科学版), 1998, 26(3): 66-69. Wang L, Liu G S, Wang L S, et al. The optimal conditions for cellulase activity measurement with DNS method [J]. Journal of Henan Normal University (Natural Science), 1998, 26(3): 66-69.
[14] 费笛波, 冯观泉, 袁超. 饲用木聚糖酶活性测定方法的研究 [J]. 浙江农业学报, 2004, 16(2): 53-58. Fei D B, Feng G Q, Yuan C. Studies on the method of measuring the enzyme activity of feed xylanase [J]. Acta Agriculturae Zhejiangensis, 2004, 16(2): 53-58.
[15] 陈小湘, 付康丽, 陆大年. 苎麻果胶的提取及在果胶酶活测定中的应用 [J]. 印染, 2012(11): 5-8. Chen X X, Fu K L, Lu D N. Extraction of pecin from ramie fiber and its application to determination of pectinase activity [J]. Dyeing and Finishing, 2012(11): 5-8.
[16] 赵彩艳, 程茂基, 蔡克周, 等. 黑曲霉酸性蛋白酶酶学性质的研究 [J]. 饲料博览, 2006(3): 5-8. Zhao C Y, Cheng M J, Cai K Z, et al. Studies on characters of acid protease excreted by aspergillus niger ANS [J]. China Journals Books Network, 2006(3): 5-8.
[17] Iemura Y, Takahashi T, Yamada T, et al. Properties of TCA-insoluble peptides in kimoto (traditional seed mash for sake brewing) and conditions for liberation of the peptides from rice protein [J]. Journal of bioscience and bioengineering, 1999, 88(5): 531-535.
[18] 李光神, 邱树毅, 吴鑫颖, 等. 黑曲霉B0201固态浅盘生料发酵产单宁酶工艺研究 [J]. 中国酿造, 2011, 299(4): 98-101. Li G S, Qiu S Y, Wu X Y, et al. Tannase production by uncooked materials and solid-state fermentation ofAspergillusnigerB0201 with shallow trays [J]. China Brewing, 2011, 299(4): 98-101.
[19] Song Y S, Frías J, Martinez-Villaluenga C, et al. Immunoreactivity reduction of soybean meal by fermentation, effect on amino acid composition and antigenicity of commercial soy products [J]. Food Chemistry, 2008, 108(2): 571-581.
[20] 严鹤松,夏俊松,梁运祥. 黑曲霉发酵豆粕的研究 [J]. 饲料工业,2009,30(13):16-21. Yan H S, Xia J S, Liang Y X. Study on aspergillus oryzae fermented soybean meal [J]. Food Industry, 2009,30(13):16-21.
[21] Hu J, Duvnjak Z. The production of a laccase and the decrease of the phenolic content in canola meal during the growth of the fungus Pleurotusostreatus in solid state fermentation processes [J]. Engineering in Life Sciences, 2004, 4(1): 50-55.
[22] 刘建峰, 葛向阳, 梁运祥. 响应面法优化豆粕固态发酵工艺的研究 [J]. 中国生物工程杂志, 2007, 27(6): 87-91. Liu J F, Ge X Y, Liang Y X. Study on optimization of soybean meal solid fermentation process by response surface analysis [J]. China Biotechnology, 2007, 27(6): 87-91.
[23] 杨玉芬, 乔利, 郑宜超. 发酵温度和水分对豆粕发酵品质的影响 [J]. 江西农业大学学报, 2009, 31(6): 1097-1100. Yang Y F, Qiao L, Zheng Y C. The effects of temperature and moisture on fermented quality of soybean meal [J]. Acta Agriculturae Universitatis Jiangxiensis, 2009, 31(6): 1097-1100.
[24] 王晓东, 麦康森, 张彦娇, 等. 双低菜粕中植酸和单宁的黑曲霉发酵降解及条件优化 [J]. 中国海洋大学学报(自然科学版), 2013, 43(2): 15-22. Wang X D, Mai K S, Zhang Y J, et al. Degradation of tannins and phytic acid in double-low rapeseed meal by Aspergillus niger in solid fermentation and optimization of fermenting condition [J]. Periodical of Ocean University of China, 2013, 43(2): 15-22.
[25] 莫重文, 黄岗. 固态发酵法生产发酵豆粕的研究 [J]. 中国油脂, 2007, 32(7): 38-40. Mo C W, Huang G. Production of fermented soybean meal by solid state fermentation [J]. China Oils and Fats, 2007, 32(7): 38-40.
[26] 杨玉芬, 乔利. 发酵温度和时间对豆粕发酵品质的影响 [J]. 北京农学院学报, 2010, 25(4): 18-20. Yang Y F, Q L. The Effects of temperature and time on fermented quality of soybean meal [J]. Journal of Beijing Agriculture College, 2010, 25(4): 18-20.
[27] 蔡俊,王立新. 发酵乳酸工厂废渣生产蛋白饲料影响因子的研究 [J]. 饲料工业, 2005, 26(10): 33-35. Cai J, Wang L X. Studies on the effecting factors for producing protein feed by fermentation of lactic acid residue [J]. Feed Industry, 2005, 26(10): 33-35.
[28] 杨承剑,黄兴国,李伟,等. 超Plackett- Burman 设计在益生菌生长主要影响因子筛选中的应用 [J]. 饲料工业, 2007, 28(16): 31-33. Yang C J, Huang X G, Li W, et al. Application of plackett-burman design in mostly influencing factor riddle of probiotic bacteria growth [J]. Food Industry, 2007, 28(16): 31-33.
[29] 郑虹,邓加聪,谢颖. 一株高温纤维素酶放线菌的筛选及发酵条件的优化 [J]. 闽江学院学报, 2015, 151(5): 100-108. Zheng H, Deng J C, Xie Y. Screening and optimization of culture conditions of a high yield cellulase actinomycetes [J]. Journal of Minjiang University, 2015, 151(5): 100-108.
[30] 刘迎春, 曹宇, 张建新, 等. 混合菌发酵豆粕条件优化及功能性低聚糖水苏糖、棉子糖的测定 [J]. 湖北农业科学, 2015, 54(16): 4007-4011. Liu Y C, Cao Y, Zhang J X, et al. The condition optimization of bacterial combinations for fermentation of bean and determination of the content of stachyose and raffinose [J]. Hubei Agricultural Sciences, 2015, 54(16): 4007-4011.
责任编辑 朱宝象
Isolation and Identification of a Strain Fermenting Soybean Meal and Optimization of Fermentation Process
ZHANG Bei-Li, HE Gen, PI Xiong-E, WANG Xin, MAI Kang-Sen, ZHOU Hui-Hui
(1.The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China; 2. Institute of Plant Protection and Microbiology, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China)
This study aimed to screen strains which can efficiently degrade carbohydrates and proteins of soybean meal and to optimize fermentation conditions. By taking the activities of cellulase, xylanase, pectinase and protease activities as indexes, a strain A-1 which can produce rich enzymes was obtained by screening 6 strains including the fungi A-1, A-2, O-1, M-4, Y-11 and the bacterium KC. Then, the 18S rRNA gene of these fungal strains was sequences and analyzed. Meanwhile, single factor experiments were conducted to optimize the fermentation conditions for soybean meal in which the strain A-1 was used to improve the protein content. The study showed that A-1 and M-4 had significantly high ability of producing cellulase (P< 0.05), while A-2 showed the highest xylanase production (P< 0.05). Meanwhile the pectinase was highly produced by A-1and A-2. Moreover, the A-1 had the highest yield of protease compared with other strains. In conclusion, A-1 was selected as fermentation strain and it was identified to beAspergillusawamori. The optimal fermentation condition was to ferment the soybean meal with 2‰ K2HPO4, 2‰ NaCl, 2‰ (NH4)2SO4, 1‰ glucose, 2‰ urea and the soybean meal-water ratio of 1∶1.1 at 31℃ for 37 h. Under such fermentation condition, the protein content of soybean meal raised from 50.8% to 61.7% and the trichloroacetic acid-nitrogen solubility index (TCA-NSI) grew from 3.9% to 19.8%. While, the contents of stachyose, trypsin inhibitor, and raffinose dropped from 32.52 mg/g, 2 mg/g, and 12.09 mg/g to 0.39 mg/g, less than 0.4mg/g, and 0.73 mg/g, respectively. Furthermore, the soy glycinin content declined from 94 mg/g to less than 1.4 mg/g, accompanying with the reduction of the β-conglycinin content from 109.2 mg/g to lower than 2.8 mg/g. The results proved thatA.awamoriwas able to significantly improve the protein content of soybean meal and reduce anti-nutritional factors thus improve the nutrition value of soybean meal. This research results provided a basis for replacing fish meal with soybean meal effectively fermented byA.awamori..
soybean meal; fermentation; cellulase; xylanase; pectinase; protease; fermentation condition
农业部公益性行业科研专项(201303053);浙江省公益项目(2014R17A52D02)资助 Supported by Special Fund for Agro-Scientific Research in the Public Interest (201303053); Public Welfare Projects of Zhejiang Province (2014R17A52D02)
2015-11-19;
2016-05-12
张蓓莉(1987-),女,博士生。E-mail:zbleducation@163.com
❋❋ 通讯作者: E-mail:pixionge@163.com
S963.5
A
1672-5174(2017)01-061-07
10.16441/j.cnki.hdxb.20150395
张蓓莉, 何艮, 皮雄娥, 等. 豆粕发酵菌株筛选和鉴定及发酵条件优化[J]. 中国海洋大学学报(自然科学版), 2017, 47(1): 61-67.
ZHANG Bei-Li, HE Gen, PI Xiong-E, et al. Isolation and identification of a strain fermenting soybean meal and optimization of fermentation process [J]. Periodical of Ocean University of China, 2017, 47(1): 61-67.
