不同强度运动对自发性高血压大鼠血管内皮结构及功能影响的氧化应激机制
2017-01-06曾凡星石丽君
叶 芳,柏 平,曾凡星,石丽君
体育科学
不同强度运动对自发性高血压大鼠血管内皮结构及功能影响的氧化应激机制
叶 芳,柏 平,曾凡星,石丽君
目的:观察不同强度运动对自发性高血压大鼠(spontaneously hypertensive rat,SHR)肠系膜动脉内皮结构及功能的影响,探讨氧化应激在其中的作用机制。方法:选用3月龄雄性SHR和正常血压大鼠(Wistar Kyoto,WKY)随机分为安静对照组(SHR-C,WKY-C)、中等强度运动组(SHR-M,WKY-M)和高强度运动组(WKY-H,SHR-H)。中等强度运动组以18~20 m/min、高强度运动组以26~28 m/min进行跑台运动,坡度为0°,60 min/天,5天/周。8周运动训练末进行无创尾动脉血压测试、血清氧化应激指标检测、内皮细胞超微结构透射电镜观察及肠系膜动脉微血管张力测定。结果:1)SHR-M的收缩压和舒张压显著低于SHR-C(P<0.05),而SHR-H显著高于SHR-C(P<0.05)。2)血清氧化产物丙二醛(MDA)检测显示:SHR-C组血清MDA含量与WKY-C相比,均值有升高趋势但不具有统计学差异(P>0.05),SHR-M组MDA含量与SHR-C不具有显著性差异(P>0.05),但SHR-H血清MDA含量显著高于SHR-C(P<0.05);抗氧化物酶谷胱甘肽过氧化物酶(GSH-Px)、过氧化物歧化酶(SOD)检测显示:SHR-C GSH-Px酶活力显著低于WKY-C组(P<0.05),SHR-M组和SHR-H组GSH-Px酶活力显著高于SHR-C(P<0.05)。WKY-M SOD显著高于WKY-C(P<0.05),SHR运动组与SHR安静组相比较SOD无统计学差异(P>0.05)。3)透射电镜结果显示:SHR-C和SHR-H组均表现为内皮细胞畸形、胶原纤维增生,而SHR-M血管内皮细胞形态完整。4)微血管张力测定结果显示:SHR-C内皮依赖性血管舒张能力显著小于WKY-C,SHR-M内皮依赖性血管舒张能力显著高于SHR-C,而SHR-H显著低于SHR-M(P<0.05)。结论:中等强度运动训练可以降低高血压大鼠血压、改善内皮结构和功能,其机制可能与运动降低氧化应激水平相关。然而,高强度运动则上调氧化应激水平,加剧了高血压诱导的内皮功能紊乱。
运动强度;高血压;内皮;氧化应激
内皮细胞主要以旁分泌方式分泌血管活性物质,作用于临近的组织、细胞。内皮细胞分泌的活性物质包括血管舒张因子(EDRF)和血管收缩因子(EDCF),两者共同作用于血管张力的调控。但是,在高血压的病理条件下,全身阻力血管处于高应力状态,通过打破EDRF和EDCF之间的平衡,直接造成内皮细胞形态结构的改变和功能的失调,加重高血压的发生和发展。在已有研究中,高血压大鼠模型中选用不同类型的动脉,如:大动脉(主动脉、颈动脉)、微血管(肾血管、肠系膜动脉),都存在着内皮依赖性血管舒张功能的下降。内皮功能紊乱是由多因素共同产生的[11],其中氧化应激(Oxidative Stress,OS)是最关键的因素。OS是一种氧化水平与抗氧化水平的失衡状态,不同程度氧化应激水平使活性氧簇(reactive oxidative species,ROS)对机体产生不同的效应。适宜的ROS水平,使机体适应性的上调酶和非酶抗氧化物的含量,使ROS发挥正常的生理功能,对机体产生正向作用。如果ROS大量蓄积而引起氧化损伤,可能会导致大分子,如DNA、脂质、蛋白质的改变和破坏,甚至危及到细胞死亡和组织损伤[5,9]。因此,有研究将抗氧化物应用于内皮功能紊乱和相关的心血管疾病的治疗中。研究发现,对伴有内皮功能紊乱的冠状动脉疾病,可通过注射维生素-C调节氧化应激水平,提高NO生物利用度,达到治疗的效果[14]。有学者提出,对高血压大鼠模型注射SOD1,研究结果表明,实验组大鼠血压显著下降[23]。抗氧化物的治疗主要通过减少ROS的生成,降低OS水平,从而达到降压效果。然而,ROS并不是单纯对机体产生不利影响,它是机体正常代谢的产物,运动、衰老、炎症都伴随ROS的产生。
《中国高血压基层管理指南》(下文简称《指南》)明确表明,改善长期生活方式是治疗高血压的基石,运动是改善生活方式的重要一环。《指南》推荐高血压患者选择中等运动方式,进行每周5~7次,每次持续30 min的运动,这是对运动作为预防和治疗高血压疾病的认可[2]。研究表明,定期有氧运动是一种有效的干预策略,可以改善疾病状态下内皮依赖性血管舒张能力,如慢性心脏衰竭和高血压[28]。长期的运动锻炼可以使机体产生适应性的变化,从而提高心血管的功能。然而,在选择运动作为治疗手段时,运动处方往往会选择中低强度的有氧运动,对于不同强度运动,尤其是中等强度和高强度运动对高血压疾病的内皮功能和超微结构影响如何,以及不同运动强度下氧化应激水平会如何调控内皮功能,目前国内外研究尚少。本研究以不同运动强度下氧化应激水平对内皮的功能性影响为立足点,探究高血压运动治疗方法的有效运动负荷。
本实验拟用自发性高血压大鼠(spontaneously hypertensive rat,SHR)和正常血压大鼠(Wistar Kyoto,WKY)随机分为安静对照组和运动组。运动组以中等强度和高强度进行跑台运动,观察不同运动强度下的系统血压、内皮细胞超微结构和功能的变化,探讨氧化应激在其中的作用机制,为运动疗法的量——效关系以及运动处方的制定提供实验依据。
1 材料与方法
1.1 实验动物与实验方案
本实验选用3月龄雄性高血压大鼠(SHR,n=24)和同龄的正常血压大鼠(WKY,n=24),体重约250 g,由北京维通利华实验动物技术有限公司提供。将SHR、WKY随机分成安静组(SHR-C,n=8;WKY-C,n=8)和运动组。运动组根据不同运动强度分成高血压中等强度运动组(SHR-M,n=8)、普通血压中等强度运动组(WKY-M,n=8)、高血压高强度运动组(SHR-H,n=8)和正常血压高强度运动组(WKY-H,n=8)。全部动物由北京体育大学动物房饲养,保持室温约22℃,湿度保持40%~45%,国家标准啮齿类动物分笼饲养,自由饮水。

1.2 尾动脉血压的测量
训练前和8周训练后采用尾动脉无创血压测试仪(BP-2010A,软隆科技有限公司,日本)测量各组大鼠的收缩压(SBP)、舒张压(DBP)。
1.3 血清氧化应激指标的检测
大鼠腹腔注射戊巴比妥钠(50 mg/kg),麻醉开腹后用粗纱布去除腹部筋膜和其他组织,找到下腔静脉进行采血,取血后在离心机上以3 500 r/min离心15 min,取上层血清并储存于-80℃,直到下次进行血清指标的分析时取出。
1.4 透射电镜检测
麻醉开腹后迅速取下肠系膜动脉(mesenteric artery,MA),剥离周围组织,防止组织自溶现象,在最短时间内投入4℃2.5%戊二醛固定液,并在固定液中过夜。次日用0.1 mol/L的磷酸盐缓冲液冲洗3次,每次至少15 min;冲洗完毕进行脱水步骤,应梯度进行:70% 丙酮15 min→80% 丙酮15 min→90%丙酮15 min→100% 丙酮20 min(10 min×2);组织进行浸透和包埋,形成包埋块室温储存;超薄切片染色后JEOL JEM-1230(日本)透射电镜进行观察并摄片。
1.5 微血管张力测定
麻醉开腹后迅速取出肠系膜动脉组织,置于4℃ Na-Hepes缓冲液的平皿中。选取一小段含MA零级及其含有三级分支的血管,固定于含有4℃ Na-Hepes缓冲液的胶皿。在体视显微镜下轻轻剪去MA上的脂肪组织,暴露出肠系膜动、静脉,辨别出静脉,去除静脉后剪取4段约1.5 mm长的三级MA备用。为保证血管活性,全程杜绝牵扯。将一根2 cm左右长的钨丝穿进备好的三级MA管腔中,并固定在内含5 mL Na-Hepes(pH=7.4,T=37℃)离体微血管环张力测定仪上,在仪器上操作将另一根钨丝穿入管腔。浴槽持续通95% O2-5% CO2的混合气,保持浴槽温度37℃。调节微调标尺,稍稍将血管扩张,张力调零平衡20 min,此后张力稳定保持在0 mN之后缓慢持续增加血管张力,当血管基础张力稳定维持在1 mN左右停止。平衡后,动脉血管环浴槽中加药观察血管收缩、舒张功能。固定离体血管环后,每轮加药后用5 mL Na-Hepes三次洗脱,等到血管环张力稳定在1 mN左右进行下一轮加药。
Na-Hepes缓冲液成分(mmol/L):121.1 NaCl、10 Hepes、15.16 KCl、2.4 MgSO4、11.08 Glucose,1.6 CaCl2。
1.6 数据分析
2 结果
2.1 不同强度运动对大鼠血压的影响
训练前和8周正式训练末对各组大鼠进行无创血压测定,结果表明:训练末WKY-M和WKY-H与正常血压安静组相比,收缩压(SBP)均显著下降(P<0.05);然而,SHR-M SBP水平显著低于SHR-C(P<0.05),而SHR-H组不仅显著高于SHR-C,亦显著高于SHR-M(P<0.05)。正常血压运动组与正常血压安静组舒张压(DBP)无显著性差异(P<0.05),但SHR-M、SHR-H与SHR-C存在显著性差异(P<0.05),具体表现为SHR-M DBP显著低于SHR-C;SHR-H则显著高于SHR-M和SHR-C(P<0.05)。此外,训练末SHR-M和SHR-H SBP和DBP均与各自训练前结果存在显著性差异(P<0.05,表1)。

表 1 不同强度运动对大鼠血压的影响Table 1 The Effects of Exercise with Different Intensity on Rats’Blood Pressure (mmHg)
注:Initial指训练前,Final指8周正式训练末;SBP为收缩压;DBP为舒张压。*表示P<0.05,与WKY-C进行比较;#表示P<0.05,与SHR-C比较;+表示P<0.05,与SHR-M比较;$表示P<0.05,与Initial比较。
2.2 不同强度运动对氧化应激水平的影响
2.2.1 丙二醛(MDA)
SHR-C组(10.9±1.2 nmol/mL)血清MDA含量与WKY-C(8.5±0.6 nmol/mL)比较,均值有升高趋势,但是不具有统计学差异(P>0.05)。SHR-H(21.0±3.1 nmol/mL)MDA含量显著高于SHR-C组(P<0.05),亦显著高于SHR-M组(10.7±2.0 nmol/mL,P<0.05),而SHR-M组与SHR-C组比较并不存在显著性差异(P>0.05,图1A)。
2.2.2 谷胱甘肽过氧化物酶(GSH-Px)
GSH-Px是机体重要的过氧化物分解酶,它特异的催化还原性谷胱甘肽对过氧化氢产生还原反应。SHR-C组GSH-Px酶活力显著低于WKY-C(SHR-C:1 348.1±42.5 U;WKY-C:1 562.6±68.9 U,P<0.05)。不同强度的高血压运动组与高血压安静组相比均表现出抗氧化物酶GSH-Px显著增加(P<0.05),但SHR-M与SHR-H两组间不具有显著性差异(SHR-M:1 639.2±119.5 U:SHR-H:1 685.1±35.00 U,P>0.05,图1B)。

图 1 血清氧化应激指标柱状图Figure1. Indicators of OxidativeStress in Serum
注:MDA:丙二醛;GSH-Px:谷胱甘肽过氧化物酶;SOD:过氧化物歧化酶;Cu/Zn-SOD为SOD的分型。 *P<0.05,与WKY-C进行比较;#P<0.05,与SHR-C比较;+P<0.05,与SHR-M比较。
2.2.3 过氧化物歧化酶(SOD)
血清总SOD(T-SOD)测定显示,WKY-M组(232.9±3.6 U/mL)显著高于WKY-C组(217.7±0.6 U/mL,P<0.05),WKY-H与WKY-C、WKY-M相比均无统计学差异。此外,高血压不同强度运动组与高血压安静组均没有统计学差异(图1C)。
Cu/Zn-SOD是SOD的分型,与内皮依赖性超极化因子发生有关。8周运动后,正常血压运动组无论中强度还是高强度运动,Cu/Zn-SOD均显著高于WKY-C组(WKY-C:163.9±4.0 U/mL;WKY-M:226.5±6.3 U/mL;WKY-H:211.8±19.7 U/mL,P<0.05)。SHR-C组Cu/Zn-SOD(213.0±1.6 U/mL)显著高于WKY-C(P<0.05),SHR-M、SHR-H与SHR-C相比均无显著性差异,SHR-M与SHR-H之间亦不具有统计学差异(图1D)。
2.3 内皮细胞的超微结构
透射电镜实验结果显示,WKY组MA内皮细胞呈扁平状,表面可见微绒毛,内膜连续性完好、内弹力膜平直与内皮细胞伴行,平滑肌排列较整齐;SHR组肠系膜动脉内皮细胞失去正常形态,核大而畸形,内皮细胞呈指状突向内腔,表面微绒毛结构消失,细胞器脱落形成空泡,内弹性模不规则,大量胶原纤维增生至内膜层。中等强度运动逆转高血压内皮细胞形态,内皮细胞较完整;高血压高强度运动组内皮细胞核大,不规则,出现空泡状结构,大量胶原纤维增生(图2)。

图 2 大鼠肠系膜动脉内皮细胞超微结构图Figure2. Ultrastructure of Endothlial Cells of Mesenteric Artery of Rats 注:EC:内皮细胞; IEL:内弹性膜;COL:胶原纤维。
2.4 不同强度运动对肠系膜动脉内皮功能的影响
2.4.1 去甲肾上腺素(NE)诱发的血管收缩反应
为排除微血管个体差异,先以KCL(60 mmol/L)诱导三级肠系膜动脉离体微血管环收缩,以产生的最大收缩张力作为100%Kmax。反应达平台加入5 mL Na-Hepes进行3次洗脱,保持血管环张力值稳定1 mN约10 min。后续实验中,加入去甲肾上腺素(norepinephrine,NE,10-5mol/L)诱发MA收缩,均将其张力标准化为Kmax百分比(%KMAX),以%KMAX作为评价血管收缩反应性的指标。各组对KCL反应的血管张力分别是(mN):WKY-C(5.98±0.90);WKY-M(6.39±0.14);WKY-H(5.96±0.29);SHR-C(6.00±0.22);SHR-M(5.98±0.18);SHR-H(6.00±0.27),组间无显著性差异(P>0.05)。
NE(10-5M)诱发收缩在SHR-C组为190.6%Kmax±9.1%Kmax,与WKY-C(175.5%Kmax±8.3%Kmax)相比无显著差异(P>0.05)。进行运动干预后,给WKY施与不同强度运动与正常血压安静组(WKY-C)相比均具有显著性差异(P<0.05),WKY-H亦与WKY-M存在显著性差异(WKY-M:154.1%Kmax±2.3%Kmax;WKY-H:198.2%Kmax±9.1%Kmax,P<0.05)。然而,SHR-M(155.8%Kmax±5.1%Kmax)与SHR-C的血管收缩反应性相比显著降低 (P<0.05); SHR-H(200.2%Kmax±10.8%Kmax)血管收缩反应性与SHR-C没有显著性差异,但显著高于SHR-M(P<0.05,图3)。
2.4.2 不同强度运动对内皮舒张功能的影响
为评价血管内皮依赖性血管舒张水平,常用递增浓度的乙酰胆碱(ACh)进行实验[10]。为比较不同强度运动对内皮舒张功能的影响,本实验进行了如下步骤:1)加入KCL(60 mmol/L)待血管张力达到平台时,Na-Hepes 3次洗脱;2)加入NE(10-5mol/L),待血管张力达到平台时,在浴槽依次加入半对数递增浓度的ACh(10-9-10-5mol/L)。如图4所示,在10-5mol/L NE刺激下,浴槽中依次加入ACh诱发MA血管环舒张,MA舒张百分比随ACh浓度的升高呈浓度依赖性增加。
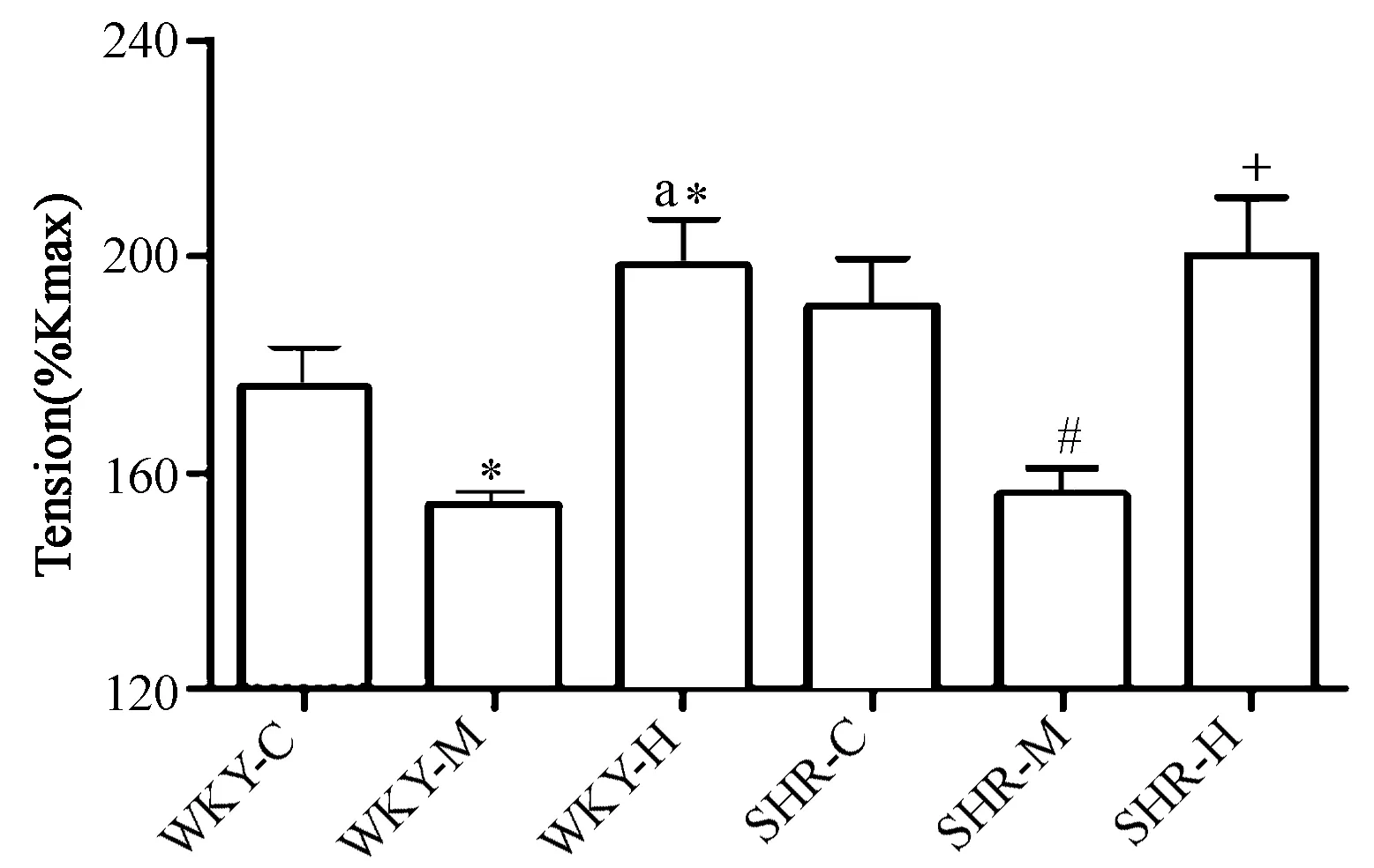
图 3 NE诱发大鼠肠系膜动脉收缩张力比较Figure 3. Comparison of the Tension Increase Induced by NE in Mesenteric Arteries of Rats
注:*P<0.05,与WKY-C比较;aP<0.05,与WKY-M比较;#P<0.05,与SHR-C比较;+P<0.05,与SHR-M比较。NE为去甲肾上腺素。
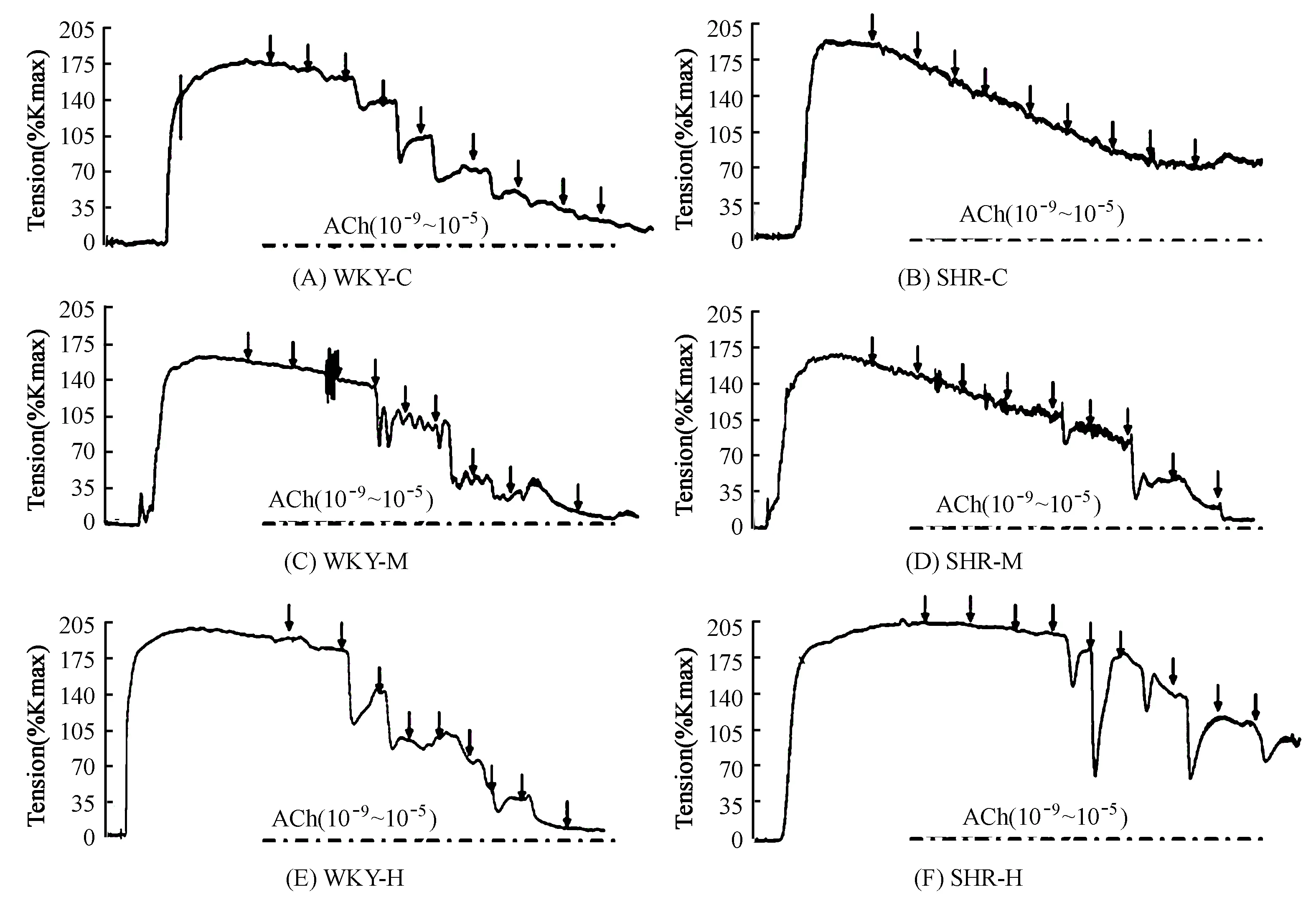
图 4 ACh诱发的内皮依赖性血管舒张反应曲线图Figure 4. ACh-induced Endothelium-dependent Vasodilation
注:图中箭头表示以半对数递增浓度方式依次加入乙酰胆碱(ACh:10-9mol/L,3×10-9mol/L,10-8mol/L,3×10-8mol/L,10-7mol/L,3×10-7mol/L,10-6mol/L,3×10-6mol/L,10-5mol/L)。
ACh(10-5mol/L)诱发的最大血管舒张在SHR-C组为87.2%NE±4.8%NE,显著小于WKY-C(97.9%NE±1.2%NE,P<0.05)。SHR-M(95.7%NE±1.2%NE)则显著改善SHR-C内皮依赖性血管舒张功能(P<0.05)。然而,SHR-H(66.0%NE±3.0%NE)显著低于SHR-C和SHR-M内皮依赖性血管舒张能力(P<0.05,图5A)。
利用GraphPad Prism 5.0剂量浓度——反应的非线性回归曲线计算得出EC50。pIC50 是EC50的负对数,pIC50值表示对药物的敏感性,值越高表示对药物的敏感性越高。各组由ACh诱发的内皮依赖性血管pIC50分别为:WKY-C(7.65±0.06);WKY-M(7.58±0.03);WKY-H(7.99±0.01);SHR-C(7.10±0.15);SHR-M(7.65±0.05);SHR-H(6.47±0.07)。WKY-H pIC50显著高于WKY-C和WKY-M(P<0.05)。SHR-C组pIC50显著低于WKY-C组(P<0.05)。SHR-M组显著高于SHR-C组pIC50(P<0.05),而SHR-H组则显著低于SHR-C(P<0.05)。不同运动强度间比较,WKY-H组 pIC50显著高于WKY-M(P<0.05),SHR-H组 pIC50显著低于SHR-M(P<0.05,图5B)。

图 5 ACh诱发内皮依赖性血管舒张的剂量-反应曲线Figure 5. Dose-Response Curve of ACh-induced Endothelium-dependent Vasodilation
注:图A为ACh诱发内皮依赖性血管舒张的剂量反应曲线,纵坐标将NE诱发MA收缩张力峰值作为100%。图B为ACh剂量反应的pIC50比较。pIC50,ACh诱导血管舒张达50%的药物浓度负对数,反映血管对药物的敏感性。*P<0.05,与WKY-C进行比较;#P<0.05,与SHR-C比较;aP<0.05,与WKY-M比较;+P<0.05,与SHR-M比较。
硝普钠(SNP)作用于平滑肌细胞使血管舒张,舒张百分比随SNP的升高浓度呈依赖性增加。本研究结果,6组均可以完全舒张,无统计学差异,排除了各组间由于平滑肌作用带来的舒张差异(图6)。
2.4.3 氧化应激对内皮依赖性血管舒张的作用
为检测氧化应激对各组血管舒张功能的贡献程度,我们进行了如下实验:1)加入KCL(60 mmol/L)待血管张力达到平台时,Na-Hepes3次洗脱;2)加入NE(10-5mol/L),待血管张力达到平台时,在浴槽依次加入半对数递增浓度的ACh;3)加入NAD(P)H氧化酶抑制剂Apocynin(3×10-4mol/L)孵育15 min,加入NE(10-5mol/L),待血管张力达到平台时,依次加入递增浓度ACh。观察ACh最大浓度下血管舒张百分比,比较加药前、后舒张百分比是否存在统计学差异。
Apocynin预孵育15 min后,在NE的刺激下,离体微血管环表现出的舒张程度随ACh浓度的升高呈依赖性的增加。每组对加入Apocynin前后,ACh诱发血管最大舒张百分比进行前后对照,只有SHR-H加抑制剂Apocynin前与加药后具有显著性差异(P<0.05,表2)。

图 6 SNP诱发非内皮依赖性血管舒张的剂量-反应曲线图Figure 6. Dose-Response Curve of SNP-induced Endothelium-independent Vasodilation
注:SNP诱发非内皮依赖性血管舒张的剂量反应曲线,纵坐标将NE诱发MA收缩张力峰值作为100%。
3 讨论
本研究以SHR和WKY为对象,观察了不同强度运动对其肠系膜动脉内皮结构及功能的影响,并探讨了氧化应激在其中的可能作用机制。
有研究对不同月龄SHR长期施加低强度游泳运动训练,结果显示:长期低强度游泳运动使青年鼠和成年鼠都会产生降低动脉血压的效果[34]。有学者提出,长期中等强度有氧运动可以使高血压患者SBP降低约6~10 mmHg,而DBP降低约4~8 mmHg[15]。然而,高强度对自发性高血压的降压效果如何并没有明确结论。本实验对高血压大鼠施加中等强度和高强度运动,与正常血压组进行对照,阐述运动强度与系统血压之间的量——效关系。本实验结果显示,高血压组中等强度运动训练后SBP和DBP显著低于高血压安静组血压水平,而高强度运动组显著高于高血压安静组所测血压值。因此,高血压组施加不同运动强度会产生相反的效果,即高血压大鼠进行长期中等强度运动可以有效降低SBP和DBP;高血压大鼠进行长期高强度运动明显提高高血压大鼠SBP和DBP。对比训练前和后的血压值,高血压安静组显示安静血压随增龄显著上升,这与前人研究结果一致[13]。有研究表明,中等强度运动对高血压大鼠内皮功能[19]和抗氧化功能[4]产生积极影响,有利于对血压的调控。高强度运动对高血压大鼠血压产生不利影响可能与内皮功能紊乱、血管张力调控功能下降有关,进而影响血压。有研究表明,高强度运动会导致高血压大鼠eNOS磷酸化水平降低,增加eNOS依赖活性氧的增加,影响内皮功能[6]。氧化应激可以诱导血管进行重构,改变正常的生理过程,产生内皮功能紊乱,影响血管收缩、舒张功能。所以,本文以氧化应激角度,研究不同强度运动对高血压内皮功能影响的分子机制。

表 2 Apocynin对ACh诱发内皮依赖性最大舒张的影响Table 2 Effect ofApocyninon the Maximum Percentage of Endothelium-dependent VasodilationInduced by ACh
注:由NE收缩离体微血管环达到张力峰值作为100%最大反应,ACh舒张离体微血管环,以最大Relaxation(%NE)表示内皮依赖性血管舒张水平。Control组是正常ACh诱发微动脉最大舒张,Apocynin组是在血管收缩前加入NAD(P)H氧化酶抑制剂,由ACh诱发微动脉最大舒张百分比。$ P<0.05,与各自空白对照组进行比较。
氧化应激是高血压等心血管疾病共同的病理生理过程,它在高血压防治中已被作为治疗靶点[18,29]。研究发现,对老年大鼠进行36周的运动训练并没有改变心脏脂质过氧化物的生物标记物,即反映机体MDA含量的TBARS水平并没有发生改变,是因为运动使大鼠体内发生适应性变化,诱导减少由于单个运动周期所产生的暂时性的氧化应激状态[33]。运动由于增加了10~20倍的氧消耗,使通过线粒体产生的ROS大量增加[30]。在运动中ROS的产生作为信号物质,可以使细胞在运动下适应地产生相关的抗氧化物酶的增加[17]。研究不同运动强度下氧化应激指标的变化,是诱导内皮功能改变、影响血压变化的重要机制之一。氧化应激水平由氧化产物与抗氧化物酶之间的平衡关系所评价,最常见的指标是MDA(氧化产物的代表),GSH-Px和SOD(抗氧化物酶的代表)[25]。本实验结果显示,SHR-C的MDA含量与WKY-C相比有增加趋势,但不具有显著性差异,这可能与样本量少有关。SHR-H的氧化应激产物MDA和抗氧化酶指标GSH-Px都表现出增加,但是,前者增加了约1倍,后者增加了约0.3倍,反映出氧化和抗氧化的平衡重心向氧化一边倾斜;SHR-M与SHR-C相比,SHR-M的MDA含量虽然不变,但是抗氧化物酶GSH-Px显著增加,表现抗氧化能力的增加。有研究表明,一次力竭运动后会使ROS产物增加,运动后抗氧化物酶含量增加是运动中产生氧化应激机制的反馈。本实验中,不同强度运动的高血压大鼠均表现出抗氧化物酶GSH-Px显著增加,这可能是对运动过程对产生的大量氧化产物所表现的适应性。GSH-Px酶活力在运动后产生的变化众说纷纭。有学者报道与本实验GSH-Px结果相似,运动会使GSH-Px活力上升[30,20-21]。然而,也有研究表明运动使高血压GSH-Px活力下降[22,31]。当然,还有部分研究支持在运动后GSH-Px活力并没有发生变化[8,12,16]。Kamal等对大鼠给予3种不同的运动方式,即耐力运动、阻力运动、耐力加阻力运动,分别对其氧化应激水平以及抗氧化物酶进行比较。研究结果显示,3组不同的运动方式均使氧化应激水平下降(MDA含量的下降和SOD酶活力的增加),但是,一些抗氧化物酶(CAT、GSH-Px)活力变化趋势是不同[24]。所以,抗氧化物酶活力变化趋势不同,可能与实验对象的选择、运动方式、运动强度和运动时间有关,这还需进一步的研究。
长时间的适宜强度运动可刺激氧化产物和抗氧化物酶的生成、减少许多慢性疾病的风险,但是,过多的ROS可以攻击细胞的成分,内皮亦是其攻击靶点,可以改变内皮细胞结构和功能[7]。有研究报道,SHR血管内皮细胞变形,细胞核增大,细胞膜向管腔呈指状突起[10],这与我们的结果一致。本研究还发现,中等强度运动有益于高血压大鼠内皮细胞的完整,而高强度运动则加重了内皮细胞的畸形和凋亡。内皮细胞超微结构伴随高血压疾病发生改变,结构的改变必然会影响其正常生理功能,影响内皮发挥血管舒张的能力。本研究中的内皮依赖性血管舒张功能实验,也为此提供了有利证据。
有研究表明,通过外源性抗氧化物治疗可以调节氧化应激水平,改善内皮功能紊乱。抗氧化物的治疗主要通过降低活性氧簇的生成、降低氧化应激水平、改善内皮功能,进而达到降压效果[14]。所以,内皮功能的正常发挥与氧化应激水平密切相关。有学者提出,适当的活性氧簇水平会产生正向作用,机体可以产生一些适应性变化,即机体本身的负反馈产生更多的抗氧化物酶;然而,在活性氧簇水平很高的情况下,对机体DNA、细胞、组织产生攻击,并且诱导血管进行重构,改变正常的生理过程,产生内皮功能紊乱、血管张力调控能力下降,影响血管收缩、舒张功能[1]。本实验中,观察了高应力状态下外周阻力血管——MA收缩反应性和舒张功能的变化,以及不同运动强度调控内皮功能的氧化应激机制。本研究结果表明,SHR-H血清MDA含量显著高于SHR-C组,高强度运动使高血压大鼠产生大量活性氧簇,发生大量的脂质过氧化物损伤,证实了高血压大鼠进行高强度运动内皮功能紊乱是由于过氧化物的产生,而抗氧化物酶不足以清除大量氧化代谢产物,氧化应激水平严重。从离体血管功能性检测中发现,通过向离体血管环浴槽中加入NAD(P)H抑制剂Apocynin,比较各组加药前后ACh诱发最大内皮依赖性血管舒张,评价各组氧化应激在调控内皮功能中的贡献程度。实验结果表明:加入Apocynin后,各组ACh诱发血管舒张均不存在显著性差异,说明各组ACh诱发最大内皮依赖性血管舒张存在的差异源自氧化应激的作用,这与Fernanada研究冠状动脉在NAD(P)H氧化酶抑制剂Apocynin作用下内皮依赖性最大舒张水平相似[32]。其中,SHR-H加入Apocynin前后对应的ACh诱发血管最大内皮依赖性舒张之间具有显著性差异,说明了高强度运动造成高血压组内皮功能紊乱主要与氧化产物大量蓄积有关,即SHR-H内皮功能下降主要是因为氧化应激水平的增加。相反,中等强度运动的高血压大鼠减少血清氧化应激水平,在内皮舒张功能性的检测中表现出SHR-M组改善了高血压诱导的内皮功能紊乱,加入抑制剂Apocynin前后对应的血管最大舒张百分比不具有统计学差异,说明中等强度运动通过降低氧化应激水平影响内皮舒张功能。
4 结论
不同运动强度调控高血压诱导的内皮功能紊乱,中等强度运动通过下调氧化应激水平达到增加内皮功能的效果,而高强度运动增加氧化应激水平,加剧了高血压大鼠血管内皮功能障碍。
[1]程训民,江时森,马瑞,等.糖尿病合并高血压大鼠心肌微血管内皮细胞超微结构的改变[J].上海医学,2007,30(11):163-167.
[2]中国高血压基层管理指南(2014年修订版)[J].中华高血压杂志,2015,23(1):24-43.
[3]AGARWAL D,WELSCH M A,FRANCIS J N,etal.Chronic exercise modulates RAS components and improves balance between pro- and anti-inflammatory cytokines in the brain of SHR[J].Basic Res Cardiol,2011,106(6):1069-1085.
[4]AGARWAL D,WELSCH M A,JNKAJ F.Chronic exercise modulates RAS components and improves balance between pro- and anti-inflammatory cytokines in the brain of SHR[J].Basic Res Cardiol,2011,106(6):1069-1085.
[5]AMES B N,SHIGENAGA M K.Oxidants are a major contributor to aging[J].Ann N Y Acad Sci,1992,(182):85-96.
[6]BATTAULT S,SINGH F,GAYRARD S,etal.Endothelial function does not improve with high-intensity continuous exercise training in shr:Implications of enos uncoupling[J].Hypertens Res,2016,39(2):70-78.
[7]BATTAULT S,SINGH F,GAYRARD S,etal.Endothelial function does not improve with high-intensity continuous exercise training in SHR:Implications of eNOS uncoupling[J].Hpertens Rse,2016,39(2):70-78.
[8]BEJMA J,RAMIRES P,JI L L.Free radical generation and oxidative stress with ageing and exercise:Differential effects in the myocardium and liver[J].Acta Physiol Scand,2000,169(4):343-351.
[9]CAI Z,YAN L J.Protein oxidative modifications:Beneficial roles in disease and health[J].J Biochem Pharmacol Res,2013,1(1):15-26.
[10]CECI R,BELTRAN VALLS M R,DURANTI G,etal.Oxidative stress responses to a graded maximal exercise test in older adults following explosive-type resistance training[J].Redox Biol,2014,43(2):65-72.
[11]COOKE J P.Does ADMA cause endothelial dysfunction[J].Arterioscler Thromb Vasc Biol,2000,20(9):2032-2037.
[12]DEMIREL H A,POWERS S K,CAILLAUD C,etal.Exercise training reduces myocardial lipid peroxidation following short-term ischemia-reperfusion[J].Med Sci Sports Exe,1998,30(8):1211-1216.
[13]DONATO A J,ESKURZA I,SILVER A E,etal.Direct evidence of endothelial oxidative stress with aging in humans[J].Circ Res,2007,100(12):1659-1666.
[14]ERBS S,GIELEN S,LINKE A,etal.Improvement of peripheral endothelial dysfunction by acute vitamin c application:Different effects in patients with coronary artery disease,ischemic,and dilated cardiomyopathy[J].Am Heart J,2003,146(2):280-285.
[15]FAGARD R H.Exercise characteristics and the blood pressure response to dynamic physical training[J].Med Sci Sports Exe,2001,33(6):1229-1232.
[16]FIEBIG R,GORE M T,CHANDWANEY R,etal.Alteration of myocardial antioxidant enzyme activity and glutathione content with aging and exercise training[J].Age,1996,19(3):83-89.
[17]GOMEZ-CABRERA M C,DOMENECH E,VIA J.Moderate exercise is an antioxidant:Upregulation of antioxidant genes by training[J].Free Radic Biol Med,2008,44(2):126-131.
[19]HALLIWELL B.The role of oxygen radicals in human disease,with particular reference to the vascular system[J].Haemostasis,1993,23(1):118-126.
[20]HUSAIN K,HAZELRIGG S R.Oxidative injury due to chronic nitric oxide synthase inhibition in rat:Effect of regular exercise on the heart[J].Biochim Biophys Acta,2002,1587(1):321-332.
[21]HUSAIN K,SOMANI S.Response of cardiac antioxidant system to alcohol and exercise training in the rat[J].Alcohol,1997,14(3):301-307.
[22]HONG H,JOHNSON P.Antioxidant enzyme activities and lipid peroxidation levels in exercised and hypertensive rat tissues[J].Int J Biochem Cell Biol,1995,27(9):923-931.
[23]NAKAZONO K,WATANABE N,MATSUNO K,etal.Does superoxide underlie the pathogenesis of hypertension[J].Proc Natl Acad Sci U S A.,1991,88(22):10045-10048.
[24]KAMALA,STEPHEN R,SIRVAN,etal.Antioxidant enzymes and oxidative stress adaptation to exercise training comparison of endurance,resistance,and concurrent training in untrained males[J].J Exe Sci,2014,12(1):1-6.
[25]RODRIGO R,LIBUY M,FELIU F.Oxidative stress-related biomarkers in essential hypertension and ischemia-reperfusion myocardial damage[J].Dis Marker,2013,35(6):773-790.
[26]ROGUE F R,BRIONES A M,GARCIA A B.Aerobic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension[J].Br J Pharmacol,2013,168(3):686-703.
[27]ROQUE F R,BRIONES1 A M,GARCA-REDONDO1 A B,etal.Aerobic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension[J].Br J Pharmacol,2013,168(3):686-703.
[28]ROQUE F R,HERNANZ R,SALAICES M,etal.Exercise training and cardiometabolic diseases:Focus on the vascular system[J].Curr Hypertens Rep,2013,15(3):204-214.
[29]SINHA N,DABLA P K.Oxidative stress and antioxidants in hypertension-a current review[J].Curr Hypertens Rev,2015,11(2):132-142.
[30]SOMANI S M,FRANK S,RYBAK L P.Responses of antioxidant system to acute and trained exercise in rat heart subcellular fractions[J].Pharmacol Biochem Behav,1995,51(4):627-634.
[31]WILSON D O,JOHNSON P.Exercise modulates antioxidant enzyme gene expression in rat myocardium and liver[J].J Appl Physiol,2000,88(5):1791-1796.
[32]YAN L J.Positive oxidative stress in aging and aging-related disease tolerance[J].Redox Biol,2014,2(2):165-169.
[33]YU T T,GUO K,CHEN H C,etal.Effects of traditional chinese medicine xin-ji-er-kang formula on 2k1c hypertensive rats:Role of oxidative stress and endothelial dysfunction[J].BMC Complement Altern Med,2013,13(13):173-180.
[34]ZAMO F S,BARAUNA V G,CHIAVEGATTO S,etal.The renin-angiotensin system is modulated by swimming training depending on the age of spontaneously hypertension rats[J].Life Sci,2011,89(17):93-99.
Oxidative Stress Mechanisms of Treadmill with Different Intensity on Endothelial Function and Ultrastructure in Spontaneously Hypertensive Rats
YE Fang,BAI Ping,ZENG Fan-xing,SHI Li-jun
Objective:To investigate the effects of treadmill exercise with different intensity on spontaneously hypertensive rats’endothelial function and ultrastructure.Methods:Three-month-old male SHR and WKY were randomly assigned to six groups:sedentary control group (SHR-C,WKY-C),moderate-intensity exercise group (SHR-M,WKY-M),and high-intensity exercise group (SHR-H,SHR-H).The animals in the exercise-trained groups ran on a motor treadmill (0° slope) at 18~20 m/min (~55~65% of the maximal aerobic velocity) and 26~28m/min (~75~85% of the maximal aerobic velocity),respectively.Each exercise-trained group ran 60 min per day,5 days per week for 8 weeks.Blood pressure examined by non-invasive methods,endothelial ultrastructure observed by transmission electron microscope,tension test to isolated vessel ring measured by DMT,protein determined by western blotting and detection for enzyme activity.Result:1)Systolic pressureand diastolic pressure in SHR-M were much lower than in SHR-C,and SHR-H significantly different from SHR-C(P<0.05).2)Oxidative product MDA demonstrated that compared to MDA in WKY-C,SHR-C had the trend to rise,but no significant difference.SHR-H were significantly higher than SHR-M (P<0.05).Antioxidant enzymes including GSH-Px,SOD demonstrated that GSH-Px in SHR-C were lower in comparison with WKY-C,GSH-Px in SHR-H and SHR-M were significantly higher compared to SHR-C (P<0.05);SOD in WKY-M were significantly higher than in WKY-C (P<0.05),SOD in SHR exercise-trained groups had no significant difference compared to SHR-C(P<0.05).3)Transmission electron microscope in SHR-C and SHR-H showed that endothelial cells’ malformation,collagen proliferation.However,SHR-M showed the intact of endothelial cells.4)Endothelial-dependent vasodilator function in SHR-C was strikingly lower in comparison with WKY-C,SHR-M ameliorated endothelium-dependent dilation dysfunction induced by hypertension;However,endothelial-dependent dilation was apparently decreased in SHR-H compared to SHR-C (P<0.05).Conclusion:Moderate-intensity exercise can reduce the SHR blood pressure,ameliorate endothelial function and ultrastructure.Whereas high-intensity exercise has an opposite effect that the increase of oxidative stress and the disorder of endothelium dependent dilation.
exerciseintensity;hypertension;endothelium;oxidativestress
1000-677X(2016)12-0058-09
10.16469/j.css.201612008
2016-09-20;
2016-12-05
中央高校基本科研业务费专项基金资助(2015ZD008);国家体育总局科研课题(2015B035)。
叶芳(1991-),女,安徽人,在读博士研究生,主要研究方向为运动和心血管生理学,E-mail:15600612858@163.com。
北京体育大学 运动与体质健康教育部重点实验室,北京 100084 Beijing Sport University,Beijing 100084,China.
G804.7
A
