抑芽剂仲丁灵在烟叶中的降解机理研究
2017-01-05喻会平曾维娅李荣玉龙友华尹显慧吴小毛
喻会平,曾维娅,李荣玉,龙友华,尹显慧,吴小毛
(1.贵州省烟草公司毕节市公司,贵州毕节551700;2.贵州大学农学院,贵州贵阳550025)
抑芽剂仲丁灵在烟叶中的降解机理研究
喻会平1,曾维娅2,李荣玉2,龙友华2,尹显慧2,吴小毛2
(1.贵州省烟草公司毕节市公司,贵州毕节551700;2.贵州大学农学院,贵州贵阳550025)
为了探明抑芽剂仲丁灵在烟草生产中的残留污染风险,在田间试验条件下,采用气相色谱-质谱法研究了仲丁灵在烟叶中的降解动态及机理。结果表明,仲丁灵在烟叶中的降解动态符合一级动力学方程,降解半衰期为5.8 d;仲丁灵在烟叶中的主要降解途径是取代胺基断裂、环化,转化成更为稳定的4-叔丁基-2,6-二硝基苯胺、N-乙基-4-叔丁基-2,6-二硝基苯胺和1-异丁基-5-叔丁基-7-硝基-苯并咪唑。
仲丁灵;烟叶;残留;降解;机理
农药是现代农业重要的组成部分,节约能源、精耕细作和获得最适产量的烟叶与农药使用密切相关。仲丁灵(Butralin)化学名称为N-仲丁基-4-特丁基-2,6-二硝基苯胺,属二硝基苯胺类除草剂,适用于防除水稻、玉米、马铃薯、花生和蔬菜等作物田中稗草、马唐、狗尾草、牛筋草等禾本科及阔叶类等杂草[1-6],而且可作为抑芽剂在烟草上使用,以提高烟草产量及质量[7-8]。目前,关于仲丁灵的残留分析方法及其在土壤中的降解已有报道[9-10],但尚未见有关仲丁灵在烟叶中的降解与转化的研究。
本研究采用GC-MS联用法,对仲丁灵在烤烟上的降解动态和转化途径进行了研究,旨在为烤烟生产中仲丁灵的安全使用提供参考。
1 材料和方法
1.1 药剂及试剂
仲丁灵标样(99.5%,国家农药质量监督检验中心),36%仲丁灵乳油(山东华阳和乐农药有限公司);二氯甲烷、丙酮、氟罗里硅土、活性炭、无水硫酸钠等试剂均为分析纯,有机溶剂使用前经全玻璃重蒸系统重蒸。
1.2 主要仪器设备
GC-MS联用仪(Agilent 7890A-5975C),气相色谱(带μECD,Agilent 6890 N),HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm),电子分析天平(0.01 g),恒温振荡器(常州澳华仪器有限公司),超声波清洗机(天津恒奥科技发展有限公司),旋转浓缩蒸发仪(上海亚荣生化仪器厂),玻璃层析柱(30 cm× 1.5 cm),微孔滤膜等。
1.3 田间降解试验
按《农药登记残留田间试验标准操作规程》[11],在贵阳市烟草(云烟85)田进行降解动态试验,包括降解动态试验和降解途径试验。小区面积30 m2,每处理重复3次,在烟草团棵期按每公顷对水750 L采用喷雾法进行施药,施药剂量:36%仲丁灵乳油推荐使用高剂量的2倍量(40倍液)。施药后于0,1,3,5,10,15,30 d随机采集烟叶样品,每小区采样量1 kg,样品带回实验室于-20℃冰箱中贮存,待测。
1.4 样品残留分析方法
1.4.1 提取称取10.0 g鲜烟叶,剪碎,置于250 mL具塞锥形三角瓶中,加入40 mL丙酮,振荡萃取2 h,过滤。滤液转入到含有20 mL饱和NaCl溶液的分液漏斗(250 mL)中,然后再用30 mL二氯甲烷激烈萃取3次,静置分层,有机相浓缩至1 mL,待净化。
1.4.2 样品净化在层析柱两端装入高度2 cm的无水硫酸钠,中间装入4.0 g氟罗里硅土和0.2 g活性炭。层析柱用10 mL二氯甲烷淋洗,加入浓缩样品,待液面降至1 cm左右时,弃去流出液,用20 mL二氯甲烷和丙酮(1∶9,V/V)的洗脱液淋洗层析柱,收集淋洗液浓缩近干,用甲醇定容至5 mL,待分析。
1.4.3 色谱条件进样口温度240℃;检测器温度270℃;柱初180℃(保持1 min),以10℃/min升至240℃(保留25 min)。高纯氮气(99.999%)用作载气,流速1.2 mL/min(恒流);分流比为4∶1;进样量1 μL;保留时间约为6.3 min。
1.4.4 质谱条件柱温为50℃(保留2 min),以6℃/min升温至320℃(保持2 min);汽化室温度为250℃;载气为高纯He(99.999%),流量1.0 mL/min;柱前压7.62 psi;进样量1 μL;溶剂延迟时间5 min。EI离子源,温度230℃;四极杆温度150℃;电子能量70 eV;发射电流34.6 μA;倍增器电压1 124 V;接口温度280℃;质量范围20~550 amu。
1.5 数据分析
采用一级动力学方程式Ct=C0e-kt来拟合仲丁灵在烟叶中的降解动态。式中,t为采样时间(d);Ct为t时间的浓度(mg/kg);C0为起始浓度(mg/kg);k为降解常数;半衰期t1/2=ln2/k,ln2=0.693。
2 结果与分析
2.1 方法的有效性
在1.4.3气相色谱条件下,仲丁灵在烟叶中能得到较好分离,无杂质干扰。采用外标法峰面积定量,仲丁灵在烟叶中的最低检出限为0.003 mg/kg。从表1可以看出,仲丁灵在烟叶中的添加回收率为85.25%~98.62%,相对标准偏差为3.46%~5.69%,符合农药残留分析的要求[12]。目前,烟叶及烟叶制品中仲丁灵的残留分析方法标准为GB/T 13595—2004(烟草及烟草制品拟除虫菊酯杀虫剂、有机磷杀虫剂、含氮农药残留量的测定)[12],该标准分析程序为混合有机溶剂萃取、凝胶渗透色谱净化、GC检测,尽管能同时分析23种农药的残留量,但有机试剂消耗量大,过程繁琐,分析一个样品所需时间较长,成本较高,不适宜仲丁灵单残留的快速检测。本试验结合烟草的特点及仲丁灵本身的性质,建立了GC分析方法,简便快速,灵敏度高,适用于烟叶中仲丁灵残留量的快速测定。
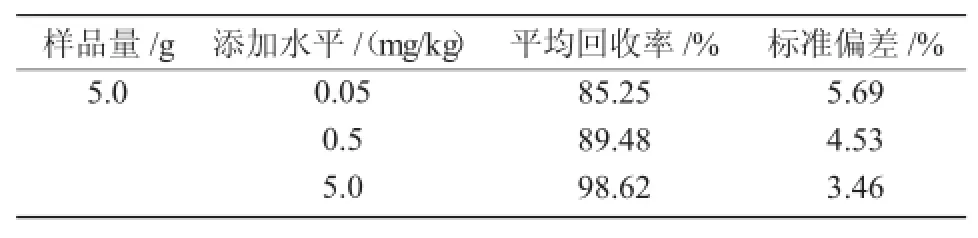
表1 烟叶中仲丁灵的加标回收率与精密度
2.2 仲丁灵在烟叶中的降解动态
仲丁灵在烟叶中的降解动态如图1所示。仲丁灵在烟叶中的原始沉积量为120.23 mg/kg,施药1~3 d降解较快,随着时间的延长而逐渐下降。仲丁灵在1 d内的降解率为68.78%,3 d后为83.10%,30 d后为98.91%。回归分析表明,仲丁灵在烟叶中的降解动态符合一级动力学方程Ct=42.230e-0.1200t(R=0.862)。根据降解速率常数,计算仲丁灵的降解半衰期为5.8 d。

在烟田中施用仲丁灵后,仲丁灵在烟株表面或因其亲脂性而渗入叶和茎,烟叶是吸收仲丁灵的主要途径。一般来说,不同生态环境是造成农药在植物中降解速率差异的主要原因。除了光照、温度、降雨等环境因素外,农药在烟株上的降解还受到农药化学性质的稳定性、烟株生长过程的稀释作用以及在烟株体内代谢作用的影响[13-15]。因此,在本试验中,仲丁灵在烟叶中的降解应该为各种因素综合影响的结果。
2.3 仲丁灵在烟叶中的降解途径
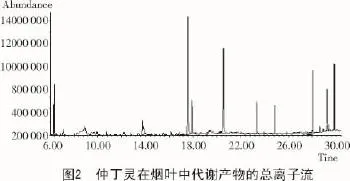
采用GC-MS测定了仲丁灵在烟叶中的代谢产物。由仲丁灵在烟叶中的代谢产物总离子流(图2)可知,仲丁灵在烟叶中的代谢产物可能有3种:A,B,C,保留时间分别为13.75,29.17,29.83 min,质荷比(m/z)值分别为240,273,265,它们的质谱图和推测的分子结构如图3所示。其他峰的质荷比(m/z)值有的大于仲丁灵的相对质量295,有的则不合理。空白对照样品的结果显示,除了上述3个代谢产物外,其余的物质均为烟叶本身的物质,不可能是仲丁灵在烟叶中的代谢产物。
根据仲丁灵代谢产物的分子结构及其母体的分子特征,解析并对比仲丁灵母体及其3种代谢产物的化学结构,可初步判断,仲丁灵在烟叶中的主要代谢途径是取代胺基断裂、环化,转化成更为稳定的4-叔丁基-2,6-二硝基苯胺、N-乙基-4-叔丁基-2,6-二硝基苯胺和1-异丁基-5-叔丁基-7-硝基-苯并咪唑。

3 结论
近年来,仲丁灵作为旱地作物选择性芽前除草剂和烟草抑芽剂,得到了大范围的应用。本研究结合烟草的特点及仲丁灵的特性,建立了烟叶中仲丁灵残留的气相色谱分析方法,该法简便快速,适用于烟叶中仲丁灵残留量的测定。仲丁灵在烟叶上的降解与其理化特性、环境因子以及烟叶的吸收、代谢有关。仲丁灵在烟叶中的降解动态符合一级动力学方程,降解半衰期为5.8 d。仲丁灵在烟叶中的主要降解途径是取代胺基断裂、环化,转化成更为稳定的4-叔丁基-2,6-二硝基苯胺、N-乙基-4-叔丁基-2,6-二硝基苯胺和1-异丁基-5-叔丁基-7-硝基-苯并咪唑。
[1]许军,杨明进,王金宁.48%仲丁灵(EC)防除麦套玉米、水稻田间杂草试验[J].宁夏农林科技,2003(7):27-29.
[2]王永存,张贵林.地乐胺防除马铃薯、菠菜田杂草试验[J].农药,1999,38(8):32-33.
[3]刘立峰,刘富华,李怀生,等.地膜马铃薯防虫除草综合栽培技术[J].宁夏农林科技,2004(5):60,63.
[4]胡健,尤庆伟,仇广灿,等.仲丁灵防除花生田杂草试验[J].现代农药,2004,3(5):3-5.
[5]刘贺昌,王翠欣.地乐胺防除密植型蔬菜田杂草的试验[J].河北农业技术师范学院学报,1995,9(3):42-45.
[6]熊桂花,温春晖,魏小渊,等.36%仲丁灵EC抑制烟草腋芽生长田间药效试验[J].江西植保,2004,27(1):26-27.
[7]马京民.烟草抑芽剂的分类及施用技术[J].中国植保导刊,2006,26(9):34-35.
[8]卓静萍.几种烟草抑芽剂筛选试验[J].湖北植保,2005(2):33-35.
[9]吴小毛,龙友华,李明.仲丁灵在土壤及水中的残留分析方法[J].贵州农业科学,2009,37(11):214-215,230.
[10]徐月明,张纪利,郭明程,等.仲丁灵在土壤中的消解动态研究[J].现代农药,2012,11(3):33-36.
[11]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007.
[12]农业部农药检定所,山西省农药重点实验室.NY/T 788—2004农药残留实验准则[S].北京:中国标准出版社,2004.
[13]Karmakar R,Kulshrestha G.Persistence,metabolism and safety evaluation of thiamethoxam in tomato crop[J].Pest Management Science,2009,65:931-937.
[14]Wang X,Xiang Z,Yan X,et al.Dissipation rate and residual fate of thiamethoxam in tobacco leaves and soil exposed to field treatments [J].Bulletin of Environmental Contamination and Toxicology,2013,91:246-250.
[15]Wu X M,Long Y H,Li J H,et al.Degradation of metolachlor in tobacco field soil[J].Soil and Sediment Contamination,2015,24(4):398-410.
Degradation Mechanism of Bud Inhibitor Butralin in Tobacco Leaf
YU Hui-ping1,ZENG Wei-ya2,LI Rong-yu2,LONG You-hua2,YIN Xian-hui2,WU Xiao-mao2
(1.Bijie Tobacco Company of Guizhou Province,Bijie 551700,China;2.College of Agronomy,Guizhou University,Guiyan 550025,China)
To explore residual contamination risk of bud inhibitor butralin in the tobacco production,degradation dynamics and mechanism of Butralin in tobacco leaf were investigated under field condition using gas chromatography-mass spectrometry(GC-MS). The results showed that degradation of Butralin in tobacco leaf fitted to the first-order kinetics,and the degradation half-life of Butralin in tobacco leaf was 5.8 d.Under field condition,the main degradation pathways of Butralin in tobacco leaf were substituted radical group fracture and cyclization.Butralin in tobacco leaf was transformed into more stable4-tert-butyl-2,6-dinitroaniline, N-ethyl-4-tert-butyl-2,6-dinitroaniline,and 1-isobutyl-5-tert-butyl-7-nitro-benzimidazole.
Butralin;tobacco leaf;residue;degradation;mechanism
S482.4
A
1002-2481(2016)01-0067-03
10.3969/j.issn.1002-2481.2016.01.19
2015-09-15
中国烟草总公司贵州省公司科技专项(201311,201414);贵州省烟草公司毕节市公司项目(BJYC-201304)
喻会平(1965-),男,贵州毕节人,农艺师,硕士,主要从事植物保护研究工作。吴小毛为通信作者。
