硼酸钠活化p53诱导人肝癌细胞HepG2凋亡
2017-01-05张有顺袁方均陈琴华周文波
魏 英,张有顺,武 伦,袁方均,陈琴华,周文波*
硼酸钠活化p53诱导人肝癌细胞HepG2凋亡
魏 英a,张有顺b,武 伦b,袁方均b,陈琴华a,周文波b*
目的 观察硼酸钠(Borax)对人肝癌细胞株HepG2的生长抑制和诱导凋亡的作用,并初步探讨其作用机制。方法 采用MTT法检测不同浓度硼酸钠对HepG2活力的影响,DAPI染色荧光显微镜及Annexin V-FITC/PI双染色流式细胞术检测硼酸钠诱导细胞凋亡的情况。实时荧光定量PCR(qRT-PCR)检测硼酸钠对肿瘤抑制因子p53及其下游基因Bcl-2、Bax、Noxa、Puma mRNA表达的影响。结果 与对照组比较,硼酸钠各剂量组均能抑制HepG2的活力(P<0.01);硼酸钠诱导HepG2细胞凋亡,不同浓度硼酸钠(0、1.0、2.0、4.0 mmol/L)处理24 h后,晚期凋亡细胞百分比从2.57%分别增加至8.13%、10.4%、15.24%,差异有统计学意义(P<0.01);硼酸钠(4.0 mmol/L)分别作用6、12、24 h后,均可不同程度上调肿瘤抑制因子p53及促凋亡基因Bax、Noxa、Puma mRNA表达,抑制抗凋亡基因Bcl-2 mRNA的表达,差异有统计学意义(P<0.01)。结论 硼酸钠抑制人肝癌细胞HepG2的生长活性并诱导凋亡,其机制与p53的活化及其下游Bax、Noxa、Puma基因表达上调,以及Bcl-2表达下调有关。
硼酸钠;人肝癌细胞株HepG2;凋亡;p53;Bcl-2
0 引言
肝细胞癌是全球常见的癌症之一,每年有超过50万人被确诊为肝细胞癌;其进展快、死亡率高,仅2012年全球新增肝细胞癌病例782 500例,死亡745 500例,发病率和死亡率几乎相等[1]。手术是肝细胞癌的首选治疗方法,但大部分患者确诊时已是肝癌晚期。晚期肝癌患者适合全身性治疗,而化疗是肝细胞癌全身治疗的首选[2]。尽管肝细胞癌化疗已取得巨大的进展,其仍具有明显的不良反应,许多化疗药物在杀伤肿瘤细胞的同时也杀伤正常细胞,导致显著细胞毒性,患者5年生存率较低[3-4],因此,开发更多的可选择性的有效抗肝细胞癌新型药物势在必行。
研究表明,硼对许多物种有益,在自然界中多以硼酸钠(Borax)的形式存在[5],生理浓度下硼无致突变致癌效应,口服吸收较好。世界卫生组织认为,硼是人体的一种必需营养元素,对动物细胞的复制与发展起着重要作用。近年来,硼在肿瘤预防及治疗方面越来越受重视,硼中子俘获治疗具有选择性杀伤正常组织内癌细胞的能力,已广泛应用于多种肿瘤,并进行了治疗肝脏恶性肿瘤的尝试[6]。文献报道,硼通过抑制氧化应激反应,改善急性肝功能衰竭的肝脏病理学变化[7];通过抑制增殖细胞核抗原的表达,降低硫代乙酰胺诱导的大鼠肝细胞癌的发生率[8],因此,硼对肝细胞癌的发生具有潜在的预防作用。目前有关硼抑制肝细胞癌的研究尚少,其涉及的机制较模糊,因此,深入探讨硼对肝细胞癌作用及其机制的研究对发现新型的抗肝癌药物意义重大。本实验观察了硼酸钠对人肝癌细胞HepG2生长活性及诱导凋亡的影响,并初步探讨了其诱导凋亡的机制。
1 材料与方法
1.1 材料
1.1.1 细胞株及试剂 人肝癌细胞株HepG2(武汉大学典型培养物保藏中心);硼酸钠(Sigma-Aldrich,221732);RPMI-1640培养液(美国Gibco公司);TRIzol Reagent(美国Incitrogen公司);逆转录试剂(美国Fermentas公司);MTT(Amresco);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(武汉安特捷生物技术有限公司);PCR引物(上海生工生物有限公司设计并合成)。
1.1.2 主要实验仪器 全波长酶标仪(美国Biotek公司);CO2培养箱(法国Thermo公司);Olympus IX71荧光显微镜(日本Olympus公司);荧光定量PCR仪Rotor Gene-6000(澳大利亚Rotor Gene公司);BD FACS Caliber流式细胞仪(美国BD公司)。
1.2 方法
1.2.1 HepG2细胞的培养 用含10%胎牛血清的RPMI-l640培养液,在37 ℃、5% CO2条件下常规培养人肝癌细胞HepG2,当细胞覆盖80%~90%瓶底后,用0.25%的胰酶-EDTA常规消化传代,进行各项实验。
1.2.2 MTT比色法检测硼酸钠对HepG2细胞活力的影响 5×105个/mL的HepG2细胞悬液接种于96孔板,每孔100 μL,周边孔用无菌PBS填充,37 ℃、5% CO2孵育12 h。分别用浓度为0、0.5、1.0、2.0、4.0、8.0、16.0 mmol/L的硼酸钠孵育,各组设置6个复孔。0、6、12、24、48、72 h后用PBS液洗涤换液,每孔加浓度为5 mg/mL的四甲基偶氮唑盐(MTT)溶液20 μL,继续培养4 h,每孔加150 μL二甲基亚砜,低速振荡10 min,使结晶物充分溶解。用酶标仪测490 nm吸光值(A490),以0 mmol/L硼酸钠处理组作为对照组,同时设置调零孔(培养基、MTT、二甲基亚砜)。分析细胞存活率(Survival rate,SR),A490可代表细胞的存活数。SR计算公式为:SR=A490各组测定值/A490对照组×100%。
1.2.3 DAPI染色荧光显微镜观察硼酸钠诱导HepG2细胞凋亡的情况 每孔1×104个细胞接种于6孔板,12 h后用浓度为0、1.0、2.0、4.0 mmol的硼酸钠作用24 h,PBS洗2次;4%多聚甲醛室温固定15 min,PBS洗3次,5 min/次;DAPI染色15 min,PBS洗2次,荧光显微镜观察照相。
1.2.4 Annexin V-FITC/PI双染色流式细胞仪检测细胞凋亡情况 将HepG2细胞悬液接种于直径6 cm的培养皿,12 h后用浓度为0、1.0、2.0、4.0 mmol的硼酸钠孵育24 h,各组设置3个复孔,收集1×106个细胞,按照Annexin V-FITC/PI双染色细胞凋亡检测试剂盒说明书染色,流式细胞仪检测细胞凋亡情况。
1.2.5 qRT-PCR法检测凋亡相关基因mRNA的表达 将1×105个/mL的HepG2细胞悬液接种于6孔板,每孔1 mL,0、4.0 mmol/L的硼酸钠孵育6、12、24 h,各组设置3个复孔,应用TRIzol Reagent总RNA抽提纯化试剂盒抽提细胞总RNA,紫外分光光度计测定A260与A280比值在1.8~2.0范围。应用逆转录试剂盒将总RNA逆转录成cDNA。在稀释至7 ng/μL的cDNA中加入SYBR®GREEN PCR Master Mix和相应基因扩增引物(序列见表1),进行定量PCR检测,反应条件:95 ℃,5 min;60 ℃,20 s;72 ℃,1 min,40个循环。以目的基因域循环数(Threshold cycle,Ct)值对同一样本的内参照基因GAPDH Ct值进行目的基因表达的相对定量分析。
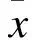
2 结果
2.1 MTT法检测硼酸钠对HepG2细胞生长活性的影响 与对照组相比,随着硼酸钠作用时间的延长和浓度的增加,存活细胞数逐渐减少(P<0.05)。见图1A、图1B)。
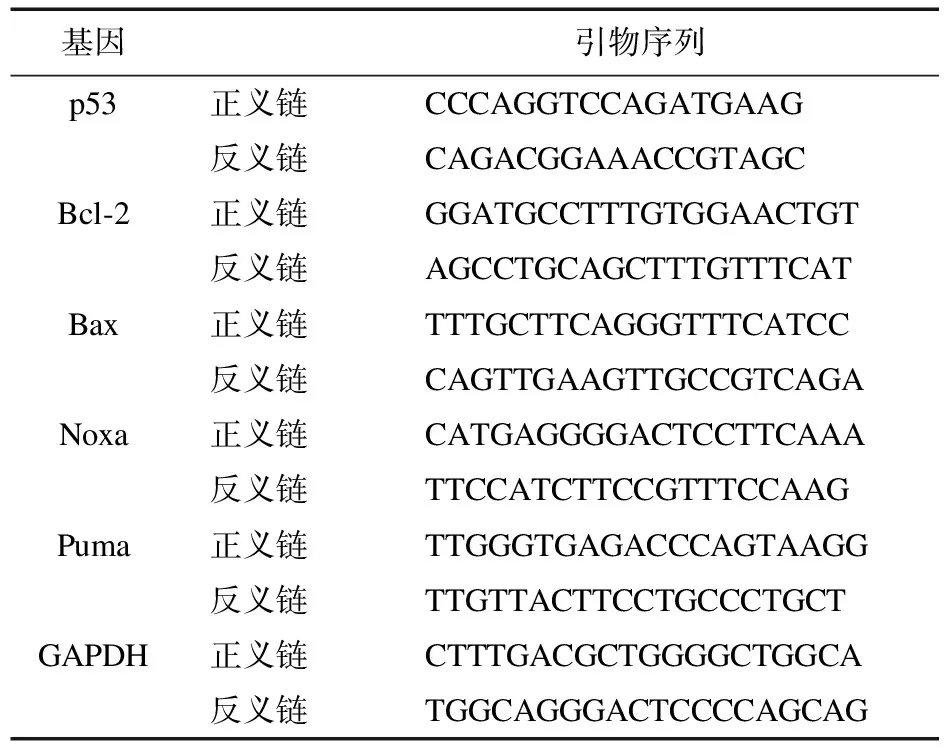
表1 p53、Bcl-2、Bax、Noxa、Puma和GAPDH基因的正义、反义链引物序列
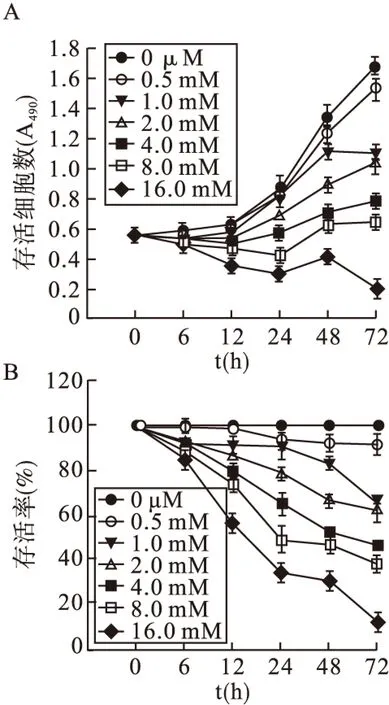
图1 硼酸钠对HepG2细胞生长活性的影响
2.2 硼酸钠对HepG2细胞凋亡的影响 硼酸钠作用HepG2细胞24 h后,DAPI染色荧光显微镜观察细胞核形态学的变化。对照组细胞核大小一致,形态完整,染色质分布均匀,呈淡蓝色均染;硼酸钠作用24 h后,细胞核大小不一,形态各异,染色质浓缩,边缘化,核膜破裂,染色质破裂成块状,形成凋亡小体等典型凋亡状态(图2A)。Annexin V-FITC/PI染色,流式细胞术检测细胞凋亡情况,左下象限(LL)显示活细胞,右下象限(LR)显示早期凋亡细胞,右上象限(UR)显示晚期凋亡细胞,左上象限(UL)显示死细胞。与对照组相比,不同浓度硼酸钠作用HepG2细胞24 h后,晚期凋亡细胞的百分比逐渐增加(从2.57%增加至8.13%、10.4%、15.24%,P<0.05)。见图2B、图3。
2.3 硼酸钠对HepG2细胞凋亡相关基因表达的影响 qRT-PCR结果显示,与对照组相比,硼酸钠作用6、12、24 h后,肿瘤抑制因子p53和促凋亡基因Bax、Noxa、Puma mRNA表达均上调(P<0.01);抗凋亡基因Bcl-2 mRNA的表达降低(P<0.01)。见图4。
3 讨论
尽管抗癌化疗有新的进展,但确切有效的化疗药物很少,因此,开发低毒有效的化疗药物是目前研究的重点。硼是维持动植物甚至是人类正常生长,完成生命周期的一种重要的营养元素,健康成年男性血中硼的浓度为4.7~350 μmol/L[9]。此外,研究者还注意到,在药物合成过程中,硼可以和其他原子(如:铁)一样提供分子修饰作用,以维持药物空间构象或药效的稳定性。近年来,基于硼的药物开发备受关注[10]。研究表明,硼能够抑制肿瘤的生长,含硼化合物对肿瘤细胞的影响包括多种酶促过程和抑制细胞分裂诱导细胞凋亡[11],而含硼化合物对肝癌细胞的影响及其机制尚不清楚。本研究表明,硼酸钠对HepG2细胞体外活性具有抑制作用,并诱导其凋亡,表明硼酸钠可作为肝细胞癌治疗的候选药物。
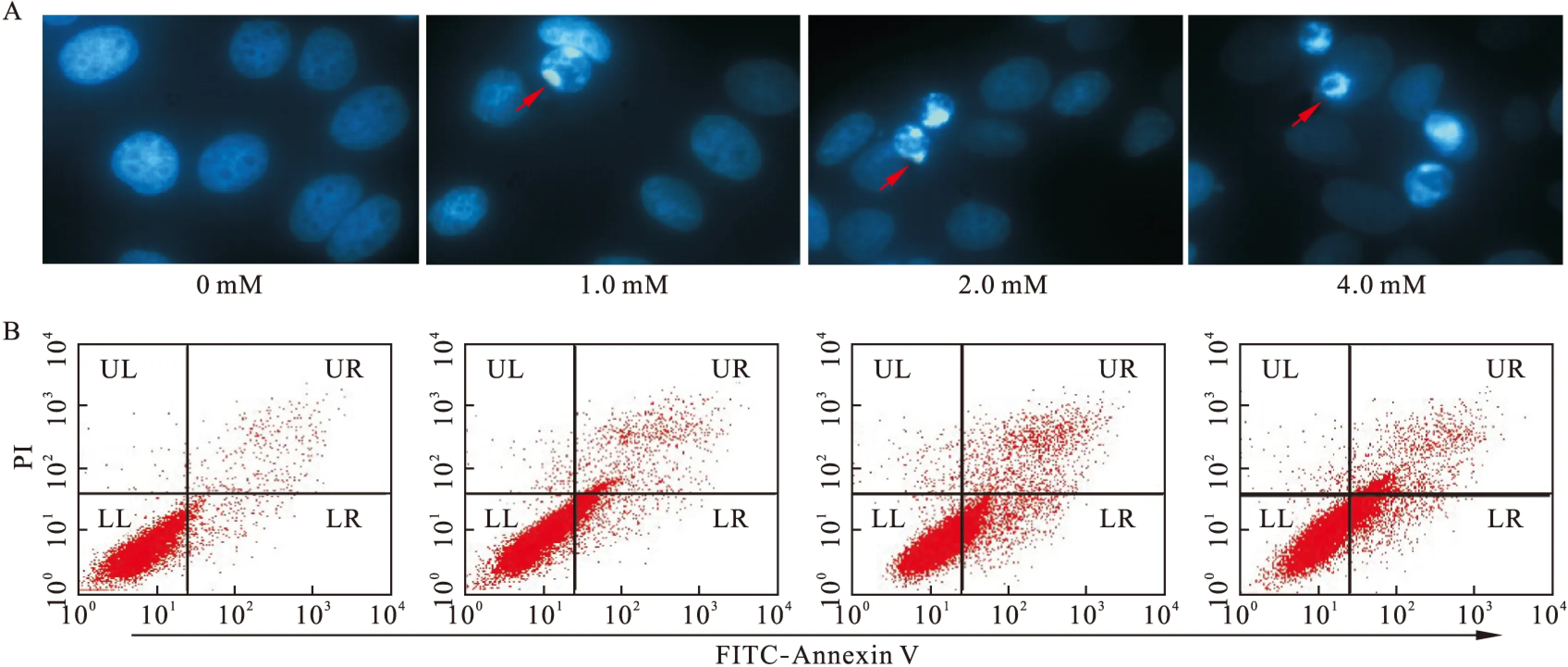
图2 硼酸钠诱导HepG2细胞凋亡
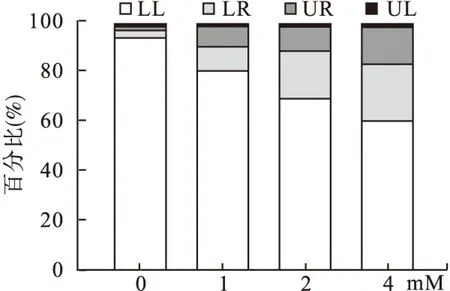
图3 Annexin V-FITC/PI染色流式细胞术检测细胞凋亡情况
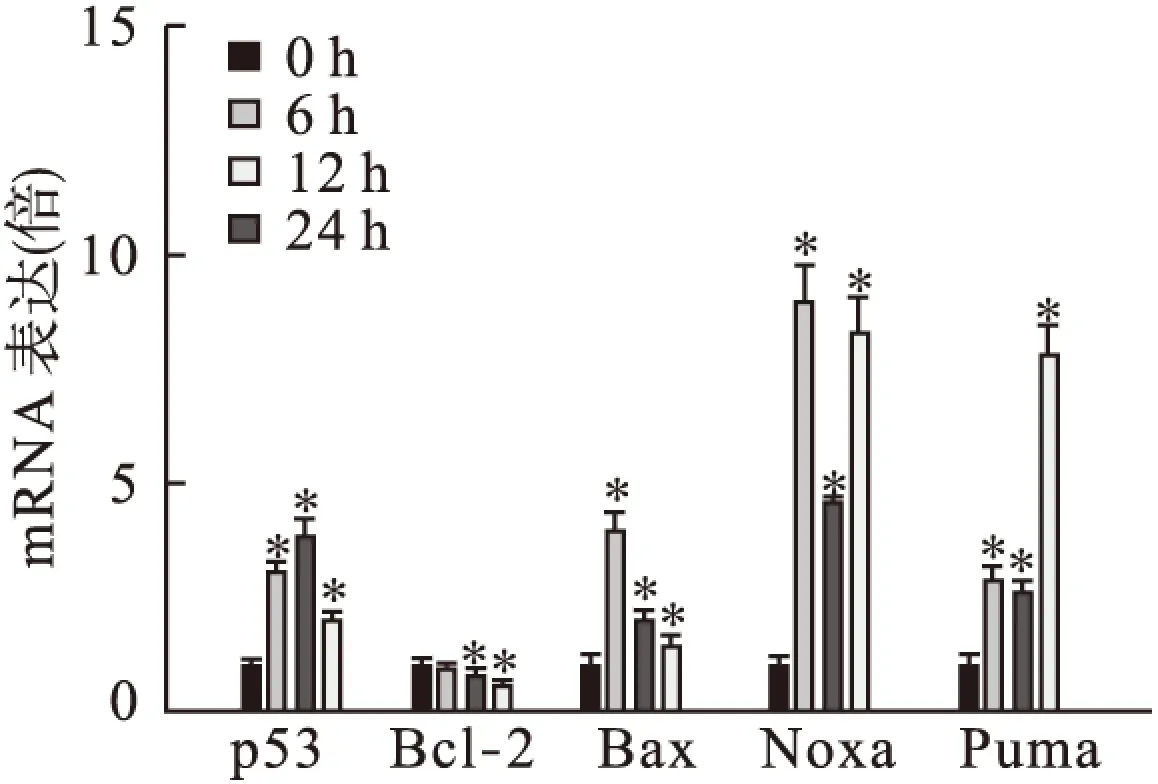
图4 qRT-PCR技术检测相关基因表达情况
目前,抗肿瘤药物的开发主要集中在诱导肿瘤细胞凋亡的作用上[12-13]。本研究DAPI染色和Annexin V-FITC/PI染色结果显示,硼酸钠能促使HepG2细胞染色质边集、浓缩,诱导凋亡的发生。
p53作为肿瘤抑制因子已经被广泛研究,其可以被DNA损伤、缺氧或异常的基因表达所激活,对损伤的DNA进行修复,受损严重的则诱导细胞凋亡,从而避免癌变。p53的活化可上调促凋亡基因Bax、Noxa、Puma等的表达,抑制抗凋亡基因Bcl-2的表达[14]。Bcl-2和Bax是Bcl-2家族的主要成员,当Bcl-2与Bax的比值降低时,线粒体透性转换孔开放,线粒体内外膜间的细胞色素C、凋亡诱导因子等释放,线粒体跨膜电位去极化,细胞发生不可逆性凋亡[15]。为阐述硼酸钠诱导HepG2细胞凋亡的机制,我们运用qRT-PCR技术检测了p53及下游相关基因的mRNA表达情况。本研究发现,硼酸钠作用HepG2细胞6、12、24 h后,p53、Bax、Noxa、Puma基因表达显著上调,而Bcl-2表达明显下调。表明硼酸钠通过活化p53,转录激活Bax等基因,抑制Bcl-2基因,从而启动线粒体依赖的凋亡途径,诱导HepG2细胞凋亡。
总之,p53的活化及其调节下游靶基因的转录在硼酸钠抑制HepG2细胞生长活性、诱导凋亡中起重要作用。本课题为更好地了解硼酸钠的抗肝癌作用提供了研究基础,并且为硼酸钠可以作为抗肝癌治疗的候选药物提供了理论依据。然而,还需要进一步的研究来阐明硼酸钠诱导肝癌细胞凋亡的其他分子机制。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65:87-108.
[2] Leake I.Hepatocellular carcinoma.Treatment potential of targeting Toll-like receptors in HCC[J].Nat Rev Gastroenterol Hepatol,2014,11(9):518.
[3] Choi AY,Choi JH,Hwang KY,et al.Licochalcone A induces apoptosis through endoplasmic reticulum stress via a phospholipase Cγ1-,Ca(2+)-,and reactive oxygen species-dependent pathway in HepG2 human hepatocellular carcinoma cells[J].Apoptosis,2014,19(4):682-697.
[4] 白琛,唐芳,骆伟,等.肝动脉化疗栓塞联合CT引导射频消融序贯治疗肝细胞癌的近远期疗效[J].中国医药,2015,10(8):1156-1160.
[5] Argus P.Distribution of boron in the environment[J].Biol Trace Element Res,1998,66:131-143.
[6] Yanagie H,Higashi S,Seguchi K,et al.Pilot clinical study of boron neutron capture therapy for recurrent hepatic cancer involving the intra-arterial injection of a(10)BSH-containing WOW emulsion[J].Appl Radiat Isot,2014,88:32-37.
[7] Pawa S,Ali S.Boron ameliorates fulminant hepatic failure by counteracting the changes associated with the oxidative stress[J].Chem Biol Interact,2006,160(2):89-98.
[8] Zafar H,Ali S.Boron inhibits the proliferating cell nuclear antigen index,molybdenum containing proteins and ameliorates oxidative stress in hepatocellular carcinoma[J].Arch Biochem Biophys,2013,529(2):66-74.
[9] Nielsen FH.Is boron nutritionally relevant[J].Nutr Rev,2008,66(4):183-191.
[10] Akama T,Dong C,Virtucio C,et al.Linking phenotype to kinase:identification of a novel benzoxaborole hinge-binding motif for kinase inhibition and development of high-potency rho kinase inhibitors[J].J Pharmacol Exp Ther,2013,347:615-625.
[11]Scorei IR.Calcium fructoborate:plant-based dietary boron as potential medicine for cancer therapy[J].Front Biosci(Schol Ed),2011,3:205-215.
[12]Goldsworthy TL,Conolly RB,Fransson-Steen R.Apoptosis and cancer risk assessment[J].Mutat Res,1996,365:71-90.
[13]Esmaeili MA,Farimani MM,Kiaei M.Anticancer effect of calycopterin via PI3K/Akt and MAPK signaling pathways,ROS-mediated pathway and mitochondrial dysfunction in hepatoblastoma cancer(HepG2) cells[J].Mol Cell Biochem,2014,397:17-31.
[14]Mirzayans R,Andrais B,Scott A,et al.New insights into p53 signaling and cancer cell response to DNA damage:implications for cancer therapy[J].J Biomed Biotechnol,2012:170325.
[15]Shimizu S,Narita M,Tsujimoto Y.Bcl-2 family proteins regulate the release of apoptogenic cytochrome c by the mitochondrial channel VDAC[J].Nature,1999,399(6735):483-487.
Apoptosis of human hepatocellular carcinoma cell HepG2 induced by borax-activated p53
WEI Yinga,ZHANG You-shunb,WU Lunb,YUAN Fang-junb,CHEN Qin-huaa,ZHOU Wen-bob*
(a.Experiment Center,b.Department of Hepatobiliary Surgery,Dongfeng Hospital,Hubei University of Medicine,Shiyan 442000,China)
Objective To observe the effect of borax on the growth inhibition and apoptosis of human hepatocellular carcinoma cell line HepG2,and to explore its mechanism.Methods The potential effect of borax on the cell viability was examined using MTT assay.The cell apoptosis rate of cells treated with borax was analyzed by DAPI and Annexin V-FITC/PI staining.The level of tumor suppressor factor p53 and its downstream gene Bcl-2,Bax,Noxa,Puma mRNA were detected by real-time PCR.Results Compared with control group,borax in different dose group could inhibit the activity of HepG2(P<0.01).Borax induced apoptosis of HepG2 cells,and after 0,1.0,2.0,4.0 mmol/L borax treat 24 h,the percentage of late apoptotic cell increased from 2.57% to 8.13%,10.4% and 15.24% respectively(P<0.01),the difference being of statistical significance.After 4.0 mmol/L borax treatment for 6,12,24 h,the tumor inhibition factor p53 and pro-apoptotic gene Bax,noxa,puma mRNA expression significantly increased,but the anti-apoptosis gene Bcl-2 mRNA expression was significantly down-regulated(P<0.01).Conclusion Borax inhibits the growth of human hepatocellular carcinoma cell HepG2 activity and induces apoptosis.The mechanism may be related to the activation of p53,up-regulation of Bax,Noxa and Puma mRNA expression,and down-regulation of Bcl-2 mRNA expression.
Borax;Human hepatocellular carcinoma cell HepG2;Apoptosis;p53;Bcl-2
2016-05-13
湖北医药学院附属东风医院a.实验中心,b.肝胆外科,湖北 十堰 442000
十堰市科技局基金(15Y56);湖北省自然科学基金面上基金(2015CFB615)
10.14053/j.cnki.ppcr.201612006
*通信作者
