正交试验优选“桂枝与白芍”药对煎煮工艺
2017-01-05陈永财王彬辉
陈永财,王彬辉,林 君
正交试验优选“桂枝与白芍”药对煎煮工艺
陈永财1,王彬辉2,林 君3
目的 优选“桂枝与白芍”药对最佳煎煮工艺。方法 以浸泡时间、武火沸后微火煎煮时间、加水量为因素,设计L9(34)正交表,以芍药苷含量、桂皮醛含量、浸膏得率为量化指标,通过数据分析,优选出最佳煎煮工艺。结果 最佳煎煮工艺为:浸泡时间60 min、武火沸后微火煎煮时间60 min、10倍加水量,其中加水量影响因素有显著差异(P<0.05)。结论 采用优选后煎煮工艺操作简便,稳定可行,重复性好,可控制煎出液内在质量,为“桂枝与白芍”药对规范化煎煮提供合理的依据。
桂枝;白芍;正交试验;煎煮工艺;含量测定
0 引言
“桂枝与白芍”为典型的相制配伍,源于《伤寒论》的桂枝汤,为临床常用的调和营卫、温通止痛药对[1]。二者伍用桂枝汤(桂枝∶白芍为1∶1,以9~10 g为宜),治太阳中风表虚证;桂枝加芍药汤(桂芍1∶2)治太阳病误下伤中土虚木乘之腹痛;桂枝加桂汤(桂芍5∶3)治心阳虚弱寒气凌心之奔豚[2],可见保证核心“桂枝与白芍”药对煎出液质量尤为关键。依据伤寒论中“桂枝汤”煎煮方法:“以上五味,以水七升,微火煮取三升[2]”,提示“桂枝汤”采用微火久煎,其久煎时间、加水量多少,直接影响煎液内在质量,按传统煎煮方法浸泡有利于有效成分溶出,故“桂枝与白芍”药对煎煮时浸泡时间、微火久煎时间、加水量等三因素影响较为显著[3-4]。本研究拟选用浸泡时间、微火煎煮时间、加水量因素,通过正交设计,以芍药苷含量、桂皮醛含量、浸膏得率为量化指标,对药对煎煮工艺进行优选,控制煎出液内在质量,为“桂枝与白芍”药对规范化煎煮提供合理的依据。
1 仪器与试剂
FL-1型可调式封闭电炉(北京市永光明医疗仪器有限公司),AB135-s型电子天平(梅特勒-托利多上海有限公司),FA2004B型电子天平(上海精密科学仪器有限公司),BC-119型电冰箱(杭州华日电冰箱股份有限公司),岛津LC-20AT高效液相色谱仪,RE-2000A旋转蒸发器(上海亚荣生化仪器),MODEL 0406-1离心机(上海医疗器械有限公司手术器械厂),甲醇、乙腈为色谱纯(美国Merck公司),乙酸为色谱纯(浙江中星化工试剂有限公司),水为超纯水,其余试剂分析纯。芍药苷、桂皮醛对照品购自中国食品药品检定研究院(批号:110736-201438、110710-201418)。桂枝、白芍中药饮片购自浙江华宇中药饮片有限公司(批号:1503190、1505100),经浙江中医药大学熊耀康教授鉴定桂枝为樟科植物肉桂(CinnamomumcassiaPresl)的干燥嫩枝,白芍为毛茛科植物芍药(PaeonialactifloraPall)的干燥根。
2 方法与结果
2.1 芍药苷、桂皮醛的含量测定[5]
2.1.1 色谱条件 Wonda Cract ODS-2色谱柱(150 mm×4.6 mm,5 μm)。流动相:乙腈(A)-0.1%冰醋酸溶液(B)梯度洗脱,洗脱条件:0~10 min,13%~35%A;10~20 min,35%~60%A;20~25 min,60%A。流量1.0 mL/min,柱温30 ℃,检测波长:254 nm,进样量10 μL。
2.1.2 对照品溶液制备 精密称取桂皮醛和芍药苷对照品适量,加入甲醇溶解并分别定容至50、25 mL量瓶中,配制成含桂皮醛1.23 mg/mL、芍药苷3.58 mg/mL的溶液。
2.1.3 供试品溶液制备及测定 按桂枝与白芍药对(1∶1)称取桂枝18 g、白芍18 g,加入定量水、浸泡一定时间,置于电炉上武火加热煮沸后,改为文火(120 ℃电炉二挡)煎煮一定时间,煎煮一次滤过,即得,滤液加水稀释定容至500 mL,精密称取25 mL稀释液,加入无水乙醇15 mL摇匀,于4 ℃冰箱静置24 h,离心,上清液减压回收溶剂至干,残渣用50%甲醇溶解并定容至25 mL,用0.45 μm微孔滤膜滤过,精密吸取10 μL注入液相色谱仪记录峰面积值。见图1。

图1 桂枝白芍药对HPLC
注:A.桂皮醛芍药苷混合对照品,B.阴性对照,C.桂枝芍药药对;1.芍药苷,2.桂皮醛
2.1.4 线性关系考察 分别精密移取上述对照品溶液0.2、0.4、0.8、1.6、2.4、3.2 mL,置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,各精密吸取10 μL注入液相色谱仪,记录各标准品峰面积。以峰面积(A)对浓度(C)进行线性回归,得到芍药苷标准曲线回归方程:A=2.0×106C-2 998.1,R2=0.998 8,结果表明,芍药苷进样量在0.071 6~1.145 6 mg范围内与峰面积有良好的线性关系;得到桂皮醛标准曲线回归方程:A=7.0×106C-445.78,R2=0.999 3,结果表明,桂皮醛进样量在0.024 6~0.394 2 mg范围内与峰面积有良好线性关系。
2.1.5 精密度实验 精密量取同一对照品溶液10 μL,按相同的色谱条件重复进样6次,记录峰面积值,结果显示,芍药苷的峰面积值分别为1 496 287、1 496 112、1 479 678、1 496 320、1 503 269、1 563 230,RSD值为1.94%,桂皮醛的峰面积值分别为184 492、186 871、187 719、187 581、185 696、187 188,RSD值为0.67%,表明本方法精密度良好。
2.1.6 重复性实验 取同一批号的饮片样品6份,按“2.1.3”项下方法制备供试品溶液并进行测定,计算桂皮醛、芍药苷含量。结果6份样品桂皮醛分别为2.222、2.199、2.238、2.252、2.186、2.243 mg/g,芍药苷含量分别为14.037、13.952、13.876、14.259、14.199、14.311 mg/g,桂皮醛、芍药苷含量的RSD值分别为1.17%、1.25%,表明本方法重现性良好。
2.1.7 回收率实验 精密量取已知桂皮醛、芍药苷成分含量的样品溶液6份,分别精密加入相同量混合对照品,按“2.1.4”项下方法操作,依法测定。结果见表1,计算得桂皮醛、芍药苷平均回收率为 92.92%、93.21%,RSD值为2.50%、2.01%。
2.1.8 稳定性试验 取同一供试品溶液6份,分别于0、2、4、6、8、12、24 h进样,分别记录芍药苷、桂皮醛的峰面积值。计算得芍药苷的含量为15.35、15.23、15.11、15.40、15.34、15.35 mg/g,RSD值为0.70%;桂皮醛的含量2.93、2.92、2.92、2.92、2.92、2.93 mg/g,RSD值为0.17%。结果表明,溶液在24 h内供试品溶液稳定性良好。
2.2 单因素试验考察 为考察“桂枝与白芍”药对最佳传统煎煮工艺,在查阅中药煎煮相关文献的基础上,进行单因素考察,以合煎液中桂皮醛、芍药苷成分含量为主要指标,同时按照2015版《中华人民共和国药典》四部浸出物测定法[6],测定浸出物含量,每份样品平行3份。

表1 供试品中桂皮醛、芍药苷的回收率(n=6)
2.2.1 控制微火考察 武火煮沸后,分别选取微火(110 ℃电炉一档、120 ℃电炉二档、130 ℃电炉三档)及武火(150 ℃电炉四档)。称取桂枝18 g、白芍18 g,加入10倍量水,浸泡60 min,煎煮60 min,按“2.1.3”项制备供试品溶液,测定芍药苷含量分别为14.32、17.35、15.17、12.39 mg/g,桂皮醛含量分别为3.21、3.35、2.85、1.39 mg/g,浸膏得率分别为6.78%、7.94%、7.35%、5.46%,结果表明,控制微火(120 ℃电炉二档)效果最好。
2.2.2 浸泡时间考察 分别选取浸泡15、30、60、90 min,加入10倍量水,控制微火(120 ℃电炉二档)煎煮60 min,按“2.1.3”项制备供试品溶液,测定芍药苷含量为15.85、16.94、17.52、16.45 mg/g,桂皮醛含量为2.85、3.39、3.48、3.24 mg/g,浸膏得率为6.84%、7.95%、8.22%、7.43%,结果表明,浸泡60 min效果最理想。
2.2.3 煎煮时间考察 加入10倍量水,浸泡60 min,控制微火(120 ℃电炉二档),分别选取煎煮15、30、60、90 min,按“2.1.3”项制备供试品溶液,测定芍药苷含量为14.63、16.54、17.29、15.84 mg/g,桂皮醛含量为2.65、3.21、3.52、2.96 mg/g,浸膏得率为7.63%、8.29%、8.32%、7.94%,结果表明,微火煎煮60 min最佳。
2.2.4 加水量考察 分别选取加水量5、6、7、8、10倍,浸泡60 min,控制微火(120 ℃电炉二档),煎煮60 min,按“2.1.3”项制备供试品溶液,测定芍药苷含量为9.35、11.31、13.89、15.32、17.63 mg/g、桂皮醛含量为1.47、1.83、2.35、2.86、3.58 mg/g,浸膏得率为4.53%、5.21%、6.85%、7.13%、8.32%,结果表明,加水量对芍药苷、桂皮醛含量和浸膏得率基本呈上升趋势,因此加水量10倍为最好。
2.3 正交实验设计 单因素试验基础上,发现首先要控制微火(120 ℃电炉二档)保持微沸状态下,选用浸泡时间(30、60、90 min),微火煎煮时间(30、60、90 min)三水平较合理,加水量影响因素最显著,考虑实际煎出量问题选用(5、7、10倍)三水平较恰当。以上述三因素三水平作为考察对象,以药对芍药苷含量、桂皮醛含量、浸膏得率为量化指标,采用L9(34)正交实验表安排实验,其各因素水平见表2,称取桂枝18 g、白芍18 g (1∶1),分别按L9(34)正交实验表所列条件,按“2.1.3”项制备供试品溶液,测定芍药苷、桂皮醛含量和浸膏得率,实验安排及结果见表3。

表2 考察因素及水平
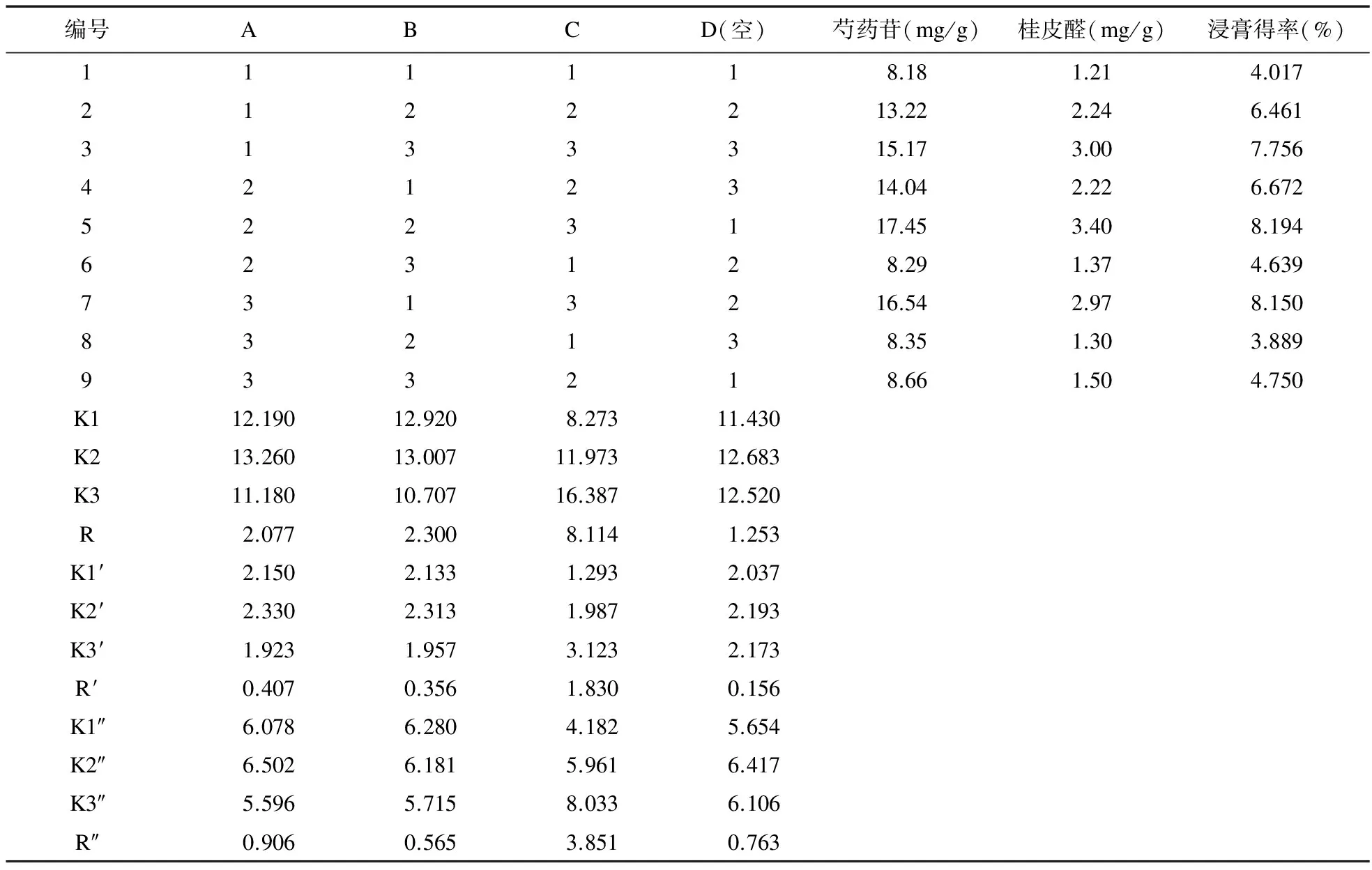
表3 正交实验表L9(34)及其实验结果
2.4 正交试验结果分析 本次实验对桂芍药对的芍药苷、桂皮醛2个有效成分,结合其提取浸膏得率同时进行分析,对所得实验结果进行直观分析和方差分析,结果见表4~表6。

表4 芍药苷含量的方差分析
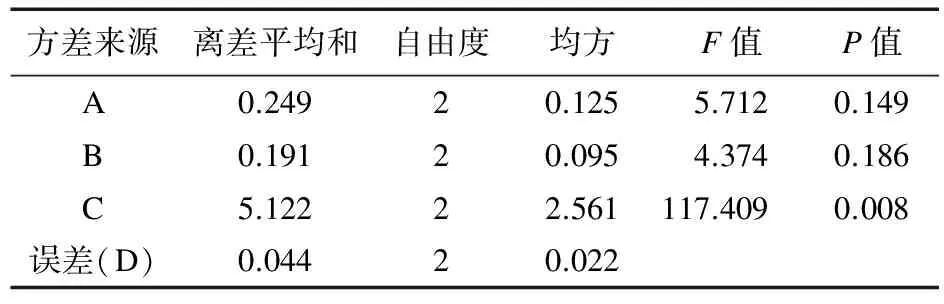
表5 桂皮醛含量的方差分析
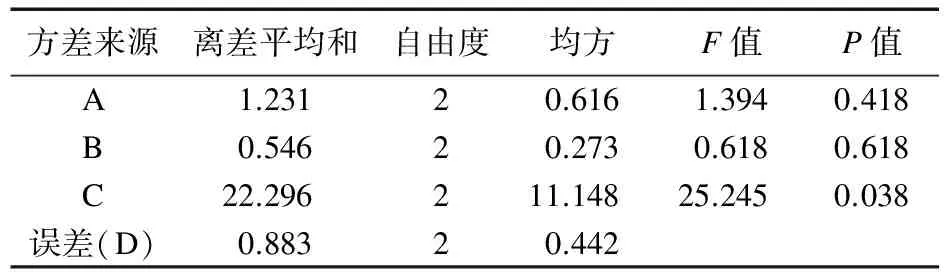
表6 浸膏得率的方差分析
电炉武火加热煮沸后改为文火(120 ℃电炉二档)煎煮D项作为误差项,由表4可知,加水量对芍药苷含量有显著差异(P<0.05),且C>B>A,即选择A2B2C3;由表5可知,加水量对桂皮醛含量有显著差异(P<0.01),且C>A>B,即选择A2B2C3;由表6可知,加水量对浸膏得率有显著差异(P<0.05),且C>A>B,即选择A2B1C3。由于B因素在浸膏得率影响很小,所以选择A2B2C3为煎煮最佳优选条件。
2.5 验证试验 按A2B2C3煎煮工艺制备3批样品,测得浸出物平均得率7.844%±0.141%,芍药苷、桂皮醛含量的平均质量分数分别为(17.29±0.05)、(3.45±0.01) mg/g。各样品测定结果见表7。结果表明,优选的工艺稳定可行,重复性较高。
3 讨论
伤寒论中“桂枝汤”[2]煎煮方法:“以上五味,以水七升,微火煮取三升”,东汉1两为15.6 g,1升为200 mL[7-8],药物总质量约201 g,加水量1 400 mL,其煎出液为600 mL,煎出量与加水量比率为42.85%。表3中2号实验(浸泡30 min、微火煎煮60 min、7倍加水量252 mL)一次煎出液120 mL,煎出量与加水量比率为47.61%,可知2号实验煎煮工艺与东汉煎煮工艺基本吻合,按优选最佳煎煮工艺(浸泡时间60 min、微火煎煮60 min、10倍加水量)一次煎出液250 mL,其煎出量与加水量比率为69.41%。优选最佳工艺煎液质量优于2号实验,因此,优选最佳煎煮工艺制备汤剂内在质量优于古人制备汤剂。

表7 样品含量及浸膏得率测定结果
桂枝含挥发油0.2%~0.9%,油中主含桂皮醛70%~80%,其主要药理作用包括解热、镇痛、镇静、抗病毒、抗菌等[9]。白芍的主要成分芍药苷,具有调节机体免疫功能作用[10]。桂皮醛不溶于水,随水蒸气的耗散而损失。实验表明,桂枝挥发油中桂皮醛在煎煮10 min时煎出量达到最大值[11],提示桂皮醛随着煎煮时间延长或武火煎煮其损失量必定增加,当武火短时间煎和微火久煎耗水量相等时,其损失挥发油是相等的,本实验也证实微火久煎60 min时,煎液中桂皮醛含量最高,表明微火久煎有利于桂皮醛溶出,减少挥发油散失。芍药苷溶于水,实验表明,芍药苷随着煎煮时间的延长而煎出量不断增加,煎煮60 min时,煎出量达到峰值而后下降[11],本实验也证实了微火久煎60 min时,煎出含量达到峰值,因此“桂枝与白芍”药对煎煮方法和“桂枝汤”微火久煎[12]相吻合,具有一定科学道理。
按药典规定,桂枝切厚片,白芍切薄片,其质地坚实,要有较长时间充分浸泡,使饮片润胀,有利于有效成分渗透扩散,但浸泡时间不宜过久,以免引起药物酶解等。本研究证实,浸泡60 min,提取桂皮醛、芍药苷含量最高。加水量的多少,直接影响汤剂质量,本研究显示,加水量影响因素有显著差异(P<0.05),药多水少有效成分浸提不完全,药少水多虽能增加有效成分的溶出量,可汤液量过大不利于患者服用,本实验证实,加水量10倍时,汤剂中桂皮醛、芍药苷质量分数达到峰值,浸膏得率提高。
本实验优选最佳煎煮工艺,既符合伤寒论中“桂枝汤”煎煮方法,又提高了煎液内在质量,为后期“桂枝与白芍”药对体内外研究奠定基础。
[1] 李贵海.常用中药药对分析与应用[M].北京:人民卫生出版社,2009:235-237.
[2] 李冀.方剂学[M].北京:中国中医药出版社,2012:27-28.
[3] 李梅,珍唐樑,黄玉宇,等.多指标正交实验优选桂枝汤最佳煎煮工艺[J].中华中医药学刊,2014,6(32):1451-1453.
[4] 王竹兰.《伤寒论》汤剂煎煮法及汤剂制备规范化研究[D].北京:北京中医药大学,2010:45-88.
[5] 王连芝,董静艳.桂枝与白芍配伍的HPLC指纹图谱研究[J].中医药信息,2010,4(27):32-33.
[6] 国家药典委员会.中华人民共和国药典(四部)[S].北京:中国医药科技出版社,2015:202.
[7] 范吉平,程先宽.经方剂量折算研究评述[J].中华中医药杂志,2011,26(1):7 -11.
[8] 王晓玲,唐勇,陈亮.汉代度量衡与经方剂量折算浅析[J].中国中医药现代远程教育,2011,9(1):81-82.
[9] 许源,宿树兰,王团结.桂枝的化学成分与药理活性研究进展[J].中药材,2013,36(4):674-678.
[10]李岩.白芍及其化学成分的药理研究进展[J].职业与健康,2015,31(15):2153-2156.
[11]赵长琦,党高潮.桂枝汤化学成分的分析研究[J].西北大学学报(自然科学版),1997,27(6):515-516.
[12]林大勇,曲道炜,李文武.论《伤寒论》桂枝汤应当“微火久煮”[J].国际中医中药,2011,7(33):636-637.
Optimization of decoction process of herbal pair of Ramulus cinnamomi and Radix Paeoniae Alba by orthogonal test
CHEN Yong-cai1,WANG Bin-hui2,LIN Jun3
(1.Wenzhou Hospital of Traditional Chinese Medicine,Wenzhou 325000,China;Medical College Affiliated Hospital of Taizhou University,Taizhou 318002,China;Zhejiang Hua Yu Pharmaceutical Co.,Wenzhou 325000,China)
Objective To optimize the best decoction process of herbal pair ofRamuluscinnamomiandRadixPaeoniaeAlba.Methods The L9(34) orthogonal table was designed with immersion time,high-heat micro-fire decoction time after boiling and added water as the factors,and paeoniflorin content,cinnamic aldehyde content and extract yield as the quantitative indicators.The best decoction process was optimized through data analysis.Results The optimal decoction technology was as follows:the immersion time was 60 min,micro-fire decoction time after high-heat boiling was 60 min,and 10 times of water should be added;the factor of added water had significant difference (P<0.05).Conclusion The optimized decoction process is simple,stable and feasible with good repeatability.It can control the inner quality and provide a reference for improving the quality control ofRamuluscinnamomiandRadixPaeoniaeAlba.
Ramuluscinnamomi;RadixPaeoniaeAlba;Orthogonal test;Decoction process;Content determination
2015-12-27
1.温州市中医院,浙江 温州 325000;2.台州学院医学院附属市立医院,浙江 台州 318002;3.浙江华宇药业,浙江 温州 325000
浙江省中医药项目(2015ZA195);温州市科委资助项目(Y20140746)
10.14053/j.cnki.ppcr.201612021
