二甲双胍对NAFLD大鼠肝脏脂联素/SIRT1 mRNA表达的影响
2017-01-05徐碧林章志建
申 甜,雷 涛,徐碧林,陈 琳,章志建
二甲双胍对NAFLD大鼠肝脏脂联素/SIRT1 mRNA表达的影响
申 甜,雷 涛*,徐碧林,陈 琳,章志建
目的 观察二甲双胍对高脂饮食诱导NAFLD大鼠肝脏脂联素和SIRT1基因表达的影响,探讨其潜在的机制。方法 将34只SD大鼠随机分为2组:对照组(NC组,12只,给予普通饲料)、高脂组(HF组,22只,给予高脂饮食),喂养8周后两组各随机抽取6只;证实NAFLD模型建立后,将剩余HF组大鼠随机分为二甲双胍干预组(HF+M组,8只)、高脂组(HF1组,8只)及对照组(NC1组,6只),均给予等体积生理盐水,灌胃8周后,测定空腹血糖(FBG)、血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(FFA)及肝脏TG含量,测定胰岛素(FINS)水平,并计算胰岛素抵抗指数(HOMA-IR);HE染色观察肝脏病理形态学变化;采用Real-time PCR法检测肝组织脂联素、SIRT1、AMPK-α mRNA表达。结果 高脂喂养8周后,HF组大鼠NAFLD模型建立,伴明显胰岛素抵抗。HF+M组大鼠血清TC、TG、FFA、FBG、ALT、AST、肝脏TG含量及HOMA-IR低于HF1组(P<0.05),血清脂联素较HF1组升高(P<0.05),肝脏脂肪变较HF1组有所改善;与HF1组比较,HF+M组肝脏SIRT1、AMPK-α mRNA表达增加(P<0.05)。结论 二甲双胍可减轻NAFLD大鼠胰岛素抵抗及肝脏TG沉积,其机制可能与通过升高血清脂联素水平,进而激活SIRT1/AMPK信号通路有关。
二甲双胍;非酒精性脂肪肝病;脂联素;SIRT1
0 引言
非酒精性脂肪肝病(Nonalcoholic fatty liver disease,NAFLD)在全球多个地区的发病率逐年增加,其在肥胖人群中的发病率为58%~74%[1]。NAFLD与肥胖、血脂升高、胰岛素抵抗(Insulin resistance,IR)和随之而来的糖耐量异常及2型糖尿病(Type 2 diabetes mellitus,T2DM)[2]密切相关。脂肪因子(瘦素、抵抗素)和炎性因子相互作用可导致IR,促进脂肪肝炎性改变及肝脏糖脂代谢紊乱加重;而脂联素(Adiponectin)是由脂肪组织分泌的唯一起保护作用的脂肪细胞因子,具有抗炎、抗糖尿病、抗动脉粥样硬化的作用。沉默调节蛋白1(SIRT1)是在哺乳动物细胞中的一种蛋白去乙酰化酶,具有改善外周胰岛素抵抗、促进脂类物质被动员的作用[3]。SIRT1可使脂肪细胞的叉头转录因子O1(FOX1)发生去乙酰化,进而上调脂联素的转录水平[4],但在NAFLD发病中的作用尚未完全明确。本研究利用高脂饮食喂养大鼠复制NAFLD模型[5],观察脂联素、SIRT1在NAFLD发病机制中的作用及二甲双胍干预对NAFLD的疗效。
1 材料与方法
1.1 材料与试剂 健康清洁级5~6周龄雄性SD大鼠34只,体重185~200 g,购于上海斯莱克实验动物有限责任公司,由上海市普陀区中心医院动物饲养中心分笼喂养。正常对照组给予普通饲料(上海市普陀区中心医院动物饲养中心提供)喂养,高脂饲料(78%基础饲料+15%猪油+5%蔗糖+1.8%胆固醇+0.2%胆盐)由上海斯莱克实验动物有限公司定制生产。盐酸二甲双胍片(500 mg/片,购于上海施贵宝制药公司)。胰岛素(FINS)、脂联素、游离脂肪酸(FFA)及三酰甘油(TG)试剂盒均购于上海钰森生物科技有限公司;PrimeScriptTMRT reagent Kit(TAKARA公司),SYBR premix EX TaqTMII(TAKARA公司)。
1.2 方法
1.2.1 动物模型制备及分组 所有SD大鼠先用普通饲料适应性喂养1周后,按随机数字法分为对照组(NC组,12只)和模型组(HF组,22只)。喂养8周后,两组随机抽取6只,进行称重(体重及肝重,并计算肝指数)及血脂、胰岛素等生化指标检测,比较各组之间肝组织病理学变化,鉴定HF组NAFLD造模成功。将剩余模型组大鼠随机分为二甲双胍干预组(HF+M组,8只,高脂喂养+二甲双胍500 mg/(kg·d)],高脂组(HF1组,8只)及剩余对照组(NC1组6只)均给予等体积生理盐水,连续灌胃8周。
1.2.2 标本采集及检测 连续灌胃8周后,取材前禁食12 h(不禁水),称重,用乙醚腹腔注射麻醉,腹主动脉取血,离心,分离血清存于超低温冰箱备用;使用全自动生化分析仪检测ALT、AST、TC、TG、FBG;分别按照脂联素、胰岛素ELISA试剂盒说明要求测定大鼠血清脂联素、FINS,根据FBG、FINS计算胰岛素抵抗指数IRI=(FINS×FBG)/22.5。迅速取出各样本肝右叶,大小为2.5 cm×2.5 cm×0.5 cm,甲醛溶液固定,包埋,制备石蜡切片,行HE染色,做肝组织病理学观察;其余肝脏-70 ℃冻存。
1.2.3 氯仿∶甲醇(2∶1)制备肝脏匀浆,应用TG测定试剂盒检测肝脏TG水平。
1.3 实时定量PCR检测 取各样本肝组织30 mg,TRIzol抽提大鼠肝脏总RNA,按SuperscriptⅢ逆转录酶试剂盒说明逆转录得到cDNA。引物设计与合成:基因序列均从GenBank中获取,引物由南京生工合成:adiponectin:5′-GTCTCCGTGCTTCCGATGAA-3′,5′-GGTCAAACTGGACTTGGGGT-3′;SIRT1:5′-GATGATGCTGACAGACCGGA-3′,5′-AGTTCCCAATGCTGGTGGAG-3′;AMPK-α:5′-GAGCCCTGAACTTGCTTTTACA-3′,5′-TGTCCGTTCTATGCGCTGG-3′;GAPDH:5′-CTCATGACCACAGTCCATGC-3′,5′-CACATTGGGGGTAGGAACAC-3′。扩增条件:95 ℃预变性30 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。根据TRIzol方法提取大鼠肝脏总RNA,按SuperscriptⅢ逆转录酶试剂盒说明逆转录得到cDNA。使用荧光定量PCR仪(罗氏96lightcycler)进行目标基因的实时荧光定量 PCR检测。PCR检测条件为:95 ℃ 3 min,95 ℃ 10 s,60 ℃ 45 s,40 个循环。扩增完成后,应用反应产物的溶解曲线检测其均一性,每个反应重复 3 次。反应结束后,对所有样品进行规一化处理,使用2-ΔΔCt方法计算样本目的基因相对表达量,以GAPDH作为内参基因。
2 结果
2.1 生化指标等比较 二甲双胍干预后,各组生化指标、FFA测定及胰岛素抵抗指数比较见表1。
2.2 肝组织病理HE染色 灌胃8周后,HF1组出现明显脂肪变性,且胞浆呈大面积空泡化,被大量小泡性脂滴所占据,大部分细胞核被挤向细胞边缘,肝窦不清晰,肝索排列紊乱,肝小叶内及汇管区可见大量以单核、淋巴细胞为主的炎症细胞浸润及点状坏死;HF+M组肝小叶结构仍有紊乱,肝细胞肿胀程度、胞浆疏松化较HF1组略有减轻,脂肪泡数目减少,脂滴缩小。见图1。

表1 二甲双胍对NAFLD大鼠生化指标、FFA及脂联素的影响
注:*与NC1组比较,P<0.05;#与HF1组比较,P<0.05
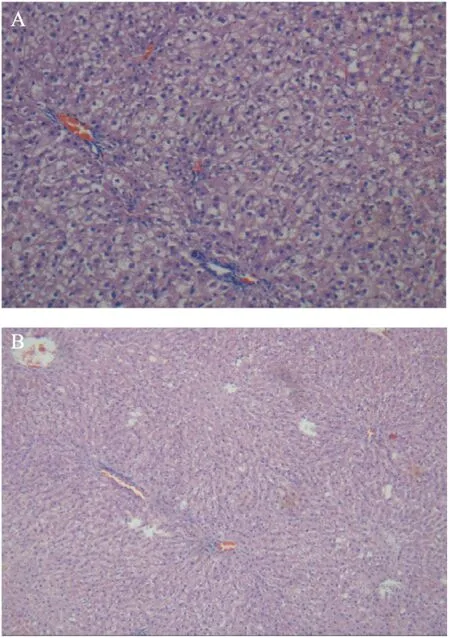
图1 肝组织HE染色(×100)
2.3 各组肝脏Adiponectin、SIRT1 mRNA、AMPK-α mRNA表达 与NC1组比较,HF1组肝脏SIRT1、AMPK-α、adiponectin mRNA表达均降低;二甲双胍干预后,肝脏SIRT1、AMPK-α mRNA表达增加(P<0.05),而adiponectin mRNA表达无显著变化(P>0.05)。见表2。

表2 干预后各组大鼠肝脏Adiponectin、SIRT1 mRNA、AMPK-α mRNA表达比较
注:*与NC1组比较,P<0.05;#与HF1组比较,P<0.05
3 讨论
NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝脏损害。经典NAFLD“二次打击学说”认为,外周胰岛素抵抗通过减弱胰岛素抑制脂肪分解的作用,使大量游离脂肪酸从脂肪组织分解释放而增加肝脏的脂肪酸摄入,导致TG在肝细胞内过度合成,形成肝脏脂肪变性,即“第一次打击”;各种炎症因子、脂肪因子紊乱增加了细胞内的氧化应激及线粒体功能障碍,可最终加重肝脏的炎症及纤维化,即“第二次打击”。由脂肪组织分泌的促炎和抗炎脂肪因子间的平衡失调有助于NAFLD 的发生、发展。脂联素是由脂肪细胞特异性分泌,具有2种受体:AdipoRl和AdipoR2。AdipoRl分布广泛,而AdipoR2主要表达于肝脏,具有改善外周组织胰岛素抵抗、降低葡萄糖和促进脂质分解的功能[6]。
本研究显示,在高脂饮食喂养8周后,模型组大鼠出现多饮、多尿、多食,体重及血糖升高,血清TC、TG及FFAs水平较对照组明显升高,脂联素水平下降。肝脏组织学显示,混和组肝脏出现明显的脂肪变性,胞浆空泡化,被大量小泡性脂滴所占据,证实高脂诱导NAFLD造模成功。作为糖尿病一线用药,二甲双胍具有降糖、降脂及改善胰岛素抵抗的作用,同时,部分动物实验也证实,其可以改善NAFLD肝脏脂肪形态学变化,根据NAFLD最新诊疗指南[7],推荐二甲双胍用于NAFLD的治疗,但有关的机制尚不完全清楚。二甲双胍可通过降低血浆葡萄糖水平而间接下调胰岛素及胰岛素生长因子-1水平[8-10],还可通过激活AMPK活性,阻止肝脏葡萄糖的释放、促进骨骼肌葡萄糖的摄取而改善胰岛素抵抗[11-12]。此外,二甲双胍通过抑制AMPK活性的相关基因(ACC1、ACC2和HMG-CoA[9,13-14],而减少游离脂肪酸的脂质合成,进而改善胰岛素抵抗。本研究中,模型组大鼠经二甲双胍灌胃后,血糖、血脂、肝酶指标及胰岛素、脂联素水平均明显改善,肝脏脂肪变程度部分逆转,推测二甲双胍可能通过提高脂联素水平而部分改善肝脏IR。
SIRT 是在哺乳动物细胞中发现的一种尼克酰胺腺嘌呤二核苷酸(NAD+)依赖的蛋白去乙酰化酶,通过使多种蛋白质的赖氨酸残基发生去乙酰化而发挥细胞代谢调节(如能量代谢、糖脂代谢等)、改善氧化应激及线粒体功能障碍和减轻炎症反应等发挥改善NAFLD肝脏病变的作用。应用转基因技术增加SIRT1表达,明显提高大鼠血清脂联素水平和肝组织AdipoR2的表达,减轻高脂饮食诱发的肝细胞脂肪变性[9]。脂联素可增加肌管细胞和枯否细胞的SIRT1蛋白表达,基因敲除AdipoR1和AdipoR2可完全阻断上述调节作用,提示脂联素直接上游调节SIRT1。AMPK为“细胞能量调节器”,在培养的肝细胞和动物模型中发现SIRT1通过调节AMPK的上游激酶-肝激酶B1直接磷酸化AMPK亚单位的172位苏氨酸激活AMPK。
有研究显示,在高热量饮食诱导的大鼠NAFLD模型中,肝脏SIRT1的表达量显著下降,而在饮食热量限制后,肝脏的SIRT1表达量显著升高,并且肝脏病变得到明显改善[10-11],而全身SIRT1敲除和肝脏特异性SIRT1敲除的小鼠则出现严重的肝脏脂肪变性,甚至炎症反应[13-16]。本试验发现,模型组SIRT1水平较对照组下降,二甲双胍干预后,其水平可升高。推断SIRT1可作为NAFLD病理生理过程中的关键调节靶点,通过下游多种机制而发挥改善NAFLD肝脏病变的作用。在对高脂喂养诱导小鼠进行肝SIRT1基因敲除后,小鼠则会出现明显的肝脂肪变、炎症改变及内质网应激反应[17],由此证实SIRT1具有胰岛素抵抗、胰岛素敏感性、改善氧化应激的调节功能。
本研究采用RT-PCR发现,模型组大鼠肝脏中AMPK-α、脂联素、SIRT1 mRNA表达低于对照组,这可能是摄入高热量抑制了SIRT1的表达,是机体的代偿反应。在使用二甲双胍后,高脂组肝脏AMPK-α及SIRT1 mRNA表达水平较高脂组升高,脂联素mRNA表达有增加趋势。
综上所述,高脂喂养大鼠可导致肝组织脂肪变,伴随血清中脂联素水平降低,肝组织SIRT1、adiponectin、AMPK-α mRNA表达下降及肝脏TG堆积。二甲双胍可明显升高血清脂联素水平,可能通过调节肝脏Adip-SIRT1-AMPK信号通路导致脂质合成的关键酶ACC和SREBP的表达下调,继而改善脂质沉积,这可能是防治NAFLD发生的重要机制之一,具体的机制有待进一步研究。
[1] Angulo P.Nonakoholic fatty liver disease[J].N Engl J Med,2002,346:1221-1231.
[2] Onyekwere CA,Ogbera AO,Samaila AA,et al.Nonalcoholic fatty liver disease:synopsis of current developments[J].Niger J Clin Pract,2015,18:703-712.
[3] Liang F,Kume S,Koya D.SIRT1 and insulin resistancet[J].Nat Rev Endocrinol,2009,5(7):367-373.
[4] Qiao L,Shao J.SIRT1 regulates adiponectin gene expression through Foxo1-C/enhancer-binding protein alpha transcriptional complex[J].J Biol Chem,2006,281(52):39915-39924.
[5] Lieber CS,Leo MA,Mak KM,et al.Model of nonalcoholic steatohepatitis[J].Am J Clin Nutr,2004,79:502-509.
[6] 魏尉,钟黄,黄忠.非酒精性脂肪性肝病患者血清脂联素与胰岛素表达水平及其相关性研究[J].中国医药,2014,9(5):674-676.
[7] Mazza A,Fruci B,Garinis GA,et al.The role of metformin in the management of NAFLD[J].Exp Diabetes Res,2012:716404.
[8] Li D.Metformin as an antitumor agent in cancer prevention and treatment[J].J Diabetes,2011,3:320-327.
[9] Kohjima M,Higuchi N,Kato M,et al.SREBP-1c,regulated by the insulin and AMPK signaling pathways,plays a role in nonalcoholic fatty liver disease[J].Int J Mol Med,2008,21:507-511.
[10]Pawalowska M,Markowska A.The influence of metformin in the etiology of selected cancers[J].Contemp Oncol (Pozn),2012,16:223-229.
[11]Aljada A,Mousa SA.Metformin and neoplasia:implications and indications[J].Pharmacol Ther,2012,133:108-115.
[12]桑敏,张跃辉,吴效科,等.二甲双胍的研究进展[J].中国医药,2015,10(8):1242-1244.
[13]Fullerton MD,Galic S,Marcinko K,et al.Single phosphorylation sites in Acc1 and Acc2 regulate lipid homeostasis and the insulin-sensitizing effects of metformin[J].Nat Med,2013,19:1649-1654.
[14]Shaw RJ.Metformin trims fats to restore insulin sensitivity[J].Nat Med,2013,19:1570-1572.
[15]Purushotham A,Schug TT,Xu Q.Hepatocyte-specific deletion of SIRT1 alters fatty acid metabolism and results in hepatic steatosis and inflammation[J].Cell Metab,2009,(4):327-338.
[16]Li Y,Wong K,Giles A,et al.Hepatic SIRT1 attenuates hepatic steatosis and controls energy balance in mice by inducing fibroblast growth factor 21[J].Gastroenterology,2014,146(2):539-549.
[17]Purushotham A,Schug TT,Xu Q,et al.Hepatocyte-specific deletion of SIRT1 alters fatty acid metabolism and results in hepatic steaotsis and inflammation[J].Cell Metab,2009,9(4):327-338.
Effect of metformin on mRNA expression of adiponectin and SIRT1 in liver tissue of NAFLD rats
SHEN Tian,LEI Tao*,XU Bi-lin,CHEN Lin,ZHANG Zhi-jian
(Shanghai Putuo District Center Hospital,Shanghai 200062,China)
Objective To observe the effect of metformin on mRNA expression of liver adiponectin and SIRT1 in NAFLD rats induced by high-fat diet,and discuss the possible mechanisms.Methods Totally 34 SD rats were randomly divided into two groups:normal control group (NC group,n=12,normal diet) and high fat group (HF group,n=22,high fat diet).Six rats were randomly selected from two groups respectively after being fed for 8 weeks to confirm that the NAFLD model had been established.The other NAFLD rats in HF group were divided into metformin treatment group (HF+M group,n=8) and HF1 group (n=8).Rats in HF+M group and NC1 group were respectively given intragastric administration of metformin 500 mg/(kg·d) and equal volume of saline for 8 weeks.The levels of serum alanine transferase (ALT),aspartate aminotransferase (AST),total cholesterol (TC),total glyceride (TG) and free fatty acid (FFA) were detected after 8 weeks of gavage,the fasting serum glucose and insulin (FINS) level were measured and the insulin resistance index (HOMA-IR) were calculated.The liver pathological changes were observed by HE staining,and the adiponectin,SIRT1 and AMPK-α mRNA were measured by using real time PCR.Results After 8 weeks of high-fat diet,the NAFLD rat model of HF group which was complicated with insulin resistance was established.Compared with HF1 group,the levels of serum TC,TG,FFA,FBG,ALT and AST,the liver TG content and HOMA-IR in HF+M group were lower (P<0.05),while the level of adiponectin was higher (P<0.05),and the pathological changes of rats′ liver were improved.The expression of SIRT1,adiponectin and AMPK-α mRNA in the liver in HF+M group was higher than that of HF1 group (P>0.05).Conclusion Metformin can alleviate the insulin resistance and the liver TG deposition of NAFLD rats induced by high-fat diet,the mechanism may be associated with the activation of SIRT1/AMPK signal pathway through up-grading the serum adiponectin level.
Metformin;Nonachoholic fatty liver disease (NAFLD);Adiponectin;SIRT1
2016-05-22
上海市普陀区中心医院,上海 200062
上海市卫生局青年科研项目(2013Y079);上海市中医药大学后备业务专家培养计划,上海市普陀区临床重点专科-内分泌科项目(2016PTZK05)
10.14053/j.cnki.ppcr.201612003
*通信作者
