胆维丁乳对酵母多糖所致多器官功能障碍综合征小鼠肾脏作用的研究
2017-01-05孙灿,刘凯,赵晴,孔娟*
孙 灿,刘 凯,赵 晴,孔 娟*
·论著·
胆维丁乳对酵母多糖所致多器官功能障碍综合征小鼠肾脏作用的研究
孙 灿1,刘 凯2,赵 晴1,孔 娟1*
目的 研究胆维丁乳对酵母多糖所致多器官功能障碍综合征小鼠肾脏的作用。方法 选取C57 BL/6源性的野生小鼠36只,随机分为对照组、胆维丁乳组、酵母多糖组、胆维丁乳+酵母多糖组,每组9只,室温饲养,按组别分别自由饮水或添加胆维丁乳喂养14 d。2周后,酵母多糖组、胆维丁乳+酵母多糖组腹腔注射酵母多糖混悬液,对照组、胆维丁乳组腹腔注射等量0.9%氯化钠溶液,18 h后处死各组小鼠,分别进行HE染色,观察肾脏组织病变情况;Western blot技术检测炎症因子蛋白表达;用TRizol法按照试剂说明书提取总RNA,用反转录试剂盒将RNA反转录成cDNA;采用SPSS 16.0 进行统计学处理。结果 胆维丁乳+酵母多糖组小鼠炎症因子IL-6、IL-18蛋白及mRNA的表达、尿素及肌酐水平高于酵母多糖组(P<0.05),且肾脏组织病理学改变较严重。结论 对于正常生长的小鼠,给予胆维丁乳不会加重小鼠的肾脏负担;对于已经发生急性肾损伤的小鼠,胆维丁乳的摄入会加重肾脏损伤。
胆维丁乳;酵母多糖;急性肾损伤
0 引言
多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS)是当机体受到感染、休克、创伤、胰腺炎等多种打击后发生的临床综合征,发病机制复杂,是ICU危重症患者的主要死亡原因,MODS时急性肾损伤进展快,并影响预后。MODS是多种打击诱发的临床综合征,加上治疗因素干扰,其病理过程和临床特征模拟十分困难[1-2]。因此,MODS动物模型的成功建立是MODS相关研究的关键[3-4]。
维生素D是脂溶性维生素家族中最为重要的成员,其调节钙磷代谢、治疗佝偻病的原理已为大家广泛接受[5-7]。近年来的研究发现,维生素D具有更为广泛的生理作用,其主要通过与广泛分布于各组织、器官中的维生素D受体结合而发挥调节下位基因的作用,影响人体内诸多系统的生理功能,另外,很多研究认为,维生素D参与人体内免疫反应的进程[8]。故有学者认为维生素D是一种激素。
近期的研究发现,维生素D与很多疾病,如炎症性肠病、牙周炎、非酒精性脂肪性肝病、毛细支气管炎、糖尿病、甲状腺疾病密切相关,但与肾脏疾病关系的研究很少,尤其是维生素D与急性肾损伤关系的研究未见报道。本研究选用的胆维丁乳(Cholecalciterol cholesterol emulsion,CCE),是一种临床常用制剂,每支含有维生素D330万U(8 mL),是活性维生素D3的前体,同时选取酵母多糖致小鼠MODS模型为研究载体,研究胆维丁乳对MODS小鼠肾脏的作用。
1 实验材料与方法
1.1 主要实验试剂 胆维丁乳,酵母多糖,蛋白浓度测定试剂盒,Trizol,PMSF(蛋白酶抑制剂)电泳缓冲液,转膜缓冲液,封闭液,一抗IL-6,IL-18,羊抗小鼠,羊抗兔,ECL化学发光试剂盒,异丙醇,氯仿,无水乙醇,High Capacity cDNA Reverse Transcription试剂盒,GoTag Green Master Mix试剂盒。
1.2 实验动物分组及动物模型建立 实验动物分组:选取C57 BL/6源性的野生小鼠36只,2月龄,体重20~25 g,雄性,随机分为阴性对照组(C组)、胆维丁乳对照组(CCE组)、酵母多糖实验组(Z组)、胆维丁乳+酵母多糖实验组(CCE+Z组),室温饲养,饲料为普通动物饲料,按组别分别自由饮水或添加胆维丁乳喂养14 d(CCE组及CCE+Z组应用胆维丁乳20 μL溶于200 mL纯水避光喂养)。
MODS动物模型制备:四组小鼠饲养2周后,将酵母多糖0.1 g与0.9%氯化钠溶液2 mL配制成混悬液,Z组及CCE+Z组按500 mg/kg剂量予无菌腹腔注射酵母多糖混悬液,C组及CCE组予无菌腹腔注射等量的0.9%氯化钠溶液。
1.3 组织学处理 Z组、CCE+Z组小鼠腹腔注射酵母多糖混悬液,C组、CCE组予无菌腹腔注射等量的0.9%氯化钠溶液18 h后,脱颈处死各组小鼠,立即冰上取新鲜肾脏组织,应用OCT复合物包埋,-80 ℃冰箱冷冻、切片,HE染色,200倍显微镜下观察肾脏组织病变情况。
1.4 Western blot测定IL-6、IL-18的表达水平 用组织蛋白裂解液(美国Boston Bioproduct公司)提取肾脏组织蛋白;测定蛋白浓度(美国BioRad公司的蛋白质定量试剂盒);常规电泳,转膜,封闭;4 ℃孵育一抗过夜;洗膜,室温孵育二抗1 h;滴加ECL发光液发光。IL-6为兔多克隆抗体,由美国Santa Cruz公司提供。
1.5 实时定量PCR测定小鼠肾脏组织细胞因子mRNA的表达水平 提取小鼠肾脏组织后,按照试剂说明书用TRizol法提取总RNA并将RNA反转录成cDNA(采用美国Invitrogen公司的反转录试剂盒)。使用Primer 3.0设计合成特异性引物。引物设计序列如下:
IL-6 P1:ATAGTCCTTCCTACCCCAATTTCC
P2:CTGACCACAGTGAGGAATGTCCAC
IL-18 P1:ACATCCGAAGCAACAAGC
P2:CGAAGTGAGAAGGCAACA
β-actin P1:CACTGTGCCCATCTACGA
P2:GGTCTTTACGGATGTCAACG
1.6 血清尿素氮、肌酐测定 经右心室取血,离心后取上清,检测各组小鼠血清尿素氮、肌酐含量,采用Sigma公司试剂盒,货号Catalog Number MAK055,依照说明操作。
2 实验结果
2.1 各组小鼠活动情况、进食(水)量、尿量、体温等指标比较 ①四组小鼠按组别分别自由饮水或添加胆维丁乳饲养14 d,活动情况、进食(水)量、尿量、体温、呼吸频率等指标无明显差别。②Z组及CCE+Z组小鼠从无菌腹腔注射酵母多糖混悬液至处死间隔时间为18 h,期间每2小时观察1次两组小鼠的状态。注射酵母多糖6 h后,Z组及CCE+Z组小鼠无死亡,但两组小鼠均出现了不同程度的尿量减少、嗜睡、腹泻、多动、烦躁等症状。12~18 h后,两组小鼠出现死亡,Z组死亡率为44%,CCE+Z组死亡率为33%,小鼠均出现了无尿、身体蜷缩、拒食、拒水、呼吸困难、体温下降等多器官功能衰竭的症状,且两组无明显差别。
2.2 摄入胆维丁乳后,各组小鼠肾脏形态学及组织学观察比较 ①C组、CCE组:小鼠肾脏大小正常,颜色红润,无肿胀、出血,光镜下可见肾小球、肾小管结构正常,无变性坏死,且两组细胞形态比较无明显差异(见图1A、图1B)。②Z组、CCE+Z组:小鼠肾脏均明显肿大,伴充血、水肿,且CCE+Z组小鼠肾脏体积肿大更明显,光镜下两组样本均可见大量的中性粒细胞及单核细胞浸润,肾小球体积增大,细胞数增多;CCE+Z组病变更为严重,可见毛细血管出血、坏死,毛细血管基底膜弥漫性增厚(见图1C、图1D)。

图1 不同组别小鼠病理学改变比较(HE,200×)
2.3 各组小鼠肾脏功能的比较 各组小鼠尿素氮、肌酐比较见图2。C组与CCE组尿素氮、肌酐水平比较差异无统计学意义(P>0.05);Z组2项指标高于C组、CCE组(P<0.05);CCE+Z组2项指标高于其余3组(P<0.05)。
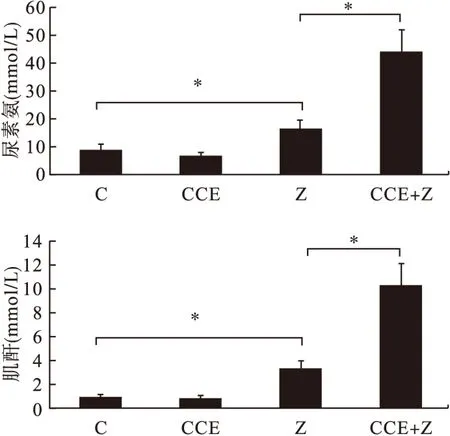
图2 各组小鼠尿素氮、肌酐水平比较(n=5)
2.4 各组小鼠肾脏组织炎症因子蛋白及mRNA水平表达比较 由图3、图4可见,C组、CCE组IL-6、IL-18的蛋白及mRNA表达水平比较差异无统计学意义(P>0.05);Z组蛋白及mRNA表达水平高于C组及CCE组,CCE+Z组高于其余3组,差异均有统计学意义(P<0.05)。
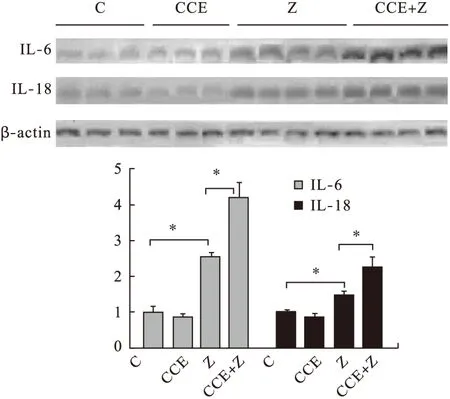
图3 各组小鼠肾脏组织中IL-6、IL-18比较(n=5)
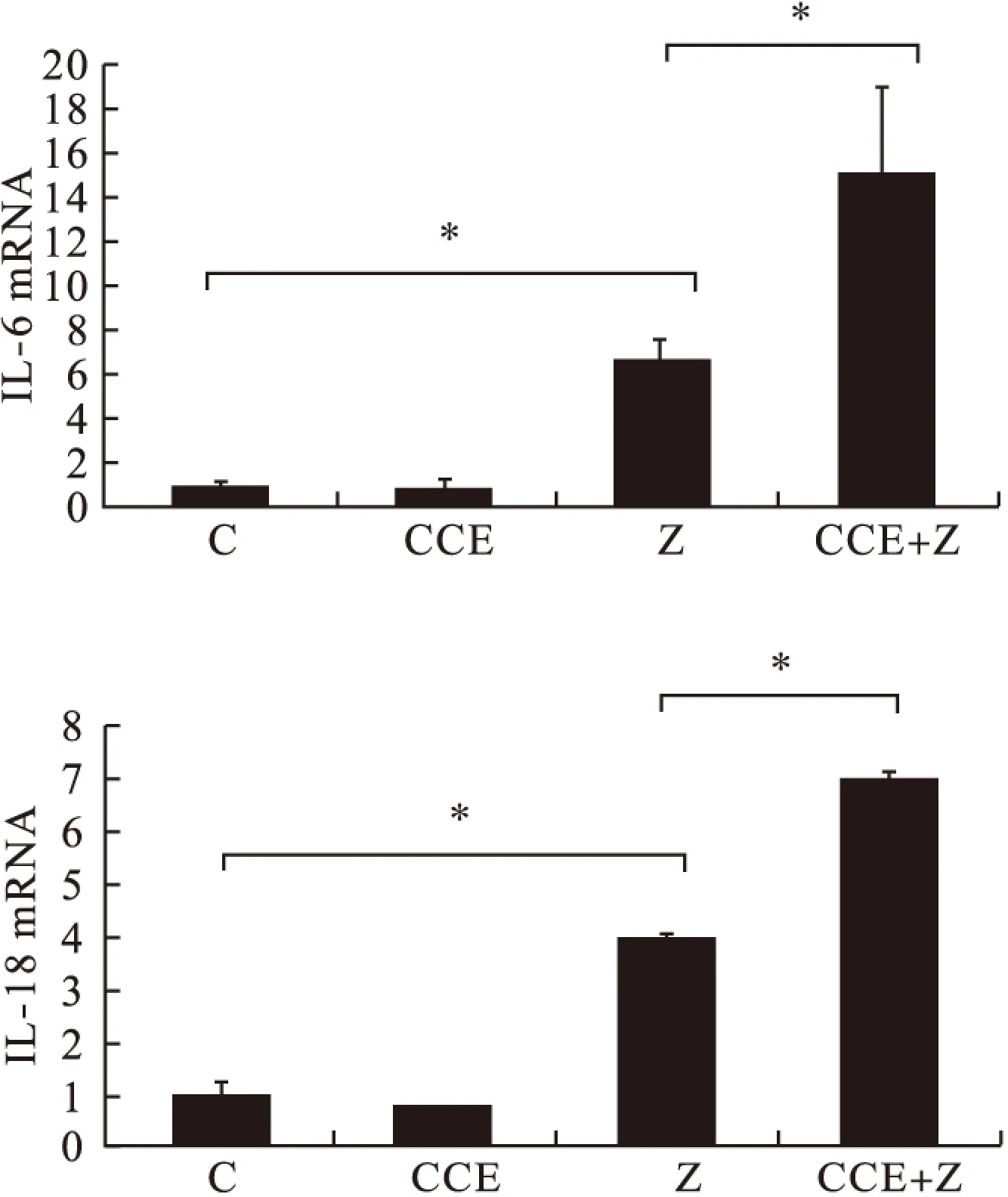
图4 各组小鼠IL-6 mRNA、IL-18 mRNA表达水平比较(n=5)
3 讨论
目前研究表明,采用酵母多糖引发多器官功能障碍综合征MODS动物模型能较好地模拟临床MODS的病理生理过程,在MODS的相关研究中已广泛应用。在MODS动物模型急性肾损伤中,酵母多糖启动巨噬细胞中炎症信号是与小鼠体内Toll 样受体(TLR2/TLR6 异质二聚体)结合后发生的,并进而触发了转录因子蛋白NF-κB的活化[9-12],从而导致促炎因子TNF-α、IL-18、IL-6、AKT1、P21、P38、N19、FL129 等的基因表达[13]。异质二聚体受体激活NF-κB后,小鼠机体内产生大量的炎症反应细胞,如T淋巴细胞及中性粒细胞,从而导致急性肾损伤。
IL-6是由成纤维细胞及活化后的T淋巴细胞产生的炎症因子,能促使前体B细胞向产生抗体的细胞转化;同时与集落刺激因子协调作用,增强NK细胞的裂解功能[14-16],从而加重小鼠体内的炎症反应。IL-18是IL-1家族成员之一,可参与诱导合成γ干扰素等[17]。最重要的作用是可以刺激T淋巴细胞的增殖,参与细胞因子的生成等,与其他炎症因子共同作用[18-21]。其在小鼠体内主要由肾脏实质细胞产生,存在于肾小球的系膜细胞、肾小管上皮细胞[22-25]。
动物研究表明,小鼠急性肾损伤时,IL-6、IL-18等炎症因子在损伤发生6 h后明显增高,12~18 h达到峰值[26]。本研究中,小鼠注射酵母多糖后逐渐出现急性中毒反应,注射后12~18 h小鼠的死亡率最高。CCE+Z组的肾脏损伤程度较其他组严重,病理切片可见大量中性粒细胞及单核细胞浸润,肾小球体积增大,细胞数增多,毛细血管坏死、出血,毛细血管基底膜弥漫性增厚;另外,CCE+Z组小鼠肾脏组织中IL-6、IL-18的蛋白、mRNA表达水平,以及尿素、肌酐水平均高于其余3组,提示该组小鼠肾脏损伤最严重;IL-6、IL-18是导致小鼠肾脏急性损伤的炎症因子。而Z组各项指标均高于C组、CCE组,C组、CCE组指标无明显差异。
由上述结果可知,对于正常生长的小鼠,给予胆维丁乳不会加重小鼠的肾脏负担;但是对于已经发生急性肾损伤的小鼠,摄入胆维丁乳会明显加重肾脏损伤。这与既往研究中维生素D对肝脏等器官有保护作用,维生素D可以调节免疫系统,减轻炎症反应的结论相悖。可能的原因如下:①胆维丁乳为活性维生素D的前体,要发挥其生物学活性,必须在肝脏和肾脏经历2次羟化过程,第2次羟化在肾内进行,进而加重肾脏负担;②胆维丁乳摄入会引起高钙血症等离子紊乱,增加肾脏负担,引起肾衰,加重MODS。关于使用活性维生素D是否会出现同样的结果,有待进一步研究。
本研究结果表明,在全身炎症反应时,胆维丁乳会加重肾脏损伤,提示对于急慢性肾脏疾病患者、肾脏功能发育不健全的婴幼儿患者,使用胆维丁乳时须谨慎,以防加重肾损伤或损伤肾脏功能。
[1] Nunes TFG,Danese S,Sans M.Familial aggregation in inflammatory bowel disease: is it gens or environment[J].World J Gastroenterol,2011,17(22):2715-2722.
[2] Wong KE,Kong J,Zhang W,et al.Targeted expression of human vitamin D receptor in adipocytes decreases energy expenditure and induces obesity in mice[J].J Biol Chem,2011,286(39):33804-33810.
[3] Kong J,Zhang Z,Musch MW,et al.Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier[J].Am J Physiol Gastrointest Liver Physiol,2008,294(1):G208-216.
[4] Kong J,Kim GH,Wei M,et al.Therapeutic effects of vitamin D analogs on cardiac hypertrophy in spontaneously hypertensive rats[J].Am J Pathol,2010,177(2):622-631.
[5] Kong J,Li YC.Effect of ANG II type I receptor antagonist and ACE inhibitor on vitamin D receptor-null mice[J].Am J Physiol Regul Integr Comp Physiol,2003,285(1):R255-R261.
[6] Charalampopoulos A,Charalabopoulos A,Batistatou A,et al.Parathormone and 1,25(OH)2D3but not 25(OH)D3serum levels,in an inverse correlation,reveal an association with advanced stages of colorectal cancer[J].Clin Exp Med,2010,10(1):69-72.
[7] Kong J,Zhang Z,Li D,et al.Loss of vitamin D receptor produces polyuria by increasing thirst[J].J Am Soc Nephrol,2008,19(2):2396-2405.
[8] Sun J,Kong J,Duan Y,et al.Increased NF-kappa B activity in fibroblasts lacking the vitamin D receptor[J].Am J Physiol Endocrinol Metab,2006,291(2):E315-E322.
[9] Thornton KA,Marín C,Mora-Plazas M,et al.Vitamin D deficiency associated with increased incidence of gastrointestinal and ear infectionsin school-age children[J].Pediatr Infect Dis J,2013,32(6):585-593.
[10]Lee JE,Li H,Chan AT,et al.Circulating levels of vitamin D and colon and rectal cancer:the Physicians′ Health Study and a meta-analysis of prospective studies[J].Cancer Prev Res,2011,4(5):735-743.
[11]Tuohimaa P,Pukkala E,Scélo G,et al.Does solar exposure,as indicated by the non-melanoma skin cancers,protect from solid cancers:Vitamin D as a possible explanation[J].Eur J Cancer,2007,43(11):1701-1712.
[12]Muir P,McCarthy J,Radtke CL,et al.Role of endochondral ossification of articular cartilage and functional adaptation of the subchondral plate in the development of fatigue microcracking of joints[J].Bone,2006,38(3):342-349.
[13]Reddy SV,Ramesh,Bhatia E.Double blind randomized control study of intramuscular vitamin D3 supplementation in tropical calcific pancreatitis[J].Calcif Tissue Int,2013,93(1):48-54.
[14]Parikh CR,Mishra J,Thiessen-Philbrook H,et al.Urinary IL-18 is an early predictive biomarker of acute kidney injury after cardiac surgery [J].Kidney Int,2006,70(1):199-203.
[16]李冰,潘志铣,刘素雁,等.甘油致BALB/C 小鼠急性肾损伤后肾脏观察[J].国际免疫学杂志,2011,34(4):318-322.
[17]Muran PJ.Mercury elimination with oral DMPS,DMSA,vitamin C,and glutathione:an observational clinical review.[J].Altern Ther Health Med,2006,12(3):70-75.
[18]Blanck S,Aberra F.Vitamin D deficiency is associated with ulcerative colitis disease activity[J].Dig Dis Sci,2013,58(6):1698-1702.
[19]Cantorna MT.Vitamin D and its role in immunology:multiple sclerosis,and inflammatory bowel disease[J].Prog Biophys Mol Biol,2006,92(1):60-64.
[20]Marwick C.Trials reveal no benefit,possible harm of beta carotene and vitamin A for lung cancer prevention[J].JAMA,1996,275(6):422-423.
[21]Kamiji M Mayumi,Oliveira R Brandt.Effect of vitamin C administration on gastric colonization by Helicobacter pylori[J].Arq Gastroenterol,2005,42(3):167-172.
[22]Yu R,J Sun J,Zheng Z,et al.Association between vitamin D level and viral load or fibrosis stage in chronic hepatitis B patients from Southern China[J].J Gastroenterol Hepatol,2015,30(3):566-574.
[23]廖长秀,汪晖,彭仁琇,等.阿魏酸钠对甘油致小鼠肾脏氧化性损伤的拮抗效应[J].药学学报,2010,38(12):900-903.
[24]Benchimol EI,Ward LM,Gallagher JC,et al.Effect of calcium and vitamin D supplementation on bone mineral density in children with inflammatory bowel disease[J].J Pediatr Gastroenterol Nutr,2007,45(5):538-545.
[25]Selvaraj P,Prabhu Anand S,Harishankar M,et al.1,25 dihydroxy vitamin D3 level and expression of vitamin D receptor and cathelicidin in pulmonary tuberculosis[J].J Clin Immunol,2009,(4):678-691.
[26]陆麒羽,周裕洋,王俊波,等.酵母多糖致全身炎症反应综合征大鼠模型的制备[J].浙江大学学报(医学版),2011,40:641-646.
Effect of cholecalciterol cholesterol emulsion on kidney of mice with zymosan-induced multiple organ dysfunction syndrome
SUN Can1,LIU Kai2,ZHAO Qing1,KONG Juan1*
(1.Department of Clinical Nutrition,Shengjing Hospital of China Medical University,Shenyang 110004,China;2.Department of Pediatrics,Liaohe Oilfield General Hospital,Panjin 124010,China)
Objective To study the effect of cholecalciterol cholesterol emulsion(CCE)on kidney of mice with zymosan-induced multiple organ dysfunction syndrome.Methods Thirty six C57 BL/6 source wild type mice were randomly divided into 4 groups:control group,CCE group,zymosan group and CCE+Zymosan group,9 mice in each group.All the mice were fed with normal animal food and water or water+CCE according to the different groups at room temperature.Mice in CCE+Zymosan group and Zymosan group were given intraperitoneal injection of zymosan(500 mg/kg)after 2 weeks,while the mice in control group and CCE group were given intraperitoneal injection of same amount of 0.9% sodium chloride solution.After 18 h,all the mice were put to death.The renal histopathological changes were observed by HE staining;the protein expression of inflammatory indicators was detected by Western blotting;the total RNA was extracted with TRizol according to the reagent instruction and reversely transcribed into cDNA;SPSS 16.0 statistical software was used.Results The protein and mRNA expression of IL-6 and IL-18 and levels of urea and creatinine in CCE+Zymosan group was higher than those of Zymosan group(P<0.05),and the renal histopathological changes were more serious.Conclusion CCE do not increase the burden on the kidneys of normal growth mice,but it can aggravate the renal damage of mice with acute kidney injury.
Cholecalciterol cholesterol emulsion;Zymosan;Acute renal injury
2016-06-30
1.中国医科大学附属盛京医院临床营养科,沈阳 110004;2.辽河油田总医院儿科一病区,辽宁 盘锦 124010
国家自然基金课题(30971401、81170065)
10.14053/j.cnki.ppcr.201612001
*通信作者
