槲皮素作为饲料添加剂在体内和体外致突变性潜力的评价
2017-01-05王盛楠肖风林姚佳颖杨家新尹文哲
■王盛楠 周 博 肖风林 王 密 姚佳颖 杨家新 李 垚* 尹文哲
(1.东北农业大学动物营养研究所,黑龙江哈尔滨 150030;2.哈尔滨医科大学第二附属医院,黑龙江哈尔滨 150086)
槲皮素(3,3',4',5,7-五羟基黄酮)是一种广泛存在于植物中的物质[1-3],在抗氧化、抗癌、抗炎和免疫调节等方面具有独特的生物学和药理学功能[4-9]。虽然其作用机制尚未明确,但大量研究表明,槲皮素的生理功能与其抗氧化的特性有关[10-12]。槲皮素作为一种天然黄酮类物质,其有望替代抗生素在畜禽饲料中使用,以提高畜产品安全,维持畜牧业可持续发展。然而,槲皮素作为饲料添加剂在动物生产中使用的安全性评价尚未明确。
本课题组前期研究表明,槲皮素可提高蛋鸡产蛋率和蛋黄卵磷脂含量,降低蛋黄胆固醇含量[13];前期的急性毒性和慢性毒性的试验发现,槲皮素的半数致死量大于10 mg/(kg·BW),表明槲皮素属于无毒类物质。在饲粮中添加槲皮素对大鼠和蛋鸡分别进行30 d和56 d的饲养试验结果表明,槲皮素对大鼠和蛋鸡均未引起慢性毒性[14]。因此,本试验通过对鼠伤寒沙门氏菌突变株(TA97、TA98、TA100和TA102)和小鼠进行致突变性检测(Ames)、骨髓微核以及精子畸形试验,以进一步评估槲皮素作为饲料添加剂在体内体外的致突变性。
1 材料和方法
1.1 试验受试物
槲皮素购自Sigma-Aldrich公司,纯度为98%(HPLC)。
1.2 试验菌株
鼠伤寒沙门氏菌突变型菌株TA97、TA98、TA100和TA102,由黑龙江省疾病预防控制中心提供。
1.3 试验动物
昆明种小鼠,由吉林大学白求恩医学院动物实验中心提供。
1.4 测定项目及方法
1.4.1 Ames试验
选取鼠伤寒沙门氏菌突变菌株TA97、TA98、TA100和TA102作为试验菌株,试验分为7组,分别是5个槲皮素试验组以及阳性和阴性对照组。试验组槲皮素的剂量为每皿8、40、200、1 000、5 000 μg,在肝微粒体多氯联苯诱导剂(9 000×g Supernatant,S9)不干预的情况下,阳性对照组分别添加50.0、1.5、10.0 μg和50.0 μg的敌克松和叠氮钠;在S9干预的情况下,阳性对照组分别添加50.0、1.5、10.0 μg和50.0 μg的2-乙酰氨基芴和1,8-二羟蒽醌。阴性对照组添加每皿0.1 ml蒸馏水。试验分别在肝微粒体多氯联苯诱导剂(9 000×g Supernatant,S9)干预和不干预的条件下进行,每个剂量设置3个平皿,每个试验重复2次。记录每皿回复突变菌落数。
1.4.2 骨髓微核试验
将50只昆明种小鼠(6~8周龄,体重25~35 g,25只雄性和25只雌性)随机分为5组,每组10个重复。槲皮素试验组分别灌胃给药500、5 000 mg/(kg·BW)和10 000 mg/(kg·BW),阳性对照组腹腔注射40 mg/(kg·BW)环磷酰胺,阴性对照组灌胃给药等体积0.5%羧甲基纤维素。试验共给药2次,间隔24 h,第2次给药后6 h处死小鼠。取胸骨制片、镜检。计算小鼠嗜多染红细胞(Poly⁃chromatic erythrocyte,PCE)、成熟红细胞(Red blood cell,RBC)数量及PCE/RBC比值。每只小鼠计数1 000个PCE,骨髓微核率(‰)=微核细胞数/检查细胞总数×1 000。
1.4.3 精子畸形试验
将50只昆明种雄性小鼠(6~8周龄,体重25~35 g)随机分为5组,每组10个重复。槲皮素试验组分别灌胃给药500、5 000 mg/(kg·BW)和10 000 mg/(kg·BW),阳性对照组腹腔注射40 mg/(kg·BW)环磷酰胺,阴性对照组灌胃给药0.5%羧甲基纤维素(槲皮素试验组、阳性对照组和阴性对照组的给药体积均相同)。试验每日给药1次,连续5 d,在第1次给药后35 d处死小鼠。取精子经常规苏木精-伊红(Hematoxylinand Eeosinstaining,HE)染色法制成切片,每张切片在OLYMPUS CH20光学显微镜下镜检1 000个完整精子,计算精子畸形率。
1.5 数据的统计分析
采用SPSS18.0进行统计分析,结果以“平均数±标准差”表示;其中Ames和骨髓微核试验结果采用卡方检测方法分析;精子畸形试验结果采用One-way ANOVA分析和Duncan's法进行多重比较。以P<0.05作为差异显著性判断标准。
2 结果
2.1 Ames试验(见表1~表4)

表1 槲皮素对鼠伤寒沙门氏菌突变菌株回复突变菌落数的影响(第1次Ames试验,不加S9,个/皿)
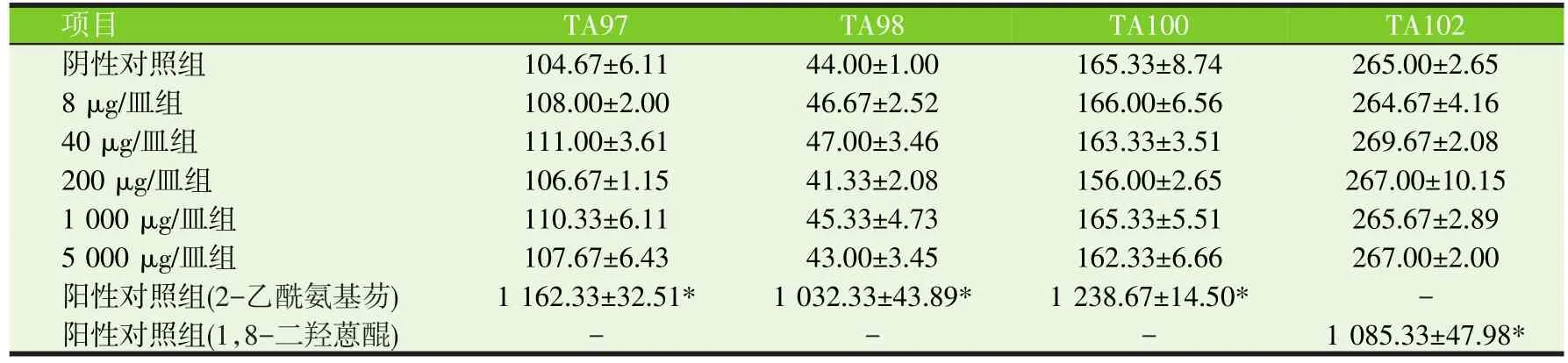
表2 槲皮素对鼠伤寒沙门氏菌突变菌株回复突变菌落数的影响(第1次Ames试验,加S9,个/皿)

表3 槲皮素对鼠伤寒沙门氏菌突变菌株回复突变菌落数的影响(第2次Ames试验,不加S9,个/皿)
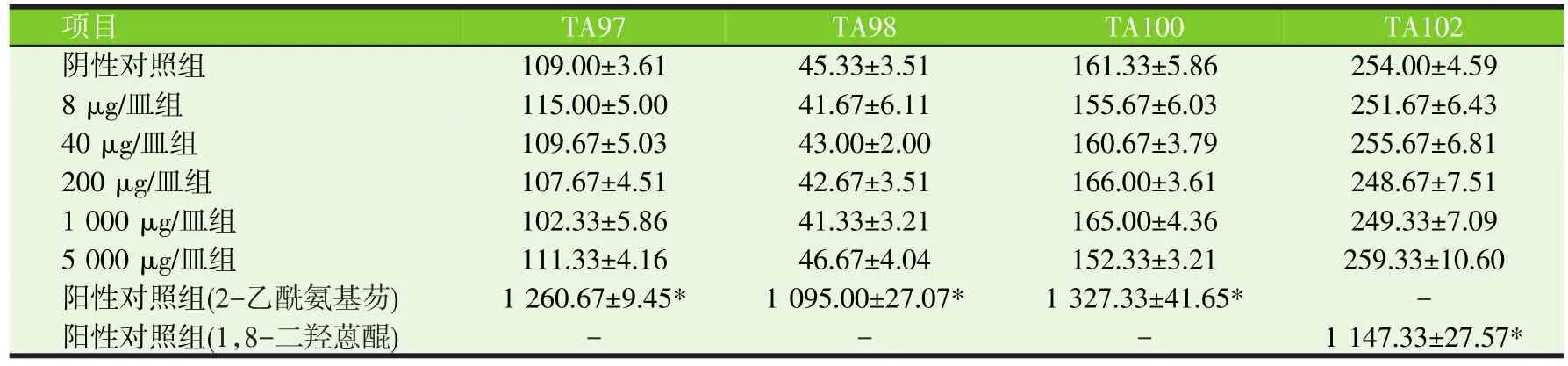
表4 槲皮素对鼠伤寒沙门氏菌突变菌株回复突变菌落数的影响(第2次Ames试验,加S9,个/皿)
由表1、2、3和表4可见,与阴性对照相比,在加S9和不加S9的情况下,槲皮素试验组鼠伤寒沙门氏菌突变菌株回复突变菌落数无显著差异(P>0.05),但阳性对照组鼠伤寒沙门氏菌突变菌株回复突变菌落数极显著增加(P<0.01)。
2.2 骨髓微核试验(见表5)

表5 槲皮素对昆明种小鼠PCE/RBC值和骨髓微核率的影响
由表5可见,与阴性对照组比,槲皮素试验组小鼠PCE/RBC和骨髓微核率无显著差异(P>0.05);但与各试验组相比,阳性对照组小鼠PCE/RBC和骨髓微核率极显著增加(P<0.01)。
2.3 精子异常检测(见表6)
由表6可见,与阴性对照相比,每组小鼠均存在一定数量的畸形精子,但槲皮素试验组小鼠精子畸形率无显著差异(P>0.05);阳性对照小鼠精子畸形率极显著增加(P<0.01)。
3 讨论

表6 槲皮素对昆明种小鼠精子畸形率的影响
槲皮素是一种常见的黄酮类化合物,广泛存在于天然植物内[1-3]。已有试验证明,槲皮素是一种强抗氧化剂[4-9],且同其他黄酮类化合物相同,都具有清除自由基的功能[15-16]。有大量数据表明,槲皮素在体外具有致突变性,但对这一结果的安全评估系统尚未建立,因此,在这种情况下,建立槲皮素作为饲料添加剂而不是治疗类药物的安全性评价已成为一个重要的研究领域。
为了评估槲皮素的致突变能力,本试验在体外和体内两种试验条件下,对槲皮素的致突变性进行测试。Ames试验又称沙门氏菌回复突变试验,由于鼠伤寒沙门氏菌是一种组氨酸营养缺陷型菌株,其在正常培养的情况下,会产生极少数的自发回复突变,但在外界诱变剂作用后,会有大量细菌发生回复突变,故可用来检测槲皮素的体外致突变性。本试验结果表明,与阴性对照组相比,槲皮素试验组鼠伤寒沙门氏菌突变菌株(TA97、TA98、TA100和TA102)回复突变菌落数均无显著影响。本试验采用骨髓微核和精子畸形试验检测槲皮素的体内致突变性,两试验均选取环磷酰胺作为阳性对照,环磷酰胺是一种广谱的抗肿瘤药物,但临床试验表明,环磷酰胺具有致突变性。本试验结果表明,与阴性对照组相比,槲皮素试验组小鼠PCE/RBC、骨髓微核率以及精子畸形数均无显著影响。在大多数对鼠伤寒沙门氏菌标准菌株的体外试验中,在不存在代谢活化的情况下,槲皮素对鼠伤寒沙门氏菌表现为致突变性[17-24],同样在对大肠杆菌的试验中,在存在或不存在代谢活化的情况下,有研究表明槲皮素可以诱导补氧系统(Supplemental oxygen system,SOS)活性、反向突变以及DNA单链断裂[18-19,23-25]。通过对这些细菌进行姐妹染色单体互换、染色体畸变、非常规DNA合成以及微核形成等试验发现,槲皮素对包括酵母和哺乳动物细胞在内的真核细胞均具有致突变性和遗传毒性[20,26-29],与以上研究结果相反的是,本试验在经过体外鼠伤寒沙门氏菌的鉴定后,用槲皮素对小鼠进行的体内试验并没有显示出任何的致突变性。此外,在体内试验,采用槲皮素对小鼠和大鼠进行单次和多次灌胃后,进行如姐妹染色单体互换、染色体畸变、非常规DNA合成以及微核形成等体外试验测试的指标发现,所有的结果均一致表明,尽管槲皮素在体外试验中变现为具有致突变的能力,但在体内槲皮素不产生任何突变物质或遗传毒性[30-32]。包括由美国国家毒理学计划(National Toxi⁃cology Program,NTP)进行的为期2年的啮齿动物的致癌性生物测定在内的大量毒理学研究进一步证实了槲皮素在体内无致突变性和遗传毒性,并且研究结果表明,槲皮素可作为人类口服药物,其作用过程没有出现任何与安全性相关的不利证据[20,23,33]。尽管NTP最初对雄性大鼠研究得出了一些与增加肾脏肿瘤发生率有关的致癌性证据[20],但随后进一步研究表明,雄性大鼠肾脏肿瘤率的提高是由慢性肾病恶化介导的,而不是槲皮素的直接作用[32]。
本试验结果与以上体内试验结果均相同,提示槲皮素在体内体外试验中,均不表现出致突变性。此外,本课题组前期研究表明,槲皮素对小鼠、大鼠和蛋鸡均没有表现出急性毒性、慢性毒性或亚慢性毒性[14]。
4 结论
槲皮素在小鼠体内和体外均未显示出致突变性。并且结合本课题组前期研究槲皮素的急性毒性和亚慢性毒性的试验数据表明,在一定剂量范围内,槲皮素可作为一种安全的饲料添加剂。
