单分散型艾塞那肽缓释微球的制备及体外评价
2017-01-05杨华,王倩,林霞,唐星*
杨 华,王 倩,林 霞,唐 星*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016; 2. 江南大学 药学院,江苏 无锡 214122)
单分散型艾塞那肽缓释微球的制备及体外评价
杨 华1,王 倩1,林 霞2,唐 星1*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016; 2. 江南大学 药学院,江苏 无锡 214122)
目的制备不同粒径单分散型载艾塞那肽聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid, PLGA)微球,考察粒径对包封率及体外释放的影响。方法采用快速膜乳化法结合复乳法制备微球,以10 μm SPG膜为例,单因素筛选优化制备条件;扫描电子显微镜观察微球形态,通过测定微球的粒径分布、包封率、体外释放等指标对微球进行评价和比较。结果优化条件下制备了粒径分别为1.917、3.869 和18.92 μm的单分散型微球,结果显示粒径越小,包封率越低,后期释放越缓慢。结论采用快速膜乳化法可制备出不同粒径的单分散型微球;不同粒径微球的包封率、释放行为差异较大,较大粒径(约20 μm)的微球包封率较高,后期稳定持续释放,适合研制成长效缓释微球产品。
药剂学;单分散型微球;快速膜乳化法;艾塞那肽;包封率;体外释放
以PLGA为骨架材料制备载蛋白、多肽类药物缓释微球,是近30多年来药剂学领域研究的重点之一,其中亮丙瑞林微球、重组人生长激素微球和艾塞那肽微球制剂BYDUREON®已获批准上市[1-2]。艾塞那肽是首个获准上市的肠促胰岛素类似物药物,降糖机制包括抑制胰高血糖素的不适当分泌、葡萄糖依赖的促胰岛素分泌、延缓胃排空、减少食物摄入以及保护 β细胞功能等[3],其微球制剂BYDUREON®已成功上市,但其制剂本身存在一些问题,如相分离法制备工艺较繁琐、有机溶剂去除困难及微球中药物的释放存在平台期等。作者采用快速膜乳化法结合复乳法制备不同粒径的单分散型载艾塞那肽PLGA缓释微球,通过单因素考察优化制备条件,并对不同粒径的载药微球进行体外评价和比较,对调整药物的释放行为具有一定的指导意义。
1 仪器与材料
IKA®T18 高速分散匀质机(德国IKA 公司),膜乳化器、Shirasu porous glass (SPG)膜(5.2 µm、10 μm和 40.1 µm)(日本SPG TECHNOLOGY CO., Ltd),EYELAN-1001 旋转蒸发仪(日本Tokyo Rikakikai公司),VirTis advantage ES-53冷冻干燥机(美国SP Industries, Inc.),ZHWY-110X30 往复式水浴恒温摇床(上海智诚分析仪器制造有限公司),KDC-28 低速离心机(科大创新股份有限公司中佳分公司),HC-3018高速冷冻离心机(安徽中科中佳科学仪器有限公司),HITACHI 高效液相色谱仪(日本日立公司),IKA Vortex Genius 3旋涡混合器(德国IKA公司),ATL-124分析天平(赛多利斯科学仪器有限公司),BT-9300S激光粒度测定仪(丹东百特仪器有限公司)。
艾塞那肽原料药(exenatide,陕西天森药物研究开发有限公司,批号 20131121),聚乳酸-羟基乙酸共聚物(PLGA,RESOMER®RG503H,体积比50∶50,赢创特种化学(上海)有限公司),聚乙烯醇(PVA,水解度87%~89%,Mw=72.6~81.4 ku,日本可乐丽株式会社),乙腈(色谱纯,天津康科德科技有限公司),其他试剂(分析纯,市售)。
2 方法
2.1 快速膜乳化法制备PLGA空白微球和艾塞那肽载药微球
采用快速膜乳化技术结合W1/O/W2复乳溶剂挥发法制备PLGA空白微球和艾塞那肽载药微球。
空白PLGA微球的制备:量取纯化水0.4 mL作为内水相W1,称取PLGA 400 mg溶于4 mL二氯甲烷(PLGA的质量浓度为100 g·L-1)作为有机相O,冰浴条件剪切搅拌下,将内水相缓慢注入到有机相中,1.2×104r·min-1均质匀化2 min 即得W1/O初乳。然后将初乳快速倒入15 mL外水相(10 g·L-1PVA,10 g·L-1NaCl)中,冰浴条件下剪切搅拌,得W1/O/W2预复乳。迅速将预复乳转移至膜乳化装置中,以一定的氮气压力通过SPG 膜(预先用外水相充分浸润),将所得乳液分散至一定体积NaCl质量浓度为10 g·L-1的水溶液中,40 ℃旋转蒸发15 min,完全去除二氯甲烷使微球固化,3 000 r·min-1离心10 min收集微球,蒸馏水洗涤3 次,冷冻干燥即得PLGA空白微球。
载艾塞那肽PLGA微球的制备:载药微球与PLGA空白微球的制备过程基本一致,不同的是载药微球的内水相为质量浓度为50 g·L-1艾塞那肽的水溶液0.4 mL,其余的制备条件与步骤均与PLGA空白微球一致。
2.2 微球粒径及粒度分布的测定
取适量冻干后微球分散至一定体积的蒸馏水中,采用激光粒度仪测定微球的粒径及其分布。具体步骤如下:设置测定参数,样品折射率实部1.52,虚部0.01,避光率为10%,将微球样品均匀分散至蒸馏水中后,滴加到粒度测定仪的样品槽中,通过进样系统带动样品吸入激光通道中,共测定3次,由测试软件自动拟合给定粒径d50及粒径分布系数Span值。Span值越小的样品均一性越好。
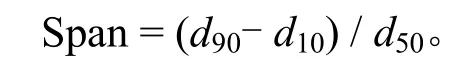
式中,d10、d50和d90分别为微球体积累积达10%、50%和90%时的粒径。
2.3 微球表面形态观察
将双面导电胶带粘附于铜锭上,取适量微球适量均匀涂布在导电胶上,喷金后进行扫描电子显微镜观察。
2.4 包封率及载药量的测定
称取艾塞那肽载药微球约10 mg,加入乙腈1 mL,涡旋震荡30 min,使PLGA 充分溶解,1.2×104r·min-1离心10 min,移除乙腈,40 ℃吹干残余乙腈,残余物加入适量纯化水,涡旋震荡30 min,充分溶解,1.2×104r·min-1离心10 min,取上清液作为样品溶液,采用HPLC法测定艾塞那肽的药物浓度。微球的实际载药量(drug loading efficiency,wLE)和包封率(entrapment efficiency, wEE)按下式计算:
实际载药量(wLE)= 微球中艾塞那肽含量/微球总质量×100%;包封率(wEE)=实际载药量 /理论载药量×100%
2.5 微球体外释放的测定
称取艾塞那肽载药微球约10 mg置于样品管中,加入pH值7.4的磷酸盐缓冲液1 mL,其中含有质量浓度为0.2 g·L-1的叠氮钠(抑菌剂)和0.2 g·L-1的吐温80(微球聚集抑制剂)。样品管置于37 ℃水浴恒温摇床中,100 r·min-1振摇,1.2×104r·min-1离心分离10 min,取出全部上清液,再重新加入新鲜释放介质1 mL。采用HPLC法测定上清液中的药物含量。
3 结果和讨论
3.1 快速膜乳化法制备空白PLGA微球的处方工艺优化
与常规膜乳化不同,快速膜乳化速度很快,液滴受力主要涉及过膜压力,而常规膜乳化过程中液滴主要受到 4种力的平衡[4]。快速膜乳化法,首先通过常规乳化方式如机械搅拌、超声粉碎、均质等方法制备预乳液,然后将预乳液快速倒入膜乳化装置的储存罐中,在一定的氮气压力下迅速通过SPG膜形成最终的乳滴,旨在制备粒径较均一、可控、批间重现性好的微球。快速膜乳化过程中,外水相中PVA浓度、有机相与外水相体积比、过膜压力和过膜次数是影响乳滴大小和均一性的主要因素,因此,作者以10 μm SPG膜为例,对以上因素进行单因素筛选,优化空白PLGA微球的制备条件。
3.1.1 外水相中PVA质量浓度对微球粒径分布的影响
研究考察了外水相中PVA质量浓度分别为2.5、5、10和30 g·L-1时对微球粒径的影响,其粒径分布图见图1。
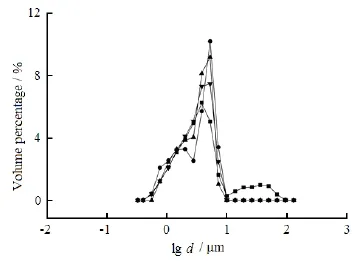
Fig. 1 The effects of PVA concentrations on the particle distributions of blank PLGA microspheres图1 PVA质量浓度对空白PLGA微球粒径分布的影响
所得微球的粒径d50分别为3.592、4.057、3.717和3.495 μm,分布系数Span分别为5.525、1.364、1.271和1.44。结果表明,随着外水相中PVA质量浓度的增加,微球的粒径变小、粒径均一性变好。外水相中足够的稳定剂,不仅可以有效降低油水界面间张力,而且还可以有效防止乳滴间的凝聚,提高乳液稳定性,从而保证微球粒径的均一性[5]。研究中采用含2.5 g·L-1PVA的外水相制备微球时,粒径分布图显示有大于SPG膜孔径的粒子存在,原因是过低质量浓度的PVA对乳滴的稳定作用较差,导致膜乳化过程后乳滴合并,造成微球粒径分布不均且成球性较差。然而,当PVA质量浓度过高时,会使小粒径微球的比例增加,影响粒径的均一性,同时PVA质量浓度过大时,预复乳的制备及膜乳化过程中会产生较多的泡沫,导致微球的洗涤困难,因此最终选择外水相中PVA质量浓度为10 g·L-1。
3.1.2 有机相与外水相的体积比对微球粒径分布的影响
快速膜乳化过程中,有机相与外水相的体积比与预复乳液滴的黏度密切相关,因而会影响液滴通过膜孔时的形变程度,从而影响乳滴的破碎程度。固定有机相体积为4 mL,研究考察不同有机相与外水相的体积比对微球粒径均一性的影响,结果见表1。
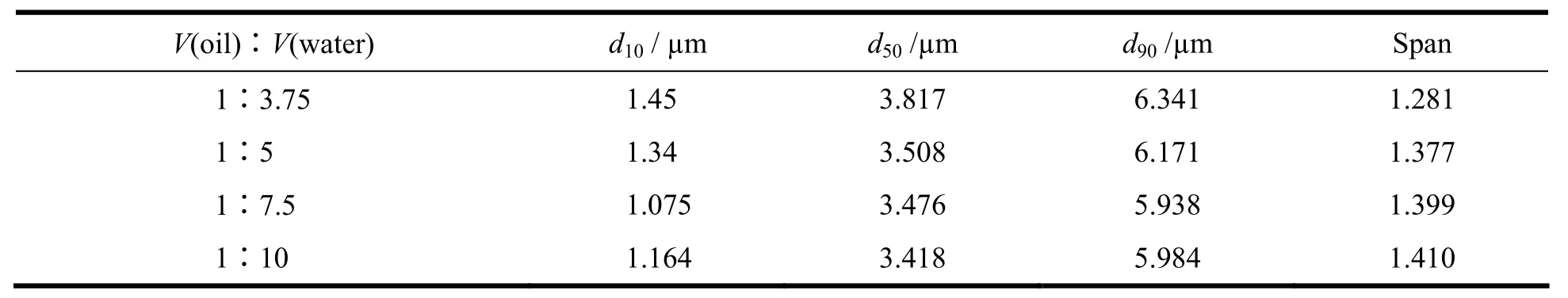
Table 1 The particle distributions of blank PLGA microspheres prepared with different volume ratios of organic solvent to water表1 不同有机相与外水相的体积比对空白PLGA微球粒径分布的影响
结果表明,不同比例有机相与外水相下制备的微球粒径d50约为3.5 µm,微球的粒径随着外水相比例的增大而稍有降低,同时Span值有所增大。说明微球的均一性变差,主要原因是外水相比例的增加使乳滴间碰撞的机会变少,同时乳液体系的乳化能力提升,更倾向于生成小粒径的微球,从而使整体的分散系数变大。因此,有机相与外水相的最优体积比为1∶3.75。
3.1.3 不同过膜压力对空白PLGA微球粒径分布的影响
分别在60、90和120 kPa的过膜压力下制备空白PLGA微球,考察过膜压力对微球粒径的影响,结果见图2。
所得的微球的粒径d50分别为3.817、3.63和3.19 µm,分散系数分别为1.281、1.329和1.282。结果表明,过膜压力对微球的粒径均一性影响不大,但对粒径d50的大小有一定的影响,随着过膜压力的增大d50减小,因为较大的过膜压力下,乳滴与膜孔壁间的剪切力增大,乳滴易破碎成更小的乳滴。当过膜压力过大时,过膜过程中产生较多的泡沫,影响过膜效率和产品收率,因此选用60 kPa的过膜压力来制备空白PLGA微球。
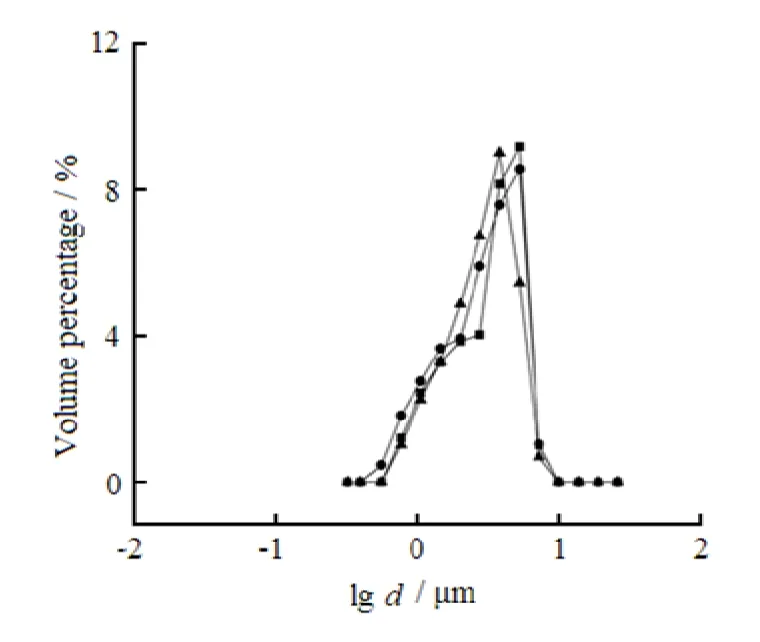
Fig. 2 The effect of transmembrane pressure (ptm) on particle size distribution of blank PLGA microspheres图2 不同过膜压力所制PLGA空白微球的粒径分布
3.1.4 不同膜乳化次数对空白PLGA微球粒径分布的影响
选择60 kPa作为跨膜压力,考察过膜次数对微球粒径分布的影响,扫描电镜照片及粒度分布见图3。膜乳化次数由1次增加到2次时,微球粒径由3.817 μm减小到3.027 μm,分散系数Span由1.281减小到1.078,增加到3次时,粒径和分散系数无明显变化。但当循环次数增加时,微球收率明显下降,原因可能是循环过膜后,部分PLGA固化沉积于SPG膜孔道中,有效孔径减小,导致收率降低。因此,最终将预复乳过膜1次以制备单分散型PLGA微球。
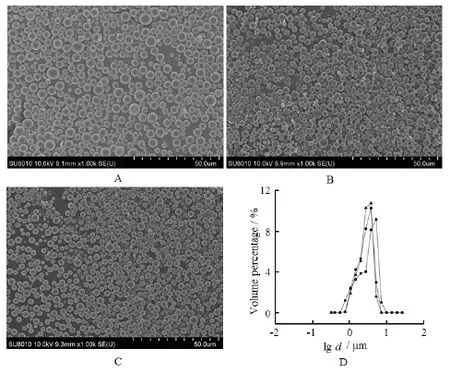
Fig. 3 SEM micrographs and size distribution of blank PLGA microspheres prepared with different membranehomogenized cyles图3 不同膜乳化次数制备的空白PLGA微球的SEM图(A、B、C)和粒径分布(D)
综上所述,采用10 μm SPG膜制备单分散型空白PLGA微球的优化条件如下:外水相中PVA质量浓度为10 g·L-1,有机相与外水相体积比为1∶3.75,过膜压力为60 kPa,过膜1次。
3.2 不同粒径PLGA空白微球的制备
SPG膜孔径大小和过膜压力是影响微球粒径的主要因素,在上述优化条件下,分别采用5.2、10.0 和40.1 μm孔径的SPG膜,在不同的跨膜压力下制备了不同粒径的单分散型空白PLGA微球,结果见表2,粒径分布图见图4。结果表明,预复乳液滴粒径一致的条件下,SPG膜孔径越小,需要的过膜压力越大,微球粒径也趋于均匀。因为大孔径的SPG膜会使粒径小于膜孔径的液滴直接过膜,从而导致微球的粒径均一性稍差。分析结果得知,SPG膜孔径与微球粒径有较好的线性关系(R2= 0.999),因此,可以选取合适孔径的SPG膜较快捷地制备出所需要孔径的单分散型微球。
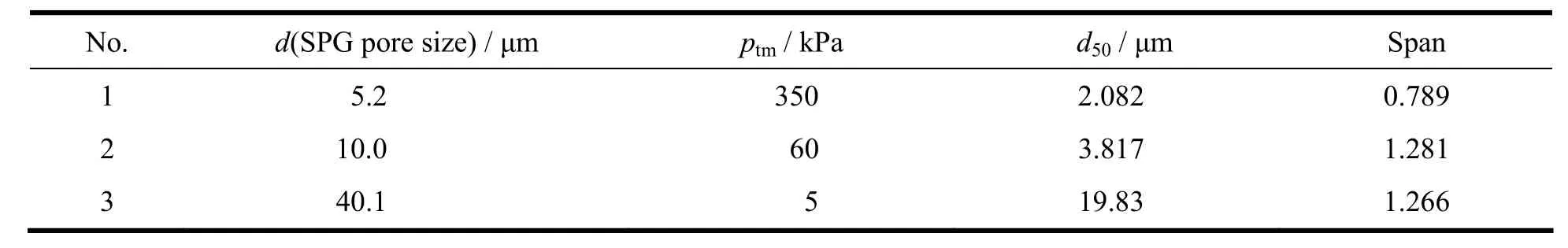
Table 2 The particle size of blank PLGA microspheres prepared with SPG membrane different pore size表2 不同孔径SPG膜制备空白PLGA微球的粒径数据
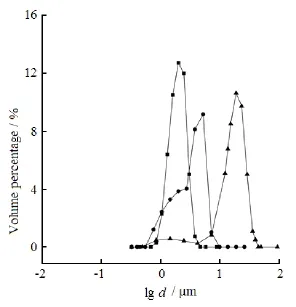
Fig. 4 The particle size distribution of blank PLGA microspheres prepared using SPG membrane with different pore size图4 不同孔径SPG膜制备空白PLGA微球的粒径分布图
3.3 快速膜乳化法制备单分散型载艾塞那肽PLGA微球的处方优化
基于优化后的空白PLGA微球的处方工艺,以10 μm SPG膜为例,通过单因素实验进一步优化装载艾塞那肽PLGA微球的制备条件。
3.3.1 内水相与有机相的体积比对包封率及突释的影响
采用复乳法制备微球过程中,内水相体积是影响微球包封率的重要因素[6]。固定有机相体积为4 mL,考察内水相与有机相体积比为1∶5、1∶8和1∶10对微球性质的影响。从图5可知,随着内水相体积的减小,微球包封率由内水相与有机相体积比为 1∶5时的 36.46%提高到体积比为 1∶10时的67.74%。内水相体积增大,导致更多的内水相液滴分布于油水界面附近,使隔离内外水相的油膜变薄,从而使内外水相融合几率变大,药物更容易扩散到外水相使微球包封率下降,突释变大[7]。因此,选择内水相与有机相体积比1∶10为最优条件。
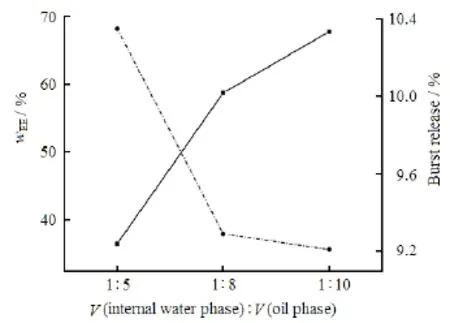
Fig. 5 The effect of volume ratio of internal water phase to organic phase on the encapsulaiton efficiency and burst release of exenatide-loaded PLGA microspheres图5 内水相与有机相的体积比对载药微球包封率及突释的影响
3.3.2 有机相中PLGA质量浓度对微球性质的影响
有机相中的PLGA质量浓度对微球的包封率、粒径及体外释放行为有重要的影响[8-9]。因此考察不同PLGA质量浓度对微球性质的影响,结果见表3。

Table 3 The effects of PLGA concentration on the characteristics of exenatide-loaded PLGA microspheres表3 有机相中PLGA质量浓度对载药微球性质的影响
结果显示,随着有机相中PLGA质量浓度的增加,微球包封率变大,突释百分数降低。这是由于PLGA质量浓度越高,有机相黏度变大,聚合物沉淀速度变快,大大减小了内水相药物扩散到外水相的几率,使分散在微球表面的药物比例减小,从而使包封率提高,突释降低。然而,当有机相中PLGA质量浓度过高时,预复乳乳滴与SPG膜孔壁摩擦力变大, SPG膜上有大量的PLGA固化,对膜材和药物的损失较严重,影响快速膜乳化的过膜效率,使微球产品的收率较低。综合考虑包封率、突释百分数和产品收率的因素,最终确定PLGA的质量浓度为100 g·L-1。
3.3.3 外水相中NaCl质量浓度对微球性质的影响
复乳法制备微球过程中,内外水相的渗透压梯度是影响载药微球包封率的重要因素。外水相中添加低质量浓度的NaCl后,减小了内外水相的渗透压差值,阻碍了水分向微球内部的渗透及药物向外水相扩散,从而可使包封率明显提高,但是如果NaCl质量浓度过高,内水相的水分有向外扩散的趋势,也不利于包封率的提高;而且随着外水相中NaCl的增加,二氯甲烷在水中的溶解度随之降低,溶剂挥发速率减缓,微球固化过程变慢,增加了药物向外水相扩散的可能性,从而使包封率降低[3]。因此考察外水相NaCl质量浓度分别为0、10 、30和60 g·L-1时对微球性质的影响,结果见图6。

Fig. 6 The effects of the NaCl concentrations in external water phase on the characteristics of exenatide-loaded PLGA microspheres图6 外水相中NaCl质量浓度对载药微球性质的影响
结果显示,与外水相中不加入NaCl相比, 当外水相中NaCl的质量浓度为10 g·L-1时,包封率增加了28.31%,突释百分数也有所下降;继续增大NaCl质量浓度,包封率明显下降,突释百分数也明显增加。扫描电镜照片显示,外水相中不加氯化钠及氯化钠质量浓度较高(30 g·L-1NaCl、60 g·L-1NaCl)时制备的微球表面有塌陷和孔洞,加入10 g·L-1NaCl水溶液制备的微球表面致密光滑无空洞,微球的形态特征也从侧面验证了上述的包封率和突释百分数数据。因此外水相中NaCl质量浓度的最优条件为10 g·L-1。
3.3.4 初乳的制备方式的考察
总结上述实验数据,最优处方制备的载药微球包封率为 67.74%,仍低于同类文献报道的数值[3,10]。初乳的处方工艺是影响包封率的重要因素,因此作者又考察了W1/O初乳的制备方式,以上处方是将溶有药物的内水相先直接倒入溶有PLGA的二氯甲烷中,然后再立即剪切制备初乳,此种方法内水相与有机相接触不充分,乳化效果不好,且会造成内水相的损失,因此包封率较低。将初乳的制备方法改良,先在较低的剪切速度下,将内水相缓慢注入有机相液面以下,然后再调至所需转速,此种方法制备的微球的包封率提高至88.04%。
通过单因素考察,得到以10 μm SPG膜制备载艾塞那肽PLGA微球的最优条件为:内水相与有机相的体积比为1∶10,有机相中PLGA的质量浓度为100 g·L-1,外水相中NaCl质量浓度为10 g·L-1,初乳的制备方式为注入式。
3.4 不同粒径单分散型载艾塞那肽PLGA微球的制备及体外评价
参照“3.2”条和“3.3”条所确定的优化处方工艺条件,制备了不同粒径单分散型载药微球(表4),并考察粒径对微球包封率及释放行为的影响(图7)。
固定预复乳的处方工艺,采用不同孔径的SPG膜制备不同粒径的载药微球,微球表面光滑无孔洞(图7),粒径分布较均匀,且随着SPG膜孔径的减小,微球粒径趋于均匀。数据显示,微球包封率随着粒径的减小而降低。在微球的制备过程中,内外水相的融合是导致药物泄漏的主要因素之一[6],粒径较小的微球内外水相间的距离较短,因此药物更容易扩散至外水相,从而导致包封率降低。
微球的释放曲线显示,粒径不同,微球的体外释放行为差异较大。粒径较小的微球,虽然突释较低,但后期释放速率太慢,释放不完全。而粒径较大的微球突释稍大,但后期稳定持续释放,粒径不同导致突释有差异的其中一个原因是微球的载药量不同,小粒径微球的载药量较低,因此突释百分数较小。
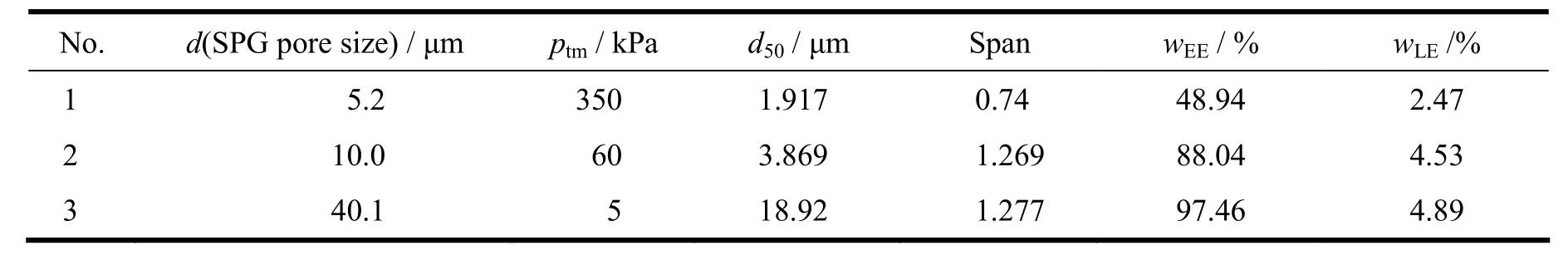
Table 4 Characterization of exenatide-loaded PLGA microspheres with different sizes表4 不同粒径载艾塞那肽PLGA微球的体外评价
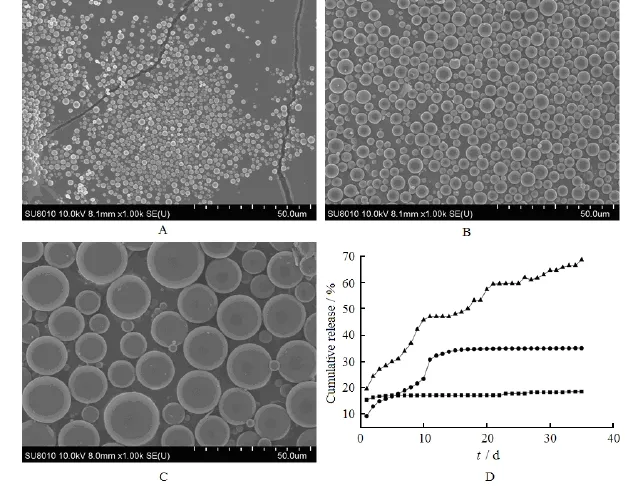
Fig. 7 SEM photographs(A、B、C) and drug release profiles(D) of exenatide-loaded PLGA microspheres with different sizes图7 不同粒径载艾塞那肽PLGA微球的SEM图(A、B、C)和体外释放曲线(D)
4 结论
快速膜乳化法结合复乳法可制备不同粒径的单分散型空白及载艾塞那肽PLGA微球。粒径大小对微球的包封率及体外释放行为有重要影响。粒径较小的微球包封率低、后期释放缓慢、释放不完全,相比之下,粒径较大(18.92 μm)的微球包封率较高,且释放行为良好,适合制备长效缓释微球。
[1] 鞠秀兰. PLGA控释微球注射剂的研究进展[J]. 卫生职业教育, 2005, 23(10): 123-124.
[2] ESWAOORTHY R, CHANG CHIACHI, W U Shuncheng, et al. Sustained release of PTH(1–34) from PLGA microspheres suppresses osteoarthritis progression in rats[J]. Acta Biomaterialia, 2012, 8(6): 2254–2262.
[3] QI Feng, WU Jie, YANG Tingyuan, et al. Mechanistic studies for monodisperse exenatide-loaded PLGA microspheres prepared by different methods based on SPG membrane emulsification[J]. Acta Biomaterialia, 2014, 10(10): 4247–4256.
[4] SCHRÖDER V, BEHREND O, SCHUBERT H, et al. Effect of dynamic interfacial tension on the emulsification process using microporous, ceramic membranes[J]. Journal of Colloid and Interface Science, 1998, 202(2): 334-340.
[5] SCHRÖDER V, SCHUBERT H. Production of emulsions using microporous, ceramic membranes[J]. Colloids andSurfaces A Physicochemical and Engineering Aspects, 1999, 152(152): 103–109.
[6] LIU Rong, HUANG Shanshan, WAN Yinhua, et al. Preparation of insulin-loaded PLA/PLGA microcapsules by a novel membrane emulsification method and its release in vitro[J]. Colloids Surf B Biointerfaces, 2006, 51(1): 30–38.
[7] ROSKOS K V, MASKIEWICZ R. Degradable controlled release systems useful for protein delivery[J]. Pharm Biotechnol, 1997, 10: 45-92.
[8] HANSHEY L A, BOLZINGER M A, BORDES C, et al. Improvement of a bovine serum albumin microencapsulation process by screening design[J]. Int J Pharm, 2007, 344: 16–25.
[9] YANG C Y, TSAY S Y, TSIANG R C, et al. An enhanced process for encapsulating aspirin in ethyl cellulose microcapsules by solvent evaporation in an O/W emulsion[J]. Journal of Microencapsulation, 2000, 17(3): 269-277.
[10] 宣吉明, 高静, 黄景彬, 等. 艾塞那肽缓释微球的制备和体外释放的研究[J]. 第二军医大学学报, 2011, 32: 772-775
Preparation of monodisperseexenatide-loaded microspheres and in vitro evaluation
YANG Hua1, WANG Qian1, LIN Xia2, TANG Xing1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. School of Pharmacy, Jiangnan University, Wuxi 214122, China)
ObjectiveThe aim of this study was to prepare monodisperse exenatide-loaded polylactic-co-glycolic acid (PLGA) microspheres with different size and investigate the size effect on the entrapment efficiency and in vitro release rate of the exenatide-loaded microspheres.MethodsThe microspheres with different sizes were prepared by premix membrane emulsification. By using single-factor test, the preparation conditions of the microspheres were optimized with the 10 μm SPG membrane. The surface morphology of PLGA microspheres was assessed by scanning electron microscope (SEM). The microspheres were evaluated and compared by particle size distribution, entrapment efficiency (EE) and in vitro release.Results The monodisperse microspheres were prepared respectively with size of 1.917 μm, 3.869 μm, 18.92 μm under the optimized conditions. The results revealed that the microspheres with smaller size obtained lower EE and lower release rate.Conclusions Premix membrane emulsification method could be used to prepare monodisperse microspheres with different sizes. There are apparent discrepancies on the EE and released behavior among the microspheres with different sizes. The microspheres with larger size (about 20 μm) are fitted to be developed into long-term release products, which possessed higher EE and better in vitro release behavior than the others in this study.
pharmaceutics; monodisperse microspheres; premix membrane emulsification; exenatide; entrapment efficiency; in vitro release
R94
A
(2016)06–0193–11
10.14146/j.cnki.cjp.2016.06.002
(本篇责任编辑:赵桂芝)
2015-05-20
杨华(1989-), 女(汉族), 河南新乡人, 硕士研究生,E-mailyanghua36275@163.com;*通讯作者:唐星(1964-), 男(汉族), 陕西商县人, 教授, 博士, 博士生导师, 主要从事药剂学研究,Tel.024-23986343,E-mailtangpharm@sina.com。
