氟比洛芬固体分散体的制备和优化
2017-01-05李淑娟赵倩倩王慧心杨星钢刘丹丹潘卫三
李淑娟, 赵倩倩, 王慧心, 杨星钢, 刘丹丹, 潘卫三*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 辽宁科技学院 生物医药与化学工程学院,辽宁 沈阳 117004)
氟比洛芬固体分散体的制备和优化
李淑娟1, 赵倩倩1, 王慧心1, 杨星钢1, 刘丹丹2, 潘卫三1*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 辽宁科技学院 生物医药与化学工程学院,辽宁 沈阳 117004)
目的制备能够提高氟比洛芬(flurbiprofen,FP)分散状态和溶出速率的固体分散体。方法以碳酸钠(Na2CO3)作为pH值调节剂,采用溶剂挥发法制备氟比洛芬固体分散体。在单因素考察的基础上,使用正交设计优化处方,最优处方采用溶出度法、差示扫描量热法(DSC)和粉末X射线衍射法(PXRD)表征。结果确定最优处方为:Kollidon®12 PF用量400 mg和Na2CO3用量3 mg。对最优处方性质的考察结果表明,与原料药和物理混合物相比,最优处方中药物的溶出速率有了显著的提高;DSC和PXRD分析结果表明,药物以无定型状态分散在载体材料中。结论由溶剂挥发法制备的氟比洛芬固体分散体使药物以无定型状态分散,能够显著提高药物的溶出速率。
药剂学;固体分散体;溶剂挥发法;正交设计;氟比洛芬;碱化剂;溶出度
氟比洛芬(flurbiprofen, FP)是一种新型强效低毒的芳基丙酸类非甾体抗炎药,在甲醇、乙醇、丙酮或乙醚中易溶,在乙腈中溶解,在水中几乎不溶。FP主要用于治疗类风湿性关节炎、骨关节炎、眼部炎症和强直性脊柱炎[1]。由于FP水溶性较差,马素伟等[2]以磷脂作为载体材料,对制备的氟比洛芬固体分散体的特性进行考察,制剂在pH值4.0、7.2的缓冲溶液及蒸馏水中45 min时的溶出度均在70 %以上。为了进一步提高药物的溶解度和溶出速率,作者选用水溶性载体材料制备氟比洛芬固体分散体,且在制剂制备过程中加入pH值调节剂,即将pH微环境调控技术[3-4]和固体分散体(solid dispersions,SD)技术相结合,既实现了药物的快速释放,又保持了药物的高度分散、抑制药物结晶析出,从而在增加药物溶出速率方面显示出来很大的优势[3-5]。另外,SD中的pH微环境调节剂可与药物官能团之间产生相互作用,将药物由结晶型转变为无定型状态,从而抑制药物形成结晶,减少上述SD体系的“老化”现象,有利于保持SD的稳定状态[6]。
1 仪器与材料
KQ-100DB数控超声仪(昆山超声仪器有限公司),AR1140电子分析天平(奥豪斯国际贸易上海有限公司),AG245超微量电子天平(瑞士Mettler Toledo公司),ZRS-6G药物溶出度仪(天津天大天发科技有限公司),RE-85Z旋转蒸发仪(巩义英峪予华仪器厂),DSC-60差示扫描量热仪(日本岛津公司),DX-2700粉末X射线衍射仪(奥龙射线仪器有限公司)。
氟比洛芬(flurbiprofen,FP,珠海远城生物化工有限公司,批号 20100122),Kolliphor®P 188、Kollidon®VA 64、Soluplus®、Kollidon 系列(Kollidon®12 PF、Kollidon®17 PF和Kollidon®30)(德国Basf有限公司),碳酸钠(Na2CO3,天津博迪化工有限公司)。
2 方法
2.1 固体分散体的制备
将处方量的Na2CO3溶于少量水中,然后加入处方量的FP和载体材料,用适量无水乙醇充分溶解混匀后,40 ℃旋转蒸发除去溶剂,研磨粉碎后过317.5 µm筛,得到的FP-SD粉末,保存于保干器中备用。
2.2 单因素考察
2.2.1 固体分散体载体材料的筛选
将FP与载体材料按质量之比1∶5的比例溶于无水乙醇,搅拌至全部溶解。40 ℃旋转蒸发除去溶剂,研磨粉碎后过317.5 µm筛,得到的SD粉末,保存于保干器中备用。实验中筛选了Kolliphor®P 188、 Kollidon®VA 64、 Soluplus®、Kollidon®12 PF、Kollidon®17 PF和Kollidon®30共6种载体材料。
2.2.2 Kollidon® 12 PF用量对体外释药行为的影响
固定处方中药物量为100 mg,碱化剂用量为1 mg,考察Kollidon®12 PF分别为300、400和500 mg作为固体分散体载体材料对药物释放行为的影响。
2.2.3 Na2CO3用量对体外释药行为的影响
固定处方中药物量为100 mg,Kollidon®12 PF用量为300 mg,考察Na2CO3分别为1、2和3 mg作为碱化剂对药物释放行为的影响。
2.3 处方优化
固定处方中药物质量为100 mg,在单因素考察的基础上,选择对本制剂释药行为影响显著的2个因素Kollidon®12 PF用量(A)和Na2CO3用量(B),采用2因素3水平的正交设计优化处方。采用综合评分法[7-8],根据指标的重要程度,确定指标权重,将评分结果进行加权相加后得出总分,最后采用直观分析法进行分析。其中2个评价指标为:(1)药物5 min的累积释放度(P5)[9],以95 %为标准,用于考察药物在5 min内释放是否完全,权重系数为0.7;(2)固体分散体总质量(m,mg),总质量越小,辅料用量越少,权重系数为0.3。由于2个指标数量级不同,故在此引入隶属度[10]的概念,将2个指标都转化为0~1的数值来计算。以L为评价指标,得到计算公式:L=|P5-95%| × 释放度的隶属度 × 0.7 + m × 总质量的隶属度× 0.3。L值越小,因素的水平越佳。根据正交实验设计表L(3)安排实验。隶属度的计算公式如下:
隶属度 =(指标值-指标最小值)/(指标最大值-指标最小值)。
2.4 氟比洛芬固体分散体的性质考察
2.4.1 氟比洛芬固体分散体载药量的测定
精密称取适量氟比洛芬固体分散体,置于100 mL量瓶中,加甲醇适量,充分振摇使氟比洛芬溶解,加甲醇至刻度,摇匀。静置使澄清,上清液以0.45 µm微孔滤膜滤过,精密量取续滤液5 mL,置于100 mL量瓶中,加甲醇至刻度,摇匀,按照紫外-可见分光光度法,在波长247 nm处测定吸光度。根据标准曲线计算氟比洛芬的载药量。计算公式如下:
载药量 = 凝胶小球中所含药物的质量/凝胶小球的质量×100%。
2.4.2 体外溶出考察
按《中华人民共和国药典》2010版二部附录XC第二法,分别以900 mL蒸馏水、pH值1.2盐酸水溶液和pH值6.8、pH值7.2的磷酸盐缓冲液为释放介质,温度控制在(37±0.5)℃,转速为100 r·min-1,分别于5、10、15、20、30、45和60 min取溶液5 mL,并及时补充空白介质溶液5 mL。将取出的溶液用0.8 μm微孔滤膜滤过,弃去初滤液,取续滤液备用;按《中华人民共和国药典》2010版二部附录XD第二法的紫外-可见分光光度法在波长247 nm处测定吸光度,按外标法分别计算不同时间点的溶出度。
2.4.3 差示扫描量热法(DSC)
采用DSC-60差示扫描量热仪对样品进行分析测定。精密称取样品约5 mg,DSC分析条件设定为:扫描范围20~200 ℃,升温速率10 ℃·min-1,扫描环境为氮气。
2.4.4 粉末X射线衍射法(PXRD)
采用DX-2700粉末X射线衍射仪测定样品的X射线衍射图谱。采用CuKα辐射源,X射线的扫描范围2θ = 5°~40°,扫描速率为2° ·min-1。
3 结果与讨论
3.1 单因素考察
3.1.1 载体材料的筛选
载体材料筛选结果见图1、2。结果表明:对于不同种类的SD载体材料,由Kolliphor®P 188制得的SD,药物几乎立刻释放完全,但是由于Kolliphor®P 188熔点很低,制得的SD不易粉碎,故选择药物释放速率较快且较易粉碎的Kollidon®30进一步筛选;对于3种不同分子质量Kollidon系列的 SD载体材料,药物释放速率均相似。据报道[11],聚维酮材料分子质量越小,越易形成氢键,从而增加SD体系的稳定性和药物的溶出速率,最终选择以Kollidon®12 PF作为本研究中SD的载体材料。
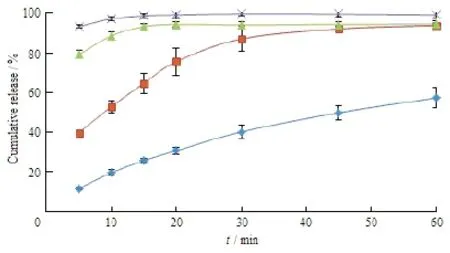
Fig. 1 Effect of various carriers on drug dissolution rate of binary SD in water (n=3)图1 不同载体对两相固体分散体在水中的溶出曲线的影响(n=3)
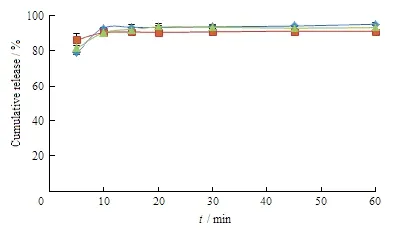
Fig. 2 Effect of Kollidon®type on drug dissolution rate of binary SD in water (n=3)图2 不同种类Kollidon®对两相固体分散体在水中的溶出曲线的影响(n=3)
3.1.2 Kollidon® 12 PF用量对体外释药行为的影响
Kollidon®12 PF用量对药物释放的影响结果见图3。结果表明:Kollidon®12 PF用量对药物的体外释放有显著影响。随着Kollidon®12 PF用量增加,药物释放明显加快,可能是因为Kollidon®12 PF改变了药物晶型,使其以高能的无定型状态分散在SD体系中[12];另外,两者形成了分子间氢键,使制得的SD溶出速率加快。暂定处方中Kollidon®12 PF用量为300 mg。
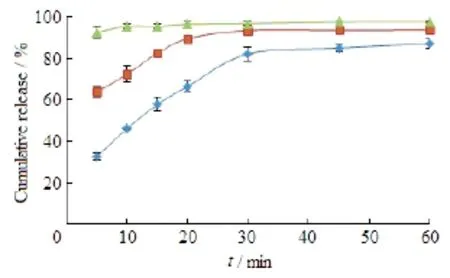
Fig. 3 Influence of amount of Kollidon®12 PF in SD system on drug release (n=3)图3 不同用量Kollidon®12PF对两相固体分散体在水中的溶出曲线的影响(n=3)
3.1.3 Na2CO3用量对体外释药行为的影响
Na2CO3用量对体外药物释放的影响结果见图4。结果表明:Na2CO3用量对药物的体外释放有显著影响。Na2CO3用量稍有增加,药物释放速率明显加快。
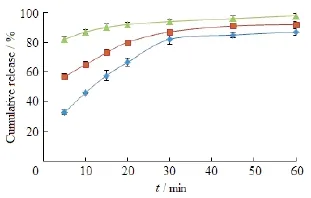
Fig. 4 Influence of amount of Na2CO3in SD system on drug release (n=3)图4 不同用量的Na2CO3对固体分散体中药物释放的影响(n=3)
3.2 处方优化
实验因素水平的划分及实验结果见表1、2。

Table 1 Factors and levels of orthogonal test表1 正交设计的因素和水平
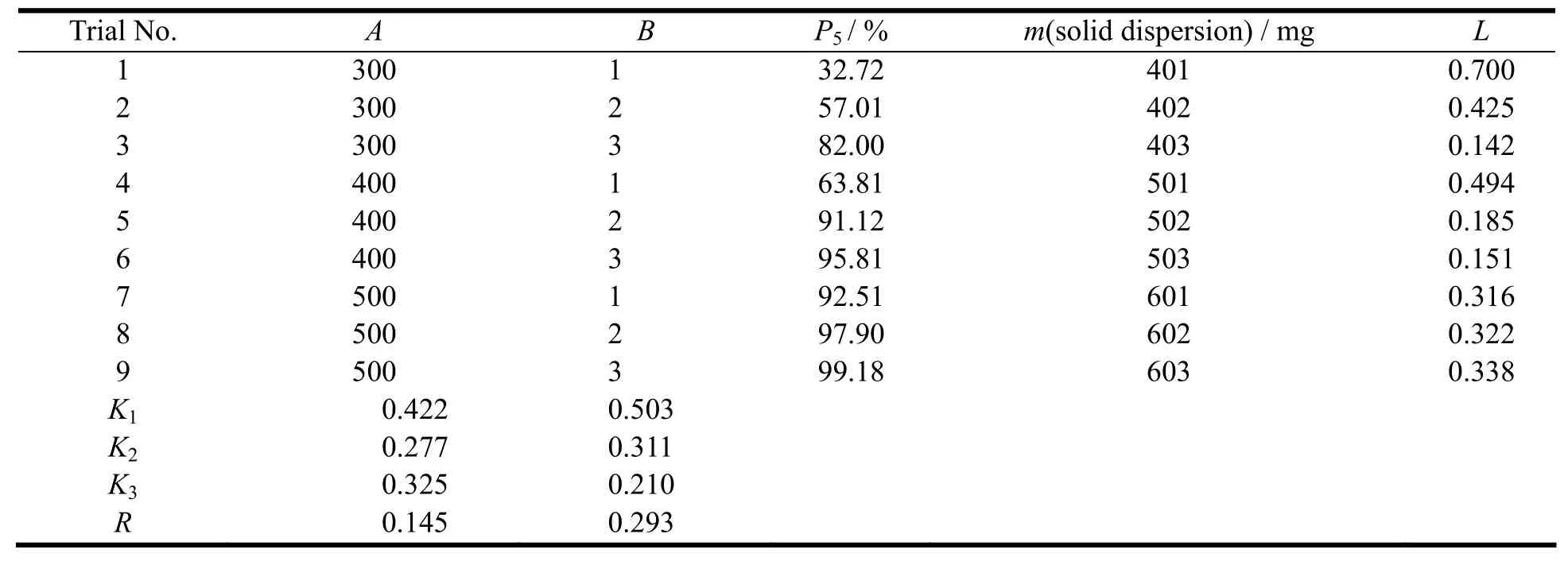
Table 2 Results of orthogonal test表2 正交设计的结果
由表2极差R可知,2种因素对指标影响的大小次序为:B>A。最佳处方为:A2B3,即Kollidon®12 PF的用量为400 mg,Na2CO3的用量为3 mg。按照该处方,以“2.1”条方法制备3批FP-SD,按“2.4.2”条方法测定制剂体外释放度,结果见图5。结果表明:制剂在前5 min的药物释放量达到95%以上,并且固体分散体总质量较小,即辅料用量较少,批间重现性较好。
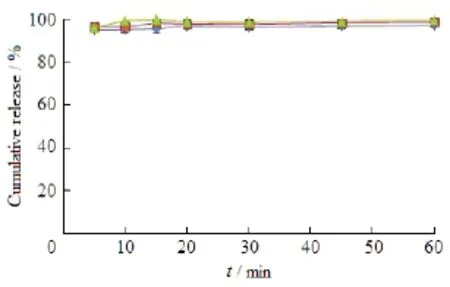
Fig. 5 Drug release profiles of three batches of FP-SD图5 三批氟比洛芬固体分散体的溶出曲线
3.3 氟比洛芬固体分散体的性质考察
3.3.1 氟比洛芬固体分散体载药量的测定
按最优处方制备3批样品,测得载药量分别为19.91%、19.87%和19.80%,RSD为0.28%。
3.3.2 体外溶出考察结果
原料药、物理混合物(physical mixture,PM)和最优处方(FP-SD)在不同溶出介质中的药物释放曲线见图6。结果表明:在4种介质中,FP-SD的释药速率明显快于原料药和PM,并且这种释药速率上的差异在pH值1.2 盐酸溶液和蒸馏水中更为突出。在蒸馏水中,FP-SD、PM和原料药在前10 min的药物累积释放度分别为95.92 %、26.53 %和6.84 %。在pH值1.2 盐酸溶液中,三者在前10 min的药物累积释放度分别为62.02 %、10.96 %和0.95 %。由此可见,FP-SD中药物释放速率比物理混合物提高了约4~6倍。在pH值6.8和7.2的磷酸盐缓冲液中,FP-SD中药物释放速率在前20 min也得到了显著提高。
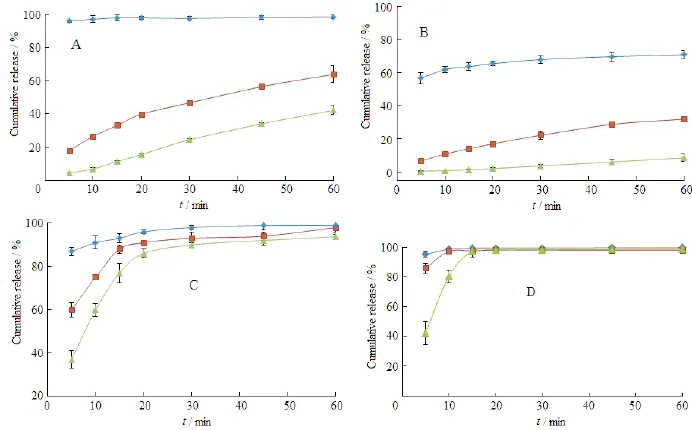
Fig. 6 Dissolution profiles of the drug from FP-SD (◆), PM (■) and FP powder (▲) at distilled water(A), pH 1.2 HCl solution (B), pH 6.8 PBS(C), pH 7.2 PBS (D) (n=3)图6 固体分散体(◆)、物理混合物(■)、原料药(▲)在蒸馏水(A)、pH 1.2盐酸溶液(B)、pH 6.8磷酸缓冲液(C)和pH 7.2磷酸缓冲液(D) 4种不同溶出介质中的溶出曲线
3.3.3 差示扫描量热法(DSC)
为了确证制备成固体分散体后药物晶型状态是否改变,采用DSC法进行考察,结果见图7。由图7中(C)和(D)曲线可知,原料药和物理混合物在117 ℃都存在较尖锐的熔点吸热峰,说明物理混合过程不会改变药物的晶型。但是由图 7中(E)可知,原料药在 117 ℃的熔点吸热峰消失,说明在FP-SD中药物以无定型的状态存在。因此可以认为,通过将药物制成固体分散体,改变了药物的物理性质,高分子材料和药物之间存在相互作用,抑制了药物晶型的形成,从而增加药物的溶出速率。
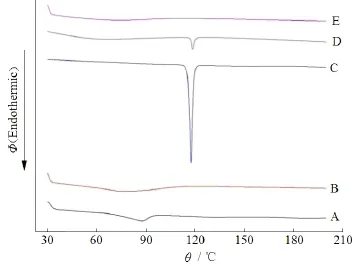
Fig. 7 DSC thermograms for Na2CO3(A), Kollidon®12 PF(B), FP (C), PM(D) and FP-SD (E)图7 Na2CO3(A)、Kollidon®12 PF(B)、FP (C)、PM(D)和FP-SD (E)的差示扫描量热图
3.3.4 粉末X射线衍射法(PXRD)
样品的粉末X射线衍射图谱见图8。由图8可知,FP在整个扫描区域都有明显的、尖锐的衍射峰,说明FP以晶体结构存在;Na2CO3在30°~40°有较强的衍射峰;Kollidon®12 PF则无明显的衍射峰。在PM的衍射图谱中,均可见FP和Na2CO3的结晶峰存在,说明物理混合过程不会改变各个成分的晶型。由图8中(E)曲线可见,FP和Na2CO3的结晶峰均消失,FP在FP-SD中以无定型的状态存在,SD技术可以改变药物的晶型。以上结果与DSC考察结果基本一致。
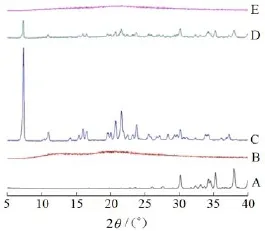
Fig. 8 PXRD diagrams of Na2CO3(A), Kollidon®12 PF(B), FP(C), PM(D) and FP-SD(E)图8 Na2CO3(A), Kollidon®12 PF(B), FP(C), PM(D)和FP-SD(E)的粉末X射线衍射图谱
4 结论
a. 作者以碳酸钠(Na2CO3)作为pH调节剂,采用溶剂挥发法制备FP-SD。确定制剂的处方组成,并进行单因素考察。结果发现,Kollidon®12 PF用量和Na2CO3用量对体外药物释放有显著影响。
b. 在单因素考察的基础上,选择对本制剂释药行为显著的2个因素,即Kollidon®12 PF用量和Na2CO3用量,采用正交设计优化处方并通过直观分析结果得到最优处方。最优处方验证结果表明,最优处方在前5 min的药物累积释放量达到95%以上,且FP-SD辅料用量较少,批间重现性较好。
c. 对优化处方的性质进行了表征。体外溶出结果表明,与原料药和PM相比, FP-SD体系中药物的溶出速率和程度有了显著的提高;DSC和粉末X射线衍射结果表明,药物以无定型状态分散在FP-SD体系。
[1] MARSH C C, SCHUNA A A, SUNDSTORM W R. A review of selected investigational nonsteroidal anti-inflammatory drugs of the 1980s[J]. Pharmacotherapy, 1986, 6: 10-25.
[2] 马素伟, 牛国琴, 陈庆华, 等. 氟比洛芬磷脂固体分散体的制备和特征[J]. 中国医药工业杂志,2008, 39(1):27-30.
[3] TRAN T T, TRAN P H, CHOI H G, et al. The roles of acidifiers in solid dispersions and physical mixtures[J]. Int J Pharm, 2010, 384(1/2): 60-66.
[4] TRAN T T, TRAN P H, LEE B J. Dissolution-modulating mechanism of alkalizers and polymers in a nanoemulsifying solid dispersion containing ionizable and poorly water-soluble drug[J]. Eur J Pharm Biopharm, 2009, 72(1): 83-90.
[5] TRAN T T, TRAN P H, LEE B J. Modulation of microenvironmental pH and crystallinity of ionizable telmisartan using alkalizers in solid dispersions for controlled release[J]. J Control Release, 2008, 129(1): 59-65.
[6] NIRMAL M, TUAN H T, BIJAY K P, et al. Fabrication and evaluation of pH-modulated solid dispersion for telmisartan by spray-drying technique [J]. Int J Pharm, 2013, 441: 424-432.
[7] 吴蘅, 杨星钢, 张志宏, 等. 大剂量难溶性药物苯扎贝特渗透泵片的研制[J]. 中国药学杂志, 2008, 43 (20): 1574-1578.
[8] 高祖新. 医药数理统计方法[M]. 5版. 北京: 人民卫生出版社, 2011: 254-256.
[9] JONDHALE S, BHISE S, PORE Y. Physicochemical investigations and stability studies of amorphous gliclazide[J]. AAPS Pharm Sci Tech, 2012, 13 (2): 448-459.
[10] 王翔朴, 王营通. 卫生学大辞典[M]. 青岛: 青岛出版社, 2000: 507-508.
[11] 崔福德. 药剂学[M]. 2版. 北京: 中国医药科技出版社, 2009: 442.
[12] AL-HAMIDI H, EDWARDS A A, MOHAMMAD M A, et al. To enhance dissolution rate of poorly water-soluble drugs: glucosamine hydrochloride as a potential carrier in solid dispersion formulations [J]. Colloids Surf B: Biointerfaces, 2010, 76: 170-178.
Preparation and optimization of solid dispersion for flurbiprofen
LI Shujuan1, ZHAO Qianqian1, WANG Huixin1, YANG Xinggang1, LIU Dandan2, PAN Weisan1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. School of Biomedical & Chemical Engineering, Liaoning Institute of Science and Technology, Benxi 117004, China)
ObjectiveTo prepare a solid dispersion of Flurbiprofen (FP-SD), which can enhance the state of dispersion and the dissolution rate of FP.MethodThe solid dispersion of flurbiprofen containing Na2CO3as the alkalizer was prepared by solvent evaporation method. Based on the single-factor study, orthogonal test was applied to screen the optimal formulation. The dissolution method, differential scanning calorimetry (DSC) and powder X-ray diffraction (PXRD) analysis were utilized to test the property of FP-SD.ResultThe result showed that the optimal formulation included 400 mg Kollidon®12 PF and 3 mg Na2CO3. The dissolution rate of SDs was markedly enhanced compared with FP powder and physical mixture (PM). Differential scanning calorimetry analysis and powder X-ray diffraction confirmed that FP of FP-SD system was in the amorphous state.ConclusionFP in FP-SD system prepared by solvent evaporation method is in the amorphous state. The dissolution rate of FP from FP-SD was significantly enhanced.
pharmaceutics; solid dispersions; solvent evaporation method; orthogonal design; flurbiprofen; alkalizer; dissolution rate
(本篇责任编辑:赵桂芝)
R94
:A
(2016)05-0151-09
10.14146/j.cnki.cjp.2016.05.002
2015-05-11
李淑娟(1988-), 女(汉族), 山东菏泽人, 硕士研究生, E-mail lishu_juan@126.com;*
潘卫三(1958-), 男(汉族), 江苏扬州人, 教授, 博士, 博士生导师, 从事药物新剂型的研究与开发,Tel. 024-83986313,E-mailppwwss@163.com。
