木薯华南8号组培苗对盐胁迫的生理响应
2017-01-04薛晶晶朱文丽陈松笔
薛晶晶, 朱文丽, 陈松笔
( 中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室, 海南 儋州 571737 )
木薯华南8号组培苗对盐胁迫的生理响应
薛晶晶, 朱文丽, 陈松笔*
( 中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室, 海南 儋州 571737 )
以NaCl胁迫生长的木薯 (Manihotesculenta) 华南8号(SC8)组培苗为材料,研究不同浓度(0、5、20、35、50 mmol·L-1及R50 mmol·L-1)NaCl处理对SC8组培苗的生长状况及叶绿素、过氧化氢(H2O2)、丙二醛(MDA)含量,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)活性的影响。结果表明:≤20 mmol·L-1的NaCl胁迫60 d对SC8组培苗的生长基本无影响;≥35 mmol·L-1的 NaCl胁迫60 d抑制了SC8组培苗的生长,但高浓度(50 mmol·L-1)胁迫30 d后正常培养30 d,可以使SC8组培苗的长势得到恢复。叶绿素和MDA含量在≤35 mmol·L-1NaCl处理下较对照出现积累现象,随NaCl浓度升高(≥50 mmol·L-1)含量开始下降;与对照相比,H2O2含量在NaCl胁迫下未出现积累现象。NaCl胁迫下,POD、CAT和APX活性较对照均有所提高;较高浓度的NaCl处理下,SOD、CAT和APX活性开始降低。实时荧光定量PCR结果表明,≥50 mmol·L-1NaCl 胁迫下,SOD、CAT、POD和APX的表达水平较对照出现上升现象。这说明短时间的盐胁迫不会对木薯造成致死伤害,可以通过调节生理指标的活性来提高木薯的耐盐性。
木薯, NaCl处理, 生理指标测定, 相关性分析, Q-PCR

木薯(Manihotesculenta)是大戟科(Euphorbiaceae)木薯属(Manihot)多年生植物,是世界三大薯类作物之一(Rogers, 1963)。木薯贮藏根淀粉含量在27%~34%之间,被誉为“淀粉之王”,是世界热带地区继水稻、玉米、高粱之后的第四大粮食作物,为热带、亚热带近8亿人口提供了基本食粮,是我国重要的工业淀粉和生物质能源原料,也是我国潜在的粮食作物(Gu et al, 2013)。木薯耐旱耐贫瘠,具有很强的适应性,在热带亚热带相对贫瘠地区广泛种植,盐渍地种植不多。目前,有关木薯耐盐方面的研究尚不多,盐胁迫下植物酶促保护系统主要酶的活性变化机理仍不清楚。本研究以不同浓度NaCl处理的华南8号组培苗为材料,研究盐胁迫下其相关生理指标变化趋势以及部分生理指标转录本水平,探讨盐胁迫下的变化规律,为进一步了解木薯盐胁迫伤害的生理机制奠定基础,为扩大木薯种植区域提供依据。
1 材料与方法
1.1 材料
选取生长40 d左右的木薯华南8号(SC8)组培苗茎段,分别放于含有0、5、20、35、50 mmol·L-1NaCl的MS培养基上,每瓶放置5个茎段,每个处理浓度培养30瓶(其中,50 mmol·L-1为60瓶)。其中,将含50 mmol·L-1NaCl培养30 d后的组培苗转至MS培养基上(以R50 mmol·L-1表示)。待所有处理均生长60 d,取不同处理的叶片进行生理指标测定和RNA提取,每个指标重复3次。
1.2 方法
1.2.1 盐胁迫下不同生理指标的测定 利用分光光度计测定叶绿素含量;利用电导仪法测定细胞膜透性(李合生,2006);植物丙二醛(MDA)、过氧化氢(H2O2)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)的测试盒,测定MDA、H2O2、CAT、SOD、POD含量,所有测试盒均购自南京建成生物工程研究所,测试方法按说明书进行;抗坏血酸过氧化物酶(APX)试剂盒购自索莱宝生物科技有限公司,测试方法按说明书进行。
1.2.2 总RNA提取与cDNA合成 木薯组培苗叶片RNA提取参照RNAprep Pure多糖多酚植物总RNA提取试剂盒(Tiangen)的操作说明进行,用Dnase I柱上消化RNA样品中残留的微量DNA。cDNA第一链的合成参照TransScript Reverse Transcriptase(TransGen)操作说明书进行。
1.2.3 实时荧光定量PCR分析 采用Thermo公司的实时荧光定量PCR系统,实验操作按仪器使用说明书进行。取1 μg RNA,逆转录合成第一链cDNA,稀释10倍后作为实时定量PCR分析的模板。10 μL反应体系中,包含1 μL模板、5 μL 2×SYBR Premix、10 μmol·L-1QPCR -F和QPCR -R引物(表1)各0.5 μL、灭菌水补足10 μL。PCR反应程序为95 ℃预变性30 s;95 ℃ 10 s、60 ℃ 20 s、72 ℃ 20 s、共40个循环,循环完后进行产物溶解曲线分析。以MeActin作为内参基因(表1),以2-△△Cq算法进行基因的相对定量表达。采用Duncan多重比较对对照和处理样品的相对定量结果进行统计分析。

表 1 引物序列
1.3 分析方法及数据处理
用GraphPad Prifm 5.0软件进行数据分析和作图,用SPSS18.0软件进行差异性等相关统计分析。
2 结果与分析
2.1 盐胁迫对木薯SC8组培苗生长情况的影响
低浓度的盐胁迫对SC8组培苗的影响不明显,但当浓度提高到50 mmol·L-1时,SC8组培苗的生长受到了严重抑制,生长缓慢;当SC8生长30 d后,将部分受50 mmol·L-1NaCl胁迫的组培苗转至正常MS培养基上,30 d后SC8组培苗的长势慢慢恢复,较50 mmol·L-1盐胁迫下的长势好(图1)。
2.2 盐胁迫对木薯SC8组培苗不同生理指标含量的影响
盐胁迫会使植物体内产生大量活性氧,进而对植物细胞形成氧化胁迫伤害。所以,活性氧清除能力的高低反应了植物耐盐性的强弱。SOD、CAT、POD及APX是酶促防御系统中重要的保护酶,可以有效地清除膜脂过氧化物对植物造成的伤害。MDA可以用来衡量膜损伤的程度。
20 mmol·L-1盐胁迫下,叶绿素和MDA的含量最高;随着盐浓度增加,叶绿素和MDA含量逐渐下降,至50 mmol·L-1盐胁迫时,含量达到最低;但是经过50 mmol·L-1盐胁迫后,在正常MS培养基上生长的SC8组培苗,其叶绿素含量有很大提高,而MDA含量却略微下降(图2)。相对电导率表示细胞膜受伤害的程度,5 mmol·L-1盐胁迫下,相对电导率最高;随着盐胁迫浓度的增加,相对电导率下降。R50 mmol·L-1盐胁迫下,其相对电导率也略有上升。CAT是对H2O2分解的活力单位,当胁迫浓度达到50 mmol·L-1时,CAT活力达最大值,而R50 mmol·L-1盐胁迫下,CAT活力下降;而H2O2含量与其呈相反趋势。35 mmol·L-1盐胁迫下,APX和POD的活性最高。盐浓度达到50 mmol·L-1时,其APX活性下降到最低;恢复生长后,APX活性有所上升,但POD的活性基本无变化。SOD活力随着盐胁迫浓度的升高而降低,20 mmol·L-1盐胁迫下,SOD活力最低。这表明木薯SC8组培苗受到50 mmol·L-1NaCl胁迫时,生长被抑制,进而影响其生理指标的含量;而R50 mmol·L-1的盐胁迫下,其相关生理指标含量会随之恢复。
2.3 不同生理指标相关性分析
对叶绿素含量、膜透性、MDA、SOD、CAT、H2O2、POD及APX进行相关性分析(表2)。正常情况下,CAT与H2O2呈极显著正相关;当添加5 mmol·L-1的NaCl时,其生理指标无显著相关性;继续添加NaCl至20 mmol·L-1时,CAT与POD呈极显著负相关;当进行35 mmol·L-1的盐胁迫时,细胞膜伤害度与MDA、CAT呈显著负相关,而与SOD呈极显著正相关;SOD与MDA、CAT呈显著负相关,MDA与CAT呈极显著正相关,APX与POD呈显著正相关;当盐胁迫浓度达到50 mmol·L-1时,其生理指标无显著相关性;当50 mmol·L-1盐胁迫恢复生长时,叶绿素含量与细胞膜伤害度呈显著负相关,POD与MDA呈显著负相关;说明一定浓度的盐胁迫(35 mmol·L-1)对木薯组培苗的生长具有抑制作用,其细胞膜受到了严重伤害,从而通过调节其他生理指标的含量来提高木薯耐盐性;当50 mmol·L-1盐胁迫恢复生长时,木薯组培苗受到的伤害也逐渐恢复,表明短时间的盐胁迫不会对木薯造成毁灭性伤害,可以通过正常培养恢复生长。

表 2 盐胁迫下不同生理指标的相关性分析
注: *. 0.05 水平上显著相关;**. 0.01 水平上显著相关。
Note: *. indicates significant correlation among different indexes at 0.05 level; **. indicates significant correlation among different indexes at 0.01 level.

图 1 木薯SC8组培苗在不同浓度盐胁迫下生长30 d (A)和60 d (B)的状况Fig. 1 Growth status of cassava SC8 tissue culture seedlings under different concentrations of salt stresses for 30 d (A) and 60 d (B)
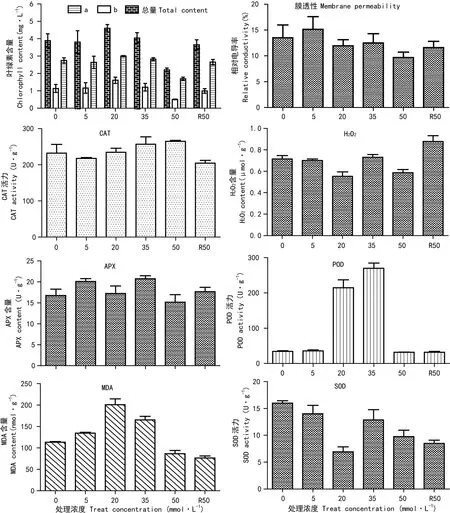
图 2 不同浓度盐胁迫下生理指标的变化趋势Fig. 2 Variation tendency of the physiological indexes under different concentrations of salt stresses
2.4 生理指标相关基因的表达分析
根据木薯已克隆的POD基因序列设计引物,同时引用已发表CAT、SOD和APX的定量PCR引物序列(Xu et al, 2013, 2014),对不同浓度盐胁迫后的木薯SC8组培苗进行转录本水平的表达分析。图3显示,不同盐浓度胁迫下,APX的相对表达量与其生理含量呈相反趋势;50 mmol·L-1时,APX的表达水平最高;当组培苗恢复生长时,其表达水平明显下降。POD和SOD的表达量在50 mmol·L-1胁迫和50 mmol·L-1恢复处理下变化不大。CAT的表达水平随着盐浓度增加,表达量降低;而组培苗恢复生长时,其表达水平到达最低水平。

图 3 盐胁迫下,不同生理指标相关基因的表达水平Fig. 3 Expression level of genes of different physiological indexes under salt stress
3 讨论与结论
生长受到抑制是植物遭受盐害最直观及最显著的效应(Munns, 2002)。盐分对植物生长的抑制机理是一个相当复杂的问题,不同盐类和同一盐类不同盐浓度、不同植物和同一植物不同器官、不同发育阶段以及盐胁迫时间的长短等,都会产生不同的结果,盐分的抑制机理也不相同。本研究中,5 mmol·L-1和20 mmol·L-1的NaCl处理下,生长30 d的木薯SC8组培苗与对照相比无差异。当盐浓度提高至50 mmol·L-1时,木薯SC8的生长受到严重抑制(图1);将50 mmol·L-1NaCl处理30 d的SC8组培苗部分移至正常MS培养基上生长,发现30 d后其生长发育恢复正常,与未处理的SC8组培苗长势无差异。可见,短时间的盐胁迫对植物的抑制作用可以恢复,植物在含盐环境下会开启自我保护模式来降低盐胁迫带来的伤害(肖强等,2003) 。
盐胁迫下,植物会通过发生氧化胁迫来破坏酶系统对氧代谢的平衡,植物通过提高自身的抗氧化系统活力来平衡活性氧代谢(Cheruth et al, 2007)。同时,盐胁迫会导致植物体内H2O2和MDA含量增加(尤佳等,2012;鲁艳等,2014;李晓雅等,2015)。本研究中,SC8 组培苗MDA的含量随着NaCl浓度的增加呈现先上升后下降的趋势,H2O2的含量在35 mmol·L-1NaCl处理时,达到最大;与菊芋块茎盐胁迫10 d的变化趋势一致(张喜洋和于涛,2015),而与多枝生柽柳、亚麻荠的研究结果略有不同(鲁艳等,2014;李晓雅等,2015)。可能是因为:第一,本研究采用的是SC8组培苗,其茎段的成熟度不同,同样生长环境下存在个体差异,且NaCl是直接加入MS培养基中,组培苗的生长有一个较长的适应过程;第二,SC8组培苗生长60 d后,随机选取3个培养瓶中的叶片进行H2O2和MDA含量测定,其测定结果会有一定的偏差。
植物体内具有复杂的抗氧化酶系统,能够清除胁迫产生的大量ROS。本研究表明,盐胁迫下植物体内 SOD、CAT、APX和POD等抗氧化酶活性的增强有利于减少体内ROS积累,从而减轻ROS引起的过氧化伤害(Dehghan et al, 2013; Mishra et al, 2013; Seckin et al, 2010)。本研究中,低浓度盐胁迫时,SOD、CAT、APX、POD等酶活性无显著变化,表明木薯可以通过调节酶活性来减少盐胁迫产生的超氧化物自由基的伤害;但是当盐浓度达到50 mmol·L-1时,胁迫产生的伤害越来越严重,SC8组培苗无法保持高水平的酶活性,酶活力下降。这一结果与多枝柽柳、棉花、大麦、烟草的研究结果类似(鲁艳等,2014; Meloni et al, 2003; Badawi et al, 2004; Liang et al, 2003)。另外,50 mmol·L-1NaCl处理30 d后恢复生长的SC8组培苗的APX酶活性会提高,但是 SOD、CAT、MDA、POD等含量低于50 mmol·L-1NaCl胁迫时的含量,推测可能是盐胁迫产生的伤害未消除,使其酶活性受到了影响。本研究进一步对APX、SOD、CAT及POD相关基因的表达水平进行分析,结果表明:盐胁迫下,APX的相对表达量与其生理含量呈相反趋势;NaCl浓度达50 mmol·L-1时,APX的表达水平最高;当组培苗恢复生长时,其表达水平明显下降。POD和SOD的表达量在50 mmol·L-1NaCl胁迫和恢复处理后变化不大;而CAT表达水平随着盐浓度增加而降低。基因的表达水平与生理指标的变化趋势存在差异,可能是因为:第一,本研究中每个酶只选择其中的一个基因进行表达水平分析,而不是分析整个家族的基因,存在一定的片面性;第二,酶起作用时还会受到其他的修饰,而基因的表达只是单一的转录本水平。
本研究是对不同浓度盐胁迫下的木薯SC8组培苗进行生理指标测定,该组培苗在培养时一直处于盐胁迫状态;我们将SC8组培苗移栽至大田中,比较其与正常种植的木薯SC8的田间长势;进一步对其进行盐胁迫,对盐胁迫后的SC8组培苗的耐盐性与正常种植的SC8进行研究,为木薯耐盐种质的选育及木薯耐盐机理的研究提供依据。
BADAWI GH, YAMAUCHI Y, SHIMADA E, et al, 2004. Enhanced tolerance to salt stress and water deficit by overexpressing superoxide dismutase in tobacco (Nicotianatabacum) chloroplasts [J]. Plant Sci, 166(40): 919-928.
BORSANI O, VALPUESTA V, BOTELLA MA, 2001. Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress inArabidopsisseedlings [J]. Plant Physiol, 126(3): 1024-1030.
CHERUTH AJ, RAGUPATHI G, PARAMASIVAM M, et al, 2007. Responses of antioxidant defense system ofCatharanthusroseus(L.) G. Don. to paclobutrazol treatment under salinity[J].Acta Physiol Plant, 29(3): 205-209.
DARWISH E, TESTERINK C, KHALIL M, et al, 2009. Phospholipid signaling responses in salt-stressed rice leaves [J]. Plant Cell Physiol, 50: 986-997.
DEHGHAN G, AMJAD L, NOSRATI H, 2013. Responses of Alfalfa leaves and roots under different salinity levels [J].Acta Biol Hung, 64: 207-217.
GU B, YAO QQ, LI KM, et al, 2013. Change in physicochemical traits of cassava roots and starches associated with genotypes and environmental factors [J]. Starch, 65: 253-263.
LIANG YC, CHEN Q, ZHANG WH, et al, 2003. Exogenous silicon (Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (HordeumvulgareL.)[J]. J Plant Physiol, 160(10): 1157-1164.LI HS, 2006. The experiment principles and techniques of plant physiology and biochemistry [M]. Beijing: Higher Education Press: 134-137; 261-263. [李合生, 2006.植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 134-137; 261-263.]
LI XY, ZHAO CZ, CHEN XJ, et al, 2015. Effects of salt stress on physiological and biochemical indexes ofCamelinasativaseedlings[J]. Acta Agric Boreal-Occident Sin, 24(4): 76-83. [李晓雅, 赵翠珠, 程小军等, 2015. 盐胁迫对亚麻荠幼苗生理生化指标的影响[J]. 西北农业学报, 24(4): 76-83.]LU Y, LI JQ, ZENG FJ et al, 2014. Effects of NaCl treatments on growth and eco-physiological characteristics ofTamarixramosissima[J]. J Desert Res, 34(6): 1509-1515. [鲁艳, 雷加强, 曾凡江等, 2014. NaCl处理对多枝生柽柳(Tamarixramosissima)生长及生理的影响[J].中国沙漠, 34(6): 1509-1515.]
MELONI DA,OLIVA MA,CAMBRAIA J, 2003. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress [J]. Environ Exp Bot, 49(1): 69-76.
MISHRA P, BHOOMIKA K, DUBEY RS, 2013. Differnential responses of antioxidative defense system to prolonged salinity stress in salt-tolerant and salt-sensitive Indica rice (OryzasativaL.) seedlings [J]. Protoplasma, 250: 3-19.
MUNNS R, 2002. Comparative physiology of salt and water stress [J]. Plant Cell Environ, 25: 239-250.
ROGERS DJ, 1963. Studies onManihotesculentaCrantz (cassava) and related species [J]. Bull Torrey Bot Club, 90: 42-54.
SECKIN B, TURKAN I, SEKMEN AH, et al, 2010. The role of antioxidant defense systems at differential salt tolerance ofH.marinumHuds. (sea barleygrass) andHordeumvulgareL.(cultivated barley)[J]. Environ Exp Bot, 69: 76-85.
SHEREEN A, MUMTAZ S, RAZA S, et al, 2005. Salinity effects on seedling growth and yield components of different inbred rice lines [J]. Pakistan J Bot, 37: 131-139.
XIAO Q, ZHENG HL, CHEN Y, et al, 2005. Effects of salinity on the growth and proline, soluble sugar and protein contents ofSpartinaalterniflora[J]. Chin J Ecol, 24(4) : 373-376.[肖强, 郑海雷, 陈瑶等, 2005. 盐度对互花米草生长及脯氨酸、可溶性糖和蛋白质含量的影响[J]. 生态学杂志, 24(4) : 373-376.]
XIONG L, SCHUMAKER KS, ZHU JK, 2002. Cell signaling during cold,drought,and salt stress[J]. Plant Cell, 14: S165-S183.
XU J, DUAN XG, YANG J, et al, 2013. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots [J]. Plant Physiol, 16: 1517-1528.
XU J, YANG J, DUAN XG, et al, 2014. Increased expression of native cytosolic Cu/Zn superoxide dismutase and ascorbate peroxidase improves tolerance to oxidative and chilling stress in cassava (ManihotesculentaCrantz ) [J]. BMC Plant Biol, 14: 208.
YANG T, YAN CL, LI YH, 2003. Na+and Cl-accumulation and salt resistance ofCasuarinaequisetifaliaseedlings under salt stress[J]. Fujian J Agric Sci, 18(3): 155-159.[杨涛, 严重玲, 李裕红, 2003. 盐胁迫下木麻黄幼苗的Na+、Cl-累积及其抗盐能力评价[J].福建农业学报, 18(3): 155-159.]
YOU J, WANG WR, LU J, et al, 2012. Effects of salinity on seed germination and seedling growth in halophyteLimoniumaureumL. Hill [J]. Acta Ecol Sin, 32(12): 3825-3833. [尤佳, 王文瑞, 卢金等, 2012. 盐胁迫对盐生植物黄花补血草种子萌发和幼苗生长的影响[J]. 生态学报, 32(12): 3825-3833.]
ZHANG XY, YU T, 2015. Study on response of ROS and antioxidant enzyme activity in sprouting jerusalem artichoke tubers under salt stress[J]. Mod Agric Sci Technol, 19: 89-90, 93. [张喜洋, 于涛, 2015. 盐胁迫下菊芋块茎萌芽成苗过程中活性氧与抗氧化酶活性的变化研究[J]. 现代农业科技, 19: 89-90, 93.]
Physiological mechanism of cassava South China 8 tissue culture seedling under salt stress
XUE Jing-Jing, ZHU Wen-Li, CHEN Song-Bi*
( Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory ofConservationandUtilizationforCassavaGermplasmResources, Danzhou 571737, Hainan, China )
The cassava (Manihotesculenta) South China 8 (SC8) tissue culture seedlings were conducted to investigate the physiological mechanism in response to salt stress. Effects of MS medium treatment contained NaCl (0, 5, 20, 35, 50 mmol·L-1and R50 mmol·L-1) on the growth and physiological indexes activities of Cassava SC8 tissue culture seedlings were evaluated. The physiological indexes include chlorophyll, hydrogen peroxide (H2O2), malonaldehyde (MDA) content, and the activities of superoxide dismutases (SOD), catalases (CAT), peroxidase (POD), ascorbate peroxidase (APX). The results of physiological showed that the growth of SC8 tissue culture seedlings did not change significantly after NaCl content (≤20 mmol·L-1) stress for 60 d, but high content (≥35 mmol·L-1) of the stress had inhibited SC8 tissue culture seedlings growth. The growth of SC8 tissue culture seedlings could be recovered at NaCl concent (50 mmol·L-1) stress for 30 d after they were transferred to the normal MS medium of 30 d. Chlorophyll and MDA contents were accumulated at NaCl content(≤35 mmol·L-1) stress, but which were not accumulated at NaCl content(≥50 mmol·L-1) stress. H2O2content had no obvious change at NaCl content stress which it was compared with control. Activities of antioxidant enzymes including POD, CAT and APX were increased at NaCl stress, whereas the activities of SOD, CAT and APX were decreased at higher NaCl stress. The results of real-time quantitative PCR showed that the expression level of SOD, CAT, POD and APX were higher than control at NaCl content(≥50 mmol·L-1)stress. The results indicated that salt stress for a short period of time would not cause devastating damage to cassava, which could improve the salt tolerance of cassava by regulating the activity of physiological indexes.
cassava, NaCl stress, physiological indexes measuring, correlation analysis, Q-PCR
10.11931/guihaia.gxzw201510027
2015-10-27
2016-01-26
国家“十二五”农村领域科技计划项目 (2012AA101204-2);海南省高层次创新创业人才启动基金;中央级公益性科研院所基本科研业务费专项(1630032013005) [Supported by National Scientific and Technological Programs in Rural Fields(2012AA101204-2); the Initial Fund of High-levele Creative Talents in Hainan Province; the National Nonprofit Institute Research Grant of CATAS-TCGRI(1630032013005)]。
薛晶晶(1983-),女,河南灵宝人,博士,助理研究员,研究方向为木薯基因克隆和表观遗传学研究,(E-mail) xuetao608@163.com。
*通讯作者: 陈松笔,博士,研究员,从事木薯蛋白质组学研究,(E-mail) songbichen@hotmail.com。
Q945.78
A
1000-3142(2016)12-1460-08
薛晶晶, 朱文丽, 陈松笔. 木薯华南8号组培苗对盐胁迫的生理响应[J]. 广西植物, 2016, 36(12):1460-1467
XUE JJ, ZHU WL, CHEN SB. Physiological mechanism of cassava South China 8 tissue culture seedling under salt stress[J]. Guihaia, 2016, 36(12):1460-1467
