难治性类风湿关节炎托珠单抗治疗临床观察
2017-01-04孙丽君林玮闫永龙郑桂敏李芳曹京旌宁晓然张凤肖
孙丽君 林玮 闫永龙 郑桂敏 李芳 曹京旌 宁晓然 张凤肖
难治性类风湿关节炎托珠单抗治疗临床观察
孙丽君 林玮 闫永龙 郑桂敏 李芳 曹京旌 宁晓然 张凤肖
目的 研究注射托珠单抗注射液(雅美罗)治疗活动性RA 4周、8周、16周的临床疗效及不良反应。方法15例活动性RA患者接受托珠单抗注射液治疗,观察治疗前、第4、8、16周各项观察指标变化,并记录不良反应发生情况。观察指标有血常规、肝功能、肾功能、压痛关节数、肿胀关节数、ESR、CRP、DAS28评分。结果15例RA患者,托珠单抗注射液治疗后ESR、CRP均有不同程度改善,与治疗前比较差异有统计学意义(P<0.01);DAS28评分对治疗前、治疗后第4、8、16周进行比较,发现治疗后第4周即有显著改善,差异具有统计学意义 (P<0.01)。结论托珠单抗注射液能在短时间内迅速改善活动性RA的临床症状和实验室炎性活动指标,可显著改善病情。
类风湿关节炎;托珠单抗;临床评价
类风湿关节炎(rheumatoid arthritis,RA)是一种以对称性累及关节及关节周围软组织的系统性自身免疫性疾病,可伴有强烈的疼痛,不可逆的关节破坏和系统性并发症,例如疲劳,贫血和发热等[1,2]。该病呈慢性、进行性侵蚀性发展。如不及时有效地控制疾病活动性,大约70%的患者在1年内即可出现不可逆的关节破坏[3,4]。病程迁延及疾病的高活动性可进一步加剧骨破坏,致残致畸性强。 在关节腔内,炎性细胞侵入滑膜,促进新生血管形成。然后滑膜细胞增生形成滑膜炎,即所谓的血管翳。滑膜炎导致软骨破坏和相邻骨的侵蚀。RA患者的血清和滑膜中IL-6水平增加和IL-6所致的促炎活性增加,例如滑膜成纤维细胞增殖,破骨细胞分化增加以及基质金属蛋白酶(MMP)和血管内皮生长因子(VEGF)的产生,IL-6参与RA的发病机制。 目前,临床上常用的RA生物制剂包括肿瘤坏死因子(TNF)-α抑制剂(依那西普和英夫利昔单抗)和重组人源化IL-6受体单克隆抗体TCZ(托珠单抗)。经过近些年的研究,TNF-α抑制剂的抑炎机制相对清楚。 研究表明,通过Foxp3磷酸化,RA患者滑膜中Treg细胞的免疫抑制功能显著降低。 TNF-α抑制剂治疗明显改变Foxp3磷酸化,恢复Treg细胞的免疫抑制功能,显著降低外周血和血清IL-17水平的Th17细胞比例。白细胞介素-6(IL-6)的过度产生在其发病机制中起重要作用[5,6]。托珠单抗为重组人源化抗人IL-6受体单克隆抗体,可以特异性与可溶性及膜性IL-6受体结合阻断信号传导,从而抑制IL-6活性。有研究表明,TCZ在传统的改变病情的抗风湿药(sDMARDs)治疗无效(例如:甲氨蝶呤、来氟米特等)以及其他生物制剂(bDMARDs)治疗效果不佳(例如:肿瘤坏死因子拮抗剂)的患者有很好的表现[7-9]。此外,有证据表明,使用利妥昔单抗(RTX)(一种靶向CD20 B细胞的嵌合单克隆抗体)使B细胞消耗在难治的类风湿关节炎患者长达18个月的随访治疗中,TCZ亦显示了良好的结果[10,11]。本研究旨在前瞻性评估15例托珠单抗治疗活动性类风湿患者临床疗效。
1 资料与方法
1.1 一般资料 2014年8月至 2016年10月河北省人民医院住院及门诊活动性类风湿患者15例。
1.2 纳入标准 年龄18~65岁,符合2009年版类风湿性关节炎 ACR/EULAR 分类标准诊断。关节受累情况(0~5 分):(1)1个中大关节0分;2~10个中大关节1分;1~3个小关节2分;4~10个小关节3分;>10个小关节5分;(2)血清学(0~3分)RF和抗CCP抗体均阴性0分;RF和/或抗 CCP 抗体低滴度阳性(滴度超过正常,但小于3倍正常上限) 2分;RF和抗CCP 抗体高滴度(滴度高于正常上限3倍)3分;(3)滑膜炎的病程:小于6周0分;大于等于6周1分;(4)急性时相反应(0~1)CRP和ESR均正常0分;CRP和(或)ESR升高1分。总分在6分以上即诊为确定RA。
1.3 排除标准 其他炎症性风湿性疾病,严重感染,结核,恶性肿瘤,重要脏器衰竭等。
1.4 方法 受试者每4周静脉滴注1次托珠单抗8 mg/kg,每次最大剂量不超过800 mg。治疗期间,如果患者丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)升高大于正常上限的3倍,可减量或暂停使用托珠单抗;如连续2次ALT或AST升高>3倍正常上限或单次升高>5倍正常上限,停用托珠单抗。研究方案获得河北省人民医院伦理委员会批准,均签署知情同意书。
1.5 观察指标 DAS28评价RA患者疾病活动度,其中DAS28<2.6为临床缓解,DAS28<3.2为轻度活动,3.2
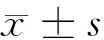
2 结果
2.1 一般资料 共计15例难治活动性RA患者入组,其中男2例,女13例,男女比例为1∶6.5, 第一次应用托珠单抗患者,年龄16~61岁,平均年龄(45.8±13.6)岁;病程5~360个月,平均病程(87.9±95.5)月。所有患者中,12例患者血清高水平RF或高水平抗-CCP抗体。在15例接受托珠单抗治疗的RA患者中,绝大部分(n=11)是传统治疗或其他生物制剂无效的患者。4例患者为接受传统治疗联合生物制剂治疗。见表1。
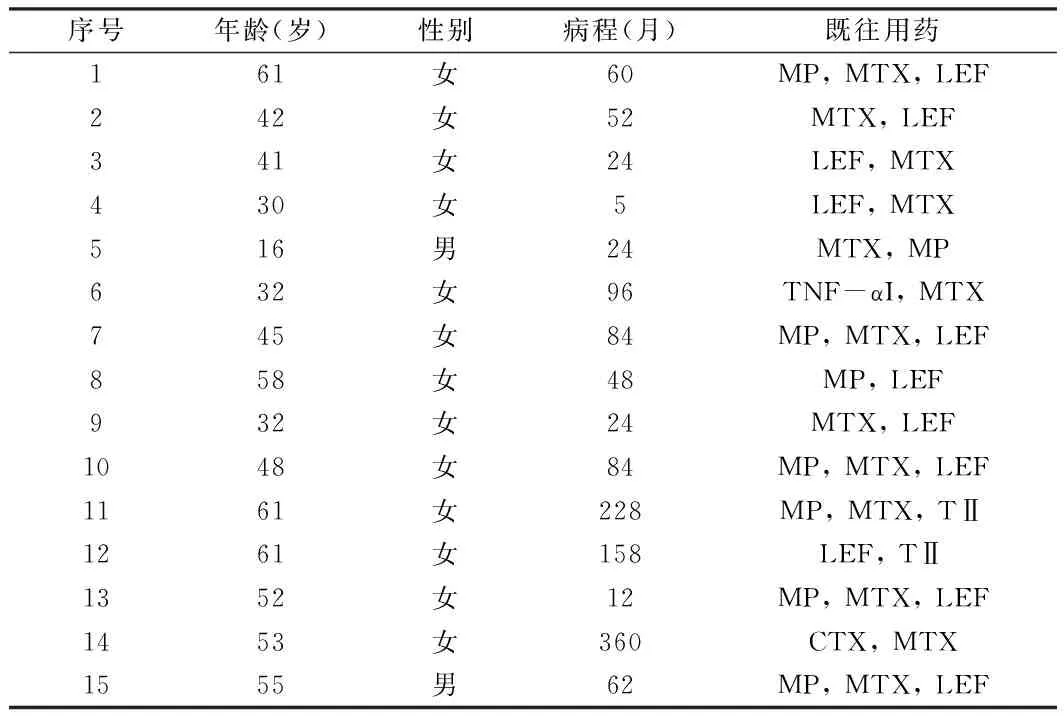
表1 患者队列的临床特点及既往抗风湿治疗策略
注:MP 美卓乐;MTX 甲氨蝶呤;LEF 来氟米特;CTX 环磷酰胺;TNF-αI 肿瘤坏死因子α抑制剂;TⅡ 雷公藤多苷片
2.2 疗效指标
2.2.1 入组RA患者基线ESR为(47.8±22.9)mm/h,托珠单抗治疗4周后下降为(14.2±19.6)mm/h,较基线水平显著下降(P=0.0002);治疗8周后,ESR降为(7.21±6.74mm/h),与基线比较差异有统计学意义(P<0.0001),与治疗4周相比较差异有统计学意义(P=0.22);治疗16周后,ESR为(10.31±11.53)mm/h,与基线比较差异有统计学意义(P<0.0001),与治疗8周相比较无差异(P=0.36)。见图1-A、表2。
2.2.2 托珠单抗治疗4周后,基线入组RA患者CRP由(22.90±15.20)mg/L下降为(6.89±10.26)mg/L,较基线水平显著下降(P=0.002);CRP治疗8周后下降为(4.98±9.77 mg/L),与基线比较P=0.0006,与治疗4周相比较无明显差异(P=0.61);治疗16周后,CRP为(3.02±5.63 mg/L),与基线比较差异有统计学意义(P<0.0001),与治疗8周相比较无差异(P=0.51)。见图1-B、表2。
2.2.3 基线患者RF为(194.6±195.7)U/ml,托珠单抗治疗4周后下降为(158.9±177.2U/ml,P=0.63),较基线水平下降无统计学意义;治疗8周后,RF降为(151.5±186.9 IU/ml),与基线比较P=0.57,与治疗4周相比较P=0.92,均无统计学差异;治疗16周后,RF为(108±143.6 IU/ml),与基线比较P=0.21,与治疗4周相比较(P=0.43)、治疗8周相比较(P=0.51)无差异。见图1-C、表2。
2.2.4 基线RA患者DAS28评分为(5.31±1.00),治疗4周后下降为(3.35±1.37,P<0.0001),较基线水平显著下降;治疗8周后,DAS28下降为(2.94±1.06),与基线比较差异有统计学意义(P<0.0001),与治疗4周相比较P=0.37无统计学差异;治疗16周后,DAS28为(2.19±0.86),与基线比较差异有统计学意义(P<0.0001),与治疗8周比较差异有统计学意义(P=0.04)。见图1-D、表2。

图1 托珠单抗治疗基线、4周、8周、16周疗效评估
注:*P<0.001
2.3 不良反应 本次入组15例患者中,3例发生谷丙转氨酶轻度升高(不超过正常值上限2倍),暂停托珠单抗治疗后复查正常。未出现严重的皮肤过敏反应、感染、胃肠道症状及脑缺血发作或中风等不良反应。


时间ESR(mm/h)CRP(mg/L)RF(U/L)DAS-28基线@47.8±22.922.9±15.2194.6±195.75.31±1.00治疗4周#14.2±19.66.89±10.26158.9±177.23.35±1.37治疗8周&7.21±6.744.98±9.77151.5±186.92.94±1.06治疗16周*10.5±11.53.02±5.63108±143.62.19±0.86P值(@VS#)0.00020.00210.630.0001P值(@VS&)<0.00010.00060.57<0.0001P值(@VS*)<0.0001<0.00010.21<0.0001P值(#VS*)0.540.210.430.01P值(&VS*)0.360.510.510.04P值(&VS#)0.220.610.920.37
3 讨论
RA病因及发病机制尚未完全明确,但多方面证据表明IL-6在RA发病中扮演重要角色[12]。IL-6可以诱导内皮细胞表达粘附分子,促进白细胞与血管内皮粘附渗透导致局部炎症,可刺激滑膜纤维母细胞和软骨细胞产生前列腺素E2和胶原等促进骨质破坏和骨吸收及纤维母细胞增生,抑制骨胶原合成。研究表明,血清IL-6水平与RA炎症程度高度相关,与疾病活动度变化相一致,并且与血沉、C反应蛋白、纤维蛋白原水平呈相关[13]。中重度活动性RA 患者的关节液中IL-6明显升高,RA活动性越高关节炎症越重。
RA患者外周血中IL-6水平明显升高,说明其在 RA发病过程中起重要作用。本研究结果显示,托珠单抗治疗后患者炎症指标较前明显下降,说明托珠单抗治疗活动性RA有较好疗效,且起效迅速。且可以更有效地降低疾病活动度,约1/2左右患者达到了短期的临床缓解。
在我们的队列中,只有少数患者出现需要停止治疗的显着副作用。共有3例受试者发生过肝酶升高不良事件,且均在停药后缓解。副作用谱与STREAM试验研究中描述相似[14]。虽然我们的患者并未发现中性粒细胞减少,但该不良反应仍然非常需要临床关注。RA-贫血的发病机制是复杂和多因素的。尽管主要由IL-6-铁调素轴介导的贫血被认为是RA中贫血的最常见原因。而缺铁性贫血(IDA),有时由与使用非甾体抗炎药物相关的胃肠道溃疡丢失引起,已被估计为RA中第二种最常见的贫血形式。有研究表明,一些患者显示相对低的血清铁调素和铁蛋白水平,这些患者的贫血可能主要由于缺铁所致。贫血亦应得到重视。此外,在TCZ应用过程中不良事件的发生(包括感染)与先前口服DMARD所导致的不良事件之间并未发现明确的相关性。因此,我们的有理由表明TCZ治疗有良好的安全性。
该应用TCZ治疗的活动性RA患者的队列研究中,没有1例患者发生显著的心血管事件。 这可能与Rao等[15]研究描述的改善的DAS-28和降低的心血管风险之间的已知相关性有关。然而,我们的研究病例人数较少,时间较短,尚不能完全评估,长期的随访观察仍在进行中。
在本次队列随访中尚未发现肿瘤发生。类风湿性关节炎的患者与无该病的大部分人群相比较,发生恶性肿瘤的几率相当; 然而,对于某些解剖学位点特异的恶性肿瘤(例如淋巴瘤和肺癌),RA患者的风险明显增加,甚至有研究报道于皮肤癌,特别是非黑素瘤皮肤癌的风险增加。大型流调结果显示RA患者肺癌的风险估计高20%~80%,淋巴瘤的风险高约2倍,而非黑素瘤皮肤癌的风险高60%~90%。在使用免疫抑制剂的RA患者中恶性肿瘤的风险可能更大,包括血液恶性肿瘤。在临床试验研究中,迄今为止对于用TCZ治疗的RA患者的长期数据并没有显示总体或位点特异性恶性肿瘤的风险高于RA预期的风险。RA的托珠单抗治疗的恶性肿瘤的长期风险有待长期大宗数据支持。
我们研究中81%的患者为女性,TCZ治疗开始时的平均年龄为45岁。这些人口学特征与先前的研究相当[16],79%为女性,平均年龄为57岁。由于我们样本的例数较少,高比例的女性可能是抽样效应,但同时也提示我们,性别可能是药物治疗效果不同的影响因素。
在这项研究中,没有患者因无效而停用TCZ。然而,目前尚无统一定论预测对TCZ的反应性。 一项早期的研究探索了RA患者血清和关节滑液的细胞因子谱,并得出结论,这可能影响对生物制剂治疗的反应。另有研究发现,患者基线血清IL-6水平是预测对TCZ治疗反应的潜在生物标志物。滑膜高IL- 6水平是抗TNF-α和RTX不应性RA患者对TCZ的良好反应的有效预测[17,18]。需要进一步研究以探讨对TCZ的反应或对抗性的确切机制。
总之IL-6对活动性RA均有较好短期疗效,能迅速改善疗效指标,降低疾病活动度,并有可能阻止或修复其影像学进展。尤其对于活动性 RA 患者疗效更显著。本研究结果也表明IL-6 治疗 RA 具有较好的安全性。我们的研究是单中心观察,患者数量相对较少,需要更大的多中心队列研究来证实RA中TCZ治疗的长期疗效及安全性。
1 王国华.类风湿关节炎免疫发病机制研究进展.中国组织化学与细胞化学杂志,2010,19:309-312.
2 谢庆云,魏萌,张波,等.外周血炎性细胞因子与类风湿关节炎.中国组织工程研究,2012,16:7945-7950.
3 Smolen JS,Aletaha D,Koeller M,et al.New therapies for treatment of rheumatoid arthritis.Lancet,2007,370:1861-1874.
4 Yazici Y.Treatment of rheumatoid arthritis: we are getting there.Lancet,2009,374:178-180.
5 苗平,陆梅生,张冬青.IL-6/IL-6受体与类风湿关节炎关联性研究新进展.免疫学杂志,2011,27:355-360.
6 刘德芳,郭明阳,呼永河,等.类风湿关节炎湿热痹阻型患者血清和关节液IL-1、IL-6、TNF-α的表达研究.免疫学杂志,2014,30:447-451.
7 Yazici Y,Curtis JR,Ince A,et al.Efficacy of tocilizumab in patients with moderate to severe active rheumatoid arthritis and a previous inadequate response to disease-modifying antirheumatic drugs: the ROSE study.Ann Rheum Dis,2012,71:198-205.
8 Wright HL,Mewar D,Bucknall RC,et al.Synovial fluid IL-6 concentrations associated with positive response to tocilizumab in an RA patient with failed response to anti-TNF and rituximab.Rheumatology (Oxford),2015,54:743-744.
9 Emery P,Keystone E,Tony HP,et al.IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial.Ann Rheum Dis,2008,67:1516-1523.
10 Das S,Vital EM,Horton S,et al.Abatacept or tocilizumab after rituximab in rheumatoid arthritis? An exploratory study suggests non-response to rituximab is associated with persistently high IL-6 and better clinical response to IL-6 blocking therapy.Ann Rheum Dis,2014,73:909-912.
11 Addimanda O,Possemato N,Macchioni P,et al.Efficacy and safety of tocilizumab in refractory rheumatoid arthritis: a real life cohort from a single centre.Clin Exp Rheumatol,2014,32:460-464.
12 Kneepkens EL,van den Oever I,Plasencia CH,et al.Serum tocilizumab trough concentration can be used to monitor systemic IL-6 receptor blockade in patients with rheumatoid arthritis: a prospective observational cohort study.Scand J Rheumatol,2016,27:1-8.
13 Shimamoto K,Ito T,Ozaki Y,et al.Serum interleukin 6 before and after therapy with tocilizumab is a principal biomarker in patients with rheumatoid arthritis.J Rheumatol,2013,40:1074-1081.
14 Nishimoto N,Miyasaka N,Yamamoto K,et al.Long-term safety and efficacy of tocilizumab,an anti-IL-6 receptor monoclonal antibody,in monotherapy,in patients with rheumatoid arthritis (the STREAM study): evidence of safety and efficacy in a 5-year extension study.Ann Rheum Dis,2009,68:1580-1584.
15 Rao VU,Pavlov A,Klearman M,et al.An evaluation of risk factors for major adverse cardiovascular events during tocilizumab therapy.Arthritis Rheumatol,2015,67:372-380.
16 Sokka T,Toloza S,Cutolo M,et al.Women,men,and rheumatoid arthritis: analyses of disease activity,disease characteristics,and treatments in the QUEST-RA study.Arthritis Res Ther,2009,11:R7.
17 Wright HL,Bucknall RC,Moots RJ,et al.Analysis of SF and plasma cytokines provides insights into the mechanisms of inflammatory arthritis and may predict response to therapy.Rheumatology (Oxford),2012,51:451-459.
18 Shimamoto K,Ito T,Ozaki Y,et al.Serum interleukin 6 before and after therapy with tocilizumab is a principal biomarker in patients with rheumatoid arthritis.J Rheumatol,2013,40:1074-1081.
10.3969/j.issn.1002-7386.2016.24.021
050051 石家庄市,河北省人民医院风湿免疫科
R 593.22
A
1002-7386(2016)24-3758-04
2016-07-06)
