N-甲基-1-萘甲胺衍生物的合成及表征
2017-01-04刘陆智华忠泽段文贵林桂汕
刘陆智,覃 雪,华忠泽,段文贵,岑 波,林桂汕
(广西大学化学化工学院, 广西南宁530004)
N-甲基-1-萘甲胺衍生物的合成及表征
刘陆智,覃 雪,华忠泽,段文贵,岑 波,林桂汕
(广西大学化学化工学院, 广西南宁530004)
为了研究以手性氮为中心的手性客体的主客体性能,以N-甲基-1-萘甲胺、二溴代烷烃或溴代烷烃为原料,在K2CO3催化作用下合成得到12个N-甲基-1-萘甲胺衍生物A1~A6以及S1~S6,其中,A1、A4~A6、S1以及S3~S6未见文献报道,并利用FT-IR、1H NMR、13C NMR以及ESI-MS对合成的化合物进行了分析表征。
N-甲基-1-萘甲胺;叔胺;铵盐;合成
叔胺是一类非常重要的有机化合物,本身及其衍生物在浮选捕收剂[1],手性催化助剂[2-4],农药医药[5-6]等领域有广泛的应用。此外,脂肪叔胺既可作为配置产品,又可以作为各种化学衍生物的中间体[7-8],可用于合成多种阳离子及两性表面活性剂,如广泛使用的叔胺主要有三类产品:单烷基二甲基叔胺、双烷基甲基叔胺和胺的乙氧基化物。
在众多的叔胺产品中,N-甲基-1-萘甲胺及其衍生物因具有抗菌活性[9-10]及在医药方面的应用前景而引起人们的关注。同时,萘作为荧光基团,其荧光发射的量子产率很高[11],可用于荧光分析[12-13],也可做成荧光传感器[14],萘基的引入利于叔胺或其盐酸盐在紫外、荧光及HPLC的检测。本文选择N-甲基-1-萘甲胺为原料,合成一系列叔胺及其盐酸盐衍生物,并通过红外光谱、核磁共振、质谱确认了结构,以期用于与超分子化学的主客体性能研究[15-18]。合成路线如图1所示。
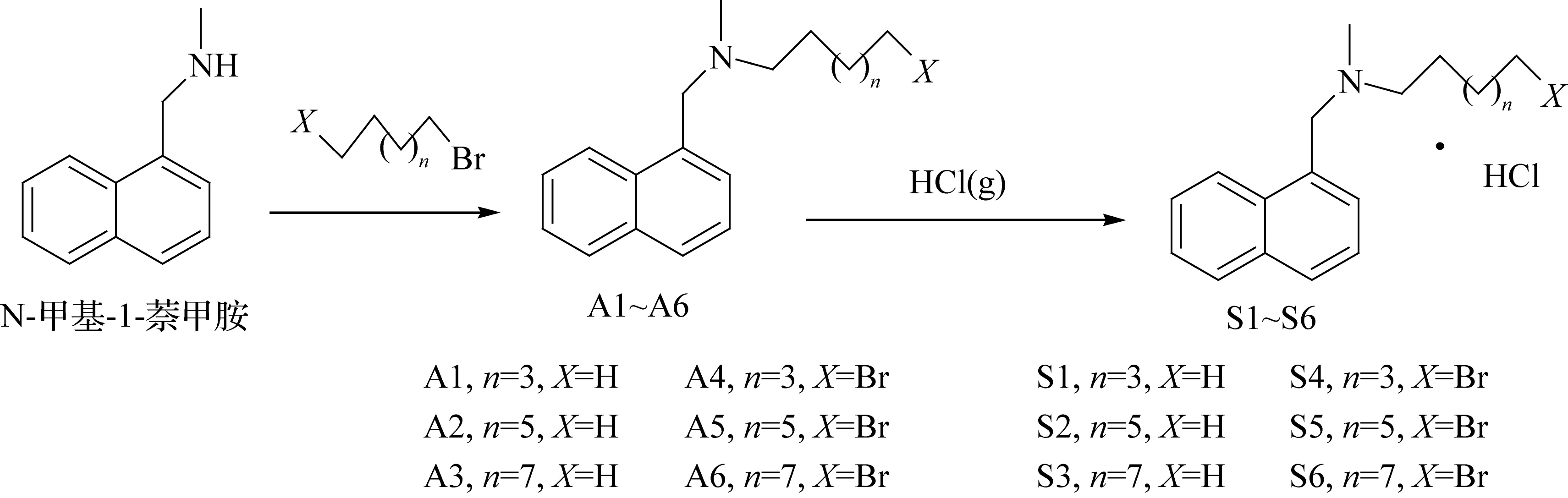
图1 N-甲基-1-萘甲胺衍生物的合成路线Fig.1 Synthetic route of N-methyl-1-naphthylmethylamine derivatives
1 实验部分
1.1 主要仪器和试剂
Nicolet iS50 FT-IR型红外光谱仪(美国Thermo Scientific公司);AVANCE Ⅲ HD 600 MHz型超导核磁共振仪(瑞士Brucker公司);TSQ Quantum Access MAX型液相色谱—质谱联用仪(美国Thermo Scientific公司); MP420型全自动熔点仪(济南海能仪器股份有限公司)。
N-甲基-1-萘甲胺(AR, Ark Pharm, Inc.);1-溴代正己烷、1,6-二溴己烷、1-溴代正辛烷、1,8-二溴辛烷、1-溴代正癸烷和1,10-二溴癸烷(AR,上海阿拉丁试剂公司);其他试剂均为市售分析纯试剂。
1.2 产物分子A1~A3的合成
参照文献[19]。在250 mL两口烧瓶中,依次加入80 mL乙腈、806 mg (5.8 mmol)无水K2CO3、相对应的正溴烷烃(23.2 mmol)和少量KI,缓慢滴加2 g (11.6 mmol) N-甲基-1-萘甲胺,在81 ℃回流搅拌反应,TLC跟踪反应进程。反应结束,冷却至室温,将反应液倒入100 mL的去离子水中,用二氯甲烷萃取(40 mL×3),无水Na2SO4干燥,过滤浓缩,通过层析柱(V石油醚∶V乙酸乙酯=40∶1)得到无色液体A1~A3。
1.3 产物分子A4~A6的合成
在250 mL两口烧瓶中,依次加入80 mL乙腈、806 mg (5.8 mmol)无水K2CO3和相对应二溴烷烃(23.2 mmol),缓慢滴加2 g (11.6 mmol) N-甲基-1-萘甲胺,在50 ℃条件下反应,TLC跟踪反应进程。反应结束后,冷却至室温,将反应液倒入100 mL的去离子水中,用二氯甲烷萃取(40 mL × 3),无水Na2SO4干燥,过滤浓缩,通过层析柱(V石油醚∶V乙酸乙酯=40∶1)得到淡棕色油状液体A4~A6。
1.4 产物分子S1~S6的合成
以S1的合成为例。在100 mL两口烧瓶中,依次加入1 g A1和40 mL无水乙醇,在常温搅拌下通入HCl气体,一段时间后,加热到50 ℃条件下反应。TLC跟踪反应进程,反应结束后,通过层析柱(V二氯甲烷∶V甲醇=30∶1)得到粉末状固体S1。同法得到S2~S6。
2 结果与讨论
2.1 产物的表征
N-甲基-N-己基-1-萘甲胺(A1):无色液体,收率75 %。IR (KBr)ν/cm-1:3 047 (νC=C—H), 2 961, 2 968, 2 860, 2 789 (νC—H), 1 599, 1 506, 1 468 (νNp—C=C—H), 792, 771 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.35 (d,J=8.5 Hz, 1H), 7.91~7.87 (m, 1H), 7.81 (d,J=7.8 Hz, 1H), 7.53 (dddd,J=23.2, 8.0, 6.8, 1.3 Hz, 2H), 7.46 (dt,J=14.8, 6.3 Hz, 2H), 3.92 (s, 2H); 2.54~2.49 (m, 2H), 2.25 (s, 3H), 1.65~1.58 (m, 2H), 1.37~1.28 (m, 6H), 0.92 (t,J=7.0 Hz, 3H);13C NMR (151 MHz, CDCl3),δ: 135.3, 133.9, 132.6, 128.4, 127.8, 127.3, 125.7, 125.5, 125.1, 124.8, 60.9, 58.3, 42.3, 31.8, 27.4, 27.2, 22.7, 14.1; ESI-MS,m/z: 256.25([M+H]+)。
N-甲基-N-辛基-1-萘甲胺(A2):无色液体,收率68.3 %。IR (KBr)ν/cm-1: 3 041 (νC=C—H), 2 931, 2 857, 2 792 (νC—H), 1 596, 1 509, 1 468 (νNp—C=C—H), 789, 771 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.38~8.33 (m, 1H), 7.88 (d,J=8.0 Hz, 1H), 7.80 (d,J=7.8 Hz, 1H), 7.58~7.49 (m, 2H), 7.48~7.41 (m, 2H), 3.91 (s, 2H), 2.53~2.48 (m, 2H), 2.24 (d,J=2.1 Hz, 3H), 1.60 (dd,J=14.0, 6.2 Hz, 2H), 1.33 (dd,J=18.4, 12.3 Hz, 10H), 0.96~0.90 (m, 3H);13C NMR (151 MHz, CDCl3),δ: 135.3, 133.9, 132.6, 128.4, 127.8, 127.3, 125.7, 125.5, 125.1, 124.8, 60.9, 58.3, 42.3, 31.9, 29.6, 29.4, 27.5, 22.7, 14.2; ESI-MS,m/z: 283.87([M+H]+)。
N-甲基-N-癸基-1-萘甲胺(A3):无色液体,收率72.8 %。IR (KBr)ν/cm-1: 3 048 (νC=C—H), 2 928, 2 854, 2 793 (νC—H), 1 600, 1 510, 1 469 (νNp—C=C—H), 792, 776 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.35 (d,J=8.2 Hz, 1H), 7.88 (d,J=8.0 Hz, 1H), 7.80 (d,J=7.8 Hz, 1H), 7.56~7.49 (m, 2H), 7.48~7.39 (m, 2H), 3.91 (s, 2H), 2.50 (dd,J=10.3, 4.3 Hz, 2H), 2.24 (d,J=2.4 Hz, 3H), 1.60 (d,J=6.7 Hz, 2H), 1.31 (d,J=27.2 Hz, 14H), 0.93 (ddd,J=7.1, 4.4, 2.1 Hz, 3H);13C NMR (151 MHz, CDCl3),δ: 135.3, 133.9, 132.6, 128.4, 127.8, 127.3, 125.7, 125.5, 125.1, 124.8, 60.9, 58.3, 42.3, 31.9, 29.8~29.5, 29.4, 27.5, 22.7, 14.1; ESI-MS,m/z: 311.87([M+H]+)。
N-甲基-N-(6-溴-己基)-1-萘甲胺(A4):淡棕色油状液体,收率65.6 %。IR (KBr)ν/cm-1: 3 050 (νC=C—H), 2 928, 2 848, 2 786 (νC—H), 1 599, 1 509, 1 462 (νNp—C=C—H), 789, 774 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.45 (d,J=8.4 Hz, 1H), 7.96 (d,J=8.0 Hz, 1H), 7.89 (d,J=7.4 Hz, 1H), 7.67~7.57 (m, 2H), 7.56~7.50 (m, 2H), 3.99 (d,J=2.6 Hz, 2H), 3.41 (t,J=6.9 Hz, 2H), 2.58~2.53 (m, 2H), 2.34 (d,J=3.4 Hz, 3H), 1.91~1.83 (m, 2H), 1.70~1.63 (m, 2H), 1.47~1.37 (m, 4H);13C NMR (151 MHz, CDCl3),δ: 135.2, 133.9, 132.6, 128.4, 127.8, 127.4, 125.7, 125.6, 125.1, 124.8, 61.0, 57.6, 42.3, 33.9, 32.9, 28.0, 27.2, 26.5; ESI-MS,m/z: 334.05([M+H]+)。
N-甲基-N-(8-溴-辛基)-1-萘甲胺(A5):淡棕色油状液体,收率73.9 %。IR (KBr)ν/cm-1: 3 044 (νC=C—H), 2 932, 2 856, 2 793 (νC-H), 1 600, 1 508, 1 467 (νNp—C=C—H), 792, 778 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.34 (d,J=8.4 Hz, 1H), 7.88 (d,J=8.0 Hz, 1H), 7.80 (d,J=7.7 Hz, 1H), 7.52 (dddd,J=21.4, 8.0, 6.8, 1.4 Hz, 2H), 7.48~7.41 (m, 2H), 3.91 (s, 2H), 3.43 (t,J=6.9 Hz, 2H), 2.51~2.46 (m, 2H), 2.24 (s, 3H), 1.89~1.83 (m, 2H), 1.62~1.56 (m, 2H), 1.41 (dd,J=14.2, 6.9 Hz, 2H), 1.32 (ddd,J=14.0, 8.1, 5.2 Hz, 6H);13C NMR (151 MHz, CDCl3),δ: 135.2, 133.9, 132.6, 128.4, 127.8, 127.3, 125.7, 125.5, 125.1, 124.8, 60.9, 58.0, 42.3, 33.9, 32.8, 29.3, 28.8, 28.2, 27.3; ESI-MS,m/z: 363.71([M+H]+)。
N-甲基-N-(10-溴-癸基)-1-萘甲胺(A6):淡棕色油状液体,收率68.6 %。IR (KBr)ν/cm-1: 3 047 (νC=C—H), 2 922, 2 851, 2 786 (νC—H), 1 512, 1 465 (νNp—C=C—H), 795, 774 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.35 (d,J=8.1 Hz, 1H), 7.88 (d,J=8.0 Hz, 1H), 7.80 (d,J=7.8 Hz, 1H), 7.53 (ddt,J=14.7, 6.8, 4.0 Hz, 2H), 7.48~7.39 (m, 2H), 3.91 (s, 2H), 3.44 (t,J=6.9 Hz, 2H), 2.53~2.47 (m, 2H), 2.24 (s, 3H), 1.92~1.85 (m, 2H), 1.63~1.57 (m, 2H), 1.45 (dt,J=14.7, 7.5 Hz, 2H), 1.35~1.27 (m, 10H);13C NMR (151 MHz, CDCl3),δ: 135.3, 133.9, 132.6, 128.4, 127.8, 127.3, 125.7, 125.5, 125.1, 124.7, 60.9, 58.1, 42.3, 34.0, 32.8, 29.6~29.4, 28.8, 28.2, 27.4; ESI-MS,m/z: 391.72([M+H]+)。
N-甲基-N-己基-1-萘甲胺盐酸盐(S1):白色固体,收率80.3 %,mp175 ℃~176 ℃。IR (KBr)ν/cm-1: 3 047 (νC=C—H), 2 958, 2 925, 2 854 (νC—H), 2 625, 2 527 (νN—H—Cl), 1 521, 1 456, (νNp—C=C—H), 804, 774 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 12.35 (d,J=34.5 Hz, 1H), 8.12 (d,J=8.5 Hz, 1H), 8.06 (dd,J=7.0, 2.7 Hz, 1H), 7.97~7.88 (m, 2H), 7.66~7.60 (m, 1H), 7.59~7.51 (m, 2H), 4.77 (d,J=12.9 Hz, 1H), 4.64 (d,J=12.5 Hz, 1H), 3.15 (s, 1H), 2.92 (s, 1H), 2.70 (s, 3H), 1.92 (d,J=77.0 Hz, 2H), 1.25 (d,J=3.9 Hz, 6H), 0.83 (t,J=5.6 Hz, 3H);13C NMR (151 MHz, CDCl3),δ: 133.9, 132.2, 131.7, 131.0, 129.4, 127.6, 126.4, 125.7, 124.5, 122.6, 55.8, 54.9, 39.4, 31.1, 26.4, 24.0, 22.3, 13.9; ESI-MS,m/z: 256.26([M-HCl]+)。
N-甲基-N-辛基-1-萘甲胺盐酸盐(S2):白色固体,收率75.6%,mp150 ℃~151 ℃。IR (KBr)ν/cm-1: 3 047 (νC=C—H), 2 955, 2 922, 2 851 (νC—H), 2 628, 2 530 (νN—H—Cl), 1 515, 1 462, (νNp—C=C—H), 789, 774 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 12.51 (s, 1H), 8.12 (d,J=8.4 Hz, 1H), 8.06 (s, 1H), 7.94 (dd,J=13.2, 8.1 Hz, 2H), 7.67~7.60 (m, 1H), 7.57 (dd,J=14.7, 6.8 Hz, 2H), 4.65 (s, 2H), 3.02 (d,J=124.5 Hz, 2H), 2.69 (s, 3H), 1.92 (d,J=44.5 Hz, 2H), 1.37~1.11 (m, 10H), 0.86 (q,J=7.0 Hz, 3H).13C NMR (151 MHz, CDCl3),δ: 133.9, 132.2, 131.6, 130.9, 129.4, 127.5, 126.4, 125.7, 122.6, 55.9, 55.1, 39.5, 31.6, 28.9, 26.8, 24.2, 22.5, 14.0; ESI-MS,m/z: 283.84([M-HCl]+)。
N-甲基-N-癸基-1-萘甲胺盐酸盐(S3):白色固体,收率70.3%,mp141 ℃~142 ℃。IR (KBr)ν/cm-1: 3 048 (νC=C—H), 2 958, 2 930, 2 854 (νC—H), 2 643, 2 539 (νN—H—Cl), 1 596, 1 518, 1 467 (νNp—C=C—H), 800, 776 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 12.50 (s, 1H), 8.13 (d,J=7.2 Hz, 1H), 8.01 (s, 1H), 7.96~7.91 (m, 2H), 7.62 (d,J=5.7 Hz, 1H), 7.55 (d,J=6.4 Hz, 2H), 4.60 (s, 2H), 2.94 (s, 2H), 2.64 (s, 3H), 1.89 (s, 2H), 1.25 (d,J=26.9 Hz, 14H), 0.92~0.85 (m, 3H);13C NMR (151 MHz, CDCl3),δ: 133.9, 132.3, 131.2, 130.6, 129.2, 127.3, 126.3, 125.6, 122.9, 55.9, 39.8, 31.8, 29.4, 29.2, 29.0, 26.9, 24.5, 22.6, 14.1; ESI-MS,m/z: 311.86([M-HCl]+)。
N-甲基-N-(6-溴-己基)-1-萘甲胺盐酸盐(S4):白色固体,收率73.8 %,mp116 ℃~117 ℃。IR (KBr)ν/cm-1: 3 048 (νC=C-H), 2 934, 2 858 (νC—H), 2 703, 2 643 (νN—H—Cl), 1 600, 1 516, 1 482 (νNp—C=C—H), 802, 774 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 8.16 (d,J=7.7 Hz, 1H), 8.08~8.02 (m, 1H), 7.93 (dt,J=15.8, 8.0 Hz, 2H), 7.63 (dt,J=14.3, 7.3 Hz, 1H), 7.57~7.51 (m, 2H), 4.73 (s, 2H), 3.50~3.43 (m, 2H), 3.08 (s, 2H), 2.73 (s, 3H), 1.94 (s, 2H), 1.83~1.75 (m, 1H), 1.74~1.65 (m, 1H), 1.42 (dd,J=17.5, 11.4 Hz, 2H), 1.32 (d,J=6.7 Hz, 2H);13C NMR (151 MHz, CDCl3),δ: 133.9, 132.2, 131.7, 131.0, 129.3, 127.6, 126.5, 125.6, 124.8, 122.9, 55.7, 44.8, 39.8, 33.6, 32.0, 27.4, 26.1, 24.1; ESI-MS,m/z: 334.03([M-HCl]+)。
N-甲基-N-(8-溴-辛基)-1-萘甲胺盐酸盐(S5):白色固体,收率67.8 %,mp126 ℃~127 ℃。IR (KBr)ν/cm-1: 3 046 (νC=C—H), 2 981, 2 936, 2 860 (νC-H), 2 699, 2 623, 2 590, 2 566 (νN—H—Cl), 1 602, 1 516, 1 457 (νNp—C=C—H), 807, 780 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 12.49 (s, 1H), 8.11 (d,J=8.4 Hz, 1H), 8.07 (s, 1H), 7.97~7.91 (m, 2H), 7.64 (q,J=7.2 Hz, 1H), 7.59~7.54 (m, 2H), 4.70 (d,J=57.6 Hz, 2H), 3.41~3.35 (m, 2H), 3.03 (d,J=125.5 Hz, 2H), 2.69 (s, 3H), 2.04~1.78 (m, 4H), 1.41~1.35 (m, 2H), 1.29 (s, 6H);13C NMR (151 MHz, CDCl3),δ: 133.9, 132.3~130.9, 130.9~130.4, 129.4, 127.6, 126., 125.7, 122.6, 55.8, 55.0, 39.5, 33.9, 32.5, 28.8, 28.4, 27.9, 26.6, 24.2; ESI-MS,m/z: 363.68([M-HCl]+)。
N-甲基-N-(10-溴-癸基)-1-萘甲胺盐酸盐(S6):白色固体,收率62.9 %,mp106 ℃~107 ℃。IR (KBr)ν/cm-1: 3 047 (νC=C—H), 2 920, 2 857 (νC—H), 2 631, 2 515 (νN—H—Cl), 1 593, 1 515, 1 465 (νNp—C=C—H), 801, 777 (γNp—C=C—H);1H NMR (600 MHz, CDCl3),δ: 12.45 (s, 1H), 8.12 (d,J=8.5 Hz, 1H), 8.06 (d,J=5.8 Hz, 1H), 7.99~7.91 (m, 2H), 7.64 (dd,J=14.8, 7.7 Hz, 1H), 7.60~7.54 (m, 2H), 4.69 (d,J=55.1 Hz, 2H), 3.41 (q,J=6.6 Hz, 2H), 3.02 (d,J=127.3 Hz, 2H), 2.69 (s, 3H), 2.12~1.86 (m, 2H), 1.83 (dd,J=14.4, 7.2 Hz, 2H), 1.39 (dd,J=14.4, 7.2 Hz, 2H), 1.30~1.21 (m, 10H);13C NMR (151 MHz, CDCl3),δ: 133.0, 132.2, 131.6, 130.9, 129.4, 127.6, 126.4, 125.7, 122.6, 55.8, 55.1, 45.2, 39.5, 33.9, 32.8, 29.2, 28.9, 28.6, 28.1, 26.8, 24.2; ESI-MS,m/z: 391.75([M-HCl]+)。
2.2 产物的合成
对于A1~A3,加入少量KI可以提高反应速率,而副产物量的变化不明显。对于A4~A6,加入少量KI可以提高反应速率,但是副产物也随KI的加入而增多,所以反应过程中不加入KI。对于S1~S6,以二氯甲烷为溶剂,二氯甲烷是极性非质子溶剂,对HCl气体的吸附作用不强,反应过程中有大量未被吸附的HCl气体排出。而以无水乙醇为溶剂,无水乙醇作为极性质子溶剂,能吸附比较多的HCl气体,反应过程中能充分吸收和利用HCl气体,有比较少的HCl气体放出。
2.3 产物的波谱分析
从IR谱图可以看到,所有合成的化合物在3 040 cm-1附近都出现萘环双键的伸缩振动吸收峰,2 900 cm-1和2 800 cm-1左右是甲基亚甲基的伸缩振动吸收峰,771 cm-1和795 cm-1附近是萘环单取代面外弯曲振动吸收峰。S1~S6在2 700~2 500 cm-1将出现宽峰,是铵盐N—H—Cl键的伸缩振动吸收峰,是胺盐酸盐最明显的特征峰。
在1H NMR 谱图中,盐酸盐S1~S6的氢的化学位移在12.5左右;所有合成的化合物萘环上的氢在7.3~8.5;在13C NMR 谱图中,萘环上碳的化学位移在120~135。
3 结 语
探索了仲胺与单溴烷烃及双溴烷烃的合成方法并成功制备了相应的叔胺及其盐酸盐衍生物。所合成化合物的手性氮中心结构利于其手性性能的进一步研究,本实验方法可望推广到其他芳香叔胺及不同碳链长度的烷基叔胺类衍生物的制备。
[1] 刘长淼, 曹学锋, 陈臣, 等.十二叔胺系列捕收剂对石英的浮选性能研究[J]. 矿冶工程, 2009, 29(3): 37-39.
[2] ZHAO Y, CHAO Z Y, ZENG X P, et al.Asymmetric sequential Au (I)/chiral tertiary amine catalysis: an enone-formation/cyanosilylation sequence to synthesize optically active 3-alkenyloxindoles from diazooxindoles[J]. Chemical Communications, 2016, 52(20): 3943-3946.
[3] DURMAZ M, TATAROGLU A, YILMAZ H, et al.Calixarene-derived chiral tertiary amine-thiourea organocatalyzed asymmetric Michael Additions of acetyl acetone and dimethyl malonate to nitroolefins[J]. Tetrahedron: Asymmetry, 2016, 27: 148-156.
[4] DENG Y H, ZHANG X Z, YU K Y, et al.Bifunctional tertiary amine-squaramide catalyzed asymmetric catalytic 1,6-conjugate addition/aromatization of para-quinone methides with oxindoles[J]. Chemical Communications, 2016, 52(22): 4183-4186.
[5] 罗宣干, 卓仁禧, 李满庆.5-氟脲嘧啶的D-氨基葡萄糖衍生物的合成及其抗肿瘤活性的研究[J]. 高等学校化学学报, 1996, 17(9): 1416-1420.
[6] 孙晓红, 王慧芳, 刘源发, 等.新杀菌剂嘧霉胺盐的合成[J]. 有机化学, 2004, 24(5): 506-511.
[7] 张宝辉.脂肪叔胺的应用[J]. 日用化学品科学, 1996(3): 6-7.
[8] 王立升, 冉炜, 刘帅兵,等.三种苦参碱衍生物的合成与表征[J]. 广西大学学报(自然科学版), 2012, 37(3): 495-497.
[9] STUETZ A, GEORGOPOULOS A, GRANITZER W, et al.Synthesis and structure-activity relationships of naftifine-related allylamine antimycotics[J]. Journal of Medicinal Chemistry, 1986, 29(1): 112-125.
[10]THVEDT T H K, KAASA K, SUNDBYAASA E, et al.Chiral N-benzyl-N-methyl-1- (naphthalen-1-yl) ethanamines and their in vitro antifungal activity against cryptococcus neoformans, trichophyton mentagrophytes and trichophyton rubrum[J]. European Journal of Medicinal Chemistry, 2013, 68: 482-496.
[11]陈令武,宋金峰,刘田东,等.含萘单元共聚物的合成与性质研究[J]. 材料科学与工程学报, 2005, 23(1):31-34.
[12]焦春联, 侯纯扬, 吴芸芳, 等.含萘荧光聚合物海水阻垢剂的合成及其阻垢性能[J]. 工业水处理, 2008, 28(9): 33-36.
[13]LIU J J, SHAN Y B, FAN C R, et al.Encapsulating naphthalene in an electron-deficient MOF to enhance fluorescence for organic amines sensing[J]. Inorganic Chemistry, 2016, 55(7): 3680-3684.
[14]彭文毫, 安小宁.萘环荧光基团—杯芳烃的荧光传感器的研究进展[J]. 广州化工, 2008, 36(2): 26-30.
[15]LIU L Z, CAO D R, JIN Y, et al.Efficient synthesis of copillar[5]arenes and their host-guest properties with dibromoalkanes[J]. Organic & Biomolecular Chemistry, 2011, 9(20): 7007-7010.
[16]LIU L Z, WANG L Y, LIU C C, et al.Dimerization control in the self-assembly behavior of copillar[5]arenes bearing ω-hydroxyalkoxy groups[J]. The Journal of Organic Chemistry, 2012, 77(20): 9413-9417.
[17]HUANG H F, LIU L Z, DUAN W D, et al.Synthesis of copillar[5]arenes and their host-guest complexation with two types of guests[J]. Chinese Journal of Chemistry, 2015, 33(3): 384-388.
[18]BI J H, ZENG X F, TIAN D M, et al.Temperature-responsive switch constructed from an anthracene- functionalized pillar[5]arene-based host-guest system[J]. Organic Letters, 2016, 18(5): 1092-1095.
[19]MAEDA T, TAKASE M, ISHIBASHI A, et al.Synthesis and antifungal activity of butenafine hydrochloride (KP-363), a new benzylamine antifungal agent[J]. Yakugaku zasshi: Journal of the Pharmaceutical Society of Japan, 1991, 111(2): 126-137.
(责任编辑 张晓云 梁碧芬)
Synthesis and characterization of N-methyl-1-naphthylmethylamine derivatives
LIU Lu-zhi, QIN Xue, HUA Zong-ze, DUAN Wen-gui, CEN Bo, LIN Gui-shan
(School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China)
In order to study the host-guest properties of chiral nitrogen as chiral guests, N-methyl- 1-naphthylmethylamine derivatives A1~A6 and S1~S6 were successfully synthesized using N-methyl-1-naphthylmethylamine, dibromoalkanes or bromoalkanes as starting materials under catalysis of K2CO3. Among the synthesized compounds, A1, A4~A6, S1 and S3~S6 had not been reported in literature. The twelve compounds were characterized and analyzed by means of infrared spectroscopy, nuclear magnetic resonance, and mass spectrometry techniques.
N-methyl-1-naphthylmethylamine; tertiary amine; ammonium salt; synthesis
2016-07-22;
2016-08-11
国家自然科学基金资助项目(21402033);广西自然科学基金资助项目(2013GXNSFBA019033)
段文贵(1964—),男,广西资源人,广西大学教授,博士生导师;E-mail:wgduan@gxu.edu.cn。
刘陆智,华忠泽,段文贵,等.N-甲基-1-萘甲胺衍生物的合成及表征[J].广西大学学报(自然科学版),2016,41(6):2017-2022.
10.13624/j.cnki.issn.1001-7445.2016.2017
O621.3
A
1001-7445(2016)06-2017-06
