射频消融治疗对原发性肝癌患者T细胞免疫功能的影响*
2017-01-04苗同国王立静马立伟陈午盛邵明亮段玉松穆永旭
苗同国 王立静 马立伟 陈午盛 邵明亮 段玉松 穆永旭
(石家庄市第五医院介入科,石家庄 050021)
·实验研究·
射频消融治疗对原发性肝癌患者T细胞免疫功能的影响*
苗同国 王立静 马立伟 陈午盛 邵明亮 段玉松 穆永旭**①
(石家庄市第五医院介入科,石家庄 050021)
目的 探讨射频消融(radio frequency ablation,RFA)前后原发性肝癌(primary hepatocellular carcinoma,PHC)患者T细胞亚群的变化。 方法 采用流式细胞术(flow cytometry,FCM)检测2011年1月~2013年6月40例PHC患者RFA术前24 h与术后1周、4周时外周血CD3+、CD4+、CD8+、CD4+/CD8+、CD4+CD25+Treg细胞的变化;酶联免疫吸附试验(ELISA)检测血清Th1型细胞因子(IL-2、IFN-γ、TNF-α)含量。选择40例健康志愿者作为对照组。 结果 术前肝癌患者外周血T细胞亚群CD3+、CD4+、CD4+/CD8+明显低于健康对照组,CD8+、Treg细胞明显高于健康对照组(P<0.01);肝癌患者IL-2、IFN-γ、TNF-α明显低于健康对照组(P<0.01)。术后1周,肝癌患者CD3+、CD8+、CD4+/CD8+与术前相比均无统计学意义(P>0.05),术后4周CD3+、CD4+明显升高,CD8+明显降低(P<0.05);Treg细胞术后1周、4周与术前比较均明显降低(P<0.01)。RFA治疗1周、4周IL-2、IFN-γ、TNF-α较治疗前均明显升高(P<0.01)。 结论 射频消融可以改善肝癌患者短期内的T淋巴细胞功能,促进Th1型细胞因子分泌,从而对原发性肝癌患者的免疫状况产生有益的影响。
原发性肝癌; 射频消融; T细胞亚群; Th1型细胞因子; 细胞免疫功能
对于原发性肝癌(primary hepatic carcinomas,PHC),肝切除术、肝移植和肝部分切除术是肝细胞肝癌唯一的根治方法,虽然有早期的检出计划,但是大多数患者确诊时仍为中晚期,只有20%~30%的患者可以手术切除[1]。射频消融(radio frequency ablation,RFA)是近年发展起来的一种治疗肿瘤的新技术,具有微创、安全、适应证宽、耐受性好、疗效肯定、并发症少等特点,已应用于各种实体肿瘤,尤其是肝癌的治疗,己经成为继手术切除、介入治疗后的第三大肝癌治疗手段,而且由于其疗效确切,特别是在小肝癌的治疗方面,射频消融疗效与手术切除相近,被认为是小肝癌的根治性治疗手段之一[2]。
近年来,许多学者认为,RFA不仅能直接灭活肿瘤,治疗后还能增加肿瘤局部和外周血中免疫细胞数量及抗肿瘤功能,提高机体免疫力可能是治疗肿瘤的另一种作用。我们选取我院2011年1月~2013年6月经临床或肝穿刺病理证实为原发性肝癌患者40例,通过观察RFA术前24 h与术后1周、4周时外周血T细胞亚群CD3+、CD4+、CD8+T细胞,CD4+/CD8+,CD4+CD25+调节性T细胞(Treg),以及Th1型细胞因子白介素2(IL-2)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)的变化,探讨RFA对肝癌患者外周血T细胞免疫功能的影响。
1 材料与方法
1.1 一般资料
病例选择标准:依据卫生部《原发性肝癌诊疗规范(2011版)》[2]选取原发性肝癌,并且符合:①不适合手术切除的直径≤5 cm单发肿瘤,或最大直径≤3 cm的多发(≤3个)肿瘤,无血管、胆管和邻近器官侵犯以及远处转移;②无肝脏肿瘤射频消融禁忌证[3]。
所选40例肝癌患者,男31例,女9例。年龄28~71岁,(56.2±13.8)岁。单发病灶25例,双病灶11例,三病灶4例,共59处病灶。病灶直径<3 cm 37处,3~5 cm 22处。均有乙型肝炎病史,治疗前均在接受核苷类药物抗病毒治疗。以年龄、性别相同为匹配条件选择40例正常体检志愿者作为对照组。所有研究对象均无糖尿病、类风湿、甲状腺功能亢进等自身免疫性疾病史和免疫治疗史。
1.2 射频消融步骤
采用美国RITA射频消融治疗系统(RF-1500),消融电极针为RITA-Star Burst XL多极肿瘤消融电极及皮肤电极(美国硅谷公司生产)。术前禁食,肌内注射哌替啶50 mg、异丙嗪25 mg。取仰卧位,建立静脉通路,常规消毒铺巾,依据肿瘤部位寻找合适进针路线,确定穿刺点。在CT引导下将射频针穿刺至预定部位,根据肿瘤大小和位置,RITA消融参数为:温度80~100 ℃,时间10~30 min。消融范围包括肿瘤及瘤周0.5~1.0 cm肝组织。
1.3 观察指标
抽取40例健康志愿者和40例PHC患者术前24 h肘静脉血3 ml作为基线,并于RFA术后1周和4周抽取40例PHC患者肘静脉血3 ml,用于测定外周血免疫细胞亚群和相关免疫细胞因子。
流式细胞术(flow cytometry,FCM)测定CD3+、CD4+、CD8+、CD4+/CD8+、CD4+CD25+Treg细胞含量。严格按照试剂说明进行,采用德国美天妮MACS Quant流式细胞仪检测并分析免疫细胞亚群。
酶联免疫吸附试验(ELISA)测定Th1型细胞因子IL-2、IFN-γ、TNF-α含量。严格按试剂说明书进行,采用美国Thermo Scientific Multiskan Spectrum全波长酶标仪测定并记录结果。
1.4 统计学方法
2 结果
2.1RFA治疗前肝癌患者与健康对照组T细胞亚群和Th1型细胞因子水平的比较
见表1。肝癌患者术前外周血T细胞亚群CD3+、CD4+、CD4+/CD8+显著低于健康对照组,CD8+、Treg细胞明显高于健康对照组(P<0.01);肝癌患者IL-2、IFN-γ、TNF-α明显低于健康对照组(P<0.01)。
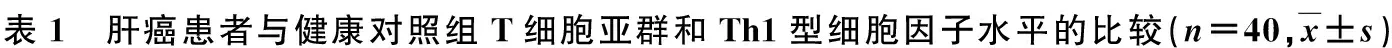
2.2 RFA治疗前后肝癌患者外周血T细胞亚群的变化
见表2。与术前比较,术后1周肝癌患者CD3+、CD8+、CD4+/CD8+无统计学意义(P>0.05);术后4周,CD3+、CD4+明显升高,CD8+明显降低(P<0.05);Treg细胞术后1周、4周与术前比较均明显降低(P<0.01)。
2.3 RFA治疗前后肝癌患者血清Th1型细胞因子含量比较
见表3。治疗1周和4周后肝癌患者IL-2、IFN-γ、TNF-α含量较术前明显升高(P<0.01)。


时间IL-2IFN-γTNF-α术前24h①86.14±7.5338.62±6.2862.35±7.21术后1周②96.52±3.2751.05±3.7074.04±6.89术后4周③100.39±11.9453.73±5.2678.38±5.85t1-2,P值-7.977,0.000-10.785,0.000-7.414,0.000t1-3,P值-6.385,0.000-11.666,0.000-10.919,0.000
3 讨论
针对PHC的基础和临床研究一直是肿瘤学科研究的重点和热点。加强对机体免疫状态的监测,对于肝癌患者病情评估、临床诊疗方案的制定、完善肝癌治疗模式和提高疗效具有重要作用[4]。机体免疫功能与肿瘤的发生、发展及转归关系密切,其中T细胞在机体抗肿瘤的免疫调节中起着举足轻重的作用[5]。
CD3+细胞代表成熟的T淋巴细胞,是细胞免疫中主要的活性细胞。可分为CD4+和CD8+T细胞2个亚群。在正常情况下,淋巴细胞亚群中CD4+细胞和CD8+细胞处于一个相对稳定平衡状态,维持机体免疫功能。但在癌症患者,机体免疫力常遭到不同程度的破坏,表现为CD4+/CD8+比值下降[6],抗肿瘤作用减弱,以致有利于肿瘤的发生、发展。Treg细胞是近年发现的非常重要的免疫负调节性细胞[7],能抑制抗肿瘤效应细胞的活化和增殖,与肿瘤免疫逃逸有关[8]。Yang等[9]分析25例肝细胞肝癌的肝组织,观察到癌旁组织的Treg细胞比例高于癌远端组织。研究[10,11]显示肝癌患者Treg细胞比例明显高于正常人群,而淋巴细胞总数偏低,同样提示肝癌患者存在不同程度的免疫抑制。因此,通过测定这些淋巴细胞亚群数目可从侧面反映肿瘤患者免疫状态。
本研究结果显示,与健康对照组相比,肝癌患者存在细胞免疫功能紊乱,表现为外周血CD4+、CD4+/CD8+水平明显降低,Treg细胞明显升高,提示肝癌患者的细胞免疫功能稳态处于明显抑制水平。40例原发性肝癌患者射频消融治疗4周后,T细胞亚群及Treg细胞产生了明显和积极的变化,与治疗前相比,均有显著性差异,一定程度上说明射频消融治疗可以在短时间内使机体细胞免疫功能有所改善,在抗肿瘤治疗中对肝癌患者是有益的。
癌变过程中,CD4+T细胞被激活并向4种方向发生极化,即Th1、Th2、Th17和Treg细胞。多数研究[12~14]认为机体的抗肿瘤作用以Th1介导的细胞免疫为主,其与抗肿瘤免疫效果有关,而Treg细胞则发挥相反的抑制作用,特别是在肿瘤晚期,Treg细胞在肿瘤局部富集,加速肿瘤的进展。因此,对于肿瘤的预防和治疗,原则上应优先考虑应用多种手段促进Th1细胞极化和功能激活。RFA治疗后可以导致Th1型细胞因子明显增多,促进Th0向Th1偏移,从而增强机体抗肿瘤细胞免疫功能。本研究结果显示RFA后1周Th1型细胞因子分泌明显增多,说明RFA可以在短期内激活Th1型免疫,并持续至术后4周。
本研究结果显示,RFA在改善肿瘤患者的免疫抑制状态上发挥了积极有益的作用,不但促进Th1型细胞因子的表达,进而促进细胞毒性T细胞的分化和杀伤作用,而且抑制Treg细胞导致的免疫抑制状态,以产生有效的抗肿瘤免疫。
1 Lencioni R,Cioni D,Donati F,et al.Combination of interventional therapies in hepatocellular carcinoma.Hepatogastroenterology,2001,48(37):8-14.
2 中华人民共和国卫生部.原发性肝癌诊疗规范(2011版).临床肝胆病杂志,2011,27(11):1141-1159.
3 郑加生,徐 克,腾皋军,等.经皮肝脏肿瘤射频消融治疗操作规范专家共识.中华放射学杂志,2012,46(7):581-585.
4 O’Beirne JP,Harrison PM.The role of the immune system in the control of hepatocellular carcinoma.Eur J Gastroenterol Hepatol,2004,16(12):1257-1260.
5 王志利,张跃伟,徐丹凤.射频消融治疗肝癌后机体免疫功能变化的研究进展.当代医学,2012,18(14):24-25.
6 Cho Y,Miyamoto M,Kato K,et al.CD4+and CD8+T cells cooperate to improve prognosis of patients with esophageal squamous cell carcinoma.Cancer Res,2003,63(7):1555-1559.
7 Chen X,Du Y,Huang Z.CD4+CD25+Treg derived from hepatocellular carcinoma mice inhibit tumor immunity.Immunol Lett,2012,148(1):83-89.
8 Delhem N,Carpentier A,Moralès O,et al.Regulatory T-cells and hepatocellular carcinoma: implication of the regulatory T lymphocytes in the control of the immune response. Bull Cancer,2008,95(12):1219-1225.
9 Yang XH,Yamagiwa S,Ichida T,et al.Increase of CD4+CD25+regulatory T-cells in the liver of patients with hepatocellular carcinoma.J Hepatol,2006,45(2):254-262.
10 陈 中,晏建军,黄 亮,等.肝癌微环境中CD4+CD25+调节性T细胞与T细胞免疫的关系.临床肝胆病杂志,2008,24(1):38-40.
11 Zhao F,Korangy F,Greten TF.Cellular immune suppressor mechanisms in patients with hepatocellular carcinoma.Dig Dis,2012,30(5):477-482.
12 Yan-bin Wang,Wei-Guo Xu,He-liang Liu,等.Effects of Radiofrequency Ablation on Lymphocyte Subsets and Tppe1/ Tppe2 T Cell Subpopulations in Patients with Hepatocellular Carcinoma.中国癌症研究(英文版),2009,21(4):310-317.
13 Armeanu S,Krusch M,Baltz KM,et al.Direct and natural killer cell-mediated antitumor effects of low-dose bortezomib in hepatocellular carcinoma.Clin Cancer Res,2008,14(11):3520-3528.
14 李 刚,寸英丽,杨丽春.肝癌患者射频消融后血清Th1、Th2型细胞因子的变化.肝胆胰外科杂志,2010,22(2):94-96.
(修回日期:2016-03-22)
(责任编辑:王惠群)
Influence of Radio Frequency Ablation on T Lymphocyte Subsets in Patients with Primary Liver Cancer
MiaoTongguo,WangLijing,MaLiwei,etal.
DepartmentofInterventionalRadiology,FifthHospitalofShijiazhuang,Shijiazhuang050021,China
MuYongxu,E-mail:myx6738@sohu.com
Objective To investigate changes of T lymphocyte subsets in patients with primary hepatocellular carcinoma (PHC) after radio frequency ablation (RFA). Methods A total of 40 patients with pathologically-proved PHC (study group) were enrolled in our study during the period from January 2011 to June 2013. Peripheral blood CD3+, CD4+and CD8+T cells as well as CD4+/CD8+, CD4+CD25+Treg cells were determined 24 h before RFA and at 1 and 4 weeks after RFA in all the patients by using flow cytometry assay. Serum Th1 type cytokines (IL-2, IFN-γ, TNF-α) were analyzed by ELISA assay. Another 40 healthy volunteers were collected and used as the control group. Results As compared to the control group, the CD3+, CD4+T cells, CD4+/CD8+, IL-2, IFN-γ and TNF-α in the study group were significantly lower while CD8+T cells and CD4+CD25+Treg cells were higher (P<0.01) 24 h before RFA. As compared to 24 h before RFA, the peripheral T lymphocyte subsets CD3+, CD8+T cells and CD4+/CD8+at 1 week after RFA had no statistically changes in the study group (P>0.05), while after 4 weeks CD3+, CD4+T cells were significantly increased and CD8+T cells significantly decreased (P<0.05). The Treg cells were obviously reduced at 1 week and 4 weeks after RFA (P<0.01). Additionally, serum IL-2, IFN-γ and TNF-α levels in the study group raised significantly after 1 week and 4 weeks (P<0.01). Conclusion RFA can improve immune functions of T lymphocytes and promote secretion of Th1 type cytokines, which benefits the immune functions against primary hepatocellular carcinoma.
Primary hepatocellular carcinoma; Radio frequency ablation; T lymphocyte subsets; Th1 type cytokines; Cellular immune function
河北省卫生厅科研基金项目(ZD20140284)
A
1009-6604(2016)06-0538-04
10.3969/j.issn.1009-6604.2016.06.017
2015-12-22)
**通讯作者,E-mail:myx6738@sohu.com
①(包头医学院第一附属医院介入科,包头 014010)
