壳聚糖导管填充辛伐他汀/泊洛沙姆407水凝胶促进大鼠坐骨神经缺损后运动功能恢复*
2017-01-04宋纯理徐迎胜
郭 琦 刘 灿 海 宝 马 腾 王 红 宋纯理 徐迎胜
(北京大学第三医院神经内科,北京 100083)
·实验研究·
壳聚糖导管填充辛伐他汀/泊洛沙姆407水凝胶促进大鼠坐骨神经缺损后运动功能恢复*
郭 琦 刘 灿①海 宝①马 腾①王 红①宋纯理①徐迎胜**
(北京大学第三医院神经内科,北京 100083)
目的 探讨壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶对大鼠坐骨神经缺损后运动功能恢复的影响。方法选取成年SD大鼠40只,随机分成壳聚糖导管组、壳聚糖导管复合辛伐他汀0 mg水凝胶组、壳聚糖导管复合辛伐他汀0.5 mg水凝胶组和壳聚糖导管复合辛伐他汀1 mg水凝胶组(前2组为对照组,后2组为辛伐他汀治疗组),每组10只,制作左侧坐骨神经10 mm缺损模型,用壳聚糖导管桥接缺损,其内填充不同浓度的辛伐他汀水凝胶。术后4、6、8、10周进行坐骨神经指数检测,术后10周进行神经电生理、荧光金逆行示踪、腓肠肌相对湿重、肌纤维面积百分比和运动终板形态检测,观察神经缺损后运动功能恢复情况。结果术后4、6、8、10周,辛伐他汀治疗组的坐骨神经指数均明显高于对照组(P<0.05);术后10周辛伐他汀治疗组复合肌肉动作电位的峰-峰值、运动神经传导速度、荧光金标记的阳性神经元数量、腓肠肌相对湿重、肌纤维面积百分比和运动终板的恢复均显著优于对照组(P<0.05)。结论壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶能够促进外周神经损伤后的功能恢复。
周围神经缺损; 辛伐他汀; 壳聚糖导管; 泊洛沙姆407水凝胶; 功能恢复; 神经再支配
外周神经损伤一直是临床上棘手的难题,并且会导致神经缺损、靶肌肉萎缩和运动功能障碍[1]。对于短距离缺损,端端吻合即可达到治愈的目的。对于长距离神经缺损,自体神经移植仍然是外周神经缺损治疗的金标准[2]。但是由于供区功能障碍、供体神经来源有限等原因,自体神经移植在临床的应用受到很大限制[3]。因此,人们尝试各种人工神经移植物以期能替代自体神经移植来促进神经再生[4,5]。
壳聚糖作为一种天然高分子聚合物,由于其低毒性、良好的生物可降解性和组织相容性而被广泛应用于基因载体、细胞培养和组织工程中[6~8]。有研究显示壳聚糖导管能促进神经再生和功能恢复[9,10]。然而,缺乏内部填充材料的单孔神经导管对于长距离神经缺损再生和功能恢复均不理想[11,12]。泊洛沙姆407水凝胶具有良好的生物组织相容性、稳定性、低毒性、低免疫原性,在体环境下实现液相-固相转变,填充于神经导管中,不仅能实现缓释药物的功能,还能形成三维立体网状结构,为新生组织长入提供机械支持和发育引导[13,14]。Xavier等[15]和我们的前期研究[16,17]表明,不管在周围神经损伤还是中枢神经损伤中,辛伐他汀均能显著促进损伤后神经功能恢复。
我们的前期实验制备壳聚糖导管/辛伐他汀/泊洛沙姆407水凝胶复合材料,并证实其能够显著促进神经缺损后的结构重建。周围神经缺损后,神经轴突断裂,神经功能完全丧失,只有当神经缺损被移植物桥接,再生的神经轴突通过移植物长到远端效应器,神经功能才能恢复。组织学上结构修复的成功并不一定代表运动功能恢复的成功。对人工神经修复材料更重要的评价是功能恢复,而不是简单的结构修复。因此,本实验进一步探索该复合材料对于神经缺损大鼠的运动功能恢复的影响,旨在为今后进一步实施大动物实验提供依据。
1 材料与方法
1.1 主要试剂与仪器
辛伐他汀原料药(中国药品生物制品检定所);壳聚糖(中国浙江金壳药业);泊洛沙姆407(德国BASF公司);荧光金(美国Fluorochrome公司);一抗α-金环蛇毒素(美国Sigma公司);光学显微镜(日本Nikon公司);荧光显微镜(德国Leica公司);肌电诱发电位仪(美国Candwell公司)。
1.2 动物分组及给药
标准分笼饲养的SD大鼠45只,SPF级,雄性,6~7周龄,体重250~300 g,由北京大学医学部实验动物科学部[SCXK(京)2011-0012]提供,采用随机数字表法将40只SD大鼠随机分为4组,每组10只:壳聚糖导管组(conduit);壳聚糖导管复合辛伐他汀0 mg水凝胶组(c+sim 0 mg);壳聚糖导管复合辛伐他汀0.5 mg水凝胶组(c+sim 0.5 mg);壳聚糖导管复合辛伐他汀1 mg水凝胶组(c+sim 1 mg)。剩余5只为正常大鼠。
1.3 壳聚糖导管和辛伐他汀/泊洛沙姆407温敏水凝胶的制备
壳聚糖导管的制备参考文献[18],略微改良。壳聚糖粉末溶解在冰醋酸中达到8%。外径为1.6 mm的玻璃毛细管竖直插入壳聚糖溶液中,竖直拔出,再浸入5% NaOH溶液中30分钟,双蒸水反复冲洗直至中性(pH=7)。最后,拔出玻璃毛细管留下壳聚糖导管,切成14 mm长度的节段备用。泊洛沙姆407粉末溶解在双蒸水中达到25%,添加辛伐他汀至3种剂量,分别为每20 μl混悬液中含有0、0.5和1 mg辛伐他汀。
1.4 外周神经损伤模型制作
麻醉后,消毒备皮,于左侧大腿外侧切开皮肤、皮下,沿肌间隙分离暴露坐骨神经,于梨状肌下孔5 mm处完全横断坐骨神经,造成10 mm缺口,两端用9-0缝线缝合壳聚糖导管,根据实验分组填充不同剂量辛伐他汀水凝胶。示意图见图1。伤口处洒青霉素粉末以防感染,分层缝合肌肉与皮肤。术后分笼饲养,每笼3只。术后观察大鼠精神状态、术侧肢体活动、饮食、伤口愈合情况等。
1.5 行为学检测
根据文献介绍的常规方法[19~21],各组随机挑选8只大鼠分别于术后4、6、8、10周进行坐骨神经功能指数(sciatic functional index,SFI)检测试验。自制大鼠足印行走箱,宽10 cm,长50 cm,箱底放置白纸,于大鼠足底涂抹碘伏让其在箱内行走并记录足印。SFI的计算公式[22]:SFI=-38.3×(EPL-NPL)/NPL+109.5×(ETS-NTS)/NTS+13.3×(EITS-NITS)/NITS-8.8,其中PL代表三趾尖到足跟的脚掌长度,TS代表一、五趾间距离,ITS代表二、四趾间距离,E和N分别代表实验侧和正常侧。SFI数值为0代表功能正常,SFI数值趋近-100表示功能近于完全丧失,达到甚至超过-100表示功能完全丧失。
1.6 神经电生理检查
取5只正常大鼠,与从各组随机挑选出的5只大鼠于术后10周进行神经电生理检测。麻醉后暴露坐骨神经,双极勾状刺激电极分别置于移植物的两端,单极针状记录电极插入腓肠肌内,记录复合肌肉动作电位(compound muscle action potential,CMAP)。分别计算CMAP的峰-峰值和运动神经传导速度(motor nerve conduction velocity,MNCV)。MNCV(m/s)=近远端刺激点间的距离(mm)/近远端刺激动作电位的潜伏期差值(ms),其中在大鼠坐骨神经近远端刺激点间的距离为10 mm,近端刺激动作电位的潜伏期差值为潜伏期2-潜伏期1,因此公式可简化为MNCV=10/(潜伏期2-潜伏期1)。
1.7 荧光金逆行示踪
每组随机挑选4只大鼠于术后10周进行荧光金逆行示踪。麻醉后再次暴露坐骨神经,于移植物远端5 mm处用微量注射器注射5%荧光金-磷酸盐缓冲液(phosphate buffer solution,PBS)溶液。1周后取L4~L6背根神经节,利用OCT包埋剂(optimal cutting temperature compound)进行包埋,于冰冻切片机上纵切片厚度为16 μm。在荧光显微镜下分别于10倍和20倍随机选取4个视野进行观察,并利用Image-pro Plus6.0计数荧光金标记的阳性细胞。
1.8 腓肠肌的恢复和神经再支配
将进行荧光金逆行示踪之外的剩余每组6只大鼠于术后10周通过注射过量麻醉剂处死,大鼠双侧腓肠肌自肌肉起止点完整切取,分别称取实验侧和正常侧的湿重并相除,算出相对湿重(relative gastrocnemius muscle weight,RGMW),其中5只于中性福尔马林中固定、脱水、石蜡包埋,横切片5 μm,Masson染色,在光学显微镜下于20倍随机选取5个视野观察,并利用Image-pro Plus6.0分析肌纤维面积百分比。余1只腓肠肌样本于4%多聚甲醛中固定,30%蔗糖溶液中脱水,OCT包埋剂进行包埋,纵切片16 μm,孵育一抗α-金环蛇毒素(标记运动终板),4 ℃,过夜,PBS水洗,甘油封片,在荧光显微镜下分别于10倍和40倍观察标记形态,正常的运动终板数量多且形态偏卵圆形。
1.9 统计学分析
2 结果
2.1 行为学结果
见图2,辛伐他汀0.5 mg和1 mg组的实验侧脚趾分开,且抓地有力,接近正常侧脚趾。术后4、6、8、10周,4组SFI均呈逐渐上升的趋势,其中辛伐他汀0.5 mg组和1 mg组的SFI显著高于对照组(P<0.01)。辛伐他汀0 mg组和导管组间无显著性差异(P>0.05)。具体统计分析数据见表1。
表1 4组术后4、6、8、10周大鼠坐骨神经指数(SFI)比较
注:conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶
与壳聚糖导管组比较,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较,**P<0.01;与壳聚糖导管复合辛伐他汀0.5 mg水凝胶组比较,※P<0.05
2.2 神经电生理结果
见图3,辛伐他汀治疗组的CMAP的峰-峰值和MNCV明显高于对照组(P<0.05)。这些参数于导管组中达最低值,辛伐他汀0 mg组和导管组无显著性差异(P>0.05)。具体统计分析数据见表2。
2.3 荧光金逆行示踪
见图4,4组中的背根神经节(dorsal root ganglion,DRG)中均可见荧光金标记的神经元的存在。辛伐他汀0.5 mg和1 mg组中的阳性细胞数相似,但均明显多于辛伐他汀0 mg组和导管组(P<0.01)。具体统计分析数据见表3。

组别神经电生理CMAP峰-峰值(mV)MNCV(m/s)normal29.38±1.2650.05±1.77conduit1.46±1.324.08±3.60c+sim0mg2.90±1.534.00±2.76c+sim0.5mg8.42±5.72##/*17.03±9.38#/*c+sim1mg10.36±5.47##/**23.47±18.00##/**F值45.78320.547P值0.0000.000
注:normal,正常组;conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶
与壳聚糖导管组比较,#P<0.05,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较,*P<0.05,**P<0.01
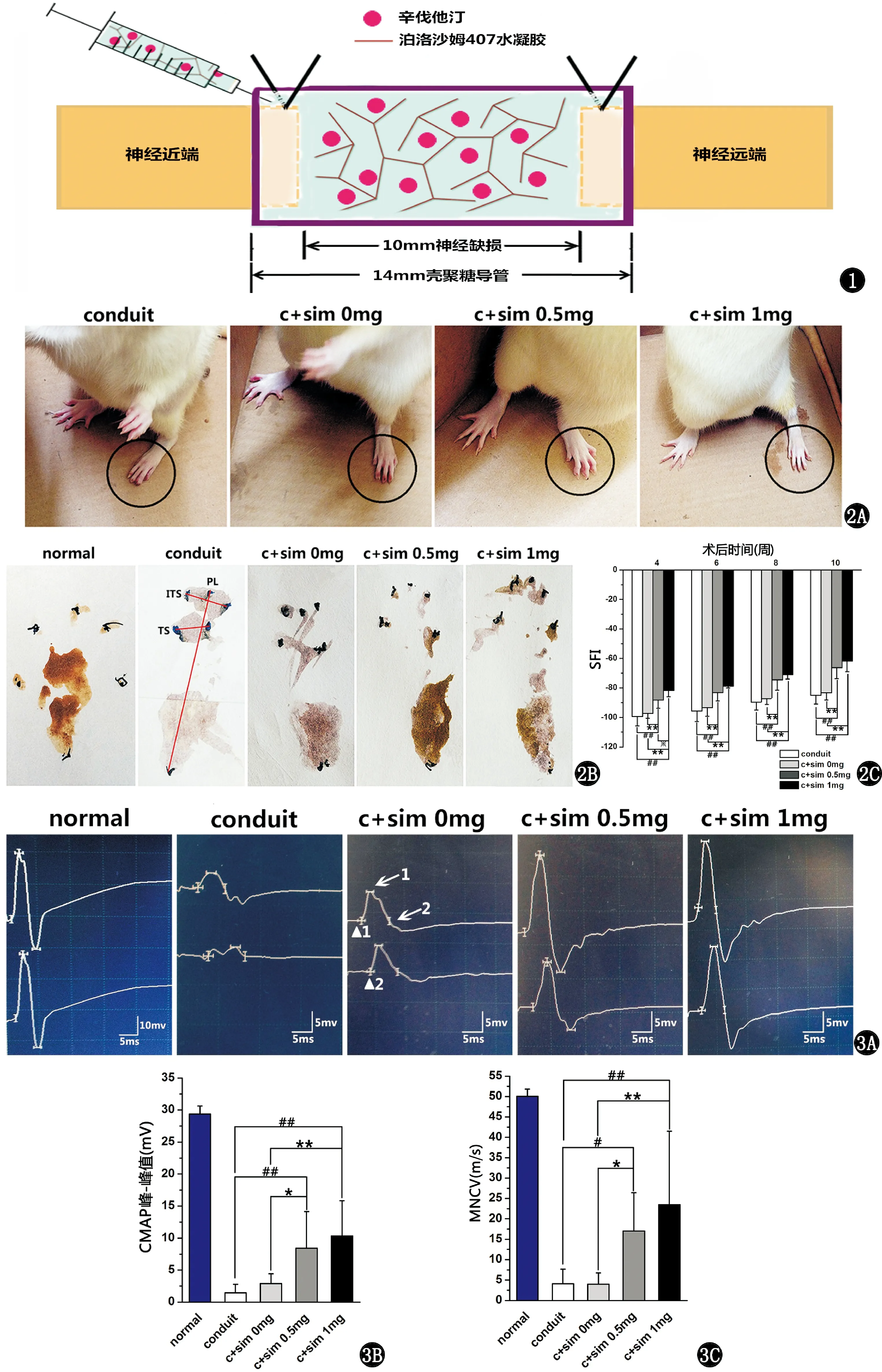
图1 壳聚糖导管填充、注射辛伐他汀水凝胶桥接坐骨神经缺损示意图 图2 A和B为术后10周大鼠步态分析的有代表性的印迹图,C为术后4、6、8、10周SFI的统计图(n=8) 图3 术后10周神经电生理结果:A为各组CMAP的代表性图[图中箭头1为波峰,箭头2为波谷,三角1为潜伏期1,三角2为潜伏期2,MNCV=10/(潜伏期2-潜伏期1)],B和C分别为CMAP的峰-峰值和MNCV的统计图(n=5) normal,正常组;conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶与壳聚糖导管组比较,#P<0.05,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较, *P<0.05,**P<0.01
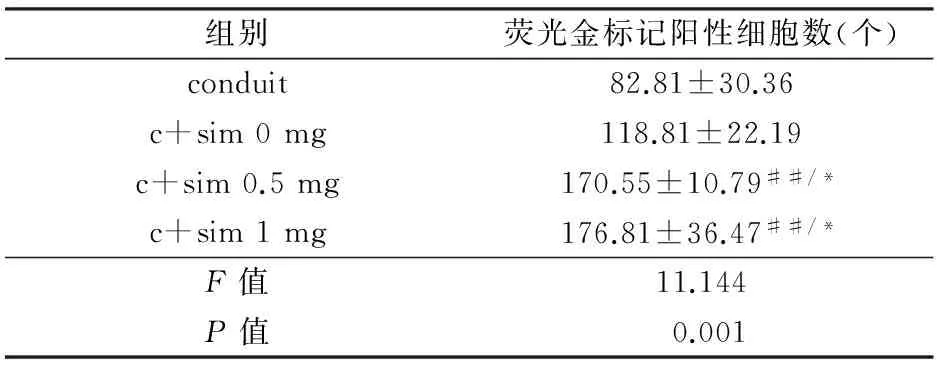
组别荧光金标记阳性细胞数(个)conduit82.81±30.36c+sim0mg118.81±22.19c+sim0.5mg170.55±10.79##/*c+sim1mg176.81±36.47##/*F值11.144P值0.001
注:conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶
与壳聚糖导管组比较,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较,*P<0.05
2.4 腓肠肌恢复和神经再支配情况
见图5,辛伐他汀治疗组的腓肠肌几乎恢复为正常腓肠肌的形态,而对照组的腓肠肌严重萎缩。辛伐他汀治疗组的RGMW显著增高(P<0.05)。在辛伐他汀治疗组中α-金环蛇毒素标记的运动终板的数目和形态明显好于对照组。Masson染色表明辛伐他汀治疗组中的腓肠肌肌纤维面积百分比显著大于对照组(P<0.05)。具体统计分析数据见表4。
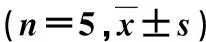
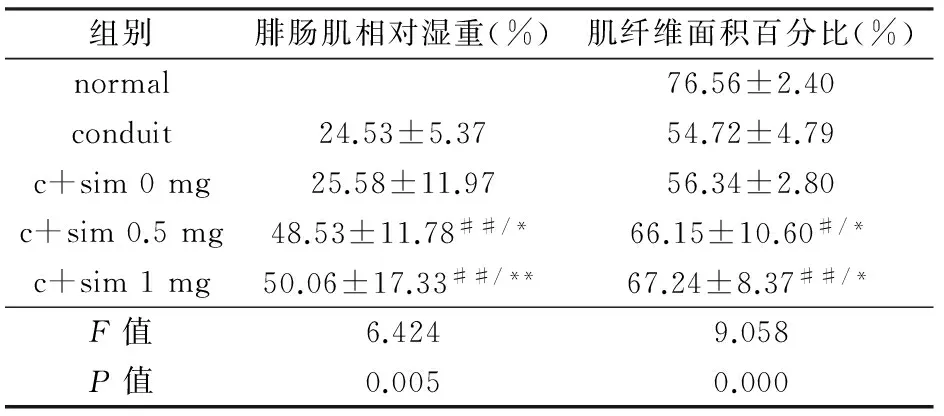
组别腓肠肌相对湿重(%)肌纤维面积百分比(%)normal76.56±2.40conduit24.53±5.3754.72±4.79c+sim0mg25.58±11.9756.34±2.80c+sim0.5mg48.53±11.78##/*66.15±10.60#/*c+sim1mg50.06±17.33##/**67.24±8.37##/*F值6.4249.058P值0.0050.000
注:normal,正常组;conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶
与壳聚糖导管组比较,#P<0.05,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较,*P<0.05,**P<0.01
3 讨论
外周神经损伤是临床常见损伤,神经缺损是损伤中最为棘手的难题。我们前期的实验结果表明壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶可以显著促进大鼠缺损10 mm的坐骨神经再生。但是结构上的修复不一定表示功能上也能得到重建,神经损伤修复的最终目的就是恢复运动功能。
本实验从不同的角度来验证壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶对于神经缺损后的功能恢复的影响。首先,SFI是目前公认的一种较有效的行为学评价方法,可以很好地反映肌肉肌力的恢复[23]。随时间延续,大鼠神经再生,各组SFI不断升高,而辛伐他汀治疗组的SFI从4周开始一直都显著高于对照组,且贯穿于整个实验进程;其次,术后10周,辛伐他汀治疗组的再生神经的CMAP的峰-峰值和MNCV明显高于对照组,表明其神经传导功能得到了极大的恢复。神经传导速度是反映受损神经功能恢复的直接证据;然后,作为神经元的一项基本活动,轴浆流动是联系神经元与末梢,运送相关物质的通道,是再生神经功能恢复的重要证明[24]。本实验中辛伐他汀治疗组的背根神经节中荧光金标记的阳性细胞数明显多于对照组,证实再生神经恢复了轴浆流动。
更重要的是,再生神经对运动功能的影响最终体现于靶器官的神经支配[25]。当周围神经离断后,由于传导功能障碍,肌纤维失去神经的营养作用,靶肌肉最终形成废用性萎缩,导致肌纤维数目下降,体积减小,胶原纤维增生[26]。本实验中辛伐他汀治疗组的术侧腓肠肌RGMW显著高于对照组;Masson染色显示辛伐他汀治疗组的肌纤维面积百分比相对于对照组显著增大,胶原纤维显著减少;且辛伐他汀治疗组中α-金环蛇毒素标记的运动终板的乙酰胆碱受体(AChR)的形态和数量均明显优于对照组。以上结果均表明随神经再生,其靶肌肉接受神经营养的作用,运动终板也得以修复,重获神经支配,使运动功能得到改善,与SFI的结果相互一致。
水凝胶是一种具有良好的生物降解性和组织相容性的聚合物,能够作为多种药物或分子的载体[27]。水凝胶在空间上分散形成三维立体结构,能够提供诱导轴突生长连接断端的结构支撑,从而促进神经再生[28]。已有研究显示泊洛沙姆407水凝胶能够作为慢病毒载体携带治疗基因促进大鼠脊髓损伤后的神经再生和功能恢复[29,30]。因此,我们将辛伐他汀与泊洛沙姆407水凝胶复合在一起,既能达到缓释他汀的效果,延长其作用时间,又能减少不良的系统反应。
使用可注射温敏性泊洛沙姆水凝胶作为辛伐他汀的载体填充壳聚糖导管具有以下优点:首先,可注射水凝胶能够填充任何形状的神经导管,不留空隙,可以更好地引导轴突生长;其次,水凝胶的温敏性使其在体内37 ℃即可实现从液相到固相的转变,不需提前干预,更便于临床应用;最后,壳聚糖导管的机械强度适合缝合和移植,复合可注射水凝胶能达到促进神经纤维长入的结构稳定性。
本研究采用的辛伐他汀剂量为0.5、1 mg, 均显示可显著促进大鼠周围神经损伤修复。但除了第4周时SFI显示辛伐他汀1 mg优于0.5 mg,而在之后的恢复过程中并没有显著性差异,本实验的目的是验证辛伐他汀治疗能有效促进外周神经再生,那么如果将剂量减小到0.5 mg以下,能否与对照组相比还具有显著的优势呢?这将会是我们未来研究的一个内容。同时,泊洛沙姆水凝胶的体外降解实验结果显示其2周内即基本完全降解,提示延长缓释时间或将更好地发挥促进神经再生的作用。这对于材料优化以及未来转化研究具有重要的意义。
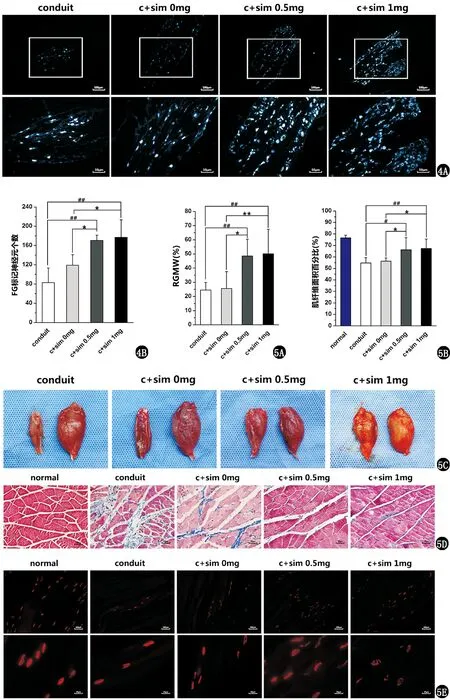
图4 荧光金逆行示踪:A为术后10周背根神经节中荧光金的标记情况(上图标尺为100 μm,下图标尺为50 μm);B为荧光金(fluoro gold,FG)标记细胞数目的统计图(n=4) 图5 术后10周腓肠肌恢复和神经再支配情况:C为同一只大鼠实验侧(左)和正常侧(右)腓肠肌的大体情况,A为RGMW统计图;D为实验侧腓肠肌Masson染色(图标尺为50 μm),B为肌纤维面积百分比统计图;E为α-金环蛇毒素标记运动终板乙酰胆碱受体(AChR)的形态图(上图标尺为100 μm,下图标尺为25 μm)normal,正常组;conduit,壳聚糖导管组;c+sim 0 mg,壳聚糖导管复合辛伐他汀0 mg水凝胶;c+sim 0.5 mg,壳聚糖导管复合辛伐他汀0.5 mg水凝胶;c+sim 1 mg,壳聚糖导管复合辛伐他汀1 mg水凝胶与壳聚糖导管组比较,#P<0.05,##P<0.01;与壳聚糖导管复合辛伐他汀0 mg水凝胶组比较,*P<0.05,**P<0.01
综上,本实验结果表明,壳聚糖导管复合辛伐他汀/泊洛沙姆407水凝胶能够显著促进大鼠坐骨神经缺损后的神经再生和运动功能的恢复。
1 Kemp SW,Walsh SK,Midha R. Growth factor and stem cell enhanced conduits in peripheral nerve regeneration and repair. Neurol Res,2008,30(10):1030-1038.
2 朱庆棠,郑灿镔,刘小林. 周围神经缺损修复材料临床适应证的考虑. 中华显微外科杂志,2013,36(5):417-421.
3 王培吉,赵家举,江 波,等. 自体神经外膜小间隙桥接法与外膜原位缝合法修复周围神经断裂的对比实验研究. 中华显微外科杂志,2013,36(5):478-481.
4 Freier T,Montenegro R,Shan Koh H,et al. Chitin-based tubes for tissue engineering in the nervous system. Biomaterials,2005,26(22):4624-4632.
5 Yang Y,Chen X,Ding F,et al. Biocompatibility evaluation of silk fibroin with peripheral nerve tissues and cells in vitro. Biomaterials,2007,28(9):1643-652.
6 Sato T,Ishii T,Okahata Y. In vitro gene delivery mediated by chitosan. effect of pH,serum,and molecular mass of chitosan on the transfection efficiency. Biomaterials,2001,22(15):2075-2080.
7 Lin SJ,Jee SH,Hsaio WC,et al. Formation of melanocyte spheroids on the chitosan-coated surface. Biomaterials,2005,26(12):1413-1422.
8 Gingras M,Paradis I,Berthod F. Nerve regeneration in a collagen-chitosan tissue-engineered skin transplanted on nude mice. Biomaterials,2003,24(9):1653-1661.
9 Wang A, Ao Q,Cao W,et al. Porous chitosan tubular scaffolds with knitted outer wall and controllable inner structure for nerve tissue engineering. J Biomed Mater Res A,2006,79(1):36-46.
10 Ishikawa N,Suzuki Y,Ohta M,et al. Peripheral nerve regeneration through the space formed by a chitosan gel sponge. J Biomed Mater Res A,2007,83(1):33-40.
11 Li A,Hokugo A,Yalom A,et al. A bioengineered peripheral nerve construct using aligned peptide amphiphile nanofibers. Biomaterials,2014,35(31):8780-8790.
12 Ribeiro-Resende VT,Koenig B,Nichterwitz S,et al. Strategies for inducing the formation of bands of Bungner in peripheral nerve regeneration. Biomaterials,2009,30(29):5251-5259.
13 Pillai O,Panchagnula R. Transdermal delivery of insulin from poloxamer gel:ex vivo and in vivo skin permeation studies in rat using iontophoresis and chemical enhancers. J Control Release,2003,89(1):127-140.
14 Tan J,Fu X,Sun CG,et al. A single CT-guided percutaneous intraosseous injection of thermosensitive simvastatin/poloxamer 407 hydrogel enhances vertebral bone formation in ovariectomized minipigs. Osteoporos Int,2016,27(2):757-767.
15 Xavier AM,Serafim KG,Higashi DT,et al. Simvastatin improves morphological and functional recovery of sciatic nerve injury in Wistar rats. Injury,2012,43(3):284-289.
16 Han X,Yang N,Cui Y,et al. Simvastatin mobilizes bone marrow stromal cells migrating to injured areas and promotes functional recovery after spinal cord injury in the rat. Neurosci Lett,2012,521(2):136-141.
17 Han X,Yang N,Xu Y,et al. Simvastatin treatment improves functional recovery after experimental spinal cord injury by upregulating the expression of BDNF and GDNF. Neurosci Lett,2011,487(3):255-259.
18 Li X,Yang Z,Zhang A,et al. Repair of thoracic spinal cord injury by chitosan tube implantation in adult rats. Biomaterials,2009,30(6):1121-1132.
19 Ma F,Xiao Z,Meng D,et al. Use of natural neural scaffolds consisting of engineered vascular endothelial growth factor immobilized on ordered collagen fibers filled in a collagen tube for peripheral nerve regeneration in rats. Int J Mol Sci,2014,15(10):18593-18609.
20 Zhu S,Ge J,Wang YQ,et al. A synthetic oxygen carrier-olfactory ensheathing cell composition system for the promotion of sciatic nerve regeneration. Biomaterials,2014,35(5):1450-1461.
21 Hare GM,Evans PJ,Mackinnon SE,et al. Walking track analysis:a long-term assessment of peripheral-nerve recovery. Plast Reconstr Surg,1992,89(2):251-258.
22 Bain JR,Mackinnon SE,Hunter DA. Functional evaluation of complete sciatic,peroneal,and posterior tibial nerve lesions in the rat. Plast Reconstr Surg,1989,83(1):129-138.
23 张雁儒,尚 燕,刘宏建,等. 化学脱细胞异体神经对大鼠坐骨神经缺损的修复. 中华实验外科杂志,2013,30(3):609-611.
24 张彩顺,吕 刚. 无细胞神经支架复合骨髓间充质干细胞构建组织工程人工神经修复坐骨神经缺损. 中国组织工程研究与临床康复,2011,15(25):4591-4596.
25 Scherman P,Lundborg G,Kanje M,et al. Neural regeneration along longitudinal polyglactin sutures across short and extended defects in the rat sciatic nerve. J Neurosurg,2001,95(2):316-323.
26 王晓亮,杨朝阳,李晓光,等. 应用人工神经修复大鼠坐骨神经损伤的实验研究. 中国康复理论与实践,2012,18(6):535-538.
27 Carballo-Molina OA,Velasco I. Hydrogels as scaffolds and delivery systems to enhance axonal regeneration after injuries. Front Cell Neurosci,2015,9:13.
28 Bellamkonda RV. Peripheral nerve regeneration:an opinion on channels,scaffolds and anisotropy. Biomaterials,2006,27(19):3515-3518.
29 Sellers DL,Kim TH,Mount CW,et al. Poly(lactic-co-glycolic) acid microspheres encapsulated in Pluronic F-127 prolong hirudin delivery and improve functional recovery from a demyelination lesion. Biomaterials,2014,35(31):8895-8902.
30 Wu HF,Cen JS,Zhong Q,et al. The promotion of functional recovery and nerve regeneration after spinal cord injury by lentiviral vectors encoding Lingo-1 shRNA delivered by Pluronic F-127. Biomaterials,2013,34(6):1686-1700.
(修回日期:2016-05-03)
(责任编辑:王惠群)
Bridging Sciatic Nerve Defect with Simvastatin Delivered by Injectable Thermosensitive Pluronic F-127 Hydrogel Promotes Nerve Regeneration in Rats
GuoQi*,LiuCan,HaiBao,etal.
*DepartmentofNeurology,PekingUniversityThirdHospital,Beijing100083,China
XuYingsheng,E-mail:xys@bjmu.edu.cn
Objective To investigate effects of simvastatin/pluronic F-127 hydrogel combined with chitosan conduit on motor functional recovery of rats with sciatic nerve defects. Methods A total of 40 adult Sprague-Dawley rats were assigned randomly into four groups:chitosan conduit group and groups of the conduit filled with pluronic F-127 hydrogel containing 0 mg,0.5 mg,and 1 mg simvastatin (the first two groups were control groups while the last two groups as simvastatin treated groups),with 10 rats in each group. A 10 mm gap was produced in left side of sciatic nerves and then was repaired by the chitosan conduit filled with pluronic F-127 hydrogel containing different doses of simvastatin. At different periods after surgery,the functional recovery was evaluated by sciatic functional index (SFI),electrophysiology,fluoro-gold retrograde tracing,the relative gastrocnemius muscle weight (RGMW),the percentage area of muscle fibers and the morphology of motor endplates. Results At 4,6,8,and 10 weeks after surgery,values of SFI in simvastatin treated groups were significantly higher than those in the control groups (P<0.05). Similarly,at 10 weeks after surgery,the peak amplitude and motor nerve conduction velocity of compound muscle action potential (CMAP),number of FG-labled neurons,RGMW,the percentage area of muscle fibers and the morphology of motor endplates in simvastatin treated groups were superior to those in the control groups (P<0.05). Conclusion These findings indicate that filling chitosan conduits with simvastatin/ pluronic F-127 hydrogel can improve motor functional recovery in rats.
Peripheral nerve defect; Simvastatin; Chitosan conduit; Pluronic F-127 hydrogel; Functional recovery;Reinnervation
国家自然科学基金(No.81171693,No.81100895);国家高技术研究发展计划(863计划)(No.SS2015AA020304)
**通讯作者,E-mail:xys@bjmu.edu.cn
①骨科
A
1009-6604(2016)07-0638-07
10.3969/j.issn.1009-6604.2016.07.017
2016-03-21)
