多系统萎缩患者血清YKL-40和CD40水平变化及相关性因素研究
2017-01-04陈建文周靖媛张凯华高松赵莉董春波
陈建文 周靖媛 张凯华 高松 赵莉 董春波
多系统萎缩患者血清YKL-40和CD40水平变化及相关性因素研究
陈建文 周靖媛 张凯华 高松 赵莉 董春波
目的 探讨多系统萎缩(MSA)患者血清几丁质酶3样蛋白1(YKL-40)、CD40水平的变化,以及其与发病年龄、病程、疾病严重程度的相关性。 方法 病例组为2013-03-01—2014-11-30期间大连医科大学附属第一医院神经内科的住院MSA患者30例,其中很可能MSA24例,可能MSA6例,均符合2008年修订Gilman诊断标准;对照组为同期年龄和性别相匹配的30例健康体检者。利用酶联免疫吸附试验(ELISA)检测血清YKL-40与CD40水平,并分析两者与MSA患者性别、年龄、发病年龄、病程和疾病严重程度〔以统一多系统萎缩评估量表(UMSARS)Ⅱ评分进行评估〕的相关性。 结果 MSA患者血清YKL-40水平〔38.32(11.74)ng/mL〕较对照组〔47.2(13.88 ng/mL〕降低(t=238.00,P=0.002);对照组不同性别间〔男(36.23±9.74) ng/mL,女(36.50 ±10.86)ng/mL,t=0.519,P=0.477)〕及病例组不同分型间〔MSA-C型:40.67(13.09)ng/mL,MSA-P型:38.24(9.90)ng/mL,U=104.00,P=0.739〕比较血清YKL-40水平差异均无统计学意义。MSA患者血清中CD40水平〔120.39(39.47)pg/mL〕较对照组〔116.12(35.85) pg/mL〕差异无统计学意义(t=439.00,P=0.871)。对照组血清YKL-40水平与年龄无明显相关性(P>0.05),病例组血清YKL-40水平与患者发病年龄、病程和UMSARSⅡ评分均无相关性(均P>0.05);ROC曲线分析显示血清YKL-40水平对MSA无明确诊断价值(AUC=0.264,P=0.002)。 结论 MSA患者血清YKL-40水平较健康人显著降低。MSA患者YKL-40水平与发病年龄、病程和UMSARSⅡ评分无相关性。
多系统萎缩;血清YKL-40;血清CD40;生物标记物
多系统萎缩(multiple system atrophy, MSA)是一种病因不明,以帕金森症状、小脑性共济失调和自主神经功能紊乱为主要表现的神经系统变性疾病,其病理学标记是少突胶质细胞内含有大量嗜银性纤维丝的少突胶质细胞包涵体(glial cytoplasmic inclusions,GCIs)形成,其主要成分是错误折叠、高度磷酸化及纤维状的α-突触核蛋白(α-synuclein, α-syn)。研究显示,α-syn异常沉积与NF-κB(nuclear factor-κB)信号转导体系的调控密切相关[1]。细胞因子几丁质酶3样蛋白1(chitinase 3-Like-1,YKL-40)和CD40的表达与NF-κB反应体系的激活密切相关。然而,MSA的致病过程中是否存在YKL-40和CD40表达的变化目前仍不清楚,本研究旨在探讨MSA患者和健康人之间血清YKL-40、CD40水平的差异,以及其与MSA发病年龄、病程、疾病严重程度的相关性,以期寻求MSA的生物标记物,为深入研究其发病机制提供线索。
1 对象和方法
1.1 观察对象 病例组:2013-03-01—2014-11-30期间作者医院神经内科MSA住院患者30例,男21例、女9例,年龄为44~78岁,平均年龄为(62.03±9.93)岁,均符合2008年修订的Gilman诊断标准[2]。其中很可能MSA患者24例,可能MSA患者6例。很可能MSA指自主神经功能障碍(如尿失禁、直立位低血压),外加多巴胺反应差的帕金森症状或小脑性共济失调。可能MSA指帕金森症状或小脑性共济失调,外加可疑的自主神经功能障碍(如无法解释的尿频、尿急、尿不尽、男性勃起功能障碍,明显但未达到很可能MSA诊断标准的直立位低血压),并伴锥体束征、喘鸣等其他特征之一。30例患者中,首发症状为头晕5例,言语不清2例,走路不稳4例,动作笨拙7例,肢体震颤2例,性功能减退5例,尿便障碍4例,认知功能障碍1例;临床亚型是以患者接受临床评估时的症状及体征确定,其中以帕金森样症状为主(MSA-P型)14例,以小脑性共济失调为主(MSA-C型)16例。发病年龄43~76岁,平均(59.43±10.04)岁,病程为3~96个月,中位数(四分位数间距)为24.00(31.50)个月。
对照组:来自同期本院体检中心的健康体检者30名,男17名、女13名,年龄40~84岁,平均年龄为(65.23±11.13)岁。两组在性别、年龄上相匹配(P性别=0.284,P年龄=0.497)。遵循知情同意原则,入组人员均被告知研究目的、内容及参与研究可能带来的风险,并签署知情同意书。
1.2 方法
1.2.1 疾病严重程度评估:采用统一多系统萎缩评估量表Ⅱ(unified multiple system atrophy rating scaleⅡ,UMSARS Ⅱ)评分评估,量表测试由两名固定的神经内科医师执行。UMSARS Ⅱ由面部表情、语言、眼动异常、静止性震颤、动作性震颤、张力增高、快速轮替、手指拍动、下肢灵活性、跟膝胫试验、从坐位站起、姿势、身体摇晃和步态14项组成,综合评估了锥体外系受损和小脑受损导致的运动功能障碍,具有很好的评分者内信度[3]。UMSARS Ⅱ量表得分越高表示运动功能损伤的程度越重。
1.2.2 血清YKL-40与CD40水平检测:采集入组人员晨空腹外周静脉血3 mL于分离胶促凝管中,4000r/min离心5 min后提取血清分装至EP 管中。血清样本存放至-80℃冰箱内待用,避免反复冻融。采用双抗体夹心法酶联免疫吸附试验〔试剂盒由美国R&D公司(R&D systems, Minneapolis,MN)生产〕,严格按照人YKL-40分子和人CD40分子ELISA检测试剂盒说明书中标明的时间、加液量及操作步骤进行。运用酶标仪测定450 nm波长处各孔的吸光度〔D(λ)〕值,绘制标准曲线,按曲线方程计算各样本浓度。本研究中,YKL-40的标准曲线方程为样本水平=0.029D(λ)值+0.063,相对系数R2=0.997;CD40的标准曲线方程为样本水平=0.007D(λ)值+0.037,R2=0.999。比较两组间、对照组不同性别间、病例组不同分型患者间的水平,对差异有统计学意义(P<0.05)者,进一步行相关分析。
1.2.3 相关性分析:血清YKL-40与CD40水平两组间比较差异有统计学意义(P<0.05)者,进一步与发表年龄、病程及UMSARS Ⅱ评分行相关性分析。
1.3 统计学处理 采用SPSS13.0统计软件包进行分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)表示,两组间比较采用Mann-WhitneyU检验;计数资料组间比较采用Pearsonχ2检验;对照组血清YKL-40水平与年龄的相关性分析采用Pearson相关分析;病例组血清YKL-40水平与发病年龄、病程、UMSARS II评分的相关性分析采用Spearman相关分析;血清YKL-40 水平对MSA的诊断价值评估采用接受者操作特性曲线(ROC曲线)。以P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组血清YKL-40、CD40水平的比较 对照组男、女间血清YKL-40水平比较差异无统计学意义〔(36.23±9.74)ng/mL vs.(36.50±10.86)ng/mL;t=0.519,P=0.477〕。病例组MSA-C型血清YKL-40水平中位数(四分位数间距)为40.67(13.09)ng/mL,MSA-P型为38.24(9.90)ng/mL,两者间比较差异无统计学意义(U=104.00,P=0.739)。与对照组比较,病例组血清YKL-40水平降低(P=0.002),而两组间CD40水平比较差异无统计学意义(P=0.871)。结果见表1。
表1 两组血清YKL-40和CD40水平比较〔n=30,Md(QR)〕

组别YKL⁃40(ng/mL)CD40(pg/mL)病例组3832(1174)12039(3947)对照组4721(1388)11612(3585)t值2380043900P值00020871
2.2 血清YKL-40水平与各因素的相关性分析 对照组血清YKL-40水平与年龄无明显相关性(r=-0.065,P=0.731);病例组UMSARS Ⅱ评分为12~36分,平均(24.20±6.43)分,病例组血清YKL-40水平与MSA发病年龄(r=0.111,P=0.560)、病程(r=-0.240,P=0.201)、UMSARS Ⅱ评分(r=-0.248,P=0.186)均无明显相关性。
2.3 血清YKL-40对MSA的诊断价值评估 ROC曲线下的面积(AUC)为0.264(P=0.002,图1),AUC<0.5表明血清YKL-40水平对MSA无明确诊断价值。
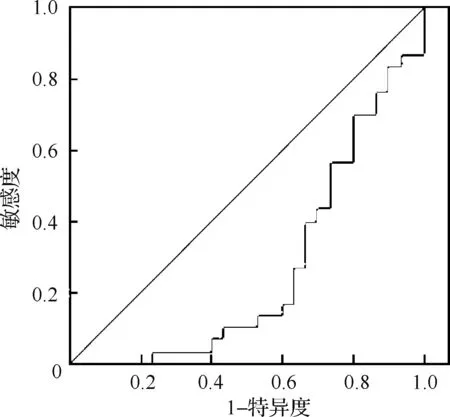
图1 MSA患者血清YKL-40诊断的ROC曲线
3 讨论
目前,MSA的病因及致病过程仍不明确,缺乏与疾病进程密切相关的生物标记物。本研究观察MSA患者的血清YKL-40、CD40水平,旨在寻求MSA的潜在生物标记物。
在MSA疾病早期,少突胶质细胞中出现p25α蛋白的聚集,这是一种与髓鞘形成相关的促微管聚合蛋白,是少突胶质细胞特有的磷酸化蛋白。它的聚集促成了α-syn的异常沉积[4],两者的共同表达可促进转录因子(IκBα)的表达,进一步诱导NF-κB的表达。NF-κB/Rel蛋白家族是传递应激信号的体系,胞质IκBα抑制蛋白可对其进行负调节[5]。2014年Kragh等[1]的研究显示,转录因子IκBα的沉默可显著增强p65亚基的核转运以及NF-κB系统激活,进而抑制了α-syn和p25α蛋白的共表达,从而实现对少突胶质细胞的保护作用。
YKL-40是糖基水解酶18家族的一员[6],与星形胶质细胞和小胶质细胞的迁移、反应性神经胶质细胞增多有关,是神经胶质细胞激活的标记物[7]。炎性因子TNF-α和IL-1β的分泌,可激活NF-κB信号转导体系,进而诱导YKL-40的表达[8-9]。YKL-40表达上调可出现于许多神经系统疾病中,如多发性硬化、亨廷顿舞蹈病、阿尔茨海默病等[7],其中,以恶性胶质瘤最受关注[10]。Recklies等发现软骨细胞中,炎性细胞因子TNF-α和IL-1β可通过NF-κB信号转导体系的作用诱导YKL-40的转录和翻译[ 9]。此外,YKL-40也可调控NF-κB体系的功能,骨骼肌细胞中,YKL-40通过抑制NF-κB的激活进而阻断TNF-α引发的炎性反应[11]。Olsson等[12]的研究显示脑脊液(CSF)中YKL-40的表达在α-突触核蛋白病(如帕金森病、MSA)中明显低于在tau蛋白病(如皮质基底节变性、进行性核上性麻痹)中的表达,推测可能因为α-突触核蛋白病的神经胶质细胞反应活性降低。
本研究中发现虽然MSA患者血清YKL-40水平较健康人降低,却与MSA患者的发病年龄、病程及病情严重程度无相关性,这可能由于YKL-40的广泛组织源性,血清YKL-40多来自外周单核细胞/巨噬细胞,不能准确代表中枢神经系统的YKL-40表达;也可能是血清YKL-40的改变并不能反映MSA的疾病进展。然而,既往研究显示CSF中YKL-40水平比血清中高7倍[12],作为神经细胞生存的内环境,可能以CSF为载体的研究更具有前景。此外,本研究中ROC曲线下的面积<0.5,也提示血清YKL-40对MSA的诊断没有价值。综上可见,血清YKL-40并不能成为MSA的生物标记物。
CD40是肿瘤坏死因子受体超家族的一员,相对分子质量约45 000~50 000,与配体CD40L(又名CD154)相互作用在细胞免疫和体液免疫中发挥着重要作用,其异常表达于多发性硬化、阿尔茨海默病及脑血管疾病等疾病[13]。CD40在巨噬细胞或小胶质细胞中的表达与NF-κB反应体系的激活密切相关[13-14]。在小胶质细胞中,细胞因子IFN-γ诱导TNF-α表达,进一步激活NF-κB反应体系,使NF-κB转录因子核易位并结合于CD40启动子上承载的3个NF-κB结合位点,CD40得以表达[13-14]。然而,这一炎性反应过程是否涉及到MSA的疾病进程仍不清楚,尚需进一步研究。
目前,尚无关于CD40表达与MSA相关性的研究见诸报道。本研究未发现在MSA患者和健康人之间血清CD40表达存在差异,以后可以进一步探究CSF甚至特定部位脑组织(如壳核、脑桥、小脑等)的CD40表达与MSA发生是否相关。
本研究发现,血清YKL-40、CD40水平均对MSA没有诊断价值,两个指标在MSA病理进程中的变化与作用仍需多部位(如CSF、特定脑区)、大样本临床研究以及涉及信号转导通路的探索明确。
[1]Kragh CL, Gysbers AM, Rockenstein E, et al. Prodegenerative IkappaBalpha expression in oligodendroglial alpha-synuclein models of multiple system atrophy[J]. Neurobiol Dis, 2014, 63:171-183.
[2]Gilman S, Wenning G K, Low P A, et al. Second consensus statement on the diagnosis of multiple system atrophy[J]. Neurology, 2008, 71(9): 670-676.
[3]Krismer F, Seppi K, Tison F, et al. The Unified Multiple System Atrophy Rating Scale: intrarater reliability[J]. Mov Disord, 2012, 27(13): 1683-1685.
[4]Lindersson E, Lundvig D, Petersen C, et al. p25alpha Stimulates alpha-synuclein aggregation and is co-localized with aggregated alpha-synuclein in alpha-synucleinopathies[J]. J Biol Chem, 2005, 280(7): 5703-5715.
[5]Papa S, Zazzeroni F, Pham CG, et al. Linking JNK signaling to NF-kappaB: a key to survival[J]. J Cell Sci, 2004, 117(Pt 22): 5197-5208.
[6]Shao R, Francescone R, Ngernyuang N, et al. Anti-YKL-40 antibody and ionizing irradiation synergistically inhibit tumor vascularization and malignancy in glioblastoma[J]. Carcinogenesis, 2014, 35(2): 373-382.
[7]Vinther-Jensen T, Budtz-Jorgensen E, Simonsen A H, et al. YKL-40 in cerebrospinal fluid in Huntington's disease - A role in pathology or a nonspecific response to inflammation?[J]. Parkinsonism Relat Disord, 2014, 20(11): 1301-1303.
[8]Bhat KP, Pelloski CE, Zhang Y, et al. Selective repression of YKL-40 by NF-kappaB in glioma cell lines involves recruitment of histone deacetylase-1 and -2[J]. FEBS Lett, 2008, 582(21-22): 3193-3200.
[9]Recklies AD, Ling H, White C, et al. Inflammatory cytokines induce production of CHI3L1 by articular chondrocytes[J]. J Biol Chem, 2005, 280(50): 41213-41221.
[10]Francescone RA, Scully S, Faibish M, et al. Role of YKL-40 in the angiogenesis, radioresistance, and progression of glioblastoma[J]. J Biol Chem, 2011, 286(17): 15332-15343.
[11]Gorgens SW, Eckardt K, Elsen M, et al. Chitinase-3-like protein 1 protects skeletal muscle from TNFalpha-induced inflammation and insulin resistance[J]. Biochem J, 2014, 459(3): 479-488.
[12]Olsson B, Constantinescu R, Holmberg B, et al. The glial marker YKL-40 is decreased in synucleinopathies[J]. Mov Disord, 2013, 28(13): 1882-1885.
[13]Benveniste EN, Nguyen VT, Wesemann DR. Molecular regulation of CD40 gene expression in macrophages and microglia[J]. Brain Behav Immun, 2004, 18(1): 7-12.
[14]Goel C, Kalra N, Dwarakanath B S, et al. Per a 10 protease activity modulates CD40 expression on dendritic cell surface by NF-kappaB pathway[J]. Clin Exp Immunol, 2015,180(2):341-351.
(本文编辑:邹晨双)
Research on serum YKL-40,CD40 and relative factors in patients with multiple system atrophy
CHENJianwen,ZHOUJingyuan,ZHANGKaihua,GAOSong,ZHAOLi,DONGChunbo*.
*DepartmentofNeurology,theFirstAffiliatedHospitalofDalianMedicalUniversity,DalianLiaoning116011,China
Corresponding author: DONG Chunbo, Email:dcb101@sina.com
Objective To detect the difference of serum YKL-40 and CD40 between multiple system atrophy (MSA) patients and healthy people and the correlation of serum YKL-40 and CD40 with onset age, disease duration and severity in MSA patients.Methods According to the 2008 diagnostic criteria of MSA revised by Gilman et al, 30 MSA inpatients were diagnosed from MAR.1, 2013 to NOV.30, 2014 and included in the study. And 30 healthy age- and gender- matched subjects were enrolled as healthy controls. 24 cases were diagnosed as probable MSA and 6 were possible MSA. With the Unified Multiple System Atrophy Rating Scale (UMSARS) Part Ⅱ, we evaluated the clinical status of each MSA patient. The concentration of serum YKL-40 and CD40 were detected by enzyme linked immunosorbent assay(ELISA). The levels of serum YKL-40 and CD40 were detected in MSA patients and healthy controls, and their relationship with gender, age, onset age, duration and UMSARS Ⅱ scores of MSA patients were analyzed. Results Serum levels of YKL-40 of the MSA patients were significantly lower [38.32(11.74) ng/mL] than those of the healthy controls [(47.21(13.88)ng/mL,t=238.00,P=0.002]. However, no significant correlation was observed between serum YKL-40 level and onset age (r=0.111,P=0.560), duration (r=-0.240,P=0.201) or UMSARS Ⅱ score (r=-0.248,P=0.186) in MSA patients. Receiver operating characteristic (ROC) curve analysis indicated that serum YKL-40 level lack the diagnostic value for MSA (AUC=0.264,P=0.002). There was no significant difference in serum CD40 concentration between MSA patients [120.39 (39.47) pg/mL] and healthy controls [116.12 (35.85) pg/mL,t=439.00,P=0.871]. There were no significant differences in serum YKL-40 levels between male and female in the control group [(36.23±9.74) ng/mL,(36.50 ±10.86)ng/mL,t=0.519,P=0.477)], and between MSA-C type and MSA-P [(40.67(13.09)ng/mL,38.24(9.90)ng/mL,U=104.00,P=0.739)] in the MSA group. Conclusions Serum YKL-40 concentration is significantly lower in MSA patients than that in healthy controls. There is a speculation that YKL-40 expression is changed under the condition of MSA. There is no correlation between YKL-40 level and onset age, duration, or UMSARSⅡ score.
multiple system atrophy;YKL-40;CD40;biomarker
10.3969/j.issn.1006-2963.2016.06.001
116011,大连医科大学附属第一医院:神经内科(陈建文、周靖媛、张凯华、赵莉、董春波),药局(高松)
董春波,Email:dcb101@sina.com
R742
A
1006-2963(2016)06-0385-04
2015-04-17)
