氮苯丙烯叉基苯胺衍生物紫外光谱中的取代基效应
2017-01-03付秀芳石崇慧陈冠凡
付秀芳,石崇慧,陈冠凡
(湖南科技大学 化学化工学院,湖南 湘潭,411201)
氮苯丙烯叉基苯胺衍生物紫外光谱中的取代基效应
付秀芳,石崇慧,陈冠凡
(湖南科技大学 化学化工学院,湖南 湘潭,411201)

氮苯丙烯叉基苯胺;紫外吸收光谱; 激发态参数;取代基效应
在有机共轭分子中,分子的前线轨道(HOMO/LUMO)之间的能级差受到其结构的影响。改变有机共轭分子中的取代基可以精细地调节其前线轨道能级[1],从而有效地改善有机共轭光电发光材料的光学性能。紫外吸收光谱作为反映分子的前线轨道之间能级差的常用光谱分析方法,其与分子结构之间的定量关系备受化学研究者关注[2-5],研究者们试图找出两者之间的定量关系,从而为有机共轭光电发光材料的设计合成提供理论依据。
著名的Hammett参数(σ参数)[6],曾是最早用于紫外吸收光谱定量研究的取代基参数。尽管其能够广泛应用于多数有机共轭分子光谱中的取代基效应定量研究,然而,其用于化合物激发态的性能研究的合理性仍受到某些研究者质疑[7]。上世纪90年代,蒋锡夔和计国桢提出了自旋-离域效应参数σJJ·[8],建立了的单参数方程(自由基取代参数σ·)和双参数方程(极性取代基参数σx和自由基取代参数σ·),并成功的应用于取代苯乙烯,取代苯乙炔等不同芳香化合物紫外吸收光谱的取代基效应研究。
υmax=ρ·σ·+ C,
(1)
υmax=ρ·σ·+ρxσx+ C。
(2)

1 数据集
1.1 模型化合物的合成
氮苯丙烯叉基苯胺衍生物(N-(3-phenylallylidene)benzenamine,简称PBA)均采用无溶剂缩合反应制备得到(如图1所示)[12],其具体操作为:称取10mmol取代肉桂醛和10mmol取代苯胺置于玛瑙研钵中,两者混合研磨,TCL检测反应终点,粗产物经乙醇重结晶,得到相应的产物,且产物结构经1H NMR 确证。

图1 氮苯丙烯叉基苯胺衍生物的合成路线Fig.1 Synthetic route of the N-(3-phenylallylidene)benzenamine derivatives
p-Me2NPBAOMe-p(1),1H NMR(CDCl3,TMS,500MHz): 8.24(d,J=8.9Hz,1H),7.42(d,J=8.7Hz,2H),7.18(d,J=8.8Hz,2H),7.04(d,J=15.8Hz,1H),6.93(q,3H),6.69(d,J=8.7Hz,2H),3.82(s,3H),3.01(s,6H)。
p-Me2NPBAMe-p(2),1H NMR(CDCl3,TMS,500MHz): 8.24(d,J=9.0Hz,1H),7.43(d,J=8.8Hz,2H),7.17(d,J=8.1Hz,2H),7.07(q,3H),6.94(q,1H),6.70(d,J=8.7Hz 2H),3.02(s,6H),2.36(s,3H)。
p-Me2NPBAH(3),1H NMR(CDCl3,TMS,500MHz): 8.23(d,J=9.0Hz,1H),7.44(d,J=8.7Hz,2H),7.37(t,2H),7.19(t,3H),7.09(d,J=15.8Hz,1H),6.95(q,1H),6.70(d,J=8.8Hz 2H),3.02(s,6H)。
p-Me2NPBAF-p(4),1H NMR(CDCl3,TMS,500MHz): 8.20(d,J=9.0Hz,1H),7.43(d,J=8.8Hz,2H),7.10(m,5H),6.92(q,1H),6.69(d,J=8.8Hz 2H),3.02(s,6H)。
p-Me2NPBACl-p(5),1H NMR(CDCl3,TMS,500MHz): 8.19(d,J=9.0Hz,1H),7.43(d,J=8.9Hz,2H),7.32(d,J=8.6Hz,2H),7.09(t,3H),6.92(q,1H),6.69(d,J=8.7Hz 2H),3.02(s,6H)。
p-MeOPBAOMe-p(6),1H NMR(CDCl3,TMS,500MHz): 8.27(d,J=8.6Hz,1H),7.8(d,J=8.6Hz,2H),7.19(d,J=9.0Hz,2H),7.03(m,2H),6.92(q,4H),3.84(d,J=8.0Hz,6H)。
p-MeOPBAMe-p(7),1H NMR(CDCl3,TMS,500MHz): 8.26(d,J=8.7Hz,1H),7.48(d,J=8.7Hz,2H),7.18(d,J=8.1Hz,2H),7.09(q,3H),7.00(q,1H),6.92(d,J=8.8Hz,2H),3.84(s,3H),2.36(s,3H)。
p-MeOPBAPhH(8),1H NMR(CDCl3,TMS,500MHz): 8.24(d,J=8.8Hz,1H),7.49(d,J=8.8Hz,2H),7.37(d,J=7.5Hz,2H),7.15(m,4H),7.00(q,1H),6.92(d,J=8.8Hz,2H),3.84(s,3H)。
p-MeOPBAF-p(9),1H NMR(CDCl3,TMS,500MHz): 8.21(d,J=8.8Hz,1H),7.49(d,J=8.8Hz,2H),7.16(q,2H),7.08(m,3H),6.96(m,3H),3.84(s,3H)。
p-MeOPBACl-p(10),1H NMR(CDCl3,TMS,500MHz): 8.20(d,J=8.8Hz,1H),7.49(d,J=8.7Hz,2H),7.33(d,J=8.7Hz,2H),7.12(t,3H),6.96(m,3H),3.84(s,3H)。
p-MePBAOMe-p(11),1H NMR(CDCl3,TMS,500MHz): 8.29(d,J=7.3Hz,1H),7.43(d,J=8.0Hz,2H),7.20(d,J=8.7Hz,4H),7.08(d,J=8.4Hz,2H),6.92(d,J=8.9Hz,2H),3.38(s,3H),2.38(s,3H)。
p-MePBAMe-p(12),1H NMR(CDCl3,TMS,500MHz): 8.25(d,J=7.8Hz,1H),7.43(d,J=8.0Hz,2H),7.20(t,4H),7.10(q,4H),2.38(s,3H),2.36(s,3H)。
p-MePBAH(13),1H NMR(CDCl3,TMS,500MHz): 8.25(d,J=8.2Hz,1H),7.44(d,J=8.0Hz,2H),7.38(t,2H),7.20(q,5H),7.08(m,2H),2.38(s,3H)。
p-MePBAF-p(14),1H NMR(CDCl3,TMS,500MHz): 8.22(d,J=8.4Hz,1H),7.43(d,J=8.1Hz,2H),7.20(d,J=7.9Hz,2H),7.16(q,2H),7.07(m,4H),2.38(s,3H)。
p-MePBACl-p(15),1H NMR(CDCl3,TMS,500MHz): 8.22(d,J=8.8Hz,1H),7.44(d,J=8.0Hz,2H),7.33(d,J=8.6Hz,2H),7.21(d,J=7.9Hz,2H),7.09(m,4H),2.38(s,3H)。
HPBAOMe-p(16),1H NMR(CDCl3,TMS,500MHz): 8.31(q,1H),7.55(t,2H),7.41(q,2H),7.36(t,1H),7.22(q,2H),7.13(t,2H),6.93(q,2H).3.84(s,3H)。
HPBAMe-p(17),1H NMR(CDCl3,TMS,500MHz): 8.29(d,J=8.0Hz,1H),7.54(d,J=7.2Hz,2H),7.37(m,3H),7.19(d,J=8.1Hz,2H),7.12(t,4H),2.36(s,3H)。
HPBAH(18),1H NMR(CDCl3,TMS,500MHz): 8.29(d,J=7.8Hz,1H),7.55(d,J=7.1Hz,2H),7.39(m,5H),7.22(m,3H),7.13(m,2H)。
HPBAF-p(19),1H NMR(CDCl3,TMS,500MHz): 8.25(d,J=8.4Hz,1H),7.55(d,J=7.0Hz,2H),7.39(m,3H),7.17(m,3H),7.09(m,3H)。
HPBACl-p(20),1H NMR(CDCl3,TMS,500MHz): 8.23(d,J=8.5Hz,1H),7.54(d,J=7.0Hz,2H),7.37(m,5H),7.12(m,4H)。
p-ClPBAOMe-p(21),1H NMR(CDCl3,TMS,500MHz): 8.29(d,J=7.4Hz,1H),7.46(d,J=8.5Hz,2H),7.36(d,J=8.5Hz,2H),7.21(d,J=8.9Hz,2H),7.07(d,J=5.4Hz,2H),6.93(d,J=8.9Hz,2H),3.83(s,3H)。
p-ClPBAMe-p(22),1H NMR(CDCl3,TMS,500MHz): 8.27(d,J=8.3Hz,1H),7.45(d,J=8.5Hz,2H),7.35(d,J=8.5Hz,2H),7.19(d,J=8.0Hz,2H),7.11(d,J=8.2Hz,2H),7.07(d,J=4.8Hz,2H),2.36(s,3H)。
p-CPBAH(23),1H NMR(CDCl3,TMS,500MHz): 8.26(d,J=8.2Hz,1H),7.46(d,J=8.5Hz,2H),7.39(q,4H),7.24(t,1H),7.19(d,J=7.4Hz,2H),7.09(d,J=6.3Hz,2H)。
p-ClPBAF-p(24),1H NMR(CDCl3,TMS,500MHz): 8.24(d,J=7.9Hz,1H),7.46(d,J=8.5Hz,2H),7.37(d,J=8.5Hz,2H),7.17(q,2H),7.06(m,4H)。
p-ClPBACl-p(25),1H NMR(CDCl3,TMS,500MHz): 8.23(d,J=8.3Hz,1H),7.47(d,J=8.4Hz,2H),7.36(q,4H),7.12(q,3H),7.06(q,1H)。
1.2 模型化合物紫外吸收光谱的测定
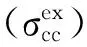
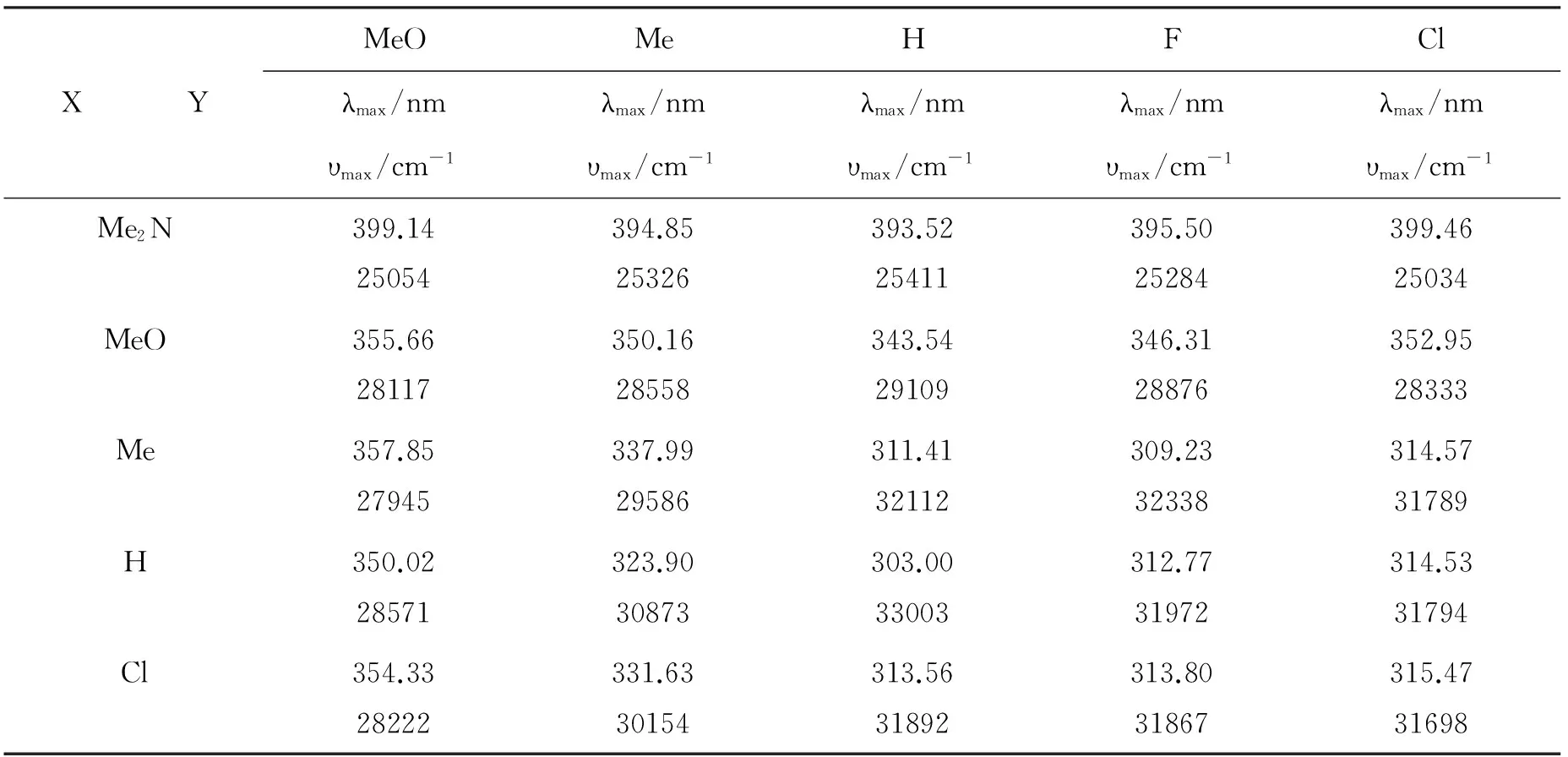
表1 氮苯丙烯叉基苯胺衍生物的最大吸收波长λmax(nm)及最大吸收波数υmax (cm-1)

表2 所用的取代基参数数值
2 结果与讨论
分析表1中数据,不同苯环上的相同取代基对于氮苯丙烯叉基苯胺衍生物的紫外吸收光谱影响明显不同。如MePBAH的最大吸收波长和波数分别为311.41nm和32112 cm-1,而HPBAMe的最大吸收波长和波数分别为323.90nm和30873cm-1。该现象意味着氮苯丙烯叉基苯胺衍生物紫外吸收光谱中碳端苯环和氮端苯环取代基效应可能呈现出不同规律。
2.1 氮端苯环取代基效应对氮苯丙烯叉基苯胺衍生物紫外吸收光谱的影响
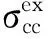
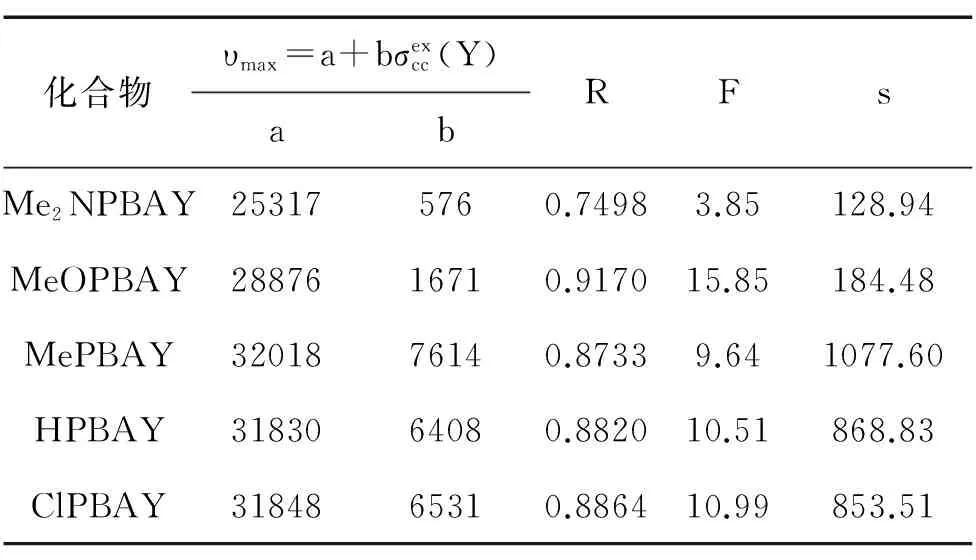
表3 单参数方程对不同系列模型化合物最大吸收波数中氮端苯环取代基变化的回归结果
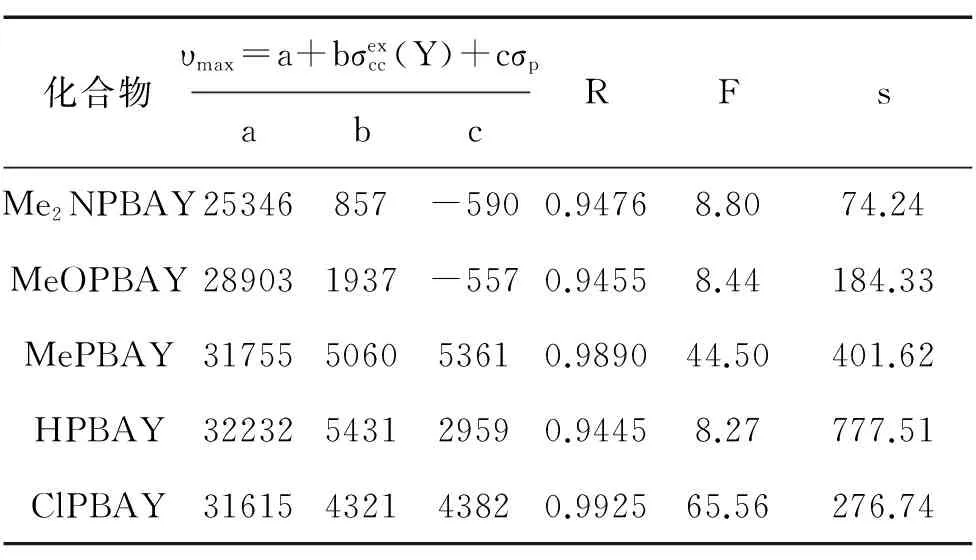
表4 双参数方程对不同系列模型化合物最大吸收波数中氮端苯环取代基变化的回归结果
2.2 碳端苯环取代基效应对氮苯丙烯叉基苯胺衍生物紫外吸收光谱的影响

根据先前的取代trans-二苯乙烯和取代氮苄叉基苯胺等的紫外光谱中取代基效应的研究结果,我们发现,氮端苯环的取代基效应适合用双参数方程关联,与先前取代氮苄叉基苯胺的紫外吸收光谱中取代基效应类似;而碳端苯环的取代基效应可用单参数方程关联,与先前trans-二苯乙烯的紫外光谱中取代基效应近似。
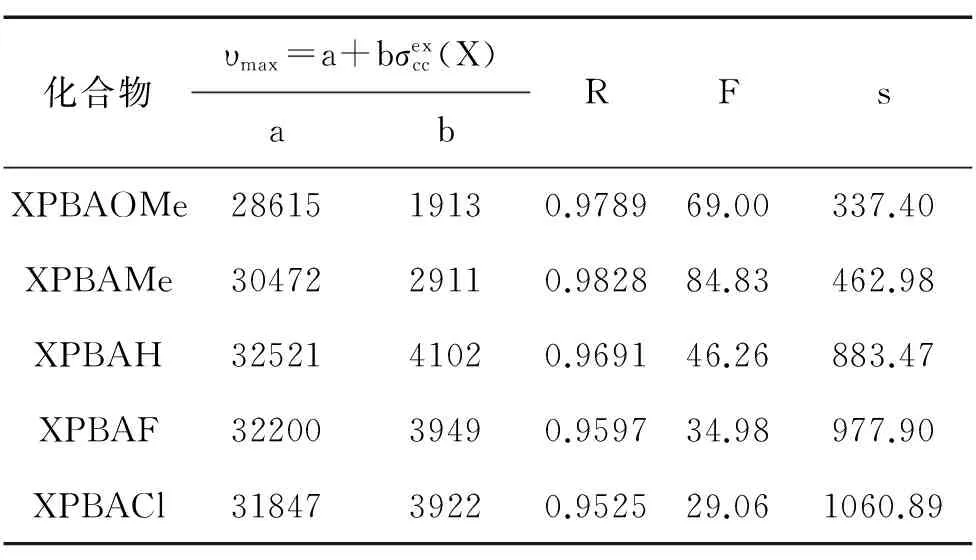
表5 单参数方程对不同系列模型化合物最大吸收波数中碳端苯环取代基变化的回归结果
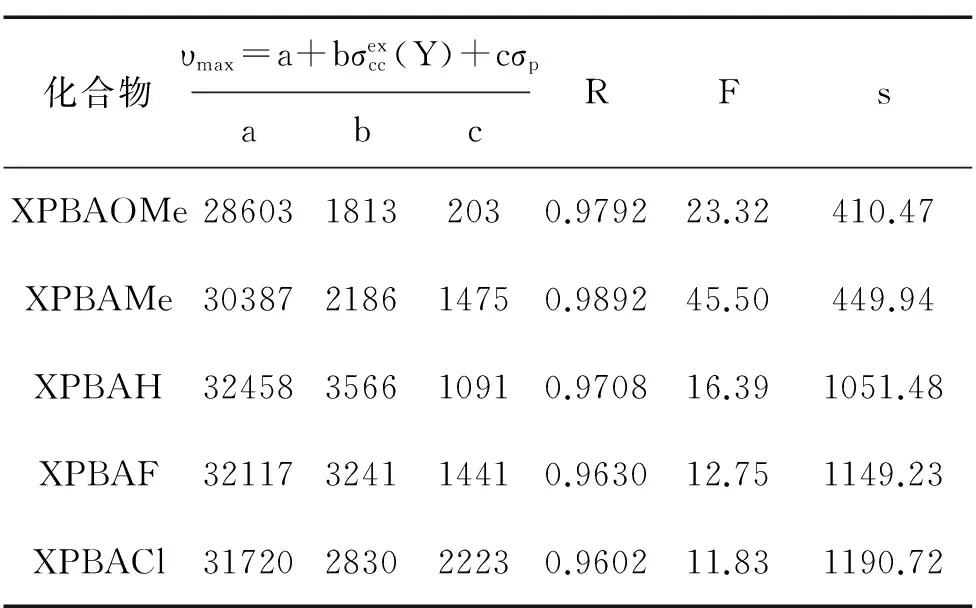
表6 双参数方程对不同系列模型化合物最大吸收波数中碳端苯环取代基变化的回归结果
3 结论

[1]曹晨忠,林原斌.共轭烯烃的共轭极化势[J].化学物理学报,2004,17(06): 703-710.
[2]S.L.Broman,M.Jevric ,M.B.Nielsen.Linear Free-Energy Correlations for the Vinylheptafulvene Ring Closure: A Probe for Hammett σ Values[J].Chemistry-A European Journal,2013,19(29): 9542-9548.
[3]G.Vastag,S.Apostolov,B.Matijevi,et al.Structure-interaction relationship study of N-(4-phenylsubstituted) cyanoacetamides by multivariate methods[J].Journal of Chemometrics.2016,30(04): 210-216.
[4]A.Taherpour,G.Shafiei.The structural relationship between Randiindices,adjacency matrixes,distance matrixes and maximum wave length of linear simple conjugated polyene compounds [J].Journal of Molecular Structure Theochem.2005,726: 183-188.
[5]L.Zhang,H.M.Muchall,G.H.Peslherbe.Substituent Effects in the Absorption Spectra of Phenol Radical Species: Origin of the Redshift Caused by 3,5-Dimethoxyl Substitution[J].Photochemistry and Photobiology,2013,89(03): 536-544.
[6]L.P.Hammett.The Effect of Structure upon the Reactions of Organic Compounds.Benzene Derivatives[J].Journal of American Chemistry Society,1937,59(01):96-103.
[7]高振衡,赵爱华,王明真.5-苯基-2-(2’-苯基(噁) 唑基-5’)1,3,4-(噁)二唑及其5-对位取代苯基衍生物的研究[J].有机化学,1988,8,18-23.
[8]X.K.Jiang.Establishment and Successful Application of the σJJScale of Spin-Delocalization Substituent Constants[J].Accounts of Chemical Research,1997,30(07):283-289.
[10]G.F.Chen,C.Z.Cao.Substituent effect on the UV spectra of p-disubstituted compounds XPh(CH=CHPh)nY (n=0,1,2) [J].Journal of Physical Organic Chemistry,2010,23(01): 776-782.
[11]G.F.Chen,C.Z.Cao,B.T.Lu,et al.The substituent effect on the UV energy of 4,4′-disubstituted benzylideneanilines[J].Journal of Physical Organic Chemistry,2012,25(08): 327-333.
[12]G.F.Chen,C.Z.Cao,B.Sheng,et al.Substituent effect study on δc values of the bridge group carbons in disubstituted cinnamyl aniline series[J].Journal of Physical Organic Chemistry,2012,25(02): 828-834.
[13]C.Hansch,A.Leo,R.W.A survey of Hammett substituent constants and resonance and field parameters[J].Chemical Reviews,1991,91 (02): 165-195.
The effect of substituent on the UV-Vis spectroscopy of substituted N-(3-phenylallylidene)benzenamine
FU Xiufang,SHI Conghui,CHEN Guanfan
(SchoolofChemistryandChemicalEngineering,HunanUniversityofScienceandTechnology,Xiangtan411201,China)
25 sorts of para-substituted N-(3-phenylallylidene)benzenamine were synthesized and their UV-Vis spectra were measured in ethanol.In the study on the UV energy of the titled compounds,for the effect of substituent X that is close to carbon in the bridge bond on the UV wavenumbers,its UV data can be correlated with a single-parameter equation,which is similar to the substituent effect of trans-stilbene on their UV wavenumbers.However,for the effect of substituent Y that is close to nitrogen in the bridge bond on the UV data,its UV energy can be correlated with a double-parameter equation,which resembles the substituent effect of benzylideneanilines on their UV wavenumbers.
N-(3-phenylallylidene)benzenamine; UV-Vis spectroscopy;excited-state substituent constant; substituent effect
1672-7010(2016)02-0108-07
2016-05-16
国家自然科学基金资助项目(21202043)
付秀芳(1992-),女,河南永城人,研究生,从事有机合成研究通信作者:陈冠凡(1978-),男,湖南韶山人,副教授,博士,从事有机合成研究;E-mail:gfchen@hnust.edu.cn
O621.4
A
