不同管理措施对高寒草甸土壤微生物量的影响研究
2017-01-03蒋永梅姚拓李建宏陈龙刘欢刘婷田永亮张标高亚敏
蒋永梅,姚拓*,李建宏,陈龙,刘欢,刘婷,田永亮,张标,高亚敏
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
不同管理措施对高寒草甸土壤微生物量的影响研究
蒋永梅1,2,姚拓1,2*,李建宏1,2,陈龙1,2,刘欢1,2,刘婷1,2,田永亮1,2,张标1,2,高亚敏1,2
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
采用氯仿熏蒸浸提法对玛曲高寒草甸4种管理措施(不围栏、围栏、围栏+施肥、围栏+补播)土壤微生物量碳(SMBC)、氮(SMBN)和磷(SMBP)连续4年(2011-2014年)变化动态进行研究,结果表明,1)同一年份,不同管理措施,相同空间层次,土壤微生物量表现为:围栏+补播>围栏+施肥>围栏>不围栏(0~20 cm)和围栏+施肥>围栏+补播>围栏>不围栏(20~40 cm);同一年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),土壤微生物量表现为0~20 cm>20~40 cm, 一般前者为后者的1.22~3.39倍。2)不同年份,相同管理措施,相同空间层次(0~20 cm,20~40 cm),除不围栏(0~20 cm)SMBC外,土壤微生物量年际变化表现为2011至2012年上升至最大值,之后下降;不同年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),0~20 cm土壤微生物量年际变化幅度大于20~40 cm。土壤微生物量与气温呈负相关关系,土壤微生物量与降水量呈显著正相关关系。运用综合指数法计算出不同管理措施下土壤质量综合指数,其值排序为:围栏+补播>围栏+施肥>围栏>不围栏。围栏+补播对土壤的改善效果明显优于其他3种措施,是玛曲高寒草甸生态恢复的重要途径。
管理措施;高寒草甸;土壤微生物量;年际变化
青藏高原是世界上著名的放牧生态系统和最大的草地系统之一[1],同时也是我国重要的畜牧业生产基地和生态安全屏障[2]。近年来受全球变暖、人类活动和草原鼠虫害的影响,加之不合理利用和管理措施,草地退化严重[3-4]。草地退化可导致生态服务功能和生产力水平下降[5],“土壤-微生物-植被”生态系统破坏,生态稳定性降低,土壤养分状况恶化,土壤微环境破坏[6]。因此,退化草地的恢复治理是亟待解决的热点问题,在恢复退化草地生态系统时,不仅要恢复地上的植被,还要兼顾地下的土壤微生物群落,重建土壤微生物生态系统[7]。
土壤微生物量是活的土壤有机质部分,也是土壤养分的“源”和“库”[8],对植物生长具有重要的作用[9],是草地土壤生态系统变化的预警。前人研究表明,围栏、施肥和补播等措施[10-12]对恢复退化草地具有重要的作用。围栏封育能够提高高寒草地土壤种子库数量[13],可食性牧草产量增加[14];长期围栏封育可使土壤养分和土壤微生物量增加[15 ];施肥是保护草地资源、维持草地生态系统养分平衡和恢复退化草地的重要措施[16],可显著提高植被盖度和生产力,增加微生物量碳含量[17];补播可有效提高退化草地的生产力水平,增加高寒草地草群高度和植被盖度,并可以增加土壤微生物数量[18]。运用上述单一管理措施或综合运用多种管理措施对退化高寒草甸地上植被和地下土壤理化性质的报道较多,对土壤生物学特性的研究报道较少,且都集中于土壤微生物数量和土壤微生物量碳的报道。而对于高寒草甸不同管理措施下土壤微生物量年际动态的研究更是鲜见报道,因此对恢复退化高寒草甸过程中土壤微生物量变化趋势尚不清楚,查明这些问题后对选择合理的管理措施提供科学依据。通过研究高寒草甸不同管理措施土壤微生物量年际变化,探讨不同管理措施对退化高寒草甸土壤微生物的影响,以期为退化高寒草甸恢复提供合理的管理措施,实现草地的可持续发展。
1 材料与方法
1.1 研究区域概况
试验样地选在玛曲县大水种畜厂,东南与四川省若尔盖县相连,地理坐标位于东经102°16′、北纬34°00′,平均海拔3471.4 m。主要草地类型为高寒草甸,拥有可利用天然草地6000 hm2,气候为寒冷湿润气候,无霜期只有20 d左右,全年无绝对无霜期,年均温为1.2 ℃,平均风速为2.5 m/s,最大风速36 m/s,年均大风日数77.1 d,年平均降水量615.5 mm,年蒸发量1353.4 mm,日照差大,日照年平均2583.9 h[19]。
1.2 样地设置
试验样地设在玛曲县大水种畜厂周边,选择平坦开阔且退化程度一致的草地(植被盖度约80%,平均高度20 cm,冬季地表有少量枯落物),样地中主要植物有垂穗披碱草(Elymusnutans)、黄花蒿(Artemisiaannua)、草地早熟禾(Poapratensis)、香青(Anaphalissinica)、蒲公英(Taraxacumofficnala)、唐松草(Thalictrumaquilegifolium)、龙胆(Gentianascabra)、狼毒(Stellerachamaejasme)、委陵菜(Potentillaaiscolor)等。2010年5月在研究区设置了4个面积为5 hm2样地(每个内设3个重复),并采取了不围栏(自由放牧)、围栏、围栏+施肥和围栏+补播4种不同的管理措施。自由放牧家畜为绵羊,放牧强度约为14只/hm2。施肥选用复合肥磷酸二铵 (NH4)2HPO4进行撒施,施肥量为10 kg/hm2。补播植物选取当地常用的垂穗披碱草、草地早熟禾和中华羊茅(Festucasinensis),补播比例为6∶2∶2,总播量为10.2 kg/hm2。
1.3 样品采集
采样时间为2011-2014年每年7月中旬(植物生长旺盛期),分别在各样地内采用5点法,用土钻分别采集0~20 cm和20~40 cm土样,每个样地5次重复,剔除植株根系和石头等杂物,把相同层次样品混合均匀后,再利用四分法的方式取适量土样,封装好带回实验室,并过孔径2 mm土壤筛,用于土壤微生物量的测定与分析。
1.4 测定方法
土壤微生物量碳、氮和磷测定采用氯仿熏蒸浸提方法[20-22]。
(1)土壤微生物量碳(soil microbial biomass carbon,SMBC)测定计算公式为:
SMBC(mg/kg)=(EC-EC0)/0.38
式中:EC、EC0分别为熏蒸和未熏蒸土壤浸提液中有机碳含量,0.38为校正系数。
(2)土壤微生物量氮(soil microbial biomass nitrogen,SMBN)测定计算公式为:
SMBN(mg/kg)=(EN-EN0)/0.54
式中:EN、EN0分别为熏蒸和未熏蒸土壤浸提液中全氮含量,0.54为校正系数。
(3)土壤微生物量磷(soil microbial biomass phosphorus, SMBP)测定计算公式为:
SMBP(mg/kg)=(EP-EP0)/0.40
式中:EP、EP0分别为熏蒸和未熏蒸土壤浸提液中磷含量,0.40为校正系数。
1.5 数据分析与处理
试验数据为3次重复的平均值,采用SPSS 19.0软件进行方差分析、相关性分析和主成分分析(principal components analysis,PCA),并用Excel 2010、Origin 8.5作图。
2 结果与分析
2.1 不同年份土壤微生物量碳变化特征
玛曲高寒草甸不同管理措施SMBC变化特征如图1所示,1)同一年份,不同管理措施,相同空间层次(0~20 cm,20~40 cm),高寒草甸SMBC含量变化各异。4种管理措施下,2011、2013年(20~40 cm)及2014年SMBC含量均表现为围栏+施肥>围栏+补播>围栏>不围栏,其余均表现为围栏+补播>围栏+施肥>围栏>不围栏。同一年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),高寒草甸SMBC含量均表现为0~20 cm大于20~40 cm,一般前者为后者的2.41~3.39倍。2)不同年份,相同管理措施,0~20 cm,SMBC年际变化总体表现为2011至2012年(除围栏外)显著上升至最大值(P<0.05),围栏+补播上升幅度最大达到31.45%,2012至2013年下降,2013至2014年显著下降至最小值(P<0.05)。20~40 cm,4种管理措施SMBC年际变化趋势与0~20 cm相似,除SMBC(围栏+补播)2012年和其他年份间差异显著外(P<0.05),其余各年份间差异不显著(P>0.05)。不同年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),0~20 cm SMBC年际变化幅度大于20~40 cm。
2.2 不同年份土壤微生物量氮变化特征
不同年份SMBN变化特征见图2,可以得到,1)同一年份,不同管理措施,相同空间层次(0~20 cm,20~40 cm),除0~20 cm,2011和2013年(围栏+施肥)外,SMBN表现为围栏+补播>围栏+施肥>围栏>不围栏;同一年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),SMBN与SMBC变化一致,且0~20 cm为20~40 cm的1.22~1.68倍。2)不同年份,相同管理措施,相同空间层次(0~20 cm,20~40 cm),SMBN年际变化趋势与SMBC基本一致,变幅较SMBC小;20~40 cm,除2011至2012年(围栏+施肥)显著上升外(P<0.05),其他管理措施没有显著差异(P>0.05),2012至2013年均呈下降趋势,2013至2014年(除不围栏、围栏外)SMBN显著下降(P<0.05),其中围栏+补播变化趋势最大。不同年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),SMBN与SMBC表现一致。

图1 土壤微生物量碳的年际动态变化Fig.1 The annual dynamics of soil microbial biomass carbon (SMBC) under different managements 不同小写字母表示同一土层同一管理措施不同年份差异显著(P<0.05),下同。Values with different letters show significant differences among different years in the same soil depth under same management at 0.05 level, The same below.
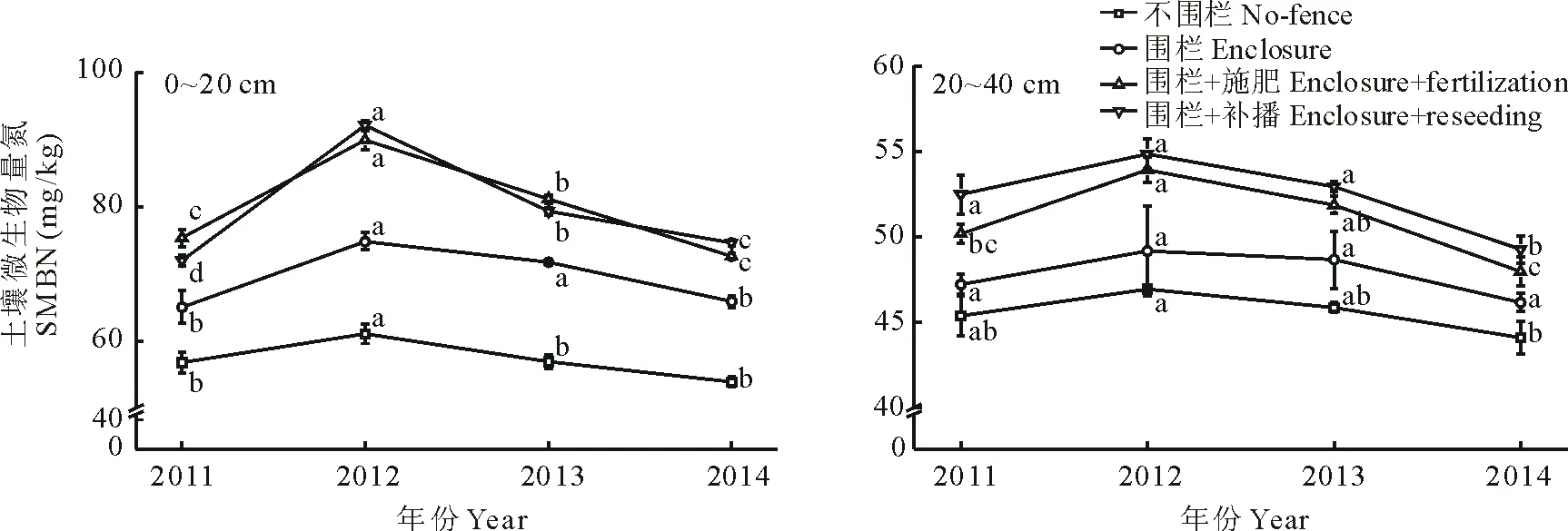
图2 土壤微生物量氮的年际动态变化Fig.2 The annual dynamics of soil microbial biomass nitrogen (SMBN) under different managements
2.3 不同年份土壤微生物量磷变化特征
不同年份SMBP变化特征见图3,可以看出,1)同一年份,不同管理措施,相同空间层次(0~20 cm,20~40 cm),除2011年(0~20 cm)不围栏外,SMBP均表现为围栏+补播>围栏+施肥>围栏>不围栏;同一年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),SMBP与SMBC和SMBN变化一致,0~20 cm为20~40 cm的 1.58~1.98倍。 2)不同年份 ,相同管理措施, 相同空间层次(0~20 cm, 20~40 cm), SMBP与SMBC和SMBN变化一致。20~40 cm,SMBP与SMBC和SMBN变化一致。不同年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),SMBP与SMBC和SMBN表现一致。
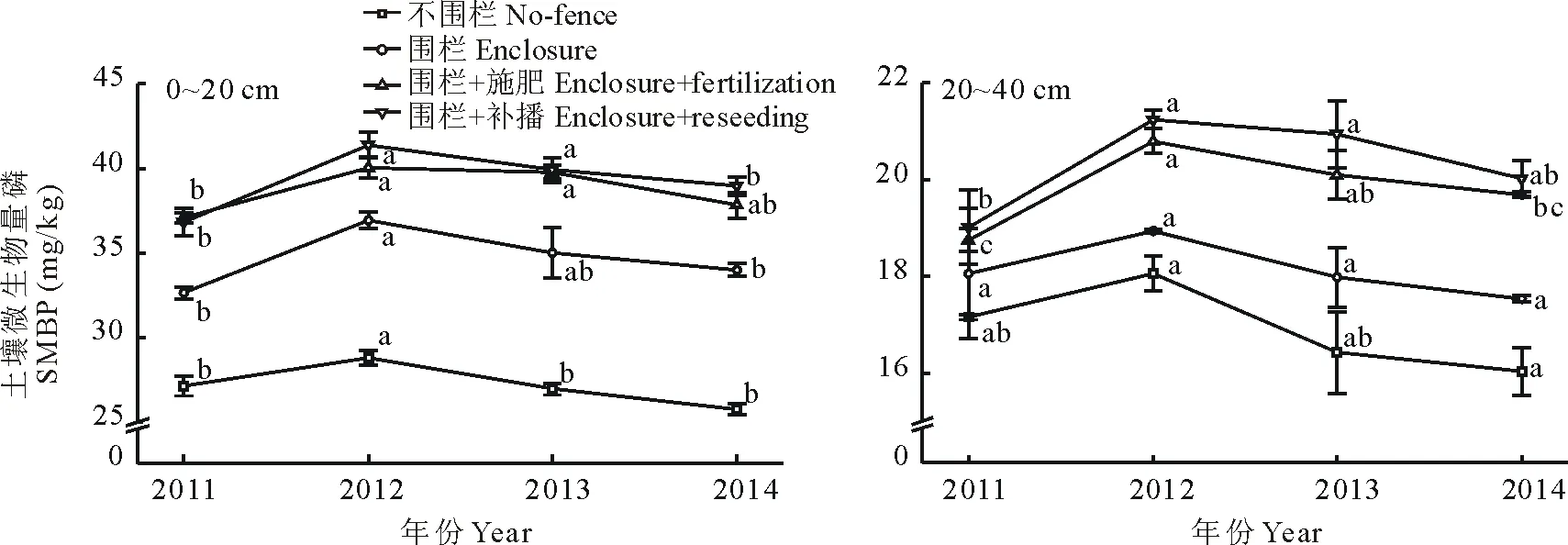
图3 土壤微生物量磷的年际动态变化Fig.3 The annual dynamics of soil microbial biomass phosphorus (SMBP) under different managements
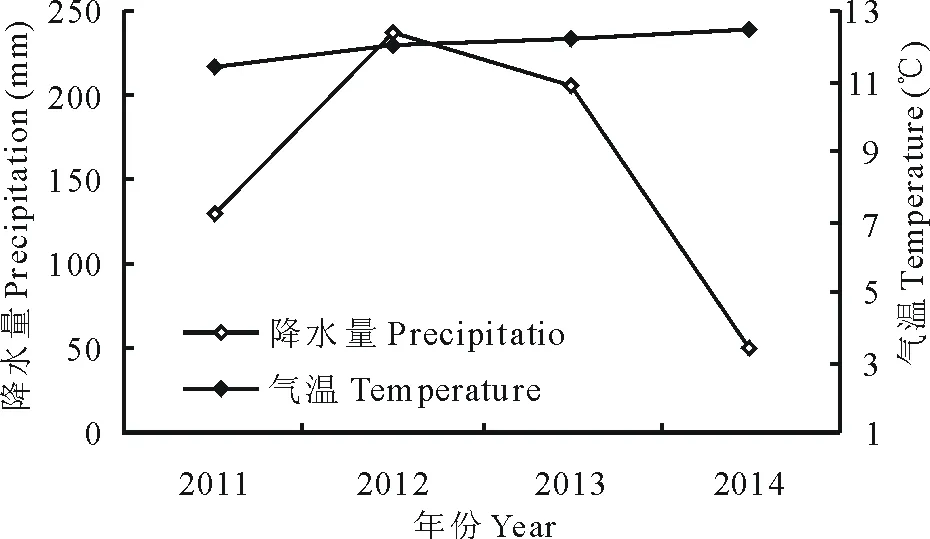
图4 不同年份气温和降水量的变化Fig.4 The change of temperature and precipitation under different years
2.4 不同年份气温和降水量变化
从中国气象科学数据共享服务网(http://www.escience.gov.cn/metdata/page/index.html)获得2011-2014年玛曲县7月的气温和降水量,其变化趋势如图4所示,4年内7月(草地生长旺盛时期,下同)平均气温变化幅度不大,最高气温出现在2014年(12.47 ℃),最低气温出现在2011年(11.42 ℃)。7月平均降水量总体呈现先增加后减少,最大降水量237.1 mm(2012年),降水量最小为50.3 mm(2014年)。
2.5 土壤微生物量与气温和降水量之间的相关性
4种管理措施下土壤微生物量(SMBC、SMBN和SMBP)与气温和降水量的相关性分析表明(表1),气温和降水量对不同空间层次,相同管理措施土壤微生物量影响程度不同。0~20 cm, SMBC(围栏+施肥)与降水量呈显著正相关(P<0.05),SMBC、SMBN和SMBP(不围栏)、SMBC(围栏)与气温间具有负相关关系,其中SMBC(不围栏)与气温间呈显著负相关(P<0.05),其他管理措施下土壤微生物量与气温和降水量呈正相关;20~40 cm, SMBC(围栏、围栏+施肥)和SMBN(不围栏、围栏+施肥、围栏+补播)与降水量呈显著正相关(P<0.05),SMBN(围栏)与降水量呈极显著正相关(P<0.01),其他管理措施下土壤微生物量与降水量呈正相关,除SMBC(围栏+补播)和SMBP(围栏+施肥、围栏+补播)外,土壤微生物量与气温呈负相关。可见,降水量对土壤微生物量的影响比气温大。
表1 不同管理措施土壤微生物量与气温和降水量的相关性
Table 1 Correlation of soil microbial biomass with temperature and precipitation in different managements
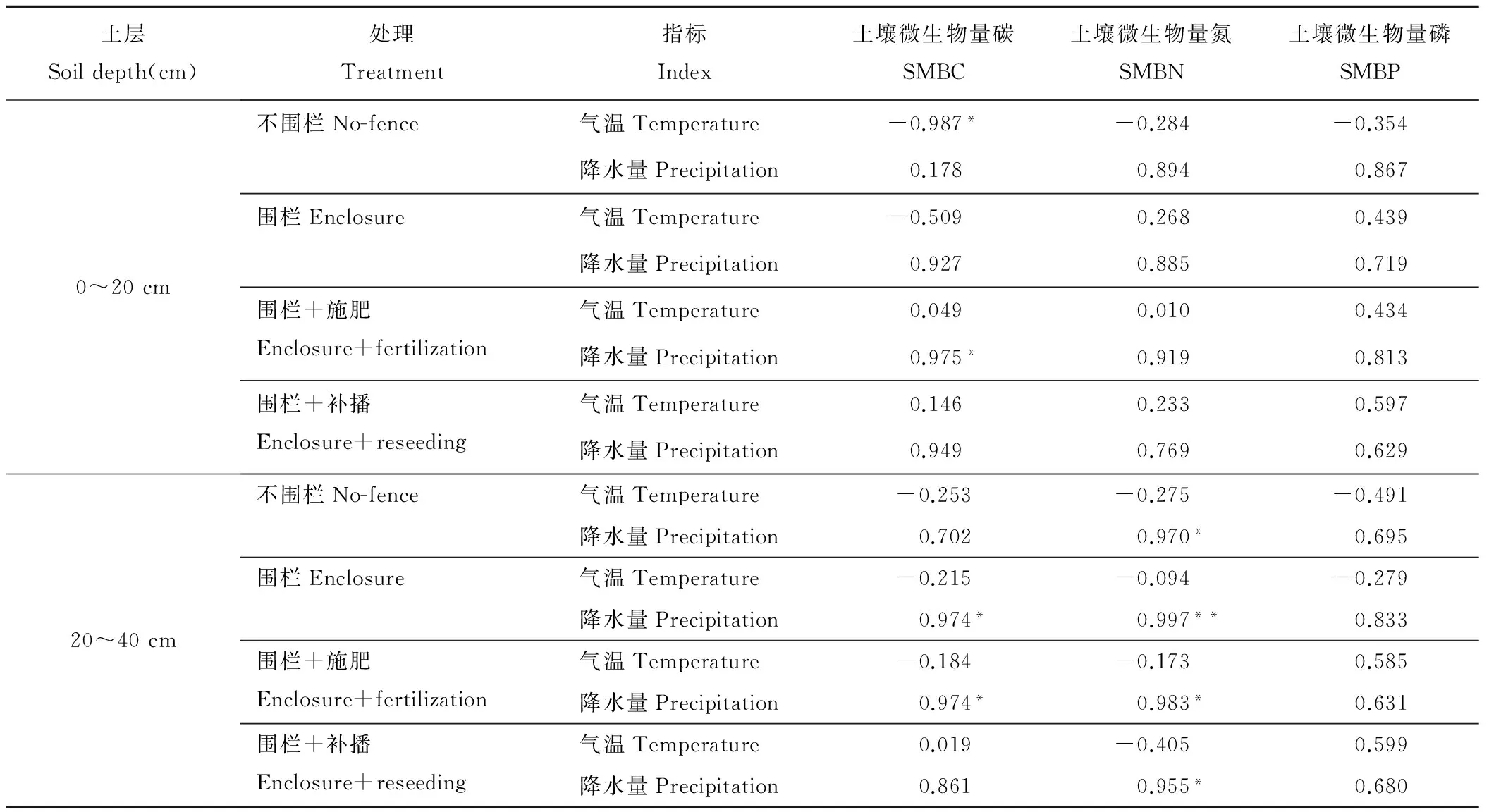
土层Soildepth(cm)处理Treatment指标Index土壤微生物量碳SMBC土壤微生物量氮SMBN土壤微生物量磷SMBP0~20cm不围栏No-fence气温Temperature-0.987*-0.284-0.354降水量Precipitation0.1780.8940.867围栏Enclosure气温Temperature-0.5090.2680.439降水量Precipitation0.9270.8850.719围栏+施肥Enclosure+fertilization气温Temperature0.0490.0100.434降水量Precipitation0.975*0.9190.813围栏+补播Enclosure+reseeding气温Temperature0.1460.2330.597降水量Precipitation0.9490.7690.62920~40cm不围栏No-fence气温Temperature-0.253-0.275-0.491降水量Precipitation0.7020.970*0.695围栏Enclosure气温Temperature-0.215-0.094-0.279降水量Precipitation0.974*0.997**0.833围栏+施肥Enclosure+fertilization气温Temperature-0.184-0.1730.585降水量Precipitation0.974*0.983*0.631围栏+补播Enclosure+reseeding气温Temperature0.019-0.4050.599降水量Precipitation0.8610.955*0.680
**:在0.01水平上显著相关;*:在0.05水平上显著相关。
**:Indicate very significant correlation (P<0.01);*:Indicate significant correlation (P<0.05).
2.6 土壤质量评价
土壤质量评价可以为退化土地的恢复和管理提供理论依据[23]。本研究利用主成分分析法对土壤质量进行综合评价,结果见表2,第1主成分的方差贡献率为59.27%,第1和第2主成分的方差贡献率为82.47%,前3个主成分累计贡献率达98.73%,符合主成分分析的要求。因此,用第1、第2和第3各主成分分析可以代表不同管理措施下土壤质量的变异信息。第1主成分主要反映的有土壤微生物量碳、土壤微生物量氮及土壤微生物量磷指标的综合变量,说明土壤微生物量是土壤质量评价中最重要的影响因子;第2和第3主成分主要反映的是气温、降水量指标的综合变量,说明这两个指标在土壤质量评价中有一定的作用,但影响较小。
由特征向量与标准化后的数据相乘得出主成分表达式:
F1=-0.010X1+0.236X2+0.984X3+0.989X4+0.981X5
F2=0.792X1-0.718X2+0.040X3+0.018X4+0.122X5
F3=0.611X1+0.654X2-0.065X3+0.003X4-0.09X5
根据以上主成分表达式利用公式:F=0.593×F1+0.232×F2+0.163×F3,计算不同管理措施下综合得分F值(土壤质量综合评价指数),并进行排序,结果见表3。从表3可以看出,不同管理措施土壤综合指数排序为:围栏+补播>围栏+施肥>围栏>不围栏。总体而言,处理围栏+补播土壤质量最优,其次为围栏+施肥。由此可知,土壤质量综合评价指数的排序结果与前面的论证结果一致,故主成分分析结果能较好地反映土壤的实际状况。
3 讨论与结论
土壤微生物在物质循环和能量流动过程中具有重要的作用[24],对外界条件的变化十分敏感,可用以评价退化生态系统恢复过程、指导天然草地的合理利用和管理[25],土壤微生物量可衡量土壤质量的状况[26]。本试验通过比较和分析4种管理措施下土壤微生物量的变化,研究发现,1)同一年份,不同管理措施,相同空间层次,围栏+施肥和围栏+补播下均能明显增加土壤微生物量含量,但其增加程度各异,这可能是因为施肥(本研究为复合肥磷酸二铵)使土壤中可溶性速效养分(N、P素)增加[16],植被生长迅速,根系生物量和根系分泌物增加;补播后植物群落多样性增加[12]和盖度及植物量,翌年形成较多的枯枝落叶,腐殖质含量增加,再加上围栏避免草地免受扰动的影响,两种综合管理措施均可促进土壤微生物的生长, 从而提高土壤微生物量。而不
表2 主成分的因子负荷量、特征根与贡献率
Table 2 Loading factor, eigenvalue and contribution ratio of principal component
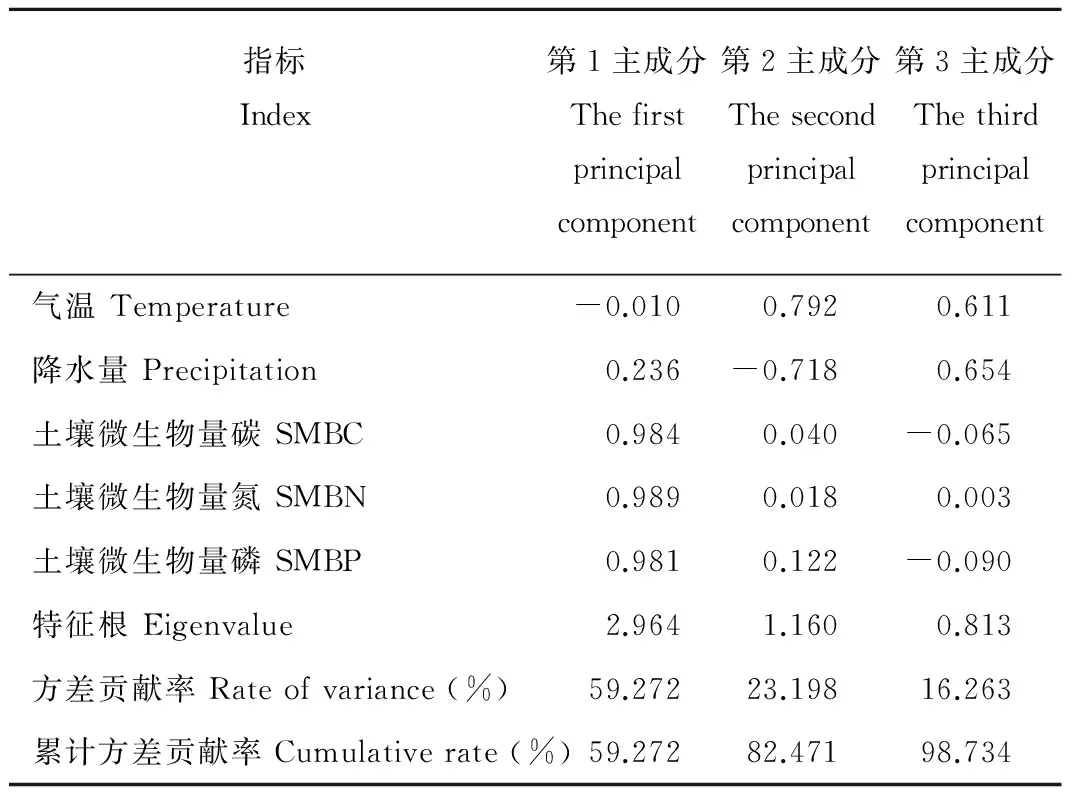
指标Index第1主成分Thefirstprincipalcomponent第2主成分Thesecondprincipalcomponent第3主成分Thethirdprincipalcomponent气温Temperature-0.0100.7920.611降水量Precipitation0.236-0.7180.654土壤微生物量碳SMBC0.9840.040-0.065土壤微生物量氮SMBN0.9890.0180.003土壤微生物量磷SMBP0.9810.122-0.090特征根Eigenvalue2.9641.1600.813方差贡献率Rateofvariance(%)59.27223.19816.263累计方差贡献率Cumulativerate(%)59.27282.47198.734
表3 不同管理措施下土壤综合得分及排序
Table 3 General sores and ranking under different managements

处理Treatment综合得分Generalsores名次Ranking不围栏No-fence-0.3044围栏Enclosure-0.0663围栏+施肥Enclosure+fertilization0.1752围栏+补播Enclosure+reseeding0.1931
围栏下草地受到家畜、人为的干扰很大,使草地退化更加剧烈,土壤微生物生长受到抑制,土壤微生物量逐渐降低。同一年份,相同管理措施,不同空间层次,土壤微生物量表现为:0~20 cm>20~40 cm,可能是由于草地表层土壤有机质丰富[27],且水热和通气状况良好[28],为微生物生长和繁殖提供适宜的环境,促进了微生物的生物活性,随着土层的加深,生境条件变差,从而影响土壤微生物量分布,这与大部分研究者[29-30]的结果一致。
2)不同年份,相同管理措施,相同空间层次,除不围栏(0~20 cm)SMBC外,土壤微生物量变化趋势总体为2011年至2012年上升至最大值,之后下降,与图4降水量变化趋势基本一致,这可能是由4年降水量变化引起的,降水量可以改变土壤的透气状况和水热条件从而促进微生物的生长和繁殖[31],增加土壤中微生物多样性,提高土壤微生物量。温度和水分是影响土壤微生物的重要环境因子[7],由不同管理措施土壤微生物量与气温和降水量之间的相关性分析可知,土壤微生物量与降水量总体呈显著正相关关系,进一步验证了 Diaz-Ravia等[32]结论,说明降雨量是制约微生物生长的主要因素,降雨量可改变土壤含水量,随土壤含水量的变化,可以通过改变土壤通气性和水热条件来影响微生物自身的生长和繁殖,从而提高土壤微生物量[33];土壤微生物量与气温总体呈负相关关系,这与Barbhuiya等[34]研究结果一致,表明气温是影响微生物生长的重要因素。不同年份,相同管理措施,不同空间层次(0~20 cm,20~40 cm),0~20 cm土壤微生物量年际变化幅度均大于20~40 cm,说明腐殖质主要分布在表层(0~20 cm),外界条件(气温和降水量)的扰动对表层土壤影响较大,土壤蓄水能力随着土层深度加深,蓄水能力逐渐减小[35],导致下层土壤湿度减小,不利于微生物的生长和繁殖[28]。
土壤质量评价有利于土壤退化程度和恢复效果的检测,也是评价土壤是否可持续利用与有效管理的手段之一[22]。土壤微生物量对土壤质量状况十分敏感[8],因此,该试验可在一定程度上反映土壤质量。本试验采用主成分分析对2011-2014年土壤微生物量、气温、降水量进行综合评价,土壤综合指数排序为:围栏+补播>围栏+施肥>围栏>不围栏,与不围栏相比,管理措施围栏+补播、围栏+施肥和围栏土壤质量综合评价指数分别提高了163.49%、157.57%、78.29%。总体来说,连续4年内4种不同管理措施不同程度地改变了土壤状况,其中,围栏+补播恢复效果最好,能够大幅度改善土壤质量,在玛曲高寒草甸生态恢复和管理过程中可作为最有效的管理措施。
[1] He Y L, Zhou H K, Zhao X Q,etal. Alpine grassland degradation and its restoration on Qinghai-Tibet plateau. Prataculture and Animal Husbandry, 2008, (11): 1-9.
[2] Hu Z Z. The Development of Grass Industry and Ecology Environment of Qinghai-Tibet Plateau[M]. Beijing: China Tibetology Press, 2000.
[3] Cui Q H, Jiang Z G, Liu J K,etal. A review of the cause of rangeland degradation on Qinghai-Tibet plateau. Pratacultural Science, 2007, 24(5): 20-26.
[4] Cheng S K, Shen L. The Tibetan plateau and population, resources, environment and development interactive relation. Journal of Natural Resources, 2000, 15(4): 297-304.
[5] Gao Q Z, Duan M J, Wan Y F,etal. Comprehensive evaluation of eco-environmental sensitivity in Northern Tibet. Acta Ecological Sinica, 2010, 30(15): 4129-4136.
[6] Tan H Y, Chen B R, Yan R R,etal. Advances on soil microbiological characteristics of grassland ecosystems and its response to human disturbances. Acta Agrectir Sinica, 2014, 22(6): 1163-1170.
[7] Shang Z H, Ding L L, Long R J,etal. Relationship between soil microorganisms, above-ground vegetation, and soil environment of degraded alpine meadows in the headwater areas of the Yangtze and Yellow Rivers, Qinghai-Tibetan Plateau. Acta Prataculturae Sinica, 2007, 16(1):34-40.
[8] Singh A K, Bordoloi L J, Kumar M,etal. Land use impact on soil quality in eastern Himalayan region of India. Environmental Monitoring and Assessment, 2014, 186(4): 2013-2024.
[9] Henrot K, Robertson G P. Vegetation removal in two soils of the humid tropics: effect on microbial biomass. Soil Biology and Biochemistry, 1994, 26(1): 111-116.
[10] Yu X J, Jing Y Y, Duan C H,etal. Influence of enclosure and grazing intensity on alpine meadow vegetation and soil characteristics in the Eastern Qilian Mountains. Agricultural Research in the Arid Areas, 2015, 33(1): 252-277.
[11] Cao W X, Li W, Li X L,etal. Effects of nitrogen fertilization on plant community structure and soil nutrient in alpine meadow-steppe. Journal of Desert Research, 2015, 35(3): 658-666.
[12] Zhang Y C, Niu D C, Han T,etal. Effect of reseeding on productivity and plant diversity on alpine meadows. Acta Prataculturae Sinica, 2012, 21(2): 305-309.
[13] Deng B, Ren G H, Liu Z Y,etal. Effect of 3-year fencing on soil seed banks of three alpine grassland communities. Acta Prataculturae Sinica, 2012, 21(5): 23-31.
[14] Shen J L, Tan G, Qiao H L,etal. Study on effect of grassland improvement on alpine degraded grassland vegetation. Chinese Journal of Grassland, 2000, (5): 50-55.
[15] Mckinley V Y, Peacock A D, White D C. Microbial community PLFA and PHB responses to ecosystem restoration in tallgrass prairie soils. Soil Biology and Biochemistry, 2005, 37(10): 1946-1958.
[16] Fensham R J, Holman J E, Cox M J. Plant species responses along a grazing disturbance gradient in Australian grassland. Journal of Vegetation Science, 1999, 10(1): 77-86.
[17] Wu G L, Liu Z H, Zhang L,etal. Long-term fencing improved soil properties and soil organic carbon storage in an alpine swamp meadow of western China. Plant and Soil, 2010, 332(1): 331-337.
[18] Chen Z X,Tian F P,Wu G L,etal. Effects of overseeding grass on aboveground biomass of different economic group in Maqu alpine desertified meadow pasture. Chinese Journal of Grassland, 2011, 33(4): 58-60.
[19] Xu T, Qi J, Pu X P,etal. Comparison of the yields and nutrients of seven forage species in Maqu county. Chinese Journal of Grassland, 2012, 34(3): 113-116.
[20] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703-707.
[21] Brookes P C, Andrea L, Pruden G,etal. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837-842.
[22] Brookes P C, Powlson D S, Jenkinson D S. Phosphorus in the soil microbial biomass. Soil Biology and Biochemistry, 1984, 16(3): 169-175.
[23] Kirkegaard J A, Sarwar M, Wong P T W,etal. Field studies on the biofumigation of take-all byBrassicabreak crops. Crop and Pasture Science, 2000, 51(4): 445-456.
[24] Schimel D S. Terrestrial ecosystems and the carbon cycle. Global Change Biology, 1995, 1(1): 77-91.
[25] Xing W, Lia Z, Fua B,etal. Restoration of ecosystem carbon and nitrogen storage and microbial biomass after grazing exclusion in semi-arid grasslands of Inner Mongolia. Ecological Engineering, 2014, 73: 395-403.
[26] Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil. Biological Reviews, 1992, 67(3): 321-358.
[27] Guo J X, Zhu Y C. Study on numbers and biomass of soil microorganism inAneurolepidiumChinense grassland. Acta Ecologica Sinica, 1997, 17(1): 78-83.
[28] Wen D R Y, Li G, Zhang J N,etal. The study of soil microbial biomass and soil enzyme activity on different grassland in Hulunbeier, Inner Mongolia. Acta Prataculturae Sinica, 2010, 19(5): 94-102.
[29] Zhong F, Chai X H, Wang G J,etal. Soil physical-chemistry and microbial characteristics under different vegetation restoration modes in the loess hilly region. Journal of Desert Research, 2014, 34(4): 1064-1072.
[30] Yang C D, Long R J, Chen X R,etal. Seasonal dynamics in soil microbial biomass and enzymatic activities under different alpine brush lands of the eastern Qilian mountains. Acta Prataculturae Sinica, 2011, 20(6): 135-142.
[31] Shan G L, Chen G, Ning F,etal. Dynamics of soil microorganism and enzyme activity in typical steppe of restoration succession process. Acta Agrectir Sinica, 2012, 20(2): 292-297.
[33] Xie L L. Studies on the Dynamics of Soil Microorganisms in a Eucalyptus Plantation[D]. Guangzhou: South China University of Tropical Agriculture, 2005.
[34] Barbhuiya A R, Arunachalam A, Pandey H N,etal. Dynamics of soil microbial C, N and P in the disturbed and undisturbed stands of a tropical wet-evergreen forest. European Journal of Soil Biology, 2004, 40(3): 113-121.
[35] Zhang J, Song W F, Peng Y G,etal. Studies on spatial and temporal variations of soil moisture in forest in water source area of Yuanyang terrace. Journal of Northwest Forestry University, 2014, 29(2): 49-60.
[1] 贺有龙, 周华坤, 赵新全, 等. 青藏高原高寒草地的退化及其恢复. 草业与畜牧, 2008, (11): 1-9.
[2] 胡自治. 青藏高原的草业发展与生态环境[M]. 北京: 中国藏学出版社, 2000.
[3] 崔庆虎, 蒋志刚, 刘季科, 等. 青藏高原草地退化原因述评. 草业科学, 2007, 24(5): 20-26.
[4] 成升魁, 沈镭. 青藏高原人口、资源、环境与发展互动关系探讨. 自然资源学报, 2000, 15(4): 297-304.
[5] 高清竹, 段敏杰, 万运帆, 等. 藏北地区生态与环境敏感性评价. 生态学报, 2010, 30(15): 4129-4136.
[6] 谭红妍, 陈宝瑞, 闫瑞瑞, 等. 草地土壤微生物特性及其对人为干扰响应的研究进展. 草地学报, 2014, 22(6): 1163-1170.
[7] 尚占环, 丁玲玲, 龙瑞军, 等. 江河源区退化高寒草地土壤微生物与地上植被及土壤环境的关系. 草业学报, 2007,16(1): 34-40.
[10] 鱼小军, 景媛媛, 段春华, 等. 围栏与不同放牧强度对东祁连山高寒草甸植被和土壤的影响. 干旱地区农业研究, 2015, 33(1): 252-277.
[11] 曹文侠, 李文, 李小龙, 等. 施氮对高寒草甸草原植物群落和土壤养分的影响. 中国沙漠, 2015, 35(3): 658-666.
[12] 张永超, 牛得草, 韩潼, 等. 补播对高寒草甸生产力和植物多样性的影响. 草业学报, 2012, 21(2): 305-309.
[13] 邓斌, 任国华, 刘志云, 等. 封育三年对三种高寒草地群落土壤种子库的影响. 草业学报, 2012, 21(5): 23-31.
[14] 沈景林, 谭刚, 乔海龙, 等. 草地改良对高寒退化草地植被影响的研究. 中国草地, 2000, (5): 50-55.
[18] 陈子萱, 田福平, 武高林, 等. 补播禾草对玛曲高寒沙化草地各经济类群地上生物量的影响.中国草地学报, 2011, 33(4): 58-60.
[19] 许涛, 祁娟, 蒲小鹏, 等. 甘南玛曲七种主要饲草营养价值比较. 中国草地学报, 2012, 34(3): 113-116.
[27] 郭继勋, 祝廷成. 羊草草原土壤微生物的数量和生物量. 生态学报, 1997, 17(1): 78-83.
[28] 文都日乐, 李刚, 张静妮, 等. 呼伦贝尔不同草地类型土壤微生物量及土壤酶活性研究. 草业学报, 2010, 19(5): 94-102.
[29] 钟芳, 柴晓虹, 王国基, 等. 植被恢复方式对黄土丘陵区土壤理化性质及微生物特性的影响. 中国沙漠, 2014, 34(4): 1064-1072.
[30] 杨成德, 龙瑞军, 陈秀蓉, 等. 东祁连山高寒灌丛草地土壤微生物量及土壤酶季节性动态特征. 草业学报, 2011, 20(6): 135-142.
[31] 单贵莲, 陈功, 宁发, 等. 典型草原恢复演替过程中土壤微生物及酶活性动态变化研究. 草地学报, 2012, 20(2): 292-297.
[33] 谢龙莲. 桉树人工林土壤微生物动态变化研究[D]. 广州: 华南热带农业大学, 2005.
[35] 张娟, 宋维峰, 彭永刚, 等. 元阳梯田水源区林地土壤水分时空变异性研究. 西北林学院学报, 2014, 29(2): 49-60.
Effects of different management measures on soil microbial biomass in an alpine meadow
JIANG Yong-Mei1,2, YAO Tuo1,2*, LI Jian-Hong1,2, CHEN Long1,2, LIU Huan1,2, LIU Ting1,2,TIAN Yong-Liang1,2, ZHANG Biao1,2, GAO Ya-Min1,2
1.PrataculturalCollege,GansuAgriculturalUniversity,Lanzhou730070,China;2.KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,Sino-U.S.CentersforGrazingLandEcosystemSustainability,Lanzhou730070,China
In this study, soil microbial biomass characteristics were monitored during 2011-2014 in Maqu alpine meadows under four different management strategies: non-fenced, enclosed, enclosed with fertilization, and enclosed and sowing. Soil microbial biomass carbon (SMBC), soil microbial biomass nitrogen (SMBN), and soil microbial biomass phosphorus (SMBP) were analyzed using the chloroform fumigation extraction method. The results showed that in the same year, the different management measures were ranked, from highest soil microbial biomass in the 0-20 cm soil layer to lowest, as follows: enclosed+sowing>enclosed+fertilization>enclosed>non-fenced, and from highest soil microbial biomass in the 20-40 cm soil layer to lowest, as follows: enclosed+fertilization>enclosed+sowing>enclosed>non-fenced. In the same year, soil microbial biomass in the 0-20 cm soil layer was always greater (1.22 to 3.39 times greater) than that in the 20-40 cm soil layer. With the same management measure and soil depth (0-20 cm or 20-40 cm), soil microbial biomass increased from 2011 to 2012, peaking in 2012 and decreased again afterwards, except for SMBC in the 0-20 cm soil layer in the non-fenced treatment. With the same management measures, the annual variation in soil microbial biomass in the 0-20 cm soil layer was greater than that in the 20-40 cm soil layer. The soil microbial biomass was negatively correlated with temperature, and significantly positively correlated with precipitation. The management measures were ranked, from highest soil quality composite index to lowest, as follows: enclosed+sowing>enclosed+fertilization>enclosed>non-fenced. The results showed that enclosure+sowing is a better soil management measure than the other three strategies for soil restoration and improvement. Consequently, enclosure+sowing should be applied for ecological restoration of Maqu alpine meadows.
management measure; alpine meadow; soil microbial biomass; annual dynamics
10.11686/cyxb2016055
http://cyxb.lzu.edu.cn
2016-02-01;改回日期:2016-04-28
国家自然科学基金项目(30360584)资助。
蒋永梅(1990-),女,甘肃榆中人,在读硕士。E-mail:1073902068@qq.com*通信作者Corresponding author. E-mail:yaotuo@gsau.edu.cn
蒋永梅, 姚拓, 李建宏, 陈龙, 刘欢, 刘婷, 田永亮, 张标, 高亚敏. 不同管理措施对高寒草甸土壤微生物量的影响研究. 草业学报, 2016, 25(12): 35-43.
JIANG Yong-Mei, YAO Tuo, LI Jian-Hong, CHEN Long, LIU Huan, LIU Ting, TIAN Yong-Liang, ZHANG Biao, GAO Ya-Min. Effects of different management measures on soil microbial biomass in an alpine meadow. Acta Prataculturae Sinica, 2016, 25(12): 35-43.
