陇东雨养农区紫花苜蓿叶片氮、磷、钾重吸收与生物固氮的偶联关系
2017-01-03段兵红陆姣云刘敏国杨梅王亚亚王振南杨惠敏
段兵红,陆姣云,刘敏国,杨梅,王亚亚,王振南,杨惠敏
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
陇东雨养农区紫花苜蓿叶片氮、磷、钾重吸收与生物固氮的偶联关系
段兵红,陆姣云,刘敏国,杨梅,王亚亚,王振南,杨惠敏*
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
叶片养分重吸收是植物提高养分利用效率、增强环境适应性的重要机制之一,易受多种因素影响。在豆科植物中,养分重吸收与生物固氮有何关联尚不可知。为揭示养分重吸收与生物固氮间的偶联关系,以陇东雨养农区已建植2、4、7、11和14年龄的陇东苜蓿草地为对象,测定了叶片N、P、K浓度及δ15N,分析了叶片N、P、K重吸收效率(NRE、PRE和KRE)、重吸收度(NRP、PRP和KRP)及其与生物固氮率的关系。随紫花苜蓿建植年龄增长,叶片NRE、PRE呈先增大后减小的趋势,NRE和PRE分别为36.5%(28.4%~43.4%)和52.6%(38.1%~68.2%),其中7年龄苜蓿的NRE和PRE最高;2、11和14年龄苜蓿KRE为17.8%(23.0%~27.5%),但4和7年龄为负值。随紫花苜蓿年龄变化,叶片NRP、PRP和KRP均无明显变化趋势。随紫花苜蓿年龄增长,生物固氮率先降低后升高,平均固氮率为51.0%,其中7年龄苜蓿的最低。紫花苜蓿生物固氮率与叶片NRE、PRE和KRP负相关,但与叶片KRE、NRP和PRP不相关。紫花苜蓿生物固氮与叶片的氮、磷、钾重吸收存在偶联关系,对氮、磷重吸收效率和钾重吸收度有显著影响。
紫花苜蓿;建植年龄;养分重吸收;生物固氮
叶片养分重吸收(nutrient resorption)是植物将衰老叶片中的部分养分转移、运输、储存到其他组织(如绿叶)中的过程,为存活的或新生的植物体提供新的营养和能量[1]。养分重吸收延长了营养在植物体内的贮存时间,使营养元素在再次进入土壤之前被重新利用,因而缩短了营养元素在植物和环境之间的循环距离[2],从而提高植物养分(主要如N、P和K)的利用效率,减少养分损失,减弱植物对土壤养分供应的依赖,增强植物适应逆境的能力[3]。因此,深入了解叶片养分重吸收的调控机制对阐明植物对多变环境的适应性意义重大,相关研究也一直受到高度关注。
重吸收效率(resorption efficiency,RE,从衰老叶转移到绿叶中的养分比例[1])或者重吸收度(resorption proficiency,RP,以衰老叶片养分转移后的最低浓度来表征[1])是植物养分重吸收强度的重要表征。除因植物物种不同[4]和寿命长短[5]而有差异外,叶片养分重吸收还受到多种环境因素(如土壤肥力)的影响。一般地,土壤养分供应较高时,N重吸收效率(NRE)和P重吸收效率(PRE)较低[6]。土壤水分增多可导致NRE降低而对P重吸收无影响[7],与水分较多改变土壤速效养分浓度有关。因此,土壤养分状况的改变对调节叶片养分重吸收意义重大。研究表明,N添加导致NRE减小[6,8],也导致N重吸收度(NRP)降低,但对P重吸收度(PRP)的影响不一致[9]。因此,N添加对N和P重吸收效率和重吸收度有不一致影响。土壤养分供应最终调控叶片养分重吸收,但二者间的关系并不明确。即便如此,前人的研究也表明,可能改变土壤养分供应(或养分来源)的因素能调控养分重吸收。豆科植物具有生物固氮(biological N fixation,BNF)能力,其对土壤N的吸收、整体的N循环模式均较非固氮植物有很大的差异,可能影响到植物体内的N浓度变化模式和重吸收[10]。此外,考虑到植物体内N与其他营养代谢的密切联系[2],豆科植物BNF可能也参与调控叶片P和K重吸收。
黄土高原陇东地区是典型的雨养农区,土壤贫瘠,降水季节性和年际差异大,后者导致的干旱或季节性干旱还加重了土壤养分供应不足问题。紫花苜蓿是雨养农区的重要作物,能适应贫瘠和一定程度干旱,并具有很强的BNF能力[11]。前期研究表明,紫花苜蓿叶片N、P、K重吸收表现出明显的年龄特异性[12],但是否受到BNF的影响还未可知。基于以上分析,研究了不同建植年龄苜蓿BNF和叶片主要元素重吸收特征,探讨了BNF能力与叶片N、P、K重吸收的偶联关系,以进一步揭示苜蓿适应黄土高原雨养条件的机制。
1 材料与方法
1.1 研究地点
试验地点位于兰州大学庆阳黄土高原草地农业系统试验站(35°40′ N,107°51′ E,海拔1298 m)。属大陆性季风气候,多年平均年降水量为561 mm,且多集中于7-9月,年均温为8.0~10.0 ℃,最低与最高温出现在1和7月,分别为-21.3和40 ℃,年均无霜期为255 d。土壤为黑垆土。试验当年降水总量为449.1 mm,月间降水量差异很大(图1)。
1.2 样地选取与管理
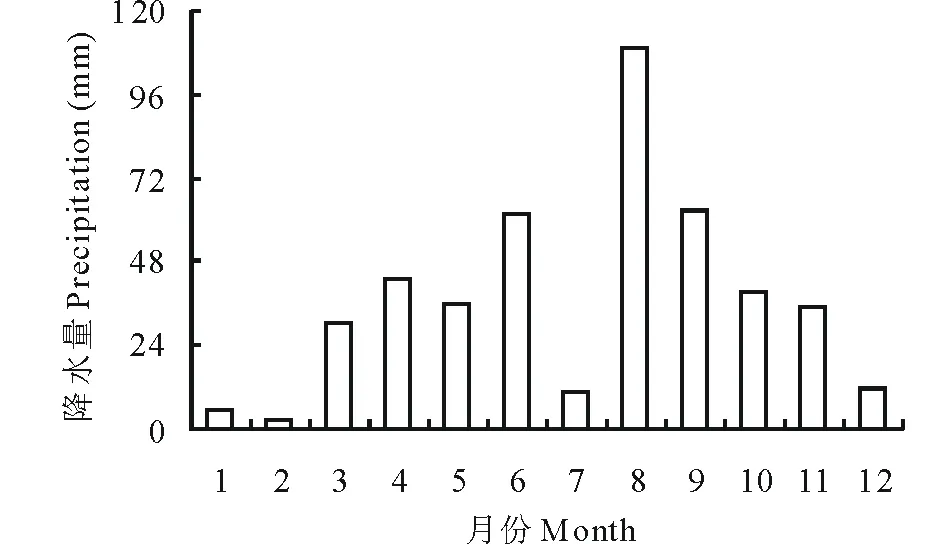
图1 实验区2015年各月降水情况Fig.1 Monthly rainfall at the station in 2015
选取建植2、4、7、11和14年龄的陇东苜蓿(Medicagosativacv. Longdong)草地,在每块苜蓿草地随机选取4 m×5 m的小区,3次重复。在苜蓿生长期,不进行人工灌溉,不施化肥。
1.3 取样及处理
在2015年6月,于紫花苜蓿初花期采集枯黄衰老叶(依然保留于苜蓿植株,但轻轻一抖苜蓿整株掉落下来的叶片)和鲜绿成熟叶(叶腋处颜色深绿且成熟的三出复叶)用于后续生化分析。同时,采集苜蓿整株10株及其附近(大部分在1 m内)的夏至草(Lagopsissupina)作为参比植物。采集的植物样品先在105 ℃杀青10 min,再在70 ℃烘48 h。烘干样品用粉碎机粉碎,过0.5 mm筛后备测。
1.4 指标测定
植物全N用凯氏定氮法测定,植物全K用火焰光度法测定,植物全P用钼锑抗比色法测定。紫花苜蓿固氮能力用15N自然丰度法(the15N natural abundance technique[13])测定。取紫花苜蓿粉样3~4 mg,参比植物粉样5~6 mg,用杜马燃烧法通过Flash EA1112元素分析仪-ConfloⅢ-Delta Plus稳定同位素质谱仪测定其δ15N。
1.5 参数计算
生物固氮率(%Ndfa)即通过BNF固定的氮素量占其全部同化氮素量的百分数,用下式计算[14]:
式中:δ15Nref表示参比植物的15N相对丰度值;δ15Nfixing-plant表示固氮植物15N相对丰度值;B表示生长于干净石英砂中、用无氮营养液培养、以空气氮为唯一氮源的固氮植物体内的15N相对丰度值。本研究使用不同国家和地区获得的B值均值-0.68‰[15]。
养分重吸收效率(nutrient RE)以下式计算[1]:
式中:Nugreen表示成熟叶养分浓度,Nusenesced表示衰老叶养分浓度。此外,叶片养分重吸收度(nutrient RP)以衰老叶养分浓度Nusenesced来表征,衰老叶养分浓度越小,则重吸收度越大。
1.6 数据分析
用Excel for Windows 2007和SPSS 17.0软件进行数据统计和方差分析,差异显著性通过ANOVA软件包中的Duncan法进行多重比较,利用线性回归模型y=ax+b分析紫花苜蓿固氮率与叶片养分浓度、重吸收效率、重吸收度的相关关系。
2 结果与分析
2.1 成熟叶N、P、K浓度
随年龄的增长,陇东苜蓿成熟叶N浓度(Ngreen)先增大后减小,2和4年龄、11和14年龄间无显著差异,最高浓度出现在7年龄苜蓿,最低值出现在2年龄(图2A)。成熟叶P浓度(Pgreen)随年龄增长呈增大-减小-增大的趋势,4、11和14年龄间、7和14年龄间无显著差异,2年龄苜蓿成熟叶P浓度最低,7年龄P浓度最高(图2B)。随年龄的增长,成熟叶K浓度(Kgreen)呈减小-增大-减小-增大的趋势,7和14年龄间无显著差异,2、4和11年龄间差异显著,且显著低于7和14年龄,最低浓度出现在4年龄,最高浓度出现在7年龄(图2C)。

图2 不同建植年龄紫花苜蓿成熟叶氮、磷、钾浓度Fig.2 The N, P and K concentrations in green leaves of differently aged lucerne stands 不同小写字母表示不同建植年龄间差异显著(a<0.05)。下同。Lowercase letters indicate significant differences among lucerne stands of different ages at a<0.05. The same below.
2.2 衰老叶N、P、K浓度和叶片养分重吸收度
随年龄的增长,陇东苜蓿衰老叶N浓度(Nsenesced)呈减小-增大-减小-增大的趋势,4和11年龄间无显著差异,最高浓度在14年龄苜蓿,最低值则出现在4年龄,表明叶片N重吸收度(NRP)随年龄而变化,在4年龄最大而14年龄最小(图3A)。随年龄的增长,衰老叶P浓度(Psenesced)呈增大-减小-增大趋势,4、7、11和14年龄间无显著差异,2、7和11年龄间无显著差异,最高浓度出现在4年龄,最低浓度出现在2年龄,表明叶片P重吸收度(PRP)随年龄变化,在2年龄时最大而4年龄最小(图3B)。衰老叶K浓度(Ksenesced)随年龄的变化趋势与P类似,其中4和11年龄间无显著差异,2、7和14年龄与其他各年龄间都有显著差异,其中2年龄苜蓿衰老叶K浓度最低,7年龄最高,表明叶片K重吸收度(KRP)也随年龄变化,2年龄最大而7年龄最小(图3C)。
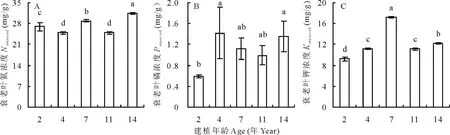
图3 不同建植年龄紫花苜蓿衰老叶氮、磷、钾浓度Fig.3 The N, P and K concentrations in senesced leaves of differently aged lucerne stands
2.3 叶片N、P、K重吸收效率
随年龄的增长,陇东苜蓿叶片N重吸收效率(NRE)呈先增大后减小的趋势(图4A),最大NRE出现在7年龄苜蓿,但4、7和11年龄间无显著差异;最低值出现在14年龄,但与2年龄间无显著差异。叶片P重吸收效率(PRE)与叶片NRE类似,最大PRE出现在7年龄苜蓿,但7、11和14年龄间、4和14年龄间无显著差异,最小PRE出现在2年龄,但与4年龄无显著差异(图4B)。叶片K重吸收效率(KRE)变化异于NRE和PRE,4和7年龄苜蓿的KRE小于零且无显著差异,2、11和14年龄苜蓿的KRE大于零且无显著差异(图4C)。
2.4 成熟叶养分浓度、叶片养分重吸收效率和重吸收度的相关性
陇东苜蓿叶片NRE与Ngreen显著正相关,而与Pgreen和Kgreen无显著相关性(表1)。叶片PRE与Ngreen、Pgreen、Kgreen显著正相关。叶片KRE与Ngreen和Kgreen无显著相关性,仅与Pgreen有弱负相关性(P=0.068)。Nsenesced与Ngreen和Pgreen无显著相关性,而与Kgreen显著正相关,说明叶片NRP随Kgreen升高而降低,不受Ngreen和Pgreen的影响。Psenesced与Ngreen和Kgreen无显著相关性,但与Pgreen显著正相关,说明叶片PRP随Pgreen升高而降低,不受Ngreen和Kgreen影响。Ksenesced与Ngreen、Pgreen、Kgreen均显著正相关,说明KRP随Ngreen、Pgreen、Kgreen升高而降低。
陇东苜蓿叶片NRE与Nsenesced显著负相关而与Ksenesced显著正相关(P=0.052),说明NRE与NRP变化一致,而与KRP反向变化,但并不受PRP影响(表2)。叶片PRE与Nsenesced和Psenesced无显著相关性,但与Ksenesced显著正相关,说明其与KRP反向变化但不受NRP和PRP影响。叶片KRE与Nsenesced和Psenesced无显著相关性,但与Ksenesced显著负相关,说明其与KRP一致变化但不受NRP和PRP影响。
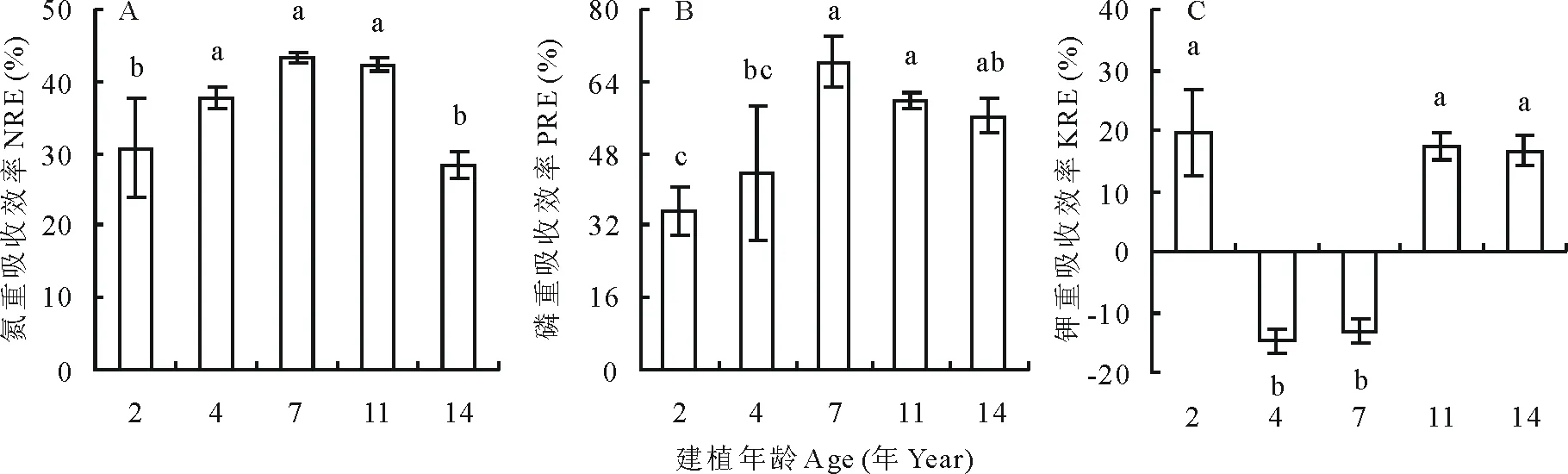
图4 不同建植年龄紫花苜蓿叶片氮、磷、钾重吸收效率Fig.4 Resorption efficiencies of N, P and K from senesced leaves of differently aged lucerne stands
表1 成熟叶和衰老叶氮、磷、钾浓度、叶片养分重吸收效率间的相关性
Table 1 Significant correlations of resorption efficiencies and concentrations in senesced and green leaves
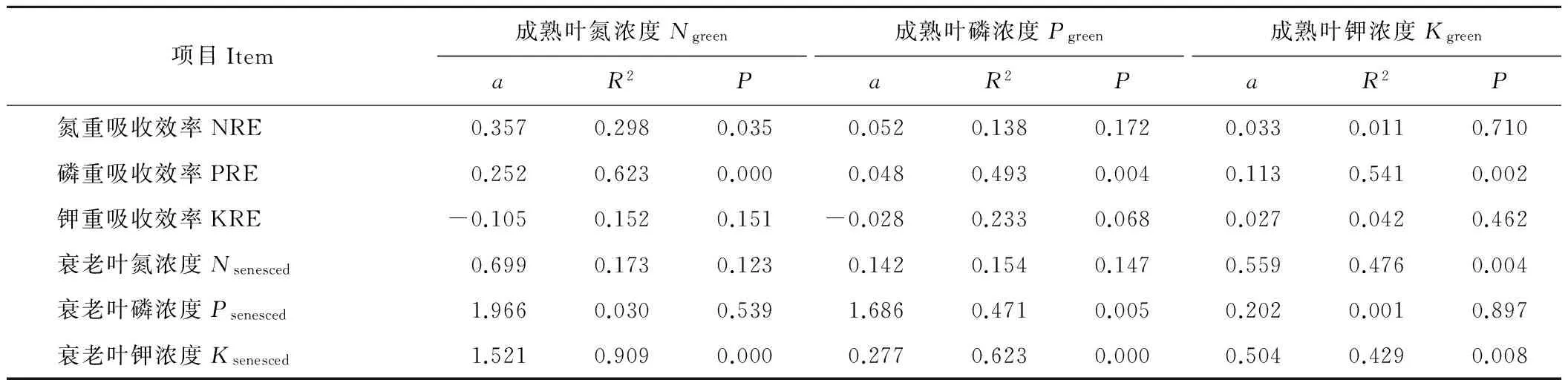
项目Item成熟叶氮浓度NgreenaR2P成熟叶磷浓度PgreenaR2P成熟叶钾浓度KgreenaR2P氮重吸收效率NRE0.3570.2980.0350.0520.1380.1720.0330.0110.710磷重吸收效率PRE0.2520.6230.0000.0480.4930.0040.1130.5410.002钾重吸收效率KRE-0.1050.1520.151-0.0280.2330.0680.0270.0420.462衰老叶氮浓度Nsenesced0.6990.1730.1230.1420.1540.1470.5590.4760.004衰老叶磷浓度Psenesced1.9660.0300.5391.6860.4710.0050.2020.0010.897衰老叶钾浓度Ksenesced1.5210.9090.0000.2770.6230.0000.5040.4290.008
注:线性回归模型y=ax+b。下同。
Note:The model isy=ax+b. The same below.
表2 叶片养分重吸收效率与衰老叶N、P、K浓度间的相关性
Table 2 Significant correlations of N, P and K resorption efficiencies with concentrations in senesced leaves
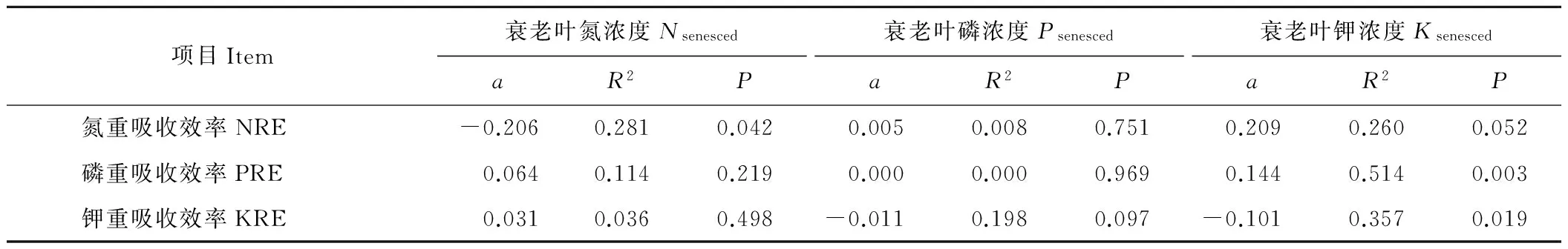
项目Item衰老叶氮浓度NsenescedaR2P衰老叶磷浓度PsenescedaR2P衰老叶钾浓度KsenescedaR2P氮重吸收效率NRE-0.2060.2810.0420.0050.0080.7510.2090.2600.052磷重吸收效率PRE0.0640.1140.2190.0000.0000.9690.1440.5140.003钾重吸收效率KRE0.0310.0360.498-0.0110.1980.097-0.1010.3570.019
2.5 生物固氮率及其与叶片养分重吸收的相关性
随年龄的增长,陇东苜蓿生物固氮率(%Ndfa)先减小后增大(图5)。7年龄苜蓿的%Ndfa最低,但与11年龄间无显著差异;2年龄最高,但与4和14年龄间无显著差异。2~14年龄陇东苜蓿平均%Ndfa为51.0%。
陇东苜蓿%Ndfa与叶片NRE和PRE显著负相关,与叶片KRE无显著相关性,说明BNF影响叶片NRE和PRE而不影响KRE(表3)。%Ndfa与Nsenesced和Psenesced无显著相关性而与Ksenesced显著负相关,说明NRP和PRP不受BNF的影响,而KRP与%Ndfa的变化一致。

图5 不同建植年龄紫花苜蓿生物固氮率Fig.5 Percentages of biologically fixed N in totals (%Ndfa) of differently aged lucerne stands
3 讨论
随着植物的生长发育,叶片N、P、K浓度表现出明显的生长季内动态[12],不同年龄间的差异可能更为复杂,与植物的吸收能力、土壤养分供应和营养在体内的代谢有关。 本研究表明, 苜蓿成熟叶N、 P、 K浓度随年龄的增长整体呈先增加后降低趋势,其中,7年龄苜蓿的营养浓度总体表现为最高,而1和4年龄的最低,11和14年龄的较高。低年龄植株的生物固氮率均较高,表明其生长并不受养分(尤其N)供应的限制,反而快速生长可能导致了体内营养浓度的稀释[16],如黄土高原雨养农区4龄苜蓿可达产量最高值[17],具有较强的营养“稀释”潜力。高年龄植株生物固氮能力减弱,土壤N供应虽也能保证其生长不会受到大的影响,但整体生理功能(如根系吸收能力)减弱会限制生长速度[18],反而存在营养“浓缩”效应。相比之下,衰老叶片养分平衡受到的干扰更大,因此,本研究中苜蓿衰老叶片N、P、K浓度在不同年龄间变化的差异较大,也说明衰老叶养分浓度所表征的重吸收度可能是表示叶片养分重吸收能力的一个更直接的指标,对调
表3 生物固氮率与叶片养分重吸收效率、衰老叶养分浓度间的相关性
Table 3 Significant correlations of N, P and K resorption efficiencies and concentrations in senesced leaves with percentages of biologically fixed N in totals

项目Item生物固氮率%NdfaaR2P氮重吸收效率NRE-1.1270.3420.022磷重吸收效率PRE-0.6980.5140.002钾重吸收效率KRE0.3380.1800.115衰老叶氮浓度Nsenesced-0.5680.0130.683衰老叶磷浓度Psenesced-4.5920.0190.627衰老叶钾浓度Ksenesced-3.6100.5900.001
节因素的变化更为敏感,但是不受限于时间变化[1]。与重吸收度不同,叶片养分重吸收效率表现出较明显的年龄特异性,其中,7年龄苜蓿叶片NRE、PRE均最高。7年龄苜蓿生物固氮能力较弱,而且根系活力降低可能导致其对土壤速效养分的吸收受到限制,而较高的养分重吸收保证其能在较少依赖土壤养分供应的情况下维持生长。本研究中,不仅11年龄苜蓿叶片养分浓度低于14龄苜蓿,而且11年龄苜蓿叶片养分重吸收效率和重吸收度大于14年龄。随着植株年龄的增长,凋落物的积累和分解导致苜蓿地养分有所恢复[19],因此,生长在较高养分供应(高龄草地)下的植物叶片养分重吸收效率和重吸收度通常较低。在本研究中,叶片K浓度低于18 mg/g,而重吸收效率低于20%甚至小于零,与Vergutz等[20]的研究结果(KRE约70%)相差较大,也低于Wang等[12]在同一地区的研究结果(KRE为21.0%~49.8%)。K在植物体内的含量较低,而且活性很强,极易因叶片受到雨水的淋洗而有所损失[21],从而导致成熟叶片K浓度降低(则计算得到的KRE偏低)。此外,KRE较低也暗示该地土壤可能不缺钾。
土壤养分供应和根系吸收能力的变化均可能影响植物体内(尤其叶片)养分浓度,因而体内养分浓度的变化可能是叶片养分重吸收变化的直接原因。研究表明,叶片NRE正比于成熟叶N浓度[22],或者叶片N、P重吸收反比于成熟叶N、P浓度[23],或者二者间无关[4]。在本研究中,陇东苜蓿叶片NRE仅与成熟叶N浓度正相关,而PRE与成熟叶N、P和K浓度均正相关,叶片KRE则仅与成熟叶P浓度有弱负相关性(P=0.068),说明叶片养分重吸收增强了衰老叶中养分的再分配和再利用,提高了成熟叶的养分浓度。然而,尽管N、P、K代谢关系密切[2],但是三者重吸收效率与成熟叶中的浓度关系表现各异,暗示P的重吸收可能对N和K的转移影响更大。陇东苜蓿叶片NRP仅与成熟叶K浓度负相关,叶片PRP仅与成熟叶P浓度负相关,而叶片KRP则与成熟叶N、P、K浓度负相关。研究表明,成熟叶N、P或K浓度较高时,衰老叶中的养分浓度也相应地较高,这可能与植株整体营养水平及其在不同组织间的权衡有关[1,24]。此外,陇东苜蓿叶片NRE与NRP、KRE与KRP均一致变化,而NRE、PRE与KRP则反向变化,说明叶片养分重吸收对衰老叶养分浓度的影响是负向而直接的,但是衰老叶K浓度不易受到其他养分重吸收的调节。
Killingbeck[1]认为固氮植物NRE低于非固氮物种。何兴元等[25]发现,非豆科固氮树种NRE为32%而豆科树种为45%,低于非固氮阔叶树种(54%)和针叶树种(60%)。Liang等[24]发现,西藏高山草甸禾草类的植物NRE为63.0%,杂草类和豆科植物则分别为46.2%和37.9%。豆科(固氮)植物的NRE较低可能受到了生物固氮的影响。而本研究中,紫花苜蓿叶片NRE与%Ndfa负相关,表明NRE确实受到生物固氮的负向调节。此外,PRE与生物固氮也负相关,可能主要是因为根瘤菌的溶磷作用[26]使土壤中有较多的速效P供植株生长。
4 结论
通过对陇东雨养农区不同建植年龄紫花苜蓿叶片氮、磷、钾养分浓度、重吸收特征及其与生物固氮的偶联关系研究,得出以下结论:
(1)随紫花苜蓿建植年龄增长,叶片NRE、PRE呈先增大后减小的趋势,NRE和PRE分别为36.5%(28.4%~43.4%)和52.6%(38.1%~68.2%),其中7年龄苜蓿的NRE和PRE最高;2、11和14年龄苜蓿KRE为17.8%(23.0%~27.5%)。
(2)紫花苜蓿生物固氮率与叶片NRE、PRE和KRP显著负相关,但与叶片KRE、NRP和PRP无显著相关性。紫花苜蓿生物固氮与叶片的氮、磷、钾重吸收存在偶联关系,对氮、磷重吸收效率和钾重吸收度有显著影响。
[1] Killingbeck K T. Nutrients in senesced leaves: keys to the search for potential resorption and resorption proficiency. Ecology, 1996, 77(6): 1716-1727.
[2] Tang L Y. The Study of Woody Plant Leaf Nutrient Resorption[D]. Beijing: Peking University, 2012.
[3] Reed S C, Townsend A R, Davidson E A,etal. Stoichiometric patterns in foliar nutrient resorption across multiple scales. New Phytologist, 2012, 196(1): 173-180.
[4] Cai Z, Bongers F. Contrasting nitrogen and phosphorus resorption efficiencies in trees and lianas from a tropical montane rain forest in Xishuangbanna, south-west China. Journal of Tropical Ecology, 2007, 23(1): 115.
[5] Huang J Y, Zhu X G, Yuan Z Y,etal. Changes in nitrogen resorption traits of six temperate grassland species along a multi-level N addition gradient. Plant and Soil, 2008, 306(1/2): 149-158.
[6] An Z, Niu D C, Wen H Y,etal. Effects of N addition on nutrient resorption efficiency and C∶N∶P stoichiometric characteristics inStipabungeanaof steppe grasslands in the Loess Plateau, China. Chinese Journal of Plant Ecology, 2011, 35(8): 801-807.
[7] Lü X, Han X. Nutrient resorption responses to water and nitrogen amendment in semi-arid grassland of Inner Mongolia, China. Plant and Soil, 2010, 327(1/2): 481-491.
[8] Lü X, Cui Q, Wang Q,etal. Nutrient resorption response to fire and nitrogen addition in a semi-arid grassland. Ecological Engineering, 2011, 37(3): 534-538.
[9] Mao R, Song C, Zhang X,etal. Response of leaf, sheath and stem nutrient resorption to 7 years of N addition in freshwater wetland of Northeast China. Plant and Soil, 2013, 364(1/2): 385-394.
[10] Killingbeck K T. Inefficient nitrogen resorption in genets of the actinorhizal nitrogen fixing shrubComptoniaperegrina: physiological ineptitude or evolutionary tradeoff. Oecologia, 1993, 94(4): 542-549.
[11] Yang H, Unkovich M, Mcneill A,etal. Symbiotic N2fixation and nitrate utilisation in irrigated lucerne (Medicagosativa) systems. Biology and Fertility of Soils, 2011, 47(4): 377-385.
[12] Wang Z, Lu J, Yang H,etal. Resorption of nitrogen, phosphorus and potassium from leaves of lucerne stands of different ages. Plant and Soil, 2014, 383(1/2): 301-312.
[13] Unkovich M J, Pate J S, Sanford P,etal. Potential precision of the δ15N natural abundance method in field estimates of nitrogen fixation by crop and pasture legumes in south-west Australia. Crop and Pasture Science, 1994, 45(1): 119-132.
[14] Shearer G, Kohl D H. N2-fixation in field settings: estimations based on natural15N abundance. Functional Plant Biology, 1986, 13(6): 699-756.
[15] Yang Z W. The Use of15N Natural Abundance to Quantify Biology Nitrogen Fixation byMedicagosativaLongdong[D]. Lanzhou: Lanzhou University, 2010.
[16] Han W, Fang J, Guo D,etal. Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China. New Phytologist, 2005, 168(2): 377-385.
[17] Li Y, Huang M. Pasture yield and soil water depletion of continuous growing alfalfa in the Loess Plateau of China. Agriculture Ecosystems and Environment, 2008, 124(1/2): 24-32.
[18] Tai J C. Study on Effects of Planting Years on Alfalfa Soil Physical-Chemical Characteristics and Microorganisms[D]. Tongliao: Inner Mongolia University for Nationalities, 2008.
[19] Zhang C X, Hao M D, Li L X. Soil composition of carbon, nitrogen and phosphorus after successive years of alfalfa planting in the gullies of the Loess Plateau. Acta Agrestia Sinica, 2005, 13(1): 66-70.
[20] Vergutz L, Manzoni S, Porporato A,etal. Global resorption efficiencies and concentrations of carbon and nutrients in terrestrial plants. Ecological Monographs, 2012, 82(2): 205-220.
[21] Li Z A, Wang B S, Lin Y B,etal. A review of study on nutrient resorption of plant. Journal of Wuhan Botanical Research, 2000, 18(3): 229-236.
[22] Diehl P, Mazzarino M J, Funes F,etal. Nutrient conservation strategies in native Andean-Patagonian forests. Journal of Vegetation Science, 2013, 14(1): 63-70.
[23] Lü X, Reed S C, Yu Q,etal. Nutrient resorption helps drive intra-specific coupling of foliar nitrogen and phosphorus under nutrient-enriched conditions. Plant and Soil, 2016, 398(1/2): 111-120.
[24] Liang D, Zhang J, Zhang S. Patterns of nitrogen resorption in functional groups in a Tibetan alpine meadow. Folia Geobotanica, 2015, 50(3): 267-274.
[25] He X Y, Zhang C G, Yang S H,etal. Transport characteristics of main nutrients in the leaves of nodulated and nitrogen-fixing trees. Chinese Journal of Ecology, 1997, 16(3): 63-66.
[26] Shi S L. Advance in the study of symbiotic nitrogen fixation of alfalfa rhizobium and comment on it. Grassland of China, 2005, 27(5): 63-68.
[2] 汤璐瑛. 木本植物叶片养分重吸收研究[D]. 北京: 北京大学, 2012.
[6] 安卓, 牛得草, 文海燕, 等. 氮素添加对黄土高原典型草原长芒草氮磷重吸收率及C∶N∶P化学计量特征的影响. 植物生态学报, 2011, 35(8): 801-807.
[15] 杨子文. 应用δ15N 自然丰度技术量化陇东苜蓿生物固氮的研究[D]. 兰州: 兰州大学, 2010.
[18] 邰继承. 种植年限对紫花苜蓿地土壤理化特性及其微生物影响的研究[D]. 通辽: 内蒙古民族大学, 2008.
[19] 张春霞, 郝明德, 李丽霞. 黄土高原沟壑区苜蓿地土壤碳、氮、磷组分的变化. 草地学报, 2005, 13(1): 66-70.
[21] 李志安, 王伯荪, 林永标, 等. 植物营养转移研究进展. 武汉植物学研究, 2000, 18(3): 229-236.
[25] 何兴元, 张成刚, 杨思河, 等. 结瘤固氮树种叶部主要养分迁移特征. 生态学杂志, 1997, 16(3): 63-66.
[26] 师尚礼. 苜蓿根瘤菌固氮研究进展及浅评. 中国草地, 2005, 27(5): 63-68.
Relationships between biological nitrogen fixation and leaf resorption of nitrogen, phosphorus, and potassium in the rain-fed region of eastern Gansu, China
DUAN Bing-Hong, LU Jiao-Yun, LIU Min-Guo, YANG Mei, WANG Ya-Ya, WANG Zhen-Nan,YANG Hui-Min*
StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
Leaf nutrient resorption is influenced by many factors, and is one of the most important strategies to enhance nutrient use efficiency and adaptability in adverse environmental conditions. The aim of this study was to explore the relationship between biological nitrogen fixation (BNF) and leaf nutrient resorption. We analyzed lucerne (Medicagosativacv. Longdong) stands of different ages (2, 4, 7, 11, and 14 years since establishment) in the rain-fed region of eastern Gansu, China. Plant samples were taken at the early flowering stage to measure the concentrations of nitrogen and δ15N, phosphorus, and potassium in green and senesced leaves. The resorption efficiencies of N and P (NRE and PRE, respectively) first increased and then decreased with stand age, while the changes in potassium resorption efficiency (KRE) showed a different pattern. The NRE ranged from 28.4% to 43.4% with an average of 36.5%, and PRE ranged from 38.1% to 68.2% and averaged 52.6%. The highest NRE and PRE were in the 7-year-old stand. The KRE values of 2-, 11-, and 14-year-old lucerne stands ranged from 23.0% to 27.5%, while they were less than zero in the 4- and 7-year-old stands. As the stands aged, the K, N, and P resorption proficiencies (KRP, NRP, and PRP, respectively) showed different patterns of change from those of resorption efficiencies. The percentage of N derived from the atmosphere (%Ndfa) tended to decrease first and then increase with stand age, and averaged 51.0%, with the minimum value in the 7-year-old stand. There were negative correlations between %Ndfa and NRE, PRE, and KRP, but few relationships between %Ndfa and KRE, NRP, and PRP. These results suggested that there is a close link between nutrient resorption and BNF in lucerne and that BNF affects NRE, PRE, and KRP.
Medicagosativa; age; nutrient resorption; biological N fixation
10.11686/cyxb2016235
http://cyxb.lzu.edu.cn
2016-06-06;改回日期:2016-08-11
国家自然科学基金(31572460和31172248)资助。
段兵红(1989-),男,甘肃静宁人,硕士。E-mail: duanbh14@lzu.edu.cn*通信作者Corresponding author. E-mail: huimyang@lzu.edu.cn
段兵红, 陆姣云, 刘敏国, 杨梅, 王亚亚, 王振南, 杨惠敏. 陇东雨养农区紫花苜蓿叶片氮、磷、钾重吸收与生物固氮的偶联关系. 草业学报, 2016, 25(12): 76-83.
DUAN Bing-Hong, LU Jiao-Yun, LIU Min-Guo, YANG Mei, WANG Ya-Ya, WANG Zhen-Nan, YANG Hui-Min. Relationships between biological nitrogen fixation and leaf resorption of nitrogen, phosphorus, and potassium in the rain-fed region of eastern Gansu, China. Acta Prataculturae Sinica, 2016, 25(12): 76-83.
