超高效液相色谱同时测定渔用饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素
2017-01-03刘永涛李乐徐春娟杨移斌董靖胥宁杨秋红艾晓辉
刘永涛,李乐,徐春娟,杨移斌,董靖,胥宁,杨秋红,艾晓辉*
(1. 中国水产科学研究院长江水产研究所, 湖北 武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心, 湖北 武汉 430223;3. 中国水产科学研究院, 北京 100141; 4. 上海海洋大学, 上海 201306)
超高效液相色谱同时测定渔用饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素
刘永涛1,2,李乐3,徐春娟4,杨移斌1,董靖1,2,胥宁1,2,杨秋红1,艾晓辉1,2*
(1. 中国水产科学研究院长江水产研究所, 湖北 武汉 430223;2. 淡水水产健康养殖湖北省协同创新中心, 湖北 武汉 430223;3. 中国水产科学研究院, 北京 100141; 4. 上海海洋大学, 上海 201306)
姜黄素是一种新的渔用饲料添加剂,但目前尚无测定鱼饲料中姜黄素类化合物添加量检测方法。本研究建立了鱼饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素同时测定的超高效液相色谱紫外法(UPLC-TUV)。方法采用乙醇作第一提取剂,乙腈为第二提取剂,基质标准曲线定量。以乙腈-0.1%乙酸水溶液(45∶55,V/V)为流动相,C18柱(2.1 mm×100 mm, 1.7 μm)为色谱柱,430 nm波长下进行检测。鱼饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素最低检测限为10 μg/kg,定量限为25 μg/kg。在空白鱼饲料中添加双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的水平在0.10~2.0 mg/kg时,平均回收率为87.68%~102.06%,相对标准偏差为1.06%~8.01%。本方法为检测鱼饲料中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的添加量提供了一种技术手段。[中国渔业质量与标准,2016, 6(5):60-64]
渔用饲料;双去甲氧基姜黄素;去甲氧基姜黄素;姜黄素;超高效液相色谱
双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素统称为姜黄素类化合物[1],3种化合物结构相近,具有多种相似的药理活性如具有保护肠黏膜、抗氧化、抗炎、抑菌、降血脂、保肝、利胆等[2]。但3种成分药理活性又有所不同,姜黄素的抗氧化活性大于去甲氧基姜黄素和双去甲氧基姜黄素,去甲氧基姜黄素降血脂的活性明显高于姜黄素,双去甲氧基姜黄素在利胆及对内皮细胞生长的抑制作用方面,较去甲氧基姜黄素和姜黄素活性强[3-4]。姜黄素在促进鱼类生长、提高鱼类消化酶活性和抗氧化力、增强免疫功能及改善肌肉品质和鱼体色泽等方面具有一定作用[5]。渔用饲料中添加姜黄素可显著提高罗非鱼(Oreochromisspp)、攀鲈(Anabastestudineus)、虹鳟(Salmogairdneri)和草鱼(Ctenopharyngodonidellus)的抗氧化能力[6-8]。姜黄素可以促进大黄鱼(Pseudosdaenacrocea)的生长、增强大黄鱼皮肤与肌肉的着色[9]。饲料中添加姜黄素可以显著提高草鱼肠道中蛋白酶和淀粉酶的活性,促进鱼体对营养物质的吸收[10]。饲料中添加姜黄素还能够预防鱼肠炎病、小瓜虫病、赤皮病等疾病[11]。可见,在渔用饲料中添加姜黄素类化合物在水产养殖业中具有较好的应用前景,2014年农业部已批准姜黄素作为新饲料添加剂使用。
姜黄素作为一种新的渔用饲料添加剂,实际包含姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素等,天然提取的姜黄素中这3种成分比例相对稳定,姜黄素含量约占70%,去甲氧基姜黄素含量约为10%~20%,双去甲氧基姜黄素含量约为10%[12]。目前,有关同时测定双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素测定的方法多是针对姜属植物[13-17],尚未见有饲料中同时测定这3种成分的报道。因此,建立同时测定渔用饲料中这3种成分的含量方法,不仅检测其含量是否符合饲料中姜黄素标示添加量,同时还可以评判姜黄素饲料添加剂的质量。
1 材料与方法
1.1 仪器与试剂
Waters ACQUITY超高效液相色谱带双通道紫外(TUV)检测器(美国Waters公司);Mettler-TOLEDO AE-240型精密电子天平(梅特勒-托利多公司);HITACHI 20PR-520型自动高速冷冻离心机(日本日立公司);FS-1高速匀浆机(华普达教学仪器有限公司);HQ-60-Ⅱ旋涡混合器(北京北方同正生物技术发展有限公司);HGC-12氮吹仪(HENGAO T&D公司)。
双去甲氧基姜黄素和去甲氧基姜黄素标准品(纯度≥98%,成都克洛玛生物科技有限公司);姜黄素标准品(纯度≥98.9%,中国食品药品检定研究院);乙腈、乙酸、乙酸乙酯、正己烷(色谱纯,美国J.T.Baker公司);超纯水由实验室用美国Milli-Q Advantage A10超纯水机制备。
渔用膨化饲料购自武汉白沙洲农副产品大市场,将渔用膨化饲料用粉碎机粉碎后过20目筛装到封口塑料袋中,经检测不含双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的渔用饲料用于本实验,常温下储存。
1.2 标准溶液的配制
分别准确称取0.1 g(精确至0.001 g)双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素对照品,用乙腈溶解并定容至100 mL,配制成1 000 μg/mL双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的标准储备液,-20 ℃冰箱中冷藏保存。用乙腈逐级稀释成500和25 μg/mL混合标准中间液。
1.3 渔用饲料基质标准工作溶液的制备
在5.0 g空白鱼饲料中分别添加不同体积双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素混合标准中间液,按1.5方法处理后,得到质量浓度分别为0.01、0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00 mg/kg渔用饲料基质标准工作溶液。
1.4 方法回收率、精密度、最低检测限和定量限
分别在渔用饲料空白样品中添加4个浓度水平的双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素标准溶液,使样品含量分别为0.10、0.50、1.00、2.00 mg/kg,每个含量水平做6个平行,每个平行设一个空白对照,计算添加回收率和相对标准偏差。定加标样品,以大于3倍和10倍信噪比分别计算双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素在鱼饲料中的最低检测限和定量限。
1.5 样品前处理
准确称取已粉碎并过20目的渔用饲料粉5.0 g置于50 mL离心管中,向离心管中加入20 mL乙醇,涡旋振荡30 s,超声提取5 min,室温条件下,8 000 r/min离心5 min,将上层乙醇提取液转移到125 mL棕色鸡心瓶中,用20 mL乙醇重复提取一次,合并提取液至125 mL棕色鸡心瓶中,将鸡心瓶置40 ℃旋转蒸发仪上将提取液浓缩至干,用6 mL乙腈分两次将鸡心瓶中的残渣转移到10 mL离心管中,将10 mL离心管置45 ℃氮吹仪上氮吹至干,用1 mL流动相定容,涡旋振荡30 s,8 000 r/min离心5 min,离心后的液体过0.22 μm聚醚砜滤头过滤到棕色进样瓶中,上UPLC-TUV测定。实验操作在避光条件下进行。
1.6 色谱条件
色谱柱为ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)反相色谱柱;柱温为30 ℃;流速为0.3 mL/min;进样量为5 μL。等度洗脱条件:A相为乙腈,B相为0.1%乙酸水溶液,A相和B相的体积比为45∶55;紫外检测波长为430 nm。
2 结果与讨论
2.1 样品前处理条件的优化
由于双去甲氧基姜黄素在自然光照条件下不稳定[4],所以本实验应在避光条件下进行。双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素不溶于水,易溶于乙醇、乙酸乙酯、乙腈等有机溶剂。本实验分别选用乙酸乙酯、乙醇、乙腈作为提取溶剂,以提取回收率为评判标准进行提取溶剂的筛选。结果表明,乙酸乙酯对双去甲氧基姜黄素的提取率(约30%)较乙腈和乙醇的低,3种溶剂对去甲氧基姜黄素和姜黄素的提取率相当,但乙腈和乙醇对3种姜黄素类化合物的提取率也仅为50%左右,因此,本试验采用了基质标准曲线法对3种姜黄素类化合物进行定量,同时考虑到成本因素,最终选择乙醇作为提取剂。实验中发现如果将乙醇提取液直接浓缩至干后加入流动相溶解渣,样品乳化现象严重。本实验分别采用加入①2 mL水+6 mL乙酸乙酯,②6 mL乙腈进行二次提取对样品进行净化,结果表明,通过方法①用水溶解除去样品中水溶性杂质,再用乙酸乙酯进行反萃取,将乙酸乙酯置氮吹仪上吹干后会在试管底部形成油滴,再加入定容溶液后样品中会有小油滴存在进而影响分析,如果采用正己烷去脂会使目标物的回收率降低;通过方法②样品经乙腈二次提取,置氮吹仪上吹干后用流动相定容、离心,过滤后样品澄清,经UPLC-TUV检测基线平稳,目标峰附近无杂峰干扰,因此,选择了乙腈作为第二提取剂。本实验也尝试采用乙腈第一提取剂,乙醇作第二提取剂也能取得较好的样品处理效果,从样品处理效果和样品制备成本综合考虑最终选择了乙醇作为第一提取剂,乙腈作为第二提取剂。
2.2 超高效液相色谱分析
分离双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的液相色谱流动相的报道有0.01 moL/L磷酸二氢钾缓冲液-乙腈[12],乙腈-3%醋酸[13],乙腈-4%冰醋酸[14],甲醇-0.5%冰醋酸[15],乙腈-0.5%冰醋酸[16],甲醇水溶液-甲基叔丁基醚[17-18],上述流动相大多成分复杂,配制繁琐,分离测定上述3种姜黄素类化合物所需时间长(12~25 min)。本实验采用具有更好的分离度、更高的灵敏度和更快的分析速度的超高效液相色谱[19]分离测定3种姜黄类化合物,以乙腈-0.1%乙酸(45∶55,V/V)为流动相(流动相成分简单,配制方便),一个样品的分析时间仅为5 min,且能将双去甲氧基姜黄素中另一种未知组分分离出来(图1和图3),而上述报道的液相色谱法是无法将双去甲氧基姜黄素中另一未知组分分离出来。
2.3 渔用饲料基质标准曲线方程及相关指数
将1.3制备的渔用饲料基质标准工作溶液进样分析,以质量浓度C和峰面积A作线性回归,获得鱼饲料基质标准曲线。结果表明,双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素在0.01~10.00 mg/kg范围内均呈线性相关,相关指数R2≥0.998 8,结果见表1。
表1 双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素基质标准曲线及相关指数
Tab. 1 Matrix-fortified calibration curves and related coefficients for bisdemethoxycurcumin,demethoxycurcumin and curcumin

化合物Compound线性范围/(mg·kg-1)Linearrange回归方程Regressionequation相关指数R2Correlationcoefficient双去甲氧基姜黄素Bisdemethoxycurcumin0.01~10.00A=309653C-1800.70.9996去甲氧基姜黄素Demethoxycurcumin0.01~10.00A=260877C-3340.60.9990姜黄素Curcumin0.01~10.00A=256059C-14903.00.9988
2.4 方法回收率、精密度、最低检测限和定量限
如表2所示,本方法平均回收率为87.68%~102.06%,相对标准偏差在1.06%~8.01%。标准
溶液、饲料空白及加标样品色谱图见图1~图3。双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素在鱼饲料中的最低检测限均为10 μg/kg,定量限均为25 μg/kg。
表2 样品中双去甲氧基姜黄素、去甲氧基姜黄素和姜黄素的添加回收率和相对标准偏差
Tab. 2 Spiked recoveries and relative standard deviations (RSD) of bisdemethoxycurcumin,demethoxycurcumin and curcumin in samplesn=6
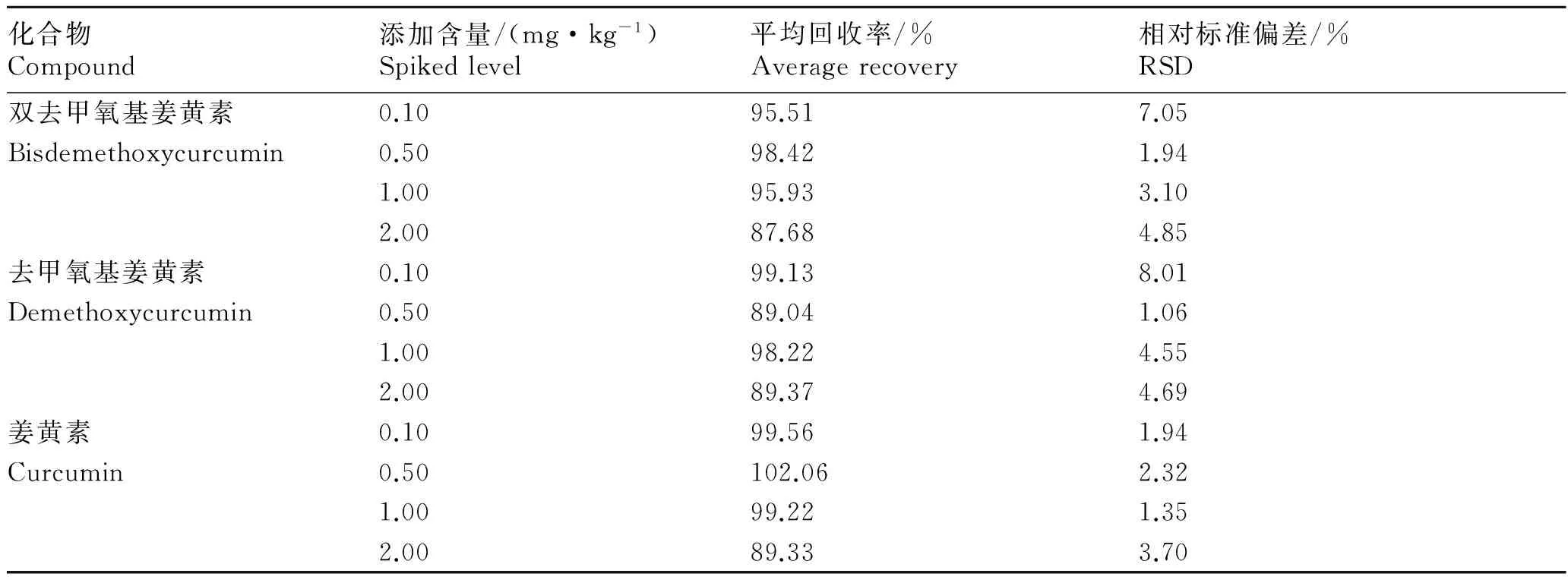

图1 100 μg·L-1混合标准溶液色谱图 1:双去甲氧基姜黄素;2:去甲氧基姜黄素;3:姜黄素。下同。Fig. 1 Chromatogram of a mixture standard solution of 100 μg·L-11: Bisdemethoxycurcumin; 2: Demethoxycurcumin; 3: Curcumin. The same blew.

图2 渔用饲料空白色谱图Fig. 2 Chromatogram of fishery feed blank
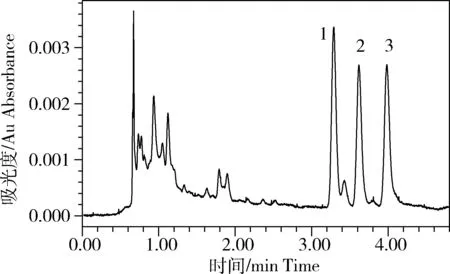
图3 50 μg·kg-1 姜黄素类化合物加标色谱图Fig. 3 Chromatogram of spiked sample with 50 μg·kg-1 curcuminoid
2.5 实际样品分析
利用本方法对市售草鱼育成配合饲料、鲫育成配合饲料、黄颡鱼配合饲料共15个样品进行检测,未检出双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素。
3 结论
本方法中双去甲氧基姜黄素、去甲氧基姜黄素、姜黄素在0.01~10.00 mg/kg范围内均呈良好的线性相关,方法回收率高于87.68%,精密度小于8.01%,检测限和定量限分别为10和25 μg/kg。本研究首次报道了渔用饲料中双甲氧基姜黄素、去甲氧基姜黄素、姜黄素的测定方法,采用超高效液相色谱作为分析仪器,与普通的高效液相色谱相比,缩短了分析时间,提高了分析效率,适用于大批量渔用饲料的检测。
[1] 王琰, 王慕邹. 姜黄属常用中药的研究进展[J]. 中国药学杂志, 2001, 36(2): 81.
[2] 赵春萍, 荀文娟, 曹婷, 等. 姜黄素作为饲料添加剂的研究进展[J]. 动物营养, 2014, 12: 20-23.
[3] 韩刚, 崔静静, 毕瑞, 等. 姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素稳定性研究[J].中国中药杂志, 2008, 33(22): 2611-2614.
[4] 赵欣, 王爱里, 袁园, 等. 姜黄中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素的光稳定性分析[J]. 中草药, 2013, 44(10): 1338-1341.
[5] 关燕云, 解文丽, 艾春香. 姜黄素的生理功能及 其在水产配合饲料中的应用[J]. 中国饲料, 2015, 16: 11-15.
[6] 郑清梅, 陈兴发, 温小波. 姜黄素对罗非鱼生长、消化和抗氧化能力的影响研究[C]//第七届世界华人鱼虾大会论文集. 北京:中国农业科学院饲料研究所, 2008.
[7] Manju M, Akbarsha M A, Oommen O V.Invivoprotective effect of dietary curcumin in fishAnabastestudineus(Bloch) [J].Fish Physiol Biochem, 2012, 38(2): 309-318.
[8] 史合群, 周永奎, 谢晓晖. 姜黄素的生理功能及其在水产饲料工业中的应用[J]. 饲料研究, 2013 (6): 9-11.
[9] 王进波, 吴天星. 姜黄素在大黄鱼饲料中的应用效果研究[J]. 水利渔业, 2007, 27(6): 105-106.
[10] 胡忠泽, 杨久峰, 谭志静, 等. 姜黄素对草鱼生长和肠道酶活力的影响[J]. 粮食与饲料工业, 2003 (11): 29-30.
[11] 牛生洋, 郝峰鸽, 许秋亚. 姜黄素的提取及应用研究进展[J]. 河南科技学院学报(自然科学版), 2008, 12, 36(4): 58-61.
[12] Revathy S, Elumalai S, Benny M, et al. Isolation, Purification and identification of curcuminoids from turmeric (CurcumalongaL.) by column chromatography[J].J Food Sci, 2011, 2(7): 21-25
[13] 赵欣, 袁丹, 王启隆, 等. 姜黄提取物中姜黄素类成分定量分析方法研究[J]. 药物分析杂志, 2005, 25(6): 643-647.
[14] 张韻慧, 张丹, 王妍, 等. HPLC内标法测定姜黄中姜黄素类成分的含量[J]. 中国药学杂志, 2009, 44(18): 1423-1425.
[15] 孙静, 孙艳涛, 张振秋, 等. 中药莪术中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素的含量测定[J]. 中国医院药学杂志, 2010, 8: 714-716.
[16] 蔡颖, 宋坤, 徐杰, 等. 不同来源莪术中姜黄素类成分的含量差异研究[J]. 药学与临床研究, 2014, 22(6): 502-505.
[17] 史晶晶, 冯素香, 郝蕊, 等. 姜黄提取物中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素的含量测定[J]. 中医学报, 2015, 30(6): 853-855.
[18] 张盼盼, 钱疆, 杨方, 等. 高效液相色谱法检测食品中姜黄素类化合物[J]. 分析测试学报, 2013, 32(9): 1127-1130.
[19] 杨方, 张盼盼, 钱疆, 等. 高效液相色谱同时检测淀粉类食品中添加的姜黄色素与类胡萝卜素化合物[J]. 中国食品卫生杂志, 2014, 26(6): 558-562.
[20] 朱瑞芝, 王凯, 吴新华, 等. 超高效液相色谱-质谱法同时快速测定烟叶中的几种芳香酸和酚酸[J]. 分析试验室, 2009, 28(10): 108-112.
Simultaneous determination of bisdemethoxycurcumin, demethoxycurcumin and curcumin in fishery feed by UPLC
LIU Yongtao1, 2, LI Le3, XU Chunjuan4, YANG Yibin1, DONG Jing1, 2, XU Ning1, 2, YANG Qiuhong1, AI Xiaohui1, 2*
(1. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;2. Hubei Freshwater Aquaculture Collaborative Innovation Center,Wuhan 430223, China;3. Chinese Academy of Fishery Sciences, Beijing 100141, China; 4. Shanghai Ocean University, Shanghai 201306, China)
Since there is no analytical method for determination of 3 curcuminoids in fishery feed, it is necessary to establish an ultra-high performance liquid chromatographic (UPLC) method for simultaneous determination of bisdemethoxycurcumin, demethoxycurcumin and curcumin in fishery feed. Ethanol was used as the first extraction solvent, and acetonitrile as the second extraction solvent, and matrix-fortified standard curve for quantification. Analytes were separated on C18column (2.1 mm× 100 mm) and detected at 430 nm wavelength by UPLC. The detection limits and quantification limits for bisdemethoxycurcumin, demethoxycurcumin and curcumin were both 10 and 25 μg/kg in fishery feed. The average recoveries of bisdemethoxycurcumin, demethoxycurcumin and curcumin in fishery feed were from 87.68% to 102.06% at the spiked level of 0.10 - 2.0 mg/kg. The relative standard deviations were from 1.06% to 8.01%. The present method provides a technical means for simultaneous determination of bisdemethoxycurcumin, demethoxycurcumin and curcumin in fishery feed. [China Fishery Quality and Standard, 2016, 6(5): 60-64]
fishery feed; bisdemethoxycurcumin; demethoxycurcumin; curcumin; UPLC
AI Xiaohui, aixh@yfi.ac.cn
2016-06-14接收日期:2016-08-02
典型化学物污染淡水水产品质量安全综合防治技术方案(鄂、皖、川、渝片区)(201503108-C-C-1);中国水产科学研究院基本科研业务费(2016JBF0104)
刘永涛(1979-),男,副研究员,研究方向为水产动物药理与水产品质量安全,liuyt@yfi.ac.cn
艾晓辉,研究员,研究方向为水产动物药理与药残控制技术,aixh@yfi.ac.cn
S94
:A
:2095-1833(2016)05-0060-05
