新型QuEChERS方法结合高效液相色谱串联四极杆飞行时间质谱法快速测定鱼肉中14种激素
2017-01-03李诗言王扬周凡郑重莺柯庆青王鼎南贝亦江
李诗言,王扬,周凡,郑重莺,柯庆青,王鼎南,贝亦江
(浙江省水产质量检测中心,浙江 杭州 310023)
新型QuEChERS方法结合高效液相色谱串联四极杆飞行时间质谱法快速测定鱼肉中14种激素
李诗言,王扬*,周凡,郑重莺,柯庆青,王鼎南,贝亦江
(浙江省水产质量检测中心,浙江 杭州 310023)
建立了一种新型QuEChERS前处理方法,结合高效液相色谱-四极杆飞行时间质谱(LC-Q-TOF/MS)技术对鱼肉中14种激素进行快速筛查测定。样品加入水分散基质后采用乙腈提取,提取液经增强型基质去脂吸附剂(EMR-lipid)脱脂,盐析后采用PSA吸附剂进一步净化并浓缩,然后用LC-Q-TOF/MS方法检测分析。所有药物在线性范围内线性良好,定量限范围为1.4~6.7 μg/kg。3个添加水平(n=6)下草鱼基质的平均回收率为75.4%~103.6%,相对标准偏差(RSD)为2.4%~9.5%;大黄鱼基质的平均回收率为73.4%~101.5%,相对标准偏差(RSD)为2.4%~9.1%。该方法利用精确质量数匹配和自建标准谱库检索,实现快速筛查,并使用多级特征碎片离子进行确证,具有操作简便、结果准确等优点,适用于不同鱼肉基质,可作为鱼肉中14种激素类药物的高通量筛查和确认检测方法。本研究为监测鱼肉中激素类药物的风险提供了有效的技术手段。[中国渔业质量与标准,2016,6(5):52-59]
高效液相色谱串联四极杆飞行时间质谱;激素;QuEChERS;草鱼;大黄鱼;筛查参数
激素主要包括雌雄激素、孕激素和糖皮质激素,因其具有影响动物性别分化、促进动物生长和提高蛋白转化率的作用,会被违规用于养殖过程中,以达到提高经济效益的目的。研究表明,某些激素可长期在水产品中残留,间接被人体摄入后会对人体正常激素平衡造成干扰,对人体内分泌、生殖系统造成影响,甚至有致癌风险[1]。因此,欧盟严格规定禁止在饲料中使用激素类药物,农业部235公告[2]也明确规定禁止在动物性食品中检出丙酸睾酮与诺龙等激素类药物。
激素的检测方法主要有气相色谱质谱法(GC-MS)[3-4]、液相色谱法(HPLC)[5-6]和液相色谱串联质谱法(LC-MS/MS)[7-10]等。其中GC-MS方法样品需要衍生化,前处理过程繁琐;HPLC方法检测灵敏度较低,定性分析易受干扰;LC-MS/MS方法具有良好选择性与灵敏度,已经在兽药、农药检测工作中得到了广泛的应用。目前,以四极杆/飞行时间质谱(Q-TOF /MS) 为代表的高分辨率质谱技术为各类药物筛查检测工作带来了新的技术手段,其具有高特异性、高质量准确度和高质量分辨率等优点,通过精确质量数的检索匹配及多级特征碎片离子确证,可以对样品中的药物进行快速筛查与确证[11-13]。
QuEChERS(quick, easy, cheap, effective, rugged and safe)方法是一种高效的前处理技术,最早在农药多残留中使用,近年来逐渐被开发用于动物源食品中药物残留的前处理工作。目前,QuEChERS方法已经在测定激素类药物的工作中得以应用[11,14-15],但传统的QuEChERS方法所用的吸附剂在去除脂类基质干扰的同时,往往会对药物的回收率产生不利影响。为建立一种高效、低干扰的鱼肉中激素类药物检测方法,本研究采用基于增强型去除脂类基质吸附剂(enhanced matrix removal-lipid, EMR-lipid)的新型QuEChERS 样品前处理技术,在去除基质干扰物的同时不会吸附待测物[16]。同时,本研究利用LC-Q-TOF/MS技术建立了鱼肉中14种激素的快速筛查和定量检测方法,为相关部门进行鱼肉中激素类药物的风险监测提供有效的技术手段。
1 实验部分
1.1 仪器与试剂
Agilent 1290-6540液相色谱-四级杆飞行时间质谱仪,配有Dual Agilent Jet Stream Electrospray Ionization (Dual AJS ESI)源(美国Agilent公司);Allegra X-15R离心机(美国Beckman公司);Hei-mixers震荡仪(德国Heidolph公司);Sigma2-6E离心机(德国Sigma公司);N≻EVAP112水浴式氮吹浓缩仪(美国Organomation Associates,Inc);IKA MS 3 B S25快速混匀器(德国IKA集团);Milli-Q超纯水系统(美国Millipore公司)。
14种激素标准品(纯度均大于95%,德国Dr.Ehrenstorfer公司),具体信息见表1;增强型去除脂类基质吸附剂EMR-lipid (enhanced matrix removal-lipid)(美国Agilent 公司);N-丙基乙二胺吸附剂(PSA)(博纳艾杰尔科技有限公司公司);十八烷基键合硅胶(C18)吸附剂(博纳艾杰尔科技有限公司公司);中性氧化铝(Alu-N)吸附剂(博纳艾杰尔科技有限公司公司);无水硫酸镁(分析纯,上海阿拉丁试剂);氯化钠(分析纯,上海凌峰化学试剂有限公司);乙腈(色谱纯,美国TEDIA公司);甲醇(色谱纯,美国TEDIA公司);甲酸(色谱纯,美国ROE scientific INC.)。
1.2 样品前处理
准确称取均质后鱼肉样品2.00 g(精确到0.01 g),置于50 mL带盖的离心管中,加入5 mL超纯水,充分涡旋混匀1 min后,准确加入15 mL乙腈,涡旋振荡10 min,9 000 r/min在4 ℃下冷冻离心5 min,待净化。
取另一50 mL带盖离心管,准确加入1.0 g EMR-lipid吸附剂,再加入5 mL超纯水,涡旋使 EMR-lipid吸附剂充分混匀,将上步骤提取的上清液全部倒入离心管中,涡旋充分混合,9 000 r/min在4 ℃下冷冻离心5 min,再移取全部上清液置于新的50 mL离心管中,加入盐析剂(3.0 g无水硫酸镁、1.0 g氯化钠),充分涡旋混匀后,9 000 r/min在4 ℃下冷冻离心5 min,分层后移取上层乙腈相10 mL至另一15 mL带塞离心管。准确加入400 mg无水硫酸镁和150 mg PSA到装有10 mL提取液的离心管中,充分涡旋混匀1 min,4 000 r/min 离心5 min,准确移取7.5 mL上清液至具塞刻度玻璃试管,于40 ℃下水浴氮吹至近干,加入0.5 mL 0.1%甲酸水溶液-甲醇(70 ∶30,V∶V)复溶,涡旋30 s,经过0.22 μm有机滤膜过滤,待上机。
1.3 LC-Q-TOF/MS条件
1.3.1 色谱条件
以0.1%甲酸溶液(流动相A)和甲醇溶液(流动相B)为色谱流动相进行梯度洗脱。色谱柱采用Agilent ZORBAX Eclipse Plus C18(3.0 mm×100 mm,1.8 μm),流速设定在400 μL/min,柱温30 ℃。梯度洗脱程序设定:0~1 min,5% B;1~5 min,5%~30% B;5~8 min,30%~50% B;8~15 min,50%~98% B;15~18 min,98% B,进样量10 μL。
1.3.2 质谱条件
离子源:Dual AJS ESI源;扫描方式:正离子全扫描;全扫描范围:m/z50~1000;毛细管电压:4 000 V;鞘气温度:350 ℃;鞘气流速:11.0 L/min;干燥气流速:10.0 L/min;干燥气温度:320 ℃;诱导解离电压:120 V。采集数据时采用参比液(C5H4N4,其离子精确质量数为121.050 873)实时质量校准。
1.4 数据处理与定量分析
数据分析采用安捷伦公司的质谱定性分析数据处理软件(MassHunter Qualitative Analysis B.5.00)。样品首先通过全扫描模式进行数据采集,之后通过建立好的14种激素类化合物筛查信息列表进行化合物提取与匹配。化合物鉴定主要基于以下3个准则:1)分析物与标准品化合物的保留时间匹配;2)化合物精确质量数匹配;3)化合物同位素丰度匹配。通过基质提取液配制标准曲线,外标法定量。空白鱼肉样品按步骤1.2方法进行处理,得到空白基质,以此配置质量浓度分别为 10、20、50、100、500、1 000 μg/L的标准溶液,LC-Q-TOF/MS进样测定,以各化合物的峰面积对其质量浓度绘制曲线,获得14种化合物基质标准曲线、线性相关系数及方法检出限。
1.5 方法学验证
称取空白鱼肉样品,添加不同体积梯度的混标工作液,涡旋混匀后,避光静置2 h,按照步骤1.2方法进行提取净化,每个加标浓度重复6次,以基质标准曲线进行定量分析,根据检测结果计算加标回收率及相对标准偏差。
2 结果与讨论
2.1 色谱及质谱条件优化
本研究对比了甲醇-水和乙腈-水这两种流动相体系(水相均添加0.1 %甲酸)对14种激素类化合物质谱响应和峰形的影响,选用Agilent ZORBAX Eclipse Plus C18色谱柱对目标化合物进行分析。结果表明,14种激素在以甲醇-水(添加0.1 %甲酸)作为流动相时的质谱响应值高于乙腈-水(添加0.1 %甲酸)为流动相时的响应值,并且可以获得良好的峰形和分离效果,因此确定以甲醇-0.1%甲酸作为流动相。飞行时间质谱仪的毛细管出口区域碰撞诱导解离电压(fragmentor)能够影响离子的传输效率,进而影响检测灵敏度。本研究分别优化了14种激素诱导解离电压在70~200 V 时各目标物的分子离子峰响应情况。结果显示,14种激素化合物的最优诱导解离电压范围为100~140 V。综合考虑,最终折中选择碰撞诱导解离电压为120 V,此时14种激素均能获得较高强度的响应值。图1为在以上优化条件下14种激素的提取离子色谱图。
化合物质谱筛查参数是飞行时间质谱筛查目标化合物的判定依据,本研究通过Agilent Mass Hunter PCDL Manager(B 4.00)软件完成化合物质谱筛查参数的建立。为了保证筛查数据的完整性和可靠性,分别采集了碰撞能量为10、20和40 eV时各化合物的二级质谱图加入谱库。本实验室之前研究工作[17]表明飞行时间质谱可得到化合物的精确质量数、同位素峰度匹配和二级特征离子匹配等信息,在药物检测和分析工作中具有比低分辨质谱更可靠的定性分析优势。表1列出了14种激素化合物的具体参数信息。
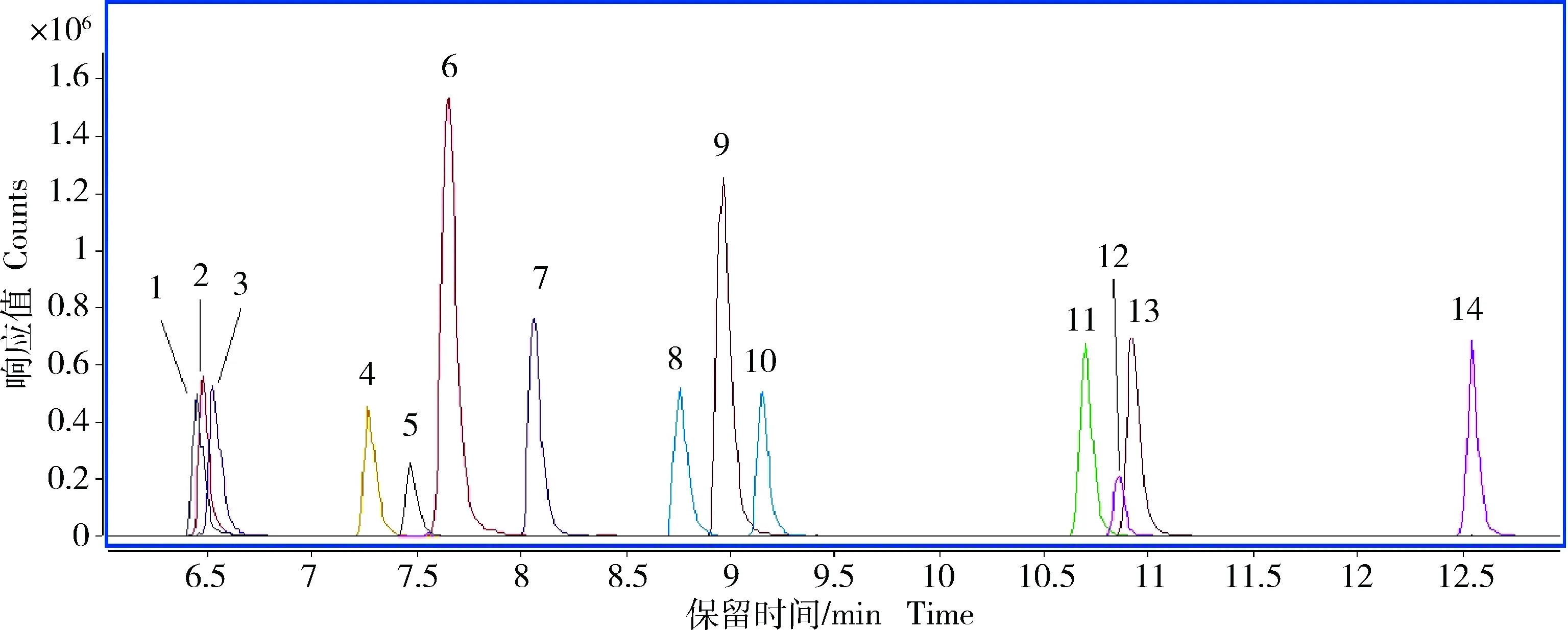
图1 14种激素的提取离子流图 1:氢化泼尼松;2:泼尼松;3:氢化可的松;4:地塞米松;5:群勃龙;6:倍氯米松;7:诺龙;8: 21α-羟孕酮;9:甲基睾丸酮;10: 17α-羟孕酮;11:孕酮;12:醋酸甲羟孕酮;13:醋酸氯地孕酮;14:丙酸睾酮。Fig: 1 High resolution extracted ion chromatogram of 14 hormones 1:Prednisolone; 2:Prednisone; 3:Hydrocortisone; 4:Dexamethasone; 5:Trenbolone; 6:Beclomethasone; 7:Nandrolone; 8:21-alpha-Hydroxyprogesterone; 9:Methyltestosterone; 10:17-alpha-Hydroxyprogesterone; 11:Progesterone; 12:Medroxyprogesterone 17-acetate; 13:Chloromadinone 17-acetate; 14:Testosterone propionate.
表1 14种激素的质谱筛查参数
Tab.1 Target compound names,formulas,exact mass, retention times and fragment ions of 14 hormones
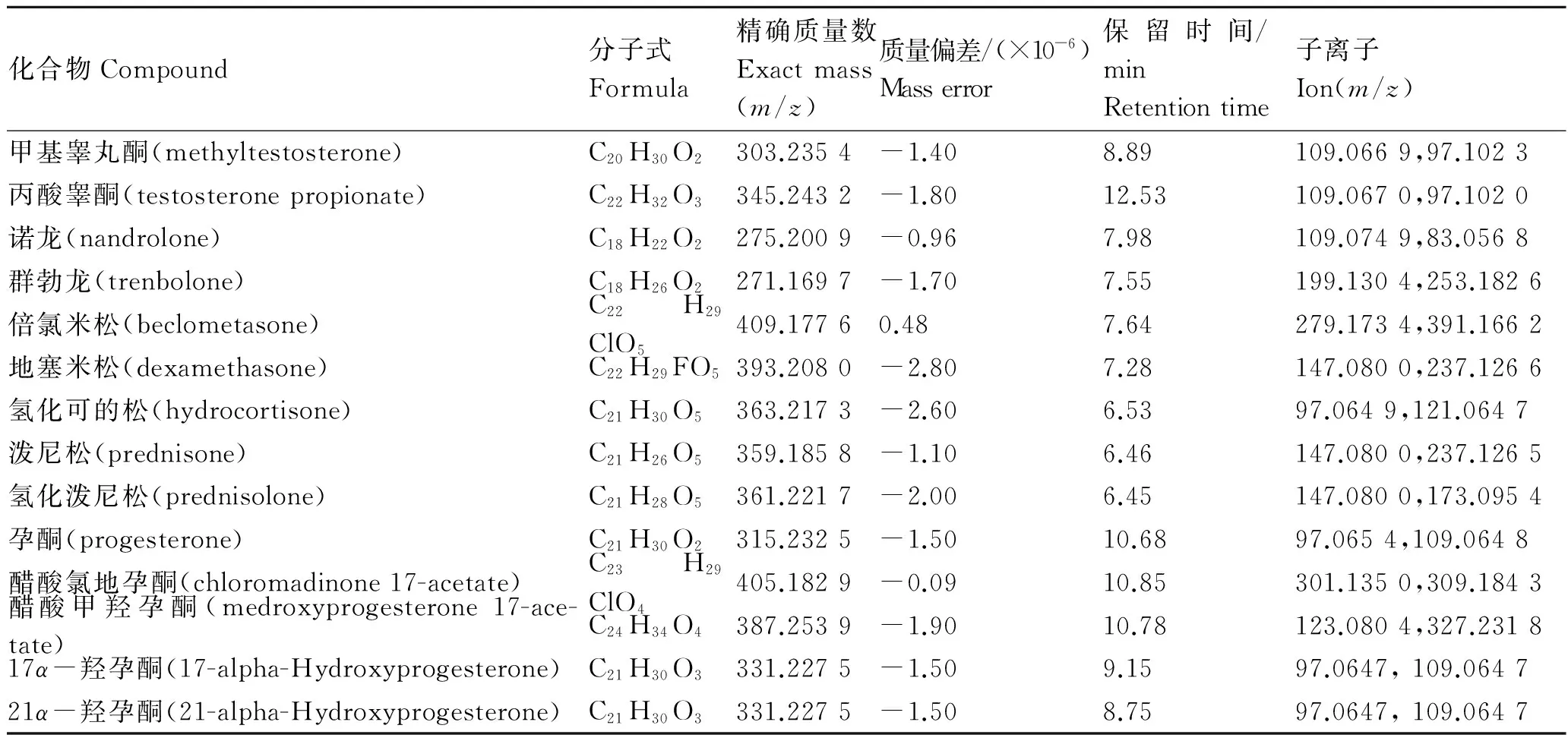
化合物Compound分子式Formula精确质量数Exactmass(m/z)质量偏差/(×10-6)Masserror保留时间/minRetentiontime子离子Ion(m/z)甲基睾丸酮(methyltestosterone)C20H30O2303.2354-1.408.89109.0669,97.1023丙酸睾酮(testosteronepropionate)C22H32O3345.2432-1.8012.53109.0670,97.1020诺龙(nandrolone)C18H22O2275.2009-0.967.98109.0749,83.0568群勃龙(trenbolone)C18H26O2271.1697-1.707.55199.1304,253.1826倍氯米松(beclometasone)C22H29ClO5409.17760.487.64279.1734,391.1662地塞米松(dexamethasone)C22H29FO5393.2080-2.807.28147.0800,237.1266氢化可的松(hydrocortisone)C21H30O5363.2173-2.606.5397.0649,121.0647泼尼松(prednisone)C21H26O5359.1858-1.106.46147.0800,237.1265氢化泼尼松(prednisolone)C21H28O5361.2217-2.006.45147.0800,173.0954孕酮(progesterone)C21H30O2315.2325-1.5010.6897.0654,109.0648醋酸氯地孕酮(chloromadinone17-acetate)C23H29ClO4405.1829-0.0910.85301.1350,309.1843醋酸甲羟孕酮(medroxyprogesterone17-ace-tate)C24H34O4387.2539-1.9010.78123.0804,327.231817α-羟孕酮(17-alpha-Hydroxyprogesterone)C21H30O3331.2275-1.509.1597.0647,109.064721α-羟孕酮(21-alpha-Hydroxyprogesterone)C21H30O3331.2275-1.508.7597.0647,109.0647
2.2 样品前处理的优化
2.2.1 提取试剂的选择
本研究14种激素类药物属于弱极性或者中等极性化合物,常用的提取试剂涉及甲醇、乙腈和乙酸乙酯等[13-15, 18],考虑到QuEChERS方法需要盐析,而甲醇作为提取剂其盐析效果不佳,因此本研究只考察了乙腈和乙酸乙酯对14种目标化合物在草鱼和大黄鱼样品基质中的提取效果情况。结果表明,在20 μg/kg的加标水平下,草鱼基质中乙腈和乙酸乙酯的14种激素类化合物平均绝对回收率基本一致,分别为56.8%和54.4%;大黄鱼基质中乙腈的14种激素类化合物平均绝对回收率要高于乙酸乙酯,其中乙腈为48.5%,乙酸乙酯则为38.1 %。乙酸乙酯作为提取试剂时,提取液颜色较深,氮吹后也残存较多的油性物质(特别是大黄鱼样品基质),说明其在提取过程中带出了较多的弱极性基质成分,进而导致了大黄鱼基质中14种激素类化合物的绝对回收率偏低,增加了后续净化难度;乙腈在有效提取目标化合物的同时还具有蛋白沉淀作用,能在一定程度上减少基质效应,也是原始QuEChERS 方法选用的提取试剂,故本实验最终采用乙腈作为提取试剂。
2.2.2 净化条件的选择
QuEChERS方法主要采用分散固相萃取的方式进行净化,常用的吸附剂主要有PSA、C18、GCB和Alu-N等。其中,C18和Alu-N具有良好的除脂能力,PSA和GCB能够去除基质中的色素和糖类物质。吸附剂在吸附杂质的同时,也可能吸附目标化合物造成其回收率的降低,因此本研究考察了上述5种吸附剂对14种激素类化合物的吸附情况。分别在100 μg/L的混合标准溶液中加入200 mg不同种类的吸附剂,充分混匀5 min,过滤膜后进行质谱分析,计算3类激素在5种吸附剂处理后的平均回收率(图2)。结果表明,EMR和PSA对雄性激素、孕激素和糖皮质激素回收率影响较小,3类激素化合物的平均回收率均在90%以上,其中EMR作为特殊聚合物基质,具有脂类物质选择性吸附的优势,基本不会吸附目标化合物,3类激素的平均回收率达到了95%以上。GCB、Alu-N和C18吸附剂均对目标化合物存在着一定的吸附作用,GCB对含有苯环官能团的化合物具有较强的吸附能力,本研究中14种化合物均含有苯环结构,因此其平均回收率最低。
吸附剂的回收率实验结果表明,基于EMR-lipid的QuEChERS方法能够在不干扰目标化合物回收率的情况下,对样品基质进行净化。EMR吸附剂需要用水活化,通过疏水作用和分子排阻作用去除基质中的长链脂类物质,因此相比于传统的QuEChERS方法,基于EMR-lipid的QuEChERS方法需要先用EMR吸附去除基质中的脂类物质后,再通过盐析脱水后进行后续的吸附净化工作。本研究中,后续吸附净化采用PSA作为吸附剂,通过回收率和基质效应结果进一步单独考察了100~400 mg PSA净化效果。结果显示,采用150 mg PSA,基质效应适中,回收率最佳。同时考虑到鱼肉样品水分较多,因此加入400 mg无水硫酸镁除去后续净化液中剩余的水分。
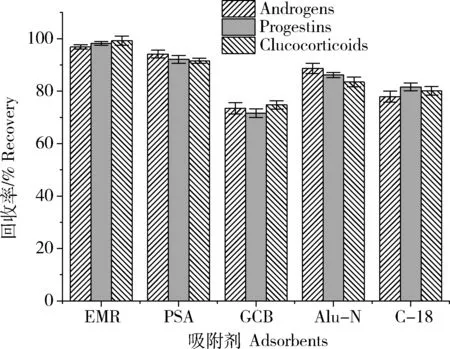
图2 不同吸附剂对14种激素回收率的影响Fig. 2 Influence of different adsorbents on recoveries of 14 hormones
2.3 基质效应的影响
在液质分析中,客观存在的基质效应往往会影响分析方法的灵敏度、精密度以及准确度,目前减少基质效应的方法通常包括稀释样品溶液、增加净化步骤、采用同位素内标物和配制基质匹配标准溶液等。用大黄鱼基质溶液配制14种激素药物的基质匹配标准曲线,通过与纯溶剂配制标准曲线的斜率之比进行评价,其比值越接近1,说明基质效应越小,反之亦然。在优化后的前处理条件下,考察了样品的基质效应(表2)。结果表明在经过优化后的QuEChERS方法处理后,样品的基质效应仍然不能被完全消除,目标化合物均存在一定的基质效应。因此,本研究采用配制基质匹配标准溶液的方法,以空白鱼肉样品的提取液为标准溶液的稀释溶液,可使标准溶液和样品溶液具有相同的离子化环境,以减少基质效应对检测的干扰。
2.4 方法学考察
2.4.1 方法的线性范围、回归方程与定量限
以大黄鱼空白基质溶液配制成6种质量浓度的混合标准工作溶液系列梯度,通过各化合物的精确分子质量数,得到其提取离子色谱图。以提取离子色谱图的峰面积(Y)为纵坐标,化合物质量浓度(X,μg/L)为横坐标绘制标准曲线,得到线性回归方程,结果见表2。14种待测物的线性范围均为10~1 000 μg/L,相关系数(r2)为0. 998 8~0. 999 8,表明各化合物具有良好的线性关系。采用标准添加法进行测定,以离子信噪比(S/N)大于3确定样品的检出限( LOD),S/N大于10为定量限( LOQ),得到14种化合物的LOD 范围为0.40 ~2.00 μg/kg,LOQ范围为1.4 ~6.7 μg/kg。
表2 14种目标化合物的基质效应、回归方程及相关系数
Tab. 2 Matrix effects,regression equations and correlation coefficients (r2) of 14 kinds of analytes
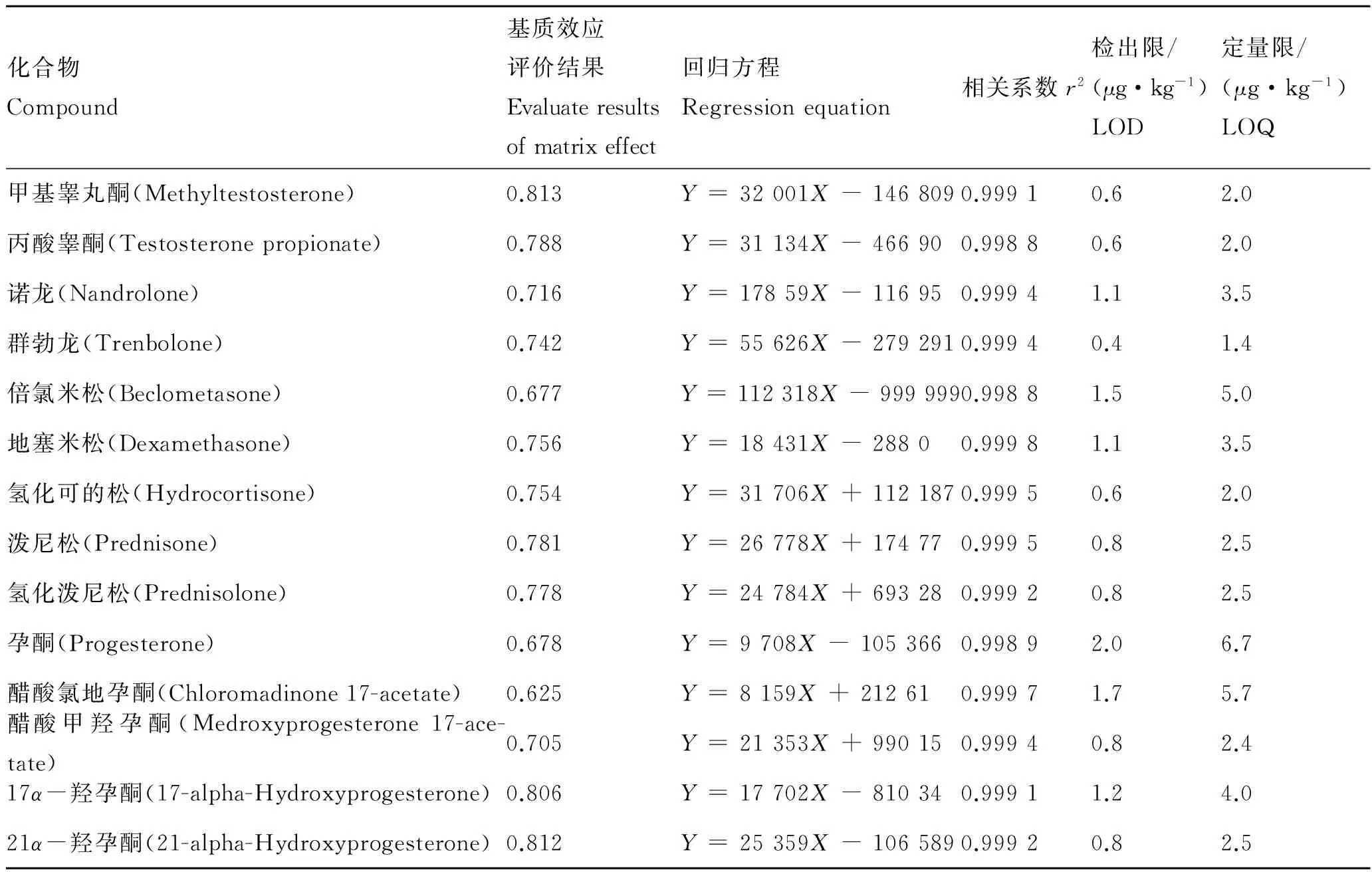
化合物Compound基质效应评价结果Evaluateresultsofmatrixeffect回归方程Regressionequation相关系数r2检出限/(μg·kg-1)LOD定量限/(μg·kg-1)LOQ甲基睾丸酮(Methyltestosterone)0.813Y=32001X-1468090.99910.62.0丙酸睾酮(Testosteronepropionate)0.788Y=31134X-466900.99880.62.0诺龙(Nandrolone)0.716Y=17859X-116950.99941.13.5群勃龙(Trenbolone)0.742Y=55626X-2792910.99940.41.4倍氯米松(Beclometasone)0.677Y=112318X-9999990.99881.55.0地塞米松(Dexamethasone)0.756Y=18431X-28800.99981.13.5氢化可的松(Hydrocortisone)0.754Y=31706X+1121870.99950.62.0泼尼松(Prednisone)0.781Y=26778X+174770.99950.82.5氢化泼尼松(Prednisolone)0.778Y=24784X+693280.99920.82.5孕酮(Progesterone)0.678Y=9708X-1053660.99892.06.7醋酸氯地孕酮(Chloromadinone17-acetate)0.625Y=8159X+212610.99971.75.7醋酸甲羟孕酮(Medroxyprogesterone17-ace-tate)0.705Y=21353X+990150.99940.82.417α-羟孕酮(17-alpha-Hydroxyprogesterone)0.806Y=17702X-810340.99911.24.021α-羟孕酮(21-alpha-Hydroxyprogesterone)0.812Y=25359X-1065890.99920.82.5
2.4.1 回收率和精密度
向空白草鱼和大黄鱼样品中添加3个浓度水平梯度的14种激素混合标准溶液,按前述前处理方法以及检测条件进行回收率实验(n=6),具体结果见表3。草鱼基质中各化合物的回收率为75.4%~103.6%,相对标准偏差(RSD)为2.4%~9.5%;大黄鱼基质中各化合物的回收率为73.4% ~ 101.5%,相对标准偏差(RSD)为2.4%~9.1%。
2.5 实际样品检测
采用本方法对23批次黄颡鱼、20批次乌鳢和14批次大黄鱼样品进行检测,均未检出激素残留。同时质控样品的回收率等指标均达到分析要求,表明结果准确可靠。
3 结论
本方法基于高分辨率质谱的抗干扰能力与高定性能力,结合运用EMR-lipid吸附剂的新型QuEChERS前处理方法,建立了鱼肉中14种激素的液相色谱-四级杆飞行时间质谱快速测定方法。通过采用基质标准曲线校准,外标法定量完成了57批次鱼肉样品中激素筛查检测。本方法前处理成本低廉、简便快捷,同时适用于低脂肪和高脂肪含量鱼肉中14种激素的筛查和定量分析。
表3 草鱼和大黄鱼中14种激素类化合物的回收率和相对标准偏差
Tab.3 Recoveries and relative standard deviations(RSDs)of 14 hormones in Grass carp and Pseudosciaena crocea fish meatn=6
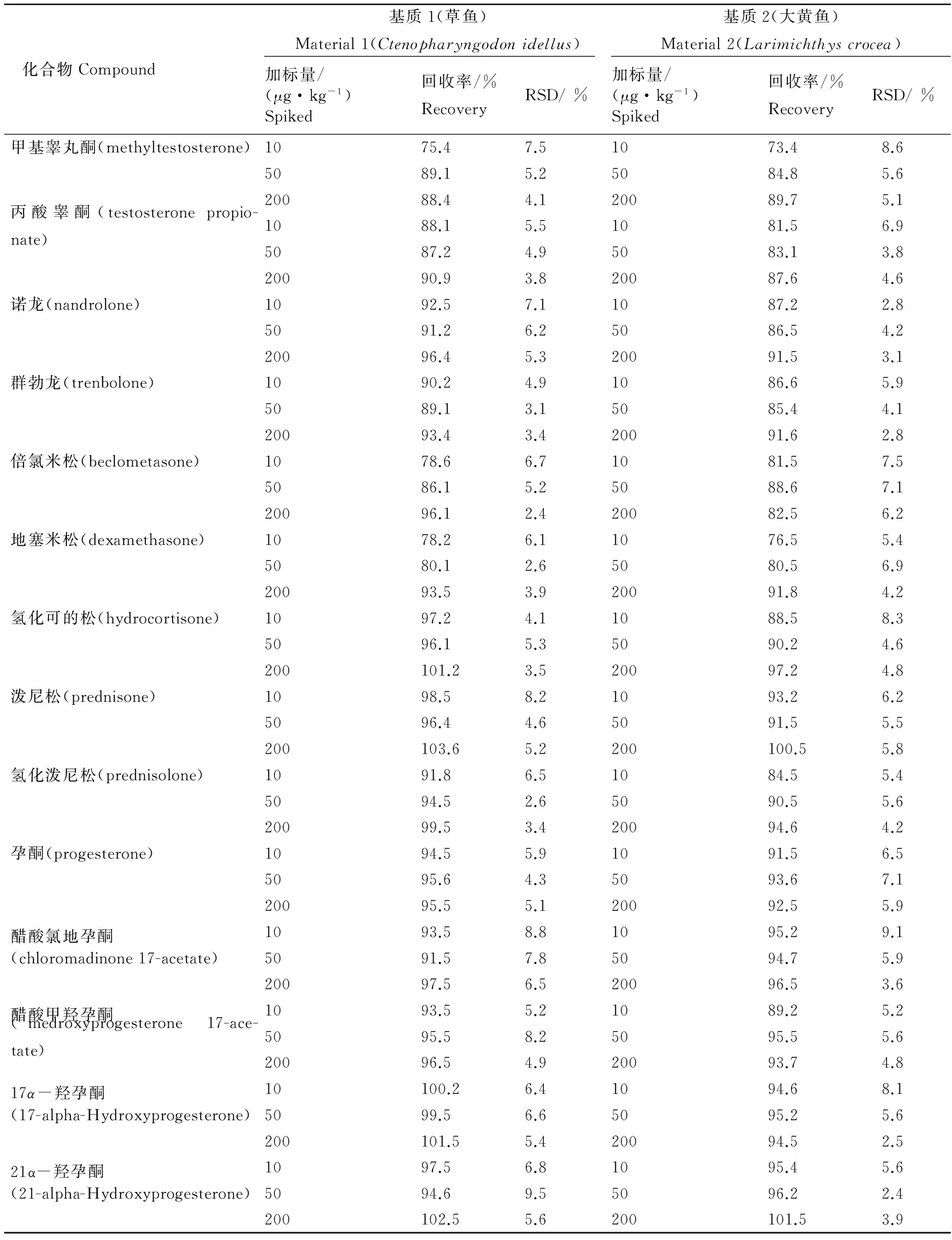
化合物Compound基质1(草鱼)Material1(Ctenopharyngodonidellus)基质2(大黄鱼)Material2(Larimichthyscrocea)加标量/(μg·kg-1)Spiked回收率/%RecoveryRSD/%加标量/(μg·kg-1)Spiked回收率/%RecoveryRSD/%甲基睾丸酮(methyltestosterone)1075.47.51073.48.65089.15.25084.85.620088.44.120089.75.1丙酸睾酮(testosteronepropio-nate)1088.15.51081.56.95087.24.95083.13.820090.93.820087.64.6诺龙(nandrolone)1092.57.11087.22.85091.26.25086.54.220096.45.320091.53.1群勃龙(trenbolone)1090.24.91086.65.95089.13.15085.44.120093.43.420091.62.8倍氯米松(beclometasone)1078.66.71081.57.55086.15.25088.67.120096.12.420082.56.2地塞米松(dexamethasone)1078.26.11076.55.45080.12.65080.56.920093.53.920091.84.2氢化可的松(hydrocortisone)1097.24.11088.58.35096.15.35090.24.6200101.23.520097.24.8泼尼松(prednisone)1098.58.21093.26.25096.44.65091.55.5200103.65.2200100.55.8氢化泼尼松(prednisolone)1091.86.51084.55.45094.52.65090.55.620099.53.420094.64.2孕酮(progesterone)1094.55.91091.56.55095.64.35093.67.120095.55.120092.55.9醋酸氯地孕酮1093.58.81095.29.1(chloromadinone17-acetate)5091.57.85094.75.920097.56.520096.53.6醋酸甲羟孕酮1093.55.21089.25.2(medroxyprogesterone17-ace-tate)5095.58.25095.55.620096.54.920093.74.817α-羟孕酮10100.26.41094.68.1(17-alpha-Hydroxyprogesterone)5099.56.65095.25.6200101.55.420094.52.521α-羟孕酮1097.56.81095.45.6(21-alpha-Hydroxyprogesterone)5094.69.55096.22.4200102.55.6200101.53.9
[1] 杨先乐,郭微微,孙琪,等. 动物源食品中性激素残留及其检测方法概述[J].食品工业科技, 2012, 33(2): 423-426.
[2] 中华人民共和国农业部. 中华人民共和国农业部公告第235号公告 动物性食品中兽药最高残留限量[EB/OL]. (2002-12-24) [2016-04-20]. http://www.aqsiq.gov.cn/xxgk_13386/jgfl/jckspaqj/ywxx/201210/t20121016_252217.htm.
[3] 卢杰,冯晓梅,隋晓,等. 亚临界1,1,1,2-四氟乙烷萃取-气相色谱-质谱法测定鱼肉中6种性激素残留[J]. 分析化学, 2013, 41(10): 1487-1492.
[4] Wei J, Bin H, Bin W, et al. Simultaneous determination of androgens and progestogen in surface water and sediment by gas chromatography-mass spectrometry[J]. Chin J Anal Chem, 2013, 41(2): 205-209.
[5] 王珊,李琼,武晓剑,等. 高效液相色谱法测定化妆品中5种性激素[J]. 理化检验(化学分册),2015, 50(3): 333-337.
[6] 李娟,商少明,陈新,等. 固相萃取-高效液相色谱法同时测定化妆品中6种糖皮质激素[J]. 分析试验室,2013, 32(5):77-80.
[7] 李向军,于慧娟,冯兵,等. 高效液相色谱串联质谱法同时测定水产品中24种性激素[J]. 分析试验室,2012, 31(5): 62-67.
[8] 刘宏程, 李宁, 林涛,等. 基质固相分散-超高效液相色谱-质谱检测器测定牛奶中9种类固醇激素残留[J].色谱, 2015, 31(11): 1163-1168.
[9] 邹红梅,左舜宇,黄东仁,等. 高效液相色谱-串联质谱法同时测定水产品中雄激素和糖皮质激素残留 [J]. 中国渔业质量与标准, 2016, 6(2): 45-50.
[10] 李兆永,王凤美,牛增元,等. 超高效液相色谱-线性离子阱/静电场轨道阱高分辨质谱快速筛查化妆品中的24种激素[J].色谱, 2014, 31(11): 1163-1168.
[11] William P, Emmanuelle V. Determination of 136 pharmaceuticals and hormones in sewage sludge us-ing quick, easy, cheap, effective, rugged and safe extraction followed by analysis with liquid chromatogr-aphy-time-of-flight-mass spectrometry[J]. J Chromatogr A, 2013, 1290(5): 46-60.
[12] Zhang Y, Liu X, Li X, et al. Rapid screening and quantification of multi-class multi-residue veterinary drugs in royal jelly by ultra performance liquid chromatography coupled to quadrupole time-of-flight mass spectrometry[J]. Food Contr, 2016, 60(2): 667-676.
[13] 严华,云环,刘鑫,等. UHPLC-LTQ Orbitrap MS 测定鸡肉组织中5 种糖皮质激素残留[J]. 分析测试学报, 2013, 32(8): 909-914.
[14] 连英杰,林升航,曾琪,等. QuEChERS/超高效液相色谱-电喷雾串联质谱法检测鸡肉中11种激素类药物残留[J]. 食品安全质量检测学报,2014,5(2): 384-392.
[15] 罗辉泰,黄晓兰,吴惠勤,等. QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J]. 分析测试学报,2011,30(12): 1329-1337.
[16] 曲斌,耿士伟,陆桂萍,等. 新型QuEChERS方法结合液相色谱串联质谱法快速测定猪肝中β-受体激动剂残留[J]. 食品安全质量检测学报,2015,6(12):4747-4754.
[17] 李诗言,张海琪,郑重莺,等. 高效液相色谱-四极杆-飞行时间质谱法筛查中华鳖中42种兽药残留[J].中国渔业质量与标准, 2015,5(1):42-51.
[18] Fan Y B, Yin Y M, Jiang W B, et al.Simultaneous determination of ten steroid hormones in animal origin food by matrix solid-phase dispersion and liquid chromatography-electrospray tandem mass spectrometry[J]. Food Chem, 2014, 142(1): 170-177.
Simultaneous determination of fourteen hormones in fish meat by liquid chromatography/quadrupole time-of-flight mass spectrometry combined with novel QuEChERS method
LI Shiyan,WANG Yang*,ZHOU Fan,ZHENG Chongying,KE Qingqing,WANG Dingnan,BEI Yijiang
(Aquatic Products Quality Inspection Center of Zhejiang Province,Hangzhou 310023,China)
The novel QuEChERS sample preparation and liquid chromatography/quadrupole time-of-flight mass spectrometry (LC-Q-TOF/MS) method was developed for the determination of 14 hormones in fish meat. The homogenized sample was dispersed by water, and then the analytes were extracted by acetonitrile. The extraction was degreased by enhanced matrix removal (EMR-lipid) material. After the salting-out, PSA adsorbent was used for further purification and concentration. Then, the analytes were detected by liquid chromatography/quadrupole time-of-flight mass spectrometry (LC-Q-TOF/MS). The linear ranges of the analytes were good within the linearity range, and the limits of detection (LOD) were from 1.4 to 6.7 μg/kg. At the different spiked levels (n=6), the average recoveries were from 75.4% to 103.6% and the relative standard deviations (RSD) ranged from 2.4% to 9.5% in the Grass carp (Ctenopharyngodonidellus) meat; the average recoveries were from 73.4% to 101.5% and the relative standard deviations (RSD) ranged from 2.4% to 9.1% in the Pseudosciaena crocea(Larimichthyscrocea)meat. The screening of analytes was performed by precision mass matching and library search. This proposed method was convenient, reliable and simple. The method was also suitable for the rapid screening analysis of 14 hormones in fish meat as a high-throughput and confirmatory method.This research provided an effective technical means for monitoring the risk of hormones in fish. [Chinese Fishery Quality and Standards, 2016, 6(5):52-59]
LC-Q-TOF/MS;hormones;QuEChERS;Ctenopharyngodonidellus;Larimichthyscrocea;screening parameters
WANG Yang, wangyangruanfeng@163.com
2016-05-04;接收日期:2016-06-07
浙江省2013年农业标准化研究
李诗言(1987-),男,硕士,工程师,研究方向为水产品质量与安全,jimmyuu1987@163.com
王扬,高级工程师,研究方向为水产品质量与安全,wangyangruanfeng@163.com
S94
:A
:2095-1833(2016)05-0052-08
