常考不衰的知识点
——H2O2的结构与性质
2017-01-03安徽曹培培
◇ 安徽 曹培培
常考不衰的知识点
——H2O2的结构与性质
◇ 安徽 曹培培
1 由一道高考试题说起
原题(2016年新课标卷Ⅰ第28题,有删节) NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图1所示,回答下列问题.

图1
“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是________.
解析由流程图容易看出,NaOH与H2O2的混合液吸收尾气中的ClO2得到成品液,进而得到NaClO2产品.从化合价的角度分析,H2O2为还原剂,ClO2为氧化剂,则氧化产物应为O2,还原产物为NaClO2,由化合价升降守恒易得氧化剂与还原剂的物质的量之比为2∶1.
2016年6月8日晚上,在官方答案还没有公布之前,在网络上有很多该试题的答案,给出的大多是1∶2和NaClO3,这是什么原因呢?原来是把H2O2当成了氧化剂,ClO2当成了还原剂所致.究其原因,一方面是平时习题中H2O2大多作为氧化剂,另一方面是对流程分析不仔细.H2O2在反应中可能体现哪些性质?在往年的高考试题中都考查过哪些性质?下面就梳理一下近年高考试题中的H2O2.
2 H2O2的结构与性质
2.1 H2O2的结构
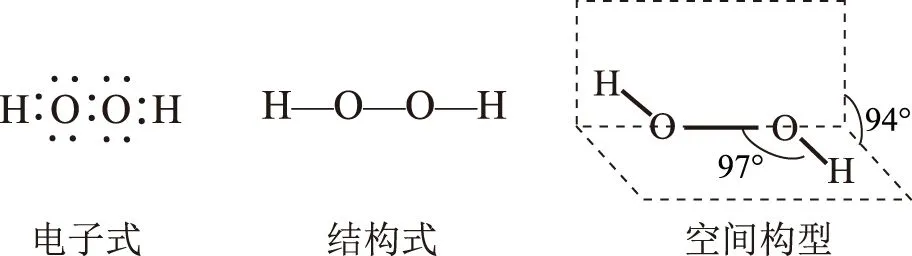
H2O2是极性分子,即2个氢原子不在同一个平面.
2.2 物理性质
纯净的过氧化氢是无色的黏稠状液体.在20℃时,密度为1.245 g·mL-1,沸点为152.1℃,熔点为-0.89℃.固态过氧化氢是无色针状晶体,密度为1.71 g·mL-3.它是一个极好的离子性溶剂,与水互溶,这是由于与水能形成新的氢键.在实验室中常用的3%~30%的过氧化氢水溶液称为双氧水.
2.3 化学性质
1) H2O2是一种弱酸.
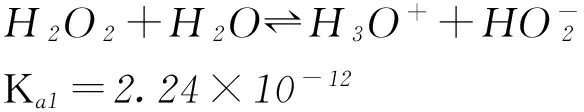
NH3(l)+H2O2=NH4OOH↓(白色).
2) 在酸性条件下,H2O2是极好的氧化剂,但遇到强氧化剂时显还原性.在碱性条件下,H2O2是中等的氧化剂.在水溶液中,过氧化氢不论是氧化剂,还是还原剂,在反应体系中都不引入任何杂质:
2H++H2O2+2e-→2H2O作氧化剂;
H2O2-2e-→O2↑+2H+作还原剂.
3) H2O2不稳定,易歧化.
a) 在OH-介质中比在H+介质中分解快; b) 若有重金属离子Fe2+、Mn2+、Cu2+、Cr3+等存在,大大加快H2O2的分解; c) 波长为320~380 nm的光促使H2O2分解; d) 受热加快H2O2分解.
预防H2O2分解的措施:把H2O2放入棕色瓶中,再放在阴凉、避光处,加入稳定剂(如微量Na2SnO3、Na4P2O7或8-羟基喹啉等)来抑制所含杂质的催化作用,这些稳定剂的作用是配位或还原杂质离子.
3 与H2O2相关的高考试题
3.1 考查H2O2的结构
例1(2015年浙江卷第27题节选) H2O2的电子式______.
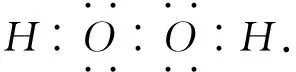
3.2 考查H2O2的氧化性
例2(2016年新课标卷Ⅱ28节选) 丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成.产生气泡的原因是________;生成沉淀的原因是________(用平衡移动原理解释).
解析溶液变为棕黄色,说明生成了Fe3+,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.溶液中有气泡出现,说明H2O2在Fe3+的催化作用下发生了分解反应,生成了O2.随后生成红褐色沉淀Fe(OH)3,由于H2O2分解放出热量,且反应消耗H+,Fe3+的水解平衡Fe3++3H2OFe(OH)3+3H+向正反应方向移动,因此得到Fe(OH)3沉淀.
答案H2O2+2Fe2++2H+=2Fe3++2H2O; Fe3+催化H2O2分解产生O2; H2O2分解反应放热,促进Fe3+的水解平衡正向移动.
【说明】 Fe2+与H2O2在酸性条件下反应的方程式在近年高考中出现的频率极高,比如,2016年四川卷第3题、2016年江苏卷第19(2)题、2010年上海卷第19题等,考查形式有离子方程式的书写和离子方程式正误判断等.
例3(2014年重庆卷第9(2)题) 装置B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为____.
解析H2O2作为氧化剂将SO2氧化为H2SO4,结合得失电子守恒和原子守恒,方程式为H2O2+SO2=H2SO4.
【说明】 H2O2与SO2的反应也是近年高考中的热点,比如,2014年北京卷第27(2)题、2012年安徽卷第27(2)题等,考查形式主要为化学方程式及离子方程式的书写等.
例4(2012年江苏卷第19(1)题) (ⅰ) 铜帽溶解时加入H2O2的目的是____________(用化学方程式表示).(ⅱ)铜帽溶解完全后, 需将溶液中过量的H2O2除去,除去H2O2的简便方法是________.
解析Cu与稀硫酸不反应,在酸性条件下H2O2作为氧化剂将Cu氧化为Cu2+,化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O,因H2O2受热易分解,故除去过量H2O2的简便方法是加热(至沸).
【说明】 Cu在酸性条件下与H2O2的反应也多次考查到,比如,2008年江苏卷第16(1)题.
例5(2008年北京卷第28(4)题)取Y中的溶液(含Fe2+),调pH约为7,加入淀粉-KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成.当消耗2 mol I-时,共转移3 mol电子,该反应的离子方程式是____.
解析当消耗2 mol I-时,共转移3 mol电子,则参与反应的Fe2+与I-的物质的量比为1∶2,则反应的离子方程式为
2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2.
3.3 考查H2O2的还原性
例6(2016年四川卷第8(5)题) 在稀硫酸中,Z(Cr)的最高价含氧酸的钾盐(橙色)氧化M(O)的一种氢化物,Z(Cr)被还原为+3价,该反应的化学方程式是________.
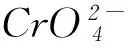
K2Cr2O7+3H2O2+4H2SO4=
K2SO4+Cr2(SO4)3+3O2↑+7H2O.
例7(2013年新课标卷第27(3)题) 某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等.现欲利用图2工艺流程回收正极材料中的某些金属资源(部分条件未给出).
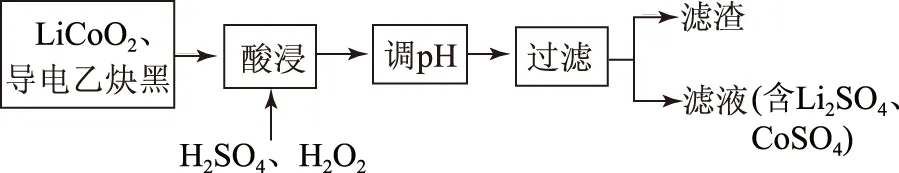
图2
“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是______.

例8(2013年安徽卷第27(2)题) 向二氧化铈(CeO2)固体中加稀硫酸和H2O2,所得溶液中含有Ce3+的反应的离子方程式是________.
解析CeO2变成Ce3+,Ce的化合价降低,则O的化合价要升高.
2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O.
3.4 以制备其他过氧化物为载体考查
(4) 步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________.
解析步骤③中CaCl2与H2O2发生复分解反应生成CaO2:CaCl2+H2O2=CaO2↓+2HCl,HCl再与NH3·H2O 反应生成NH4Cl和H2O,总反应为CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O或CaCl2+2NH3·H2O+H2O2+6H2O=CaO2·8H2O↓+2NH4Cl.H2O2受热易分解,所以反应需在冰浴下进行.
3.5 以H2O2的分解为载体考查
例10(2015年天津卷第3题)下列说法不正确的是( ).
A Na与H2O的反应是熵增的放热反应,该反应能自发进行;
B 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同;
C FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同;
D Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)=Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
解析FeCl3和MnO2对H2O2分解均有催化作用,但催化效率不同,因此同等条件下二者对H2O2分解速率的改变不同.答案为C.
例11(2014年新课标卷Ⅰ第9题)已知分解1 mol H2O2放出热量98 kJ.在含少量I-的溶液中,H2O2分解的机制为:
H2O2+I-→H2O+IO-(慢),
H2O2+IO-→H2O+O2+I-(快).
下列有关该反应的说法正确的是( ).
A 反应速率与I-浓度有关;
B IO-也是该反应的催化剂;
C 反应活化能等于98 kJ·mol-1;
Dv(H2O2)=v(H2O)=v(O2)
解析决定化学反应速率的主要是慢反应,所以I-浓度越大,则整个反应速率越快,选项A正确;催化剂改变反应的速率,自身的质量和化学性质不发生变化,该反应的催化剂是I-,IO-是反应的中间体,选项B错误;98 kJ·mol-1是该反应的反应热,反应活化能应大于98 kJ·mol-1,选项C错误;过氧化氢分解方程式为2H2O2=2H2O+O2↑,v(H2O2)=2v(O2),选项D错误.
变式训练(2014年广东卷第33题) H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛.
(1) 某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响.限选试剂与仪器:30% H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器.
(ⅰ) 写出H2O2分解反应方程式并标明电子转移的方向和数目________.
(ⅱ) 设计实验方案:在不同H2O2浓度下,测定____(要求所测得的数据能直接体现反应速率大小).
(ⅲ) 设计实验装置,完成如图3装置示意图.
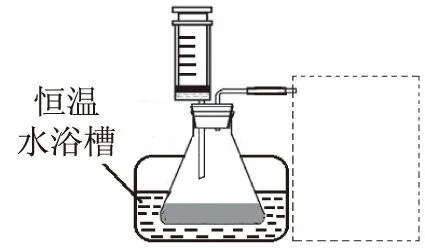
图3
(ⅳ) 参照表1格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示).

表1

(ⅱ) 收集相同体积的氧气所需时间或者相同时间内所收集氧气的体积.
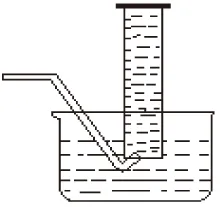
(ⅳ) 见表2和3.
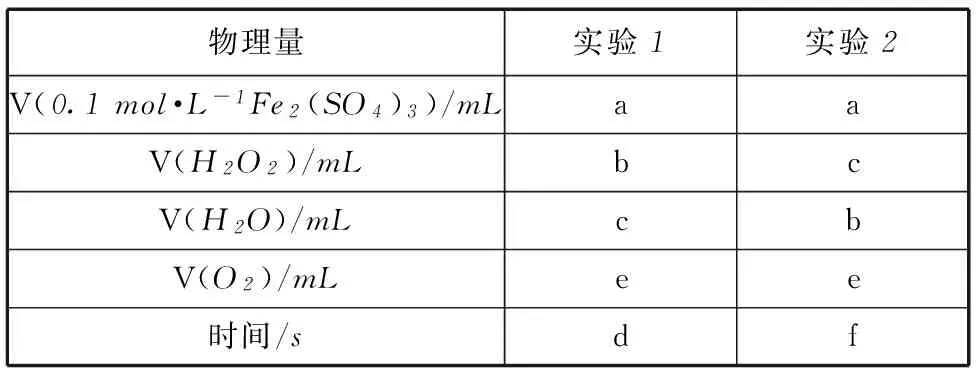
表2
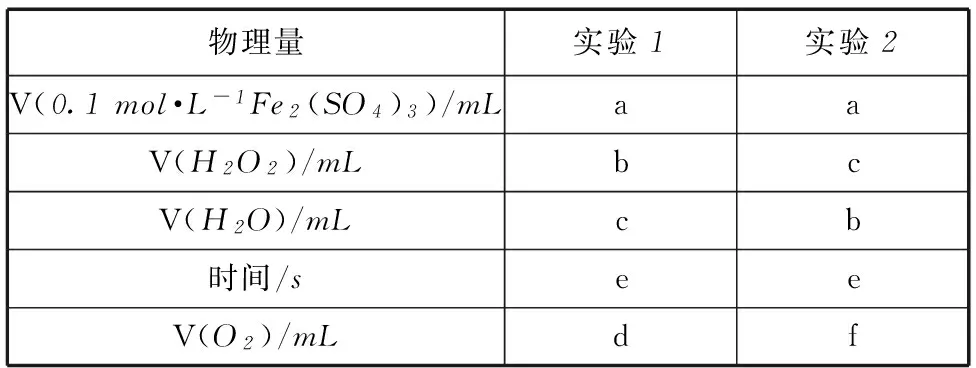
表3
安徽淮南二中)
